9.2溶解度同步练习-2021-2022学年九年级化学人教版下册(word版有答案)
文档属性
| 名称 | 9.2溶解度同步练习-2021-2022学年九年级化学人教版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 279.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-24 19:56:47 | ||
图片预览



文档简介
9.2 溶解度 同步练习
一、单选题
1.NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是
温度/℃ 0 20 40 60
NaCl的溶解度/g 35.7 36.0 36.6 37.3
KNO3的溶解度/g 13.3 31.6 63.9 110
A.20℃时,100gH2O最多能溶解36.0gNaCl
B.40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.可用冷却海水的方法获取大量食盐
D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
2.甲物质的溶液可用作化肥、电镀液等。甲的溶解度曲线如图所示,下列说法正确的是
A.甲的溶解度是102.5g
B.甲的溶解度随温度的升高而增大
C.20℃时,100 g甲的饱和溶液中溶质质量为28.6 g
D.将70℃甲的饱和溶液升高温度或降低温度,都有晶体析出
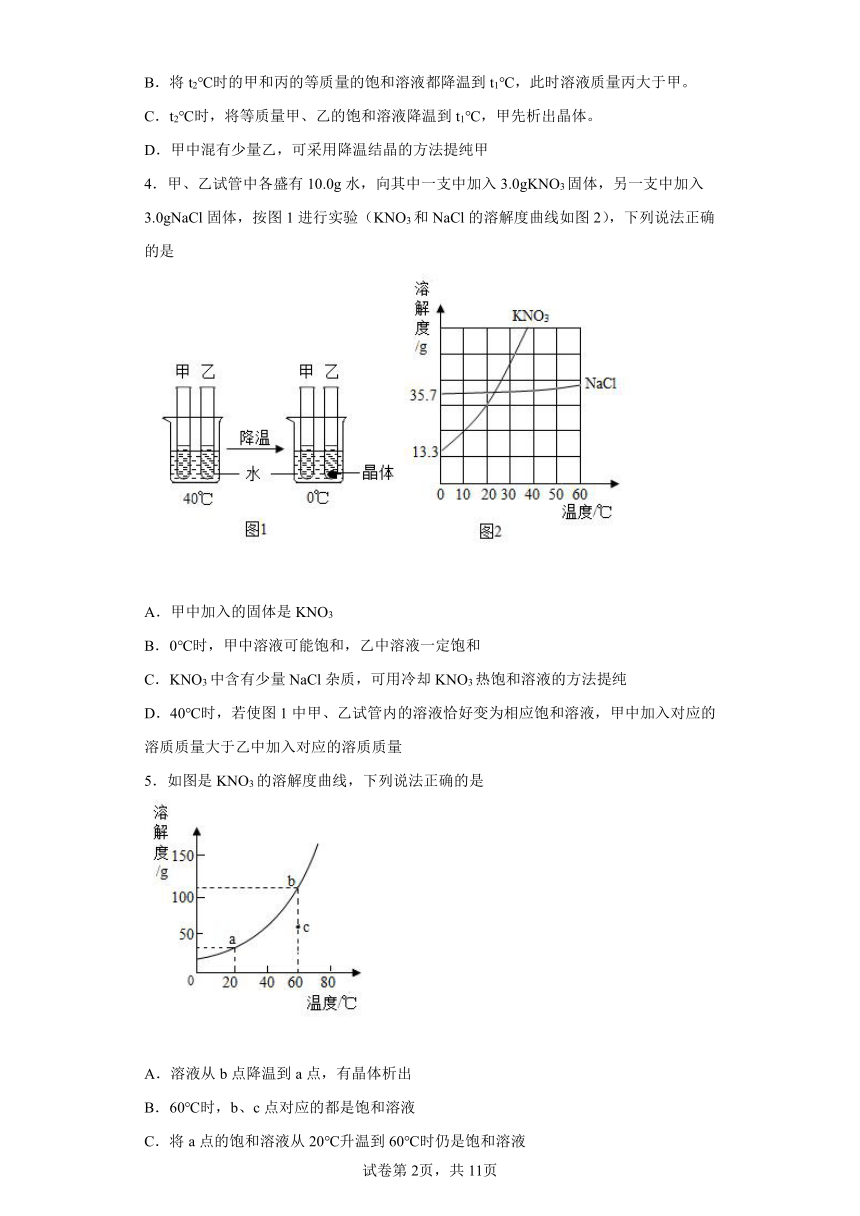
3.如图是甲、乙、丙三种固体物质的溶解度曲线。下列说法错误的是
A.t2℃时,甲、乙两物质的溶解度相等
B.将t2℃时的甲和丙的等质量的饱和溶液都降温到t1℃,此时溶液质量丙大于甲。
C.t2℃时,将等质量甲、乙的饱和溶液降温到t1℃,甲先析出晶体。
D.甲中混有少量乙,可采用降温结晶的方法提纯甲
4.甲、乙试管中各盛有10.0g水,向其中一支中加入3.0gKNO3固体,另一支中加入3.0gNaCl固体,按图1进行实验(KNO3和NaCl的溶解度曲线如图2),下列说法正确的是
A.甲中加入的固体是KNO3
B.0℃时,甲中溶液可能饱和,乙中溶液一定饱和
C.KNO3中含有少量NaCl杂质,可用冷却KNO3热饱和溶液的方法提纯
D.40℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量大于乙中加入对应的溶质质量
5.如图是KNO3的溶解度曲线,下列说法正确的是
A.溶液从b点降温到a点,有晶体析出
B.60℃时,b、c点对应的都是饱和溶液
C.将a点的饱和溶液从20℃升温到60℃时仍是饱和溶液
D.60℃时,向50g水中加入60gKNO3,形成不饱和溶液
6.以下是Na2CO3、NaHCO3的溶解度表。下列说法中错误的是( )
0℃ 10℃ 20℃ 30℃ 40℃ 50℃ 60℃
Na2CO3的溶解度(g/100g水) 7.1 12.5 21.5 39.7 49.0 48.5 46.0
NaHCO3的溶解度(g/100g水) 6.9 8.1 9.6 11.1 12.7 14.5 16.4
A.40℃的饱和Na2CO3溶液升温到60℃,会析出晶体
B.60℃的NaHCO3溶液蒸干并充分灼烧,可得到NaHCO3晶体
C.30℃的溶质质量分数为25%的Na2CO3溶液降温到20℃,有晶体析出
D.20℃的饱和Na2CO3溶液中通足量CO2,生成的NaHCO3会部分析出
7.夏季,鱼虾养殖塘内常放一些水泵,把水喷向空中(如图),从化学角度分析,喷水的目的是
A.增加观赏性 B.降低塘内水温
C.杀灭水中细菌 D.便于溶解氧气
8.下表是某同学的实验记录,以下说法不正确的是( )
溶质 碘 高锰酸钾
溶剂 水 汽油 酒精 水 汽油
溶解性 不溶 易溶 可溶 易溶 不溶
A.衣服不慎沾上碘酒,可用汽油擦洗
B.溶液都是均一、稳定、无色的混合物
C.水、汽油、酒精都可以做溶剂
D.同一物质在不同溶剂中溶解性不同
9.甲、乙两种物质(不含结晶水)的溶解度曲线如图所示,下列叙述正确的是
A.甲和乙的溶解度相等且均为30g
B.甲物质的溶解度随温度的升高而减小
C.a1℃时,乙的饱和溶液中溶质与溶剂的质量比为3:7
D.将a2℃150g甲的饱和溶液降温到a1℃,有20g固体析出
10.分析下图溶解度曲线,判断下列说法错误的是
A.t1℃时,甲乙的溶解度是相等的,都是40g
B.t3℃时等质量的甲、乙饱和溶液降温至t1℃时,所得甲溶液质量小于乙溶液
C.甲中混有少量乙,可以用冷却热饱和溶液的方法提纯甲物质
D.取t2℃的甲乙的饱和溶液降温至t1℃时,甲乙溶液中析出固体的质量比2:1
11.除质量分数以外,人们有时也用体积分数来表示溶液的浓度.例如,52%的饮用白酒就是指每100体积的饮用白酒中含有52体积的乙醇.下列溶液的浓度属于用体积分数来表示的是( )
A.0.9%的生理盐水 B.5%的葡萄糖注射液
C.10%的氢氧化钠溶液 D.75%的医用酒精
12.时,50g水中溶解某物质0.1045g即达到饱和,一般把这种物质划分为。
A.易溶物质 B.可溶物质
C.微溶物质 D.难溶物质
13.20℃时,氯化钠的溶解度为36g。对这句话理解错误的是
A.20℃时,100g水中最多能溶解氯化钠36g
B.20℃时,100g氯化钠饱和溶液中含氯化钠36g
C.20℃时,氯化钠饱和溶液中水与氯化钠的质量比为100∶36
D.20℃时,将36g氯化钠溶解于100g水中,所得溶液为该温度下氯化钠的饱和溶液
14.如图是利用海水提取粗盐的过程(温度不变),有关说法正确的是
A.氯化钠在海水中以分子的形式存在 B.①为蒸发池,②为结晶池
C.①中氧化钠的质量分数逐渐减小 D.母液是氯化钠的不饱和溶液
15.溶液与人们的生活息息相关。下列有关溶液说法正确的是
A.溶质可以是固体,也可以是液体或气体
B.将汽油与水充分混合,得到的是溶液
C.将10%的某溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.某饱和溶液降温到t℃析出晶体后,得到的溶液是t°C时的不饱和溶液
16.甲、乙两种物质的溶解度曲线如图,下列说法正确的是
A.时,甲、乙两种物质溶液的溶解度相等
B.时,乙物质饱和溶液降温到,溶质质量分数升高
C.时,甲、乙两种物质饱和溶液的溶质质量分数相等
D.时,甲物质溶液的质量分数一定大于乙物质溶液的质量分数
二、综合应用题
17.下图是实验室制取某些常见气体所使用的一些装置和仪器。
(1)实验室制取二氧化碳反应的化学方程式为______________,证明二氧化碳集满的方法是_____________________。
(2)某实验小组用氯酸钾和二氧化锰制取氧气,完全反应后从残余物中提纯KCl,进行以下操作:
(提示:MnO2不溶于水,含钾化合物均可溶于水)
操作X的名称是________,在实验室中进行该操作时用到的玻璃仪器有玻璃棒、烧杯、________,在该操作中玻璃棒的作用是________。
18.今年,广州“镉大米”事件再次引发了人们对食品安全、环境污染问题的思考。小明同学查阅了镉的相关信息:①镉元素位于第五周期ⅡB族。②镉是银白色有光泽的金属,熔点320.9℃,沸点765℃,密度8.64g/cm3,有韧性和延展性;镉在潮湿空气中缓慢氧化并失去金属光泽;镉可溶于酸,但不溶于碱。③镉对人体十分有害,摄入过量镉污染的食品和水,会引起肺和肾脏疾病。回答下列问题:
(1)根据图中的相关信息,下列对镉元素的判断不正确的是_______
A 镉属于金属元素 B 一个镉原子中有48个质子
C 镉原子示意图中X=18 D 镉的相对原子质量为112.4g
(2)归纳镉单质的化学性质_______________________________;
(3)“镉大米”主要出现在河水、土壤遭到镉污染的地区,消除“镉大米”需要从源头治理。目前河水治理的方法是:把适量Na2CO3投入被Cd2+污染的河水中,形成CdCO3沉淀,以降低河水中Cd2+的浓度。
①若某河段主要含有氯化镉,与碳酸钠反应的化学方程式为_________________________。
②25℃时,CdCO3的溶解度为2.8×10-6g,则1L河水中含Cd2+的质量为______mg(河水密度为1.0g/cm3,计算结果精确到0.001mg)。国家要求水中Cd2+的含量的标准≦0.005mg/L,用Na2CO3处理的河水____(填“是”或“否”)达标。
19.某化学小组从理论上初步探究“已知质量比的硝酸钾和氯化钠的混合物中提纯硝酸钾”.
【分析提纯方法】
表一:常温下(20℃)溶解度和溶解性的关系
溶解度S S≥10g 1g≤S<10g 0.01g≤S<1g S<0.01g
溶解性 易溶 可溶 微溶 难溶
表二:硝酸钾和氯化钠在不同温度时的溶解度
温度/℃ 0 20 40 60 80 100
溶解度/g KNO3 13.3 31.6 63.9 110 169 246
NaCl 35.7 36.0 36.6 37.3 38.4 39.8
(1)①常温下,KNO3和NaCl的溶解性均为______。
②根据表中数据,绘制KNO3的溶解度曲线_____.
③根据KNO3的溶解度曲线,获得KNO3在70℃时的溶解度约为 ______g.
(2)【设计提纯步骤】
①选取样品(95gKNO3和5gNaCl的混合物)
②配制80℃时KNO3的饱和溶液(加水约56.2mL,水的密度约为1g mL﹣1)
③降温至20℃
④得到晶体
【设计提纯方案】
为了证明④中得到的晶体为纯净的KNO3,该小组同学结合已有知识,从理论上初步设计了以下方案;(不考虑不同溶质对溶解度的相互影响及实验过程中水铬固体的损失等影响因素)
方案一 通过化学实验进行检验,取少量(4)中得到的晶体于试管中,加水配成溶液,滴加________,观察实验现象.
方案二 计算析出KNO3晶体的质量约为________g(精确到0.1g)与(4)中得到晶体的质量进行比较;
方案三________与95%进行比较;
方案四________.
20.(1)用化学符号填空:
①2个锰酸根离子,并标出锰元素的化合价:______。
②分离液态空气,先出来的物质的化学式:______。
(2)烧碱和氯气是重要的化工生产原料,我们可以通过反应 制取,已知B是相对分子质量最小的气体,则A的化学式为______。
(3)金属材料的应用推动了社会的发展。某废弃物中可能含有Cu、CuO、Mg、Zn中的一种或几种,为确定其成分并回收金属,取样品进行如图实验。试回答:
若溶液C中只含一种溶质,则溶质的成分是______(填化学式);若步骤中生成的氢气质量,则样品中的成分有______种。
(4)将34g晶体W(不是结晶水合物)投入盛有16g水的烧杯中,充分溶解,测得0℃、t℃、t2℃、t3℃时烧杯中溶液的质量分别如图中A、B、C、D点所示。则t1℃时,晶体W的溶解度是______g,A、B、C、D四点对应的溶液中,一定属于饱和溶液的是______(选填字母)。
21.水和溶液在生产、生活中起着十分重要的作用,请回答下列问题。
(1)请完成鉴别硬水和软水的实验报告。
实验步骤 实验现象及结论
___ ___
(2)电解水实验装置如图甲所示,a管产生的气体是___,用燃着的木条靠近该管尖嘴处,打开活塞,可观察到的现象___。
(3)图乙是氢氧化钙的溶解度曲线。40℃时,氢氧化钙的溶解度是0.14g,这句话的含义是___。将室温下的饱和氢氧化钙溶液升温(不超过100℃),发现氢氧化钙溶液变浑浊,请根据溶解度曲线解释原理:___。
(4)某石灰水含有氢氧化钙1.48g,要使该石灰水中的氢氧化钙全部转化为碳酸钙沉淀,至少需要二氧化碳的质量是_____?(请在答题纸上写出完整的解题过程)
22.化学通常是从宏观、微观两个方面来研究物质。
(1)下图是几种粒子结构示意图和周期表中的部分信息,则下列说法中正确的是( )
A、a、b粒子的化学性质相似,都是稳定结构
B、氯化钠是由c、d两种粒子构成的离子化合物
C、e的结构示意图中x=8,且该元素位于第四周期
D、氟的相对原子质量是19.00,且氟原子在化学反应中易失电子
(2)下图是某反应的微观示意图。下列说法正确的是( )
A、该反应中共有四种原子 B、A中氮元素的化合价为+3
C、这四种物质中有两种是氧化物 D、该反应中B和C的质量比为12∶7
(3)a.b.c三种物质的溶解度曲线如图所示。下列分析正确的是( )
A、t1℃时,a、c两种物质的饱和溶液中溶质的质量相等
B、t2℃时,把50g a放入50g水中能得到a的饱和溶液,其中溶质和溶液的质量比为1:3
C、将t2℃时,a、b、c三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数的大小关系是:b>c=a
D、将c的饱和溶液变成不饱和溶液,可采用升温的方法
(4)在和的混合溶液中,加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀无气体产生,则滤渣中一定含有的金属是_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.C
4.C
5.A
6.B
7.D
8.B
9.D
10.D
11.D
12.C
13.B
14.B
15.A
16.C
17. CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ 用燃着的木条放在集器瓶口,木条熄灭,证明集满。 过滤 漏斗 引流
18. D 镉在潮湿空气中缓慢氧化;镉可溶于酸,不溶于碱;镉有毒性 CdCl2+Na2CO3=CdCO3↓+2NaCl 0.018 否
19. 易溶 138 硝酸银 77.2 82% 利用20.2g与5g进行比较
20. N2 H2O ZnSO4 4 100 AB
21. 向两只试管中加入等量的水样品,向其中滴加等量的肥皂水后,同时振荡 出现较多泡沫、较少浮渣的样品为软水,出现较多浮渣,较少泡沫的样品为硬水 O2 木条燃烧得更加剧烈 40℃时,每 100g 水中最多能溶解 0.14g 氢氧化钙 温度升高,氢氧化钙溶解度下降, 室温下饱和溶液中溶解的氢氧化钙部分固体析出,溶液浑浊 0.88g(详见解析过程)
22. C D B Ag
答案第1页,共2页
答案第1页,共2页
一、单选题
1.NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是
温度/℃ 0 20 40 60
NaCl的溶解度/g 35.7 36.0 36.6 37.3
KNO3的溶解度/g 13.3 31.6 63.9 110
A.20℃时,100gH2O最多能溶解36.0gNaCl
B.40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.可用冷却海水的方法获取大量食盐
D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
2.甲物质的溶液可用作化肥、电镀液等。甲的溶解度曲线如图所示,下列说法正确的是
A.甲的溶解度是102.5g
B.甲的溶解度随温度的升高而增大
C.20℃时,100 g甲的饱和溶液中溶质质量为28.6 g
D.将70℃甲的饱和溶液升高温度或降低温度,都有晶体析出
3.如图是甲、乙、丙三种固体物质的溶解度曲线。下列说法错误的是
A.t2℃时,甲、乙两物质的溶解度相等
B.将t2℃时的甲和丙的等质量的饱和溶液都降温到t1℃,此时溶液质量丙大于甲。
C.t2℃时,将等质量甲、乙的饱和溶液降温到t1℃,甲先析出晶体。
D.甲中混有少量乙,可采用降温结晶的方法提纯甲
4.甲、乙试管中各盛有10.0g水,向其中一支中加入3.0gKNO3固体,另一支中加入3.0gNaCl固体,按图1进行实验(KNO3和NaCl的溶解度曲线如图2),下列说法正确的是
A.甲中加入的固体是KNO3
B.0℃时,甲中溶液可能饱和,乙中溶液一定饱和
C.KNO3中含有少量NaCl杂质,可用冷却KNO3热饱和溶液的方法提纯
D.40℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量大于乙中加入对应的溶质质量
5.如图是KNO3的溶解度曲线,下列说法正确的是
A.溶液从b点降温到a点,有晶体析出
B.60℃时,b、c点对应的都是饱和溶液
C.将a点的饱和溶液从20℃升温到60℃时仍是饱和溶液
D.60℃时,向50g水中加入60gKNO3,形成不饱和溶液
6.以下是Na2CO3、NaHCO3的溶解度表。下列说法中错误的是( )
0℃ 10℃ 20℃ 30℃ 40℃ 50℃ 60℃
Na2CO3的溶解度(g/100g水) 7.1 12.5 21.5 39.7 49.0 48.5 46.0
NaHCO3的溶解度(g/100g水) 6.9 8.1 9.6 11.1 12.7 14.5 16.4
A.40℃的饱和Na2CO3溶液升温到60℃,会析出晶体
B.60℃的NaHCO3溶液蒸干并充分灼烧,可得到NaHCO3晶体
C.30℃的溶质质量分数为25%的Na2CO3溶液降温到20℃,有晶体析出
D.20℃的饱和Na2CO3溶液中通足量CO2,生成的NaHCO3会部分析出
7.夏季,鱼虾养殖塘内常放一些水泵,把水喷向空中(如图),从化学角度分析,喷水的目的是
A.增加观赏性 B.降低塘内水温
C.杀灭水中细菌 D.便于溶解氧气
8.下表是某同学的实验记录,以下说法不正确的是( )
溶质 碘 高锰酸钾
溶剂 水 汽油 酒精 水 汽油
溶解性 不溶 易溶 可溶 易溶 不溶
A.衣服不慎沾上碘酒,可用汽油擦洗
B.溶液都是均一、稳定、无色的混合物
C.水、汽油、酒精都可以做溶剂
D.同一物质在不同溶剂中溶解性不同
9.甲、乙两种物质(不含结晶水)的溶解度曲线如图所示,下列叙述正确的是
A.甲和乙的溶解度相等且均为30g
B.甲物质的溶解度随温度的升高而减小
C.a1℃时,乙的饱和溶液中溶质与溶剂的质量比为3:7
D.将a2℃150g甲的饱和溶液降温到a1℃,有20g固体析出
10.分析下图溶解度曲线,判断下列说法错误的是
A.t1℃时,甲乙的溶解度是相等的,都是40g
B.t3℃时等质量的甲、乙饱和溶液降温至t1℃时,所得甲溶液质量小于乙溶液
C.甲中混有少量乙,可以用冷却热饱和溶液的方法提纯甲物质
D.取t2℃的甲乙的饱和溶液降温至t1℃时,甲乙溶液中析出固体的质量比2:1
11.除质量分数以外,人们有时也用体积分数来表示溶液的浓度.例如,52%的饮用白酒就是指每100体积的饮用白酒中含有52体积的乙醇.下列溶液的浓度属于用体积分数来表示的是( )
A.0.9%的生理盐水 B.5%的葡萄糖注射液
C.10%的氢氧化钠溶液 D.75%的医用酒精
12.时,50g水中溶解某物质0.1045g即达到饱和,一般把这种物质划分为。
A.易溶物质 B.可溶物质
C.微溶物质 D.难溶物质
13.20℃时,氯化钠的溶解度为36g。对这句话理解错误的是
A.20℃时,100g水中最多能溶解氯化钠36g
B.20℃时,100g氯化钠饱和溶液中含氯化钠36g
C.20℃时,氯化钠饱和溶液中水与氯化钠的质量比为100∶36
D.20℃时,将36g氯化钠溶解于100g水中,所得溶液为该温度下氯化钠的饱和溶液
14.如图是利用海水提取粗盐的过程(温度不变),有关说法正确的是
A.氯化钠在海水中以分子的形式存在 B.①为蒸发池,②为结晶池
C.①中氧化钠的质量分数逐渐减小 D.母液是氯化钠的不饱和溶液
15.溶液与人们的生活息息相关。下列有关溶液说法正确的是
A.溶质可以是固体,也可以是液体或气体
B.将汽油与水充分混合,得到的是溶液
C.将10%的某溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.某饱和溶液降温到t℃析出晶体后,得到的溶液是t°C时的不饱和溶液
16.甲、乙两种物质的溶解度曲线如图,下列说法正确的是
A.时,甲、乙两种物质溶液的溶解度相等
B.时,乙物质饱和溶液降温到,溶质质量分数升高
C.时,甲、乙两种物质饱和溶液的溶质质量分数相等
D.时,甲物质溶液的质量分数一定大于乙物质溶液的质量分数
二、综合应用题
17.下图是实验室制取某些常见气体所使用的一些装置和仪器。
(1)实验室制取二氧化碳反应的化学方程式为______________,证明二氧化碳集满的方法是_____________________。
(2)某实验小组用氯酸钾和二氧化锰制取氧气,完全反应后从残余物中提纯KCl,进行以下操作:
(提示:MnO2不溶于水,含钾化合物均可溶于水)
操作X的名称是________,在实验室中进行该操作时用到的玻璃仪器有玻璃棒、烧杯、________,在该操作中玻璃棒的作用是________。
18.今年,广州“镉大米”事件再次引发了人们对食品安全、环境污染问题的思考。小明同学查阅了镉的相关信息:①镉元素位于第五周期ⅡB族。②镉是银白色有光泽的金属,熔点320.9℃,沸点765℃,密度8.64g/cm3,有韧性和延展性;镉在潮湿空气中缓慢氧化并失去金属光泽;镉可溶于酸,但不溶于碱。③镉对人体十分有害,摄入过量镉污染的食品和水,会引起肺和肾脏疾病。回答下列问题:
(1)根据图中的相关信息,下列对镉元素的判断不正确的是_______
A 镉属于金属元素 B 一个镉原子中有48个质子
C 镉原子示意图中X=18 D 镉的相对原子质量为112.4g
(2)归纳镉单质的化学性质_______________________________;
(3)“镉大米”主要出现在河水、土壤遭到镉污染的地区,消除“镉大米”需要从源头治理。目前河水治理的方法是:把适量Na2CO3投入被Cd2+污染的河水中,形成CdCO3沉淀,以降低河水中Cd2+的浓度。
①若某河段主要含有氯化镉,与碳酸钠反应的化学方程式为_________________________。
②25℃时,CdCO3的溶解度为2.8×10-6g,则1L河水中含Cd2+的质量为______mg(河水密度为1.0g/cm3,计算结果精确到0.001mg)。国家要求水中Cd2+的含量的标准≦0.005mg/L,用Na2CO3处理的河水____(填“是”或“否”)达标。
19.某化学小组从理论上初步探究“已知质量比的硝酸钾和氯化钠的混合物中提纯硝酸钾”.
【分析提纯方法】
表一:常温下(20℃)溶解度和溶解性的关系
溶解度S S≥10g 1g≤S<10g 0.01g≤S<1g S<0.01g
溶解性 易溶 可溶 微溶 难溶
表二:硝酸钾和氯化钠在不同温度时的溶解度
温度/℃ 0 20 40 60 80 100
溶解度/g KNO3 13.3 31.6 63.9 110 169 246
NaCl 35.7 36.0 36.6 37.3 38.4 39.8
(1)①常温下,KNO3和NaCl的溶解性均为______。
②根据表中数据,绘制KNO3的溶解度曲线_____.
③根据KNO3的溶解度曲线,获得KNO3在70℃时的溶解度约为 ______g.
(2)【设计提纯步骤】
①选取样品(95gKNO3和5gNaCl的混合物)
②配制80℃时KNO3的饱和溶液(加水约56.2mL,水的密度约为1g mL﹣1)
③降温至20℃
④得到晶体
【设计提纯方案】
为了证明④中得到的晶体为纯净的KNO3,该小组同学结合已有知识,从理论上初步设计了以下方案;(不考虑不同溶质对溶解度的相互影响及实验过程中水铬固体的损失等影响因素)
方案一 通过化学实验进行检验,取少量(4)中得到的晶体于试管中,加水配成溶液,滴加________,观察实验现象.
方案二 计算析出KNO3晶体的质量约为________g(精确到0.1g)与(4)中得到晶体的质量进行比较;
方案三________与95%进行比较;
方案四________.
20.(1)用化学符号填空:
①2个锰酸根离子,并标出锰元素的化合价:______。
②分离液态空气,先出来的物质的化学式:______。
(2)烧碱和氯气是重要的化工生产原料,我们可以通过反应 制取,已知B是相对分子质量最小的气体,则A的化学式为______。
(3)金属材料的应用推动了社会的发展。某废弃物中可能含有Cu、CuO、Mg、Zn中的一种或几种,为确定其成分并回收金属,取样品进行如图实验。试回答:
若溶液C中只含一种溶质,则溶质的成分是______(填化学式);若步骤中生成的氢气质量,则样品中的成分有______种。
(4)将34g晶体W(不是结晶水合物)投入盛有16g水的烧杯中,充分溶解,测得0℃、t℃、t2℃、t3℃时烧杯中溶液的质量分别如图中A、B、C、D点所示。则t1℃时,晶体W的溶解度是______g,A、B、C、D四点对应的溶液中,一定属于饱和溶液的是______(选填字母)。
21.水和溶液在生产、生活中起着十分重要的作用,请回答下列问题。
(1)请完成鉴别硬水和软水的实验报告。
实验步骤 实验现象及结论
___ ___
(2)电解水实验装置如图甲所示,a管产生的气体是___,用燃着的木条靠近该管尖嘴处,打开活塞,可观察到的现象___。
(3)图乙是氢氧化钙的溶解度曲线。40℃时,氢氧化钙的溶解度是0.14g,这句话的含义是___。将室温下的饱和氢氧化钙溶液升温(不超过100℃),发现氢氧化钙溶液变浑浊,请根据溶解度曲线解释原理:___。
(4)某石灰水含有氢氧化钙1.48g,要使该石灰水中的氢氧化钙全部转化为碳酸钙沉淀,至少需要二氧化碳的质量是_____?(请在答题纸上写出完整的解题过程)
22.化学通常是从宏观、微观两个方面来研究物质。
(1)下图是几种粒子结构示意图和周期表中的部分信息,则下列说法中正确的是( )
A、a、b粒子的化学性质相似,都是稳定结构
B、氯化钠是由c、d两种粒子构成的离子化合物
C、e的结构示意图中x=8,且该元素位于第四周期
D、氟的相对原子质量是19.00,且氟原子在化学反应中易失电子
(2)下图是某反应的微观示意图。下列说法正确的是( )
A、该反应中共有四种原子 B、A中氮元素的化合价为+3
C、这四种物质中有两种是氧化物 D、该反应中B和C的质量比为12∶7
(3)a.b.c三种物质的溶解度曲线如图所示。下列分析正确的是( )
A、t1℃时,a、c两种物质的饱和溶液中溶质的质量相等
B、t2℃时,把50g a放入50g水中能得到a的饱和溶液,其中溶质和溶液的质量比为1:3
C、将t2℃时,a、b、c三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数的大小关系是:b>c=a
D、将c的饱和溶液变成不饱和溶液,可采用升温的方法
(4)在和的混合溶液中,加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀无气体产生,则滤渣中一定含有的金属是_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.C
4.C
5.A
6.B
7.D
8.B
9.D
10.D
11.D
12.C
13.B
14.B
15.A
16.C
17. CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ 用燃着的木条放在集器瓶口,木条熄灭,证明集满。 过滤 漏斗 引流
18. D 镉在潮湿空气中缓慢氧化;镉可溶于酸,不溶于碱;镉有毒性 CdCl2+Na2CO3=CdCO3↓+2NaCl 0.018 否
19. 易溶 138 硝酸银 77.2 82% 利用20.2g与5g进行比较
20. N2 H2O ZnSO4 4 100 AB
21. 向两只试管中加入等量的水样品,向其中滴加等量的肥皂水后,同时振荡 出现较多泡沫、较少浮渣的样品为软水,出现较多浮渣,较少泡沫的样品为硬水 O2 木条燃烧得更加剧烈 40℃时,每 100g 水中最多能溶解 0.14g 氢氧化钙 温度升高,氢氧化钙溶解度下降, 室温下饱和溶液中溶解的氢氧化钙部分固体析出,溶液浑浊 0.88g(详见解析过程)
22. C D B Ag
答案第1页,共2页
答案第1页,共2页
同课章节目录
