10.2酸和碱的中和反应 同步练习—2021~2022学年九年级化学人教版下册(word版有答案)
文档属性
| 名称 | 10.2酸和碱的中和反应 同步练习—2021~2022学年九年级化学人教版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 125.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-24 20:04:09 | ||
图片预览


文档简介
10.2 酸和碱的中和反应 同步练习
一、单选题
1.某物质能使紫色石蕊溶液变为蓝色,关于该物质的下列说法中正确的是
A.该物质可能是氢氧化铜
B.该物质一定是纯碱的水溶液
C.可以将pH试纸放入该物质的稀溶液中测其pH
D.向该物质的水溶液中滴加稀盐酸,溶液的pH一定变小
2.pH是水质监测的重要指标之一,下列水样酸性最强的是
A.pH=1.3的工业废水 B.pH=4.5的雨水
C.pH=7.0的蒸馏水 D.pH=7.3的矿泉水
3.U形管中是滴有酚酞试液的蒸馏水,向左、右两管中分别同时逐滴滴加一定量的氢氧化钠稀溶液和稀盐酸(如图所示)。下列说法正确的是
A.开始时左边溶液呈蓝色,右边溶液呈红色
B.开始时左边溶液呈无色,右边溶液呈红色、
C.充分反应后U形管中溶液可能呈红色
D.充分反应后U形管中溶液一定呈无色
4.中国工程院院士袁隆平宣布了一项重大突破成果——水稻亲本去镉技术,水稻对镉的吸收量与土壤pH关系如图所示。下列物质可用于改良土壤结构,降低水稻对镉吸收量的是( )
A.熟石灰 B.硫酸铜
C.稀盐酸 D.氯化钠
5.下表是几种作物适宜生长的pH范围:
作物 马铃薯 茶树 水稻 莲
pH 4.8~5.5 5.0~5.5 6.0~7.0 8.0~9.0
某地土壤呈碱性,则该地适宜种植的作物是( )A.马铃薯 B.茶树 C.水稻 D.莲
6.“归纳或类推”是学习化学常用的方法。下列说法正确的是 ( )
A.氧化物中都含有氧元素,含有氧元素的化合物都是氧化物
B.中和反应生成盐和水,有盐和水生成的反应一定是中和反应
C.一氧化碳和氢气都能夺取氧化铜中的氧,它们都具有还原性
D.碱溶液能使酚酞试液变红,所以能使酚酞试液变红的物质一定是碱溶液
7.推理是学习化学的一种重要方法,下列推理合理的是
A.离子是带电荷的粒子,则带电荷的粒子一定是离子
B.单质是由同种元素组成的,则只含一种元素的纯净物一定是单质
C.中和反应有盐和水生成,则有盐和水生成的反应一定是中和反应
D.溶液具有均一性和稳定性,则具有均一性和稳定性的液体一定是溶液
8.利用饱和碳酸钠溶液与酸反应,小科同学制作了如图甲所示的简易酸碱灭火器装置,并进行操作。操作结束后,对瓶中残留液进行如图乙所示的实验。实验现象:A试管溶液变红色,B试管中有白色沉淀生成。则残留液中含有的溶质有
A.盐酸 B.碳酸钠 C.硫酸钠 D.氯化钠
9.新鲜魔芋在去皮时出现的白色汁液内含有一种碱性物质——皂角甙,皮肤沾上它会奇痒难忍。下列厨房中的物质止痒效果最好的是
A.料酒 B.食醋 C.纯碱溶液 D.食盐水
10.生活中一些物质的pH如下:
物质 白醋 橘子汁 料酒 炉具清洁剂
pH 2~3 3~4 6~7 12~13
其中能使无色酚酞溶液变红的是A.白醋 B.橘子汁 C.料酒 D.炉具清洁剂
11.紫甘蓝是大众爱吃的蔬菜,含有丰富的花青素,花青素遇酸性溶液变红色,遇碱性溶液变蓝色,在凉拌紫甘蓝丝时,观察到菜丝变成红色,可能是加入了下列哪种调味品
A.食盐 B.味精 C.食醋 D.香油
12.推理是化学学习中常用的思维方法。下列推理正确的是( )
A.酸碱中和反应有盐和水生成,则有盐和水生成的反应一定是酸碱中和反应
B.碱能使无色酚酞溶液变红,则能使无色酞溶液变红的一定是碱
C.单质是由同种元素组成的,则由同种元素组成的物质一定是单质
D.浓硫酸敞放于空气中浓度会减小,则可证明浓硫酸具有吸水性
13.证据推理是化学学科核心素养的重要内容,下列推理正确的是
A.酸能使紫色石蕊溶液变色,所以酸也能使无色酚酞溶液变色
B.化合物由不同种元素组成,所以由不同种元素组成的纯净物一定是化合物
C.中和反应是有盐和水生成的反应,所以有盐和水生成的反应一定是中和反应
D.燃烧都伴随有发光、放热现象,所以有发光、放热现象的变化一定是燃烧
14.下列有关酸碱盐的说法中,错误的是( )
A.用氢氧化铝治疗胃酸过多是利用了中和反应原理
B.浓盐酸敞口放置在空气中会产生白雾
C.侯氏制碱法中的“碱”是指NaOH
D.治理硫酸厂的污水时,可向该污水中投放适量的生石灰
15.类推是化学学习中常用的思维方法.下列类推正确的是( )
A.活泼金属与酸反应有气体产生,则与酸反应产生气体的一定是活泼金属
B.酸与碱发生中和反应生成盐和水,则生成盐和水的反应一定是中和反应
C.单质一定是由同种元素组成的物质,则由同种元素组成的物质一定是单质
D.碱性溶液能使酚酞溶液变红,则能使酚酞溶液变红的溶液一定是碱性溶液
16.下列关于酸、碱的说法错误的是
A.苛性钠、烧碱、火碱都是氢氧化钠
B.氢氧化钙可以用来改良酸性土壤
C.稀盐酸能够使酚酞溶液变红
D.生活中许多常见的物质(如柠檬、柑橘)中含有酸
二、综合应用题
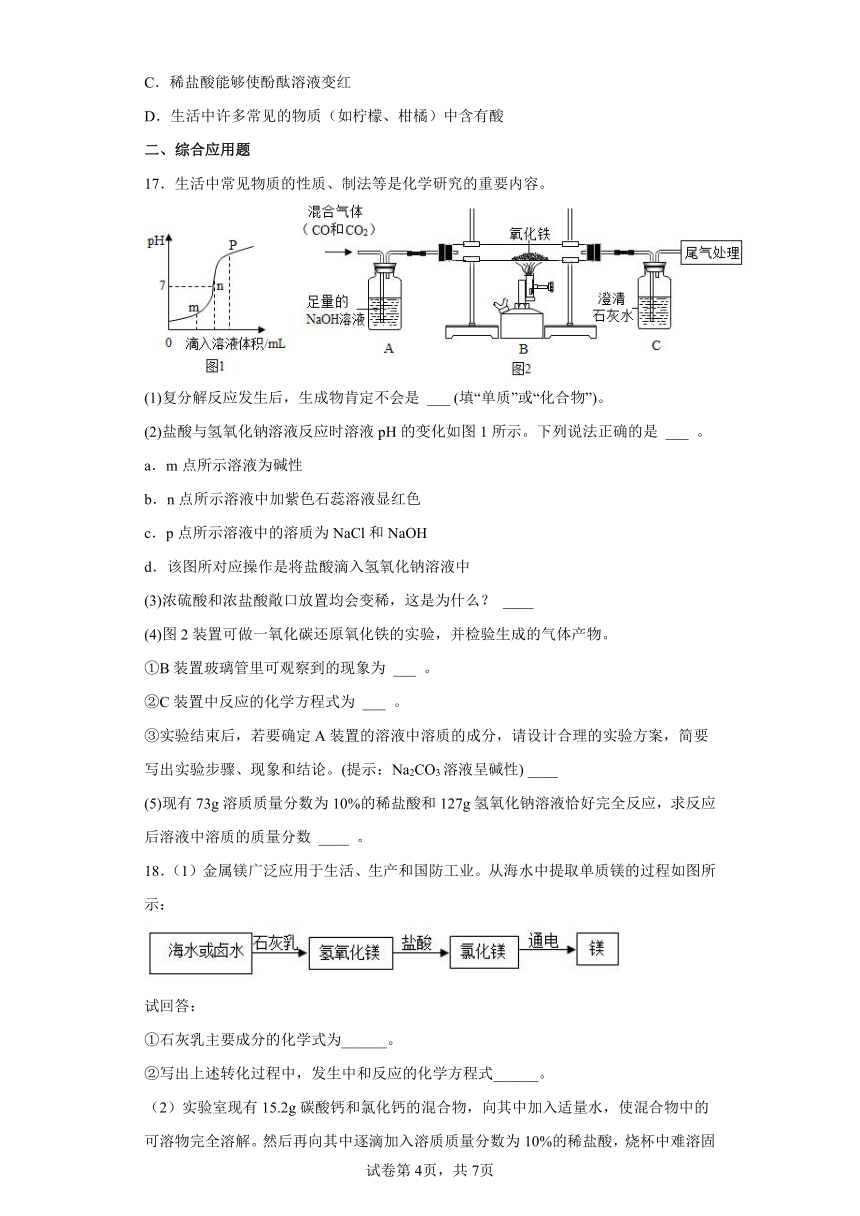
17.生活中常见物质的性质、制法等是化学研究的重要内容。
(1)复分解反应发生后,生成物肯定不会是 ___ (填“单质”或“化合物”)。
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图1所示。下列说法正确的是 ___ 。
a.m点所示溶液为碱性
b.n点所示溶液中加紫色石蕊溶液显红色
c.p点所示溶液中的溶质为NaCl和NaOH
d.该图所对应操作是将盐酸滴入氢氧化钠溶液中
(3)浓硫酸和浓盐酸敞口放置均会变稀,这是为什么? ____
(4)图2装置可做一氧化碳还原氧化铁的实验,并检验生成的气体产物。
①B装置玻璃管里可观察到的现象为 ___ 。
②C装置中反应的化学方程式为 ___ 。
③实验结束后,若要确定A装置的溶液中溶质的成分,请设计合理的实验方案,简要写出实验步骤、现象和结论。(提示:Na2CO3溶液呈碱性) ____
(5)现有73g溶质质量分数为10%的稀盐酸和127g氢氧化钠溶液恰好完全反应,求反应后溶液中溶质的质量分数 ____ 。
18.(1)金属镁广泛应用于生活、生产和国防工业。从海水中提取单质镁的过程如图所示:
试回答:
①石灰乳主要成分的化学式为______。
②写出上述转化过程中,发生中和反应的化学方程式______。
(2)实验室现有15.2g碳酸钙和氯化钙的混合物,向其中加入适量水,使混合物中的可溶物完全溶解。然后再向其中逐滴加入溶质质量分数为10%的稀盐酸,烧杯中难溶固体物质的质量与所滴入稀盐酸的质量关系曲线如图所示。试回答:
①在滴入稀盐酸的过程中,观察到的一项明显现象是:______。
②当滴入10%的稀盐酸至图中A点时,烧杯中溶液里含有的溶质是(写化学式)______。
③试计算原混合物中氯化钙的质量______。(写出计算过程,结果精确至0.1g)
19.金属、酸、碱是重要的化学物质,与人类日常生活和工农业生产关系十分密切。
(1)某同学为探究相关金属的化学性质,做了下列实验:
①只通过A和B实验尚不能证明银铜的活动性强弱,需补充一个实验来证明,应补充的实验是______。
②实验C中物质充分反应后溶液呈无色,过滤所得滤渣的成分是______。
(2)铁车架的表面刷油漆能防止锈蚀,其原因是______;用硫酸除铁锈(Fe2O3)的化学方程式为______。
(3)如图是盐酸和氢氧化钠反应的过程中,溶液pH的变化图象,请回答下列问题。
①写出氢氧化钠和盐酸反应的化学方程式______。
②当溶液呈中性时,所消耗氢氧化钠溶液的体积是______mL。
③向图中b点所示溶液中滴加酚酞溶液,溶液呈______色。
(4)某同学用50g稀盐酸与石灰石反应制取CO2气体,恰好完全反应后,得到溶质质量分数为20%的溶液55.5g,则该稀盐酸中溶质的质量分数是多少?
20.化学源于生活,生活中蕴含着许多化学知识。
(1)酒精洒到餐桌上着火,用湿抹布盖灭,主要是利用灭火原理中的______。
(2)生活中常用洗涤剂除油污,是因为洗涤剂具有______。
(3)用含氢氧化铝的药物治疗胃酸过多,原因是______(用化学方程式表示),该反应的基本反应类型是______。
(4)喝了汽水以后,常常会打嗝,说明______。
(5)生石灰常用作食品干燥剂,其原因是(用化学方程式表示)______。
(6)生活中的燃烧着火点比较:蜂窝煤______小木条(填“>”、“<”或“=”)。生煤炉过程中,不断扇入空气目的是______,煤不完全燃烧产生一种有毒气体的化学式是______;
(7)食品包装学问大
①嘶马羊耳采用真空包装,延长了食品的保质期,原理是______;
②将N2充入包装袋内做保护气,是因为N2的化学性质______(填“活泼”或“稳定”);
③下图是“504双吸剂”的标签,请回答下列问题:
a.其中至少含有______种单质;
b.为测定此双吸剂的使用效果,取足量双吸剂做了如下图所示的实验,一段时间后,进入试管中水的体积______21%(填“>”、“<”或“=”),理由是______;
c.部分失效的双吸剂中,有红棕色固体,其主要是______;
d.此双吸剂中,NaCl的作用可能是______。
21.为从定量角度认识中和反应,小明同学自行设计并进行了下面实验:
①在小烧杯中倒人8%的氢氧化钠溶液l0g,滴入2滴酚酞试剂后,溶液呈红色;
②另取10%的稀盐酸逐滴滴加到氢氧化钠溶液中,边滴边振荡,随盐酸滴入,溶液颜色逐渐变浅;
③在溶液红色消失瞬间,停止实验。
若停止实验时,两溶液恰好反应。请分析小明实验后回答:
(1)实验中酚酞试剂的作用是_________________________________________;
(2)如果红色消失瞬间继续滴加稀盐酸,溶液会呈____色,此时溶液中的溶质有__________(不包括指示剂)
(3)计算在溶液红色消失瞬间,停止实验,这时共用去稀盐酸的质量是多少________ (精确到0.1)
22.判断化学反应发生的根本依据应该是有新物质生成.
(1)两种物质的溶液混合后,若有沉淀、气体产生,可以帮助我们判断化学反应是否发生.请写出一有沉淀产生,且属于复分解反应类型的化学方程式_______________.
(2)氢氧化钠与CO2反应时无明显现象.如图1是某同学设计的实验装置,其气密良好.
①若胶头滴管中的物质是浓NaOH溶液,锥形瓶中充满CO2,则挤压胶头滴管后观察到什么现象______________并写出发生反应的化学方程式______.
②小明同学认为原因是二氧化碳溶于了水中所造成的.请你在上述实验的基础,进一步做补充实验,证明氢氧化钠和二氧化碳确实发生了化学反应(要求写出实验操作及判断依据)_______
(3)氢氧化钠溶液与稀盐酸发生反应过程中溶液pH变化如图2所示.
①B点表示的溶液中溶质为:_____
②该实验过程中,后用滴管加入的溶液为_____;
③为探究盐酸与氢氧化钠溶液是否发生反应,某同学在两者混合后溶液样品中加硝酸银溶液,看是否产生白色沉淀.同学们认为此方案不正确,请简述其中的理由__________
(4)称取12.5g石灰石(杂质不参加反应)放入烧杯中,向其中加入50g稀盐酸,二者恰好完全反应.应结束后称量烧杯中剩余物质的总质量为58.lg(不包括烧杯的质量,且气体的溶解忽略不计).请算:石灰石中杂质的质量分数是多少?_________
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.A
3.C
4.A
5.D
6.C
7.B
8.C
9.B
10.D
11.C
12.D
13.B
14.C
15.D
16.C
17. 单质 C 浓硫酸有吸水性,吸收空气中水蒸气使溶剂增多,浓盐酸有挥发性,使溶质减小。 固体红色粉末逐渐变黑 CO2+Ca(OH)2===CaCO3↓+H2O 取少量,A装置中溶液少量放在试管中,加入过量(足量)CaCl2溶液静置,向上层清液中加入几滴酚酞。若溶液变红,则溶质为Na2CO3和NaOH,若溶液没有变成红色则溶质为Na2CO3
18. Ca(OH)2 固体物质不断溶解(或有气体产生) CaCl2 解:73 g 10%的稀盐酸中含HCl的质量是:73g×10% = 7.3g
设原混合物中碳酸钙的质量为x
原混合物中氯化钙的质量=15.2 g-10.0g =5.2g
答:原混合物中氯化钙的质量为5.2g。
19.(1) Cu和Ag NO3溶液反应。 Ag和Cu,可能有Zn。
(2) 隔绝空气中的氧气和水蒸气。
(3) 10 红色
(4)14.6%
20.(1)隔绝氧气
(2)乳化作用
(3) 复分解反应
(4)二氧化碳等气体的溶解度随温度升高而降低。
(5)
(6) > 提供充足的氧气 CO
(7) 隔绝氧气 稳定 两 > 双吸剂可以吸收空气中的氧气、二氧化碳、水蒸气 氧化铁 加快铁粉生锈的速率
21. 判断反应进行和进行的程度 无 NaCl、HCl )7.3g
22. 2NaOH+CuSO4═Cu(OH)2↓+Na2SO4 U形管内出现左高右低的现象 2NaOH+CO2═Na2CO3+H2O 取反应后的溶液加入试管中,滴加稀盐酸,有气泡产生 氢氧化钠、氯化钠 氢氧化钠溶液 滴加硝酸银有白色沉淀,只能说明溶液中含有氯离子,不能说明生成了新物质氯化钠,因为盐酸与硝酸银溶液反应也有白色沉淀 20%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.某物质能使紫色石蕊溶液变为蓝色,关于该物质的下列说法中正确的是
A.该物质可能是氢氧化铜
B.该物质一定是纯碱的水溶液
C.可以将pH试纸放入该物质的稀溶液中测其pH
D.向该物质的水溶液中滴加稀盐酸,溶液的pH一定变小
2.pH是水质监测的重要指标之一,下列水样酸性最强的是
A.pH=1.3的工业废水 B.pH=4.5的雨水
C.pH=7.0的蒸馏水 D.pH=7.3的矿泉水
3.U形管中是滴有酚酞试液的蒸馏水,向左、右两管中分别同时逐滴滴加一定量的氢氧化钠稀溶液和稀盐酸(如图所示)。下列说法正确的是
A.开始时左边溶液呈蓝色,右边溶液呈红色
B.开始时左边溶液呈无色,右边溶液呈红色、
C.充分反应后U形管中溶液可能呈红色
D.充分反应后U形管中溶液一定呈无色
4.中国工程院院士袁隆平宣布了一项重大突破成果——水稻亲本去镉技术,水稻对镉的吸收量与土壤pH关系如图所示。下列物质可用于改良土壤结构,降低水稻对镉吸收量的是( )
A.熟石灰 B.硫酸铜
C.稀盐酸 D.氯化钠
5.下表是几种作物适宜生长的pH范围:
作物 马铃薯 茶树 水稻 莲
pH 4.8~5.5 5.0~5.5 6.0~7.0 8.0~9.0
某地土壤呈碱性,则该地适宜种植的作物是( )A.马铃薯 B.茶树 C.水稻 D.莲
6.“归纳或类推”是学习化学常用的方法。下列说法正确的是 ( )
A.氧化物中都含有氧元素,含有氧元素的化合物都是氧化物
B.中和反应生成盐和水,有盐和水生成的反应一定是中和反应
C.一氧化碳和氢气都能夺取氧化铜中的氧,它们都具有还原性
D.碱溶液能使酚酞试液变红,所以能使酚酞试液变红的物质一定是碱溶液
7.推理是学习化学的一种重要方法,下列推理合理的是
A.离子是带电荷的粒子,则带电荷的粒子一定是离子
B.单质是由同种元素组成的,则只含一种元素的纯净物一定是单质
C.中和反应有盐和水生成,则有盐和水生成的反应一定是中和反应
D.溶液具有均一性和稳定性,则具有均一性和稳定性的液体一定是溶液
8.利用饱和碳酸钠溶液与酸反应,小科同学制作了如图甲所示的简易酸碱灭火器装置,并进行操作。操作结束后,对瓶中残留液进行如图乙所示的实验。实验现象:A试管溶液变红色,B试管中有白色沉淀生成。则残留液中含有的溶质有
A.盐酸 B.碳酸钠 C.硫酸钠 D.氯化钠
9.新鲜魔芋在去皮时出现的白色汁液内含有一种碱性物质——皂角甙,皮肤沾上它会奇痒难忍。下列厨房中的物质止痒效果最好的是
A.料酒 B.食醋 C.纯碱溶液 D.食盐水
10.生活中一些物质的pH如下:
物质 白醋 橘子汁 料酒 炉具清洁剂
pH 2~3 3~4 6~7 12~13
其中能使无色酚酞溶液变红的是A.白醋 B.橘子汁 C.料酒 D.炉具清洁剂
11.紫甘蓝是大众爱吃的蔬菜,含有丰富的花青素,花青素遇酸性溶液变红色,遇碱性溶液变蓝色,在凉拌紫甘蓝丝时,观察到菜丝变成红色,可能是加入了下列哪种调味品
A.食盐 B.味精 C.食醋 D.香油
12.推理是化学学习中常用的思维方法。下列推理正确的是( )
A.酸碱中和反应有盐和水生成,则有盐和水生成的反应一定是酸碱中和反应
B.碱能使无色酚酞溶液变红,则能使无色酞溶液变红的一定是碱
C.单质是由同种元素组成的,则由同种元素组成的物质一定是单质
D.浓硫酸敞放于空气中浓度会减小,则可证明浓硫酸具有吸水性
13.证据推理是化学学科核心素养的重要内容,下列推理正确的是
A.酸能使紫色石蕊溶液变色,所以酸也能使无色酚酞溶液变色
B.化合物由不同种元素组成,所以由不同种元素组成的纯净物一定是化合物
C.中和反应是有盐和水生成的反应,所以有盐和水生成的反应一定是中和反应
D.燃烧都伴随有发光、放热现象,所以有发光、放热现象的变化一定是燃烧
14.下列有关酸碱盐的说法中,错误的是( )
A.用氢氧化铝治疗胃酸过多是利用了中和反应原理
B.浓盐酸敞口放置在空气中会产生白雾
C.侯氏制碱法中的“碱”是指NaOH
D.治理硫酸厂的污水时,可向该污水中投放适量的生石灰
15.类推是化学学习中常用的思维方法.下列类推正确的是( )
A.活泼金属与酸反应有气体产生,则与酸反应产生气体的一定是活泼金属
B.酸与碱发生中和反应生成盐和水,则生成盐和水的反应一定是中和反应
C.单质一定是由同种元素组成的物质,则由同种元素组成的物质一定是单质
D.碱性溶液能使酚酞溶液变红,则能使酚酞溶液变红的溶液一定是碱性溶液
16.下列关于酸、碱的说法错误的是
A.苛性钠、烧碱、火碱都是氢氧化钠
B.氢氧化钙可以用来改良酸性土壤
C.稀盐酸能够使酚酞溶液变红
D.生活中许多常见的物质(如柠檬、柑橘)中含有酸
二、综合应用题
17.生活中常见物质的性质、制法等是化学研究的重要内容。
(1)复分解反应发生后,生成物肯定不会是 ___ (填“单质”或“化合物”)。
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图1所示。下列说法正确的是 ___ 。
a.m点所示溶液为碱性
b.n点所示溶液中加紫色石蕊溶液显红色
c.p点所示溶液中的溶质为NaCl和NaOH
d.该图所对应操作是将盐酸滴入氢氧化钠溶液中
(3)浓硫酸和浓盐酸敞口放置均会变稀,这是为什么? ____
(4)图2装置可做一氧化碳还原氧化铁的实验,并检验生成的气体产物。
①B装置玻璃管里可观察到的现象为 ___ 。
②C装置中反应的化学方程式为 ___ 。
③实验结束后,若要确定A装置的溶液中溶质的成分,请设计合理的实验方案,简要写出实验步骤、现象和结论。(提示:Na2CO3溶液呈碱性) ____
(5)现有73g溶质质量分数为10%的稀盐酸和127g氢氧化钠溶液恰好完全反应,求反应后溶液中溶质的质量分数 ____ 。
18.(1)金属镁广泛应用于生活、生产和国防工业。从海水中提取单质镁的过程如图所示:
试回答:
①石灰乳主要成分的化学式为______。
②写出上述转化过程中,发生中和反应的化学方程式______。
(2)实验室现有15.2g碳酸钙和氯化钙的混合物,向其中加入适量水,使混合物中的可溶物完全溶解。然后再向其中逐滴加入溶质质量分数为10%的稀盐酸,烧杯中难溶固体物质的质量与所滴入稀盐酸的质量关系曲线如图所示。试回答:
①在滴入稀盐酸的过程中,观察到的一项明显现象是:______。
②当滴入10%的稀盐酸至图中A点时,烧杯中溶液里含有的溶质是(写化学式)______。
③试计算原混合物中氯化钙的质量______。(写出计算过程,结果精确至0.1g)
19.金属、酸、碱是重要的化学物质,与人类日常生活和工农业生产关系十分密切。
(1)某同学为探究相关金属的化学性质,做了下列实验:
①只通过A和B实验尚不能证明银铜的活动性强弱,需补充一个实验来证明,应补充的实验是______。
②实验C中物质充分反应后溶液呈无色,过滤所得滤渣的成分是______。
(2)铁车架的表面刷油漆能防止锈蚀,其原因是______;用硫酸除铁锈(Fe2O3)的化学方程式为______。
(3)如图是盐酸和氢氧化钠反应的过程中,溶液pH的变化图象,请回答下列问题。
①写出氢氧化钠和盐酸反应的化学方程式______。
②当溶液呈中性时,所消耗氢氧化钠溶液的体积是______mL。
③向图中b点所示溶液中滴加酚酞溶液,溶液呈______色。
(4)某同学用50g稀盐酸与石灰石反应制取CO2气体,恰好完全反应后,得到溶质质量分数为20%的溶液55.5g,则该稀盐酸中溶质的质量分数是多少?
20.化学源于生活,生活中蕴含着许多化学知识。
(1)酒精洒到餐桌上着火,用湿抹布盖灭,主要是利用灭火原理中的______。
(2)生活中常用洗涤剂除油污,是因为洗涤剂具有______。
(3)用含氢氧化铝的药物治疗胃酸过多,原因是______(用化学方程式表示),该反应的基本反应类型是______。
(4)喝了汽水以后,常常会打嗝,说明______。
(5)生石灰常用作食品干燥剂,其原因是(用化学方程式表示)______。
(6)生活中的燃烧着火点比较:蜂窝煤______小木条(填“>”、“<”或“=”)。生煤炉过程中,不断扇入空气目的是______,煤不完全燃烧产生一种有毒气体的化学式是______;
(7)食品包装学问大
①嘶马羊耳采用真空包装,延长了食品的保质期,原理是______;
②将N2充入包装袋内做保护气,是因为N2的化学性质______(填“活泼”或“稳定”);
③下图是“504双吸剂”的标签,请回答下列问题:
a.其中至少含有______种单质;
b.为测定此双吸剂的使用效果,取足量双吸剂做了如下图所示的实验,一段时间后,进入试管中水的体积______21%(填“>”、“<”或“=”),理由是______;
c.部分失效的双吸剂中,有红棕色固体,其主要是______;
d.此双吸剂中,NaCl的作用可能是______。
21.为从定量角度认识中和反应,小明同学自行设计并进行了下面实验:
①在小烧杯中倒人8%的氢氧化钠溶液l0g,滴入2滴酚酞试剂后,溶液呈红色;
②另取10%的稀盐酸逐滴滴加到氢氧化钠溶液中,边滴边振荡,随盐酸滴入,溶液颜色逐渐变浅;
③在溶液红色消失瞬间,停止实验。
若停止实验时,两溶液恰好反应。请分析小明实验后回答:
(1)实验中酚酞试剂的作用是_________________________________________;
(2)如果红色消失瞬间继续滴加稀盐酸,溶液会呈____色,此时溶液中的溶质有__________(不包括指示剂)
(3)计算在溶液红色消失瞬间,停止实验,这时共用去稀盐酸的质量是多少________ (精确到0.1)
22.判断化学反应发生的根本依据应该是有新物质生成.
(1)两种物质的溶液混合后,若有沉淀、气体产生,可以帮助我们判断化学反应是否发生.请写出一有沉淀产生,且属于复分解反应类型的化学方程式_______________.
(2)氢氧化钠与CO2反应时无明显现象.如图1是某同学设计的实验装置,其气密良好.
①若胶头滴管中的物质是浓NaOH溶液,锥形瓶中充满CO2,则挤压胶头滴管后观察到什么现象______________并写出发生反应的化学方程式______.
②小明同学认为原因是二氧化碳溶于了水中所造成的.请你在上述实验的基础,进一步做补充实验,证明氢氧化钠和二氧化碳确实发生了化学反应(要求写出实验操作及判断依据)_______
(3)氢氧化钠溶液与稀盐酸发生反应过程中溶液pH变化如图2所示.
①B点表示的溶液中溶质为:_____
②该实验过程中,后用滴管加入的溶液为_____;
③为探究盐酸与氢氧化钠溶液是否发生反应,某同学在两者混合后溶液样品中加硝酸银溶液,看是否产生白色沉淀.同学们认为此方案不正确,请简述其中的理由__________
(4)称取12.5g石灰石(杂质不参加反应)放入烧杯中,向其中加入50g稀盐酸,二者恰好完全反应.应结束后称量烧杯中剩余物质的总质量为58.lg(不包括烧杯的质量,且气体的溶解忽略不计).请算:石灰石中杂质的质量分数是多少?_________
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.A
3.C
4.A
5.D
6.C
7.B
8.C
9.B
10.D
11.C
12.D
13.B
14.C
15.D
16.C
17. 单质 C 浓硫酸有吸水性,吸收空气中水蒸气使溶剂增多,浓盐酸有挥发性,使溶质减小。 固体红色粉末逐渐变黑 CO2+Ca(OH)2===CaCO3↓+H2O 取少量,A装置中溶液少量放在试管中,加入过量(足量)CaCl2溶液静置,向上层清液中加入几滴酚酞。若溶液变红,则溶质为Na2CO3和NaOH,若溶液没有变成红色则溶质为Na2CO3
18. Ca(OH)2 固体物质不断溶解(或有气体产生) CaCl2 解:73 g 10%的稀盐酸中含HCl的质量是:73g×10% = 7.3g
设原混合物中碳酸钙的质量为x
原混合物中氯化钙的质量=15.2 g-10.0g =5.2g
答:原混合物中氯化钙的质量为5.2g。
19.(1) Cu和Ag NO3溶液反应。 Ag和Cu,可能有Zn。
(2) 隔绝空气中的氧气和水蒸气。
(3) 10 红色
(4)14.6%
20.(1)隔绝氧气
(2)乳化作用
(3) 复分解反应
(4)二氧化碳等气体的溶解度随温度升高而降低。
(5)
(6) > 提供充足的氧气 CO
(7) 隔绝氧气 稳定 两 > 双吸剂可以吸收空气中的氧气、二氧化碳、水蒸气 氧化铁 加快铁粉生锈的速率
21. 判断反应进行和进行的程度 无 NaCl、HCl )7.3g
22. 2NaOH+CuSO4═Cu(OH)2↓+Na2SO4 U形管内出现左高右低的现象 2NaOH+CO2═Na2CO3+H2O 取反应后的溶液加入试管中,滴加稀盐酸,有气泡产生 氢氧化钠、氯化钠 氢氧化钠溶液 滴加硝酸银有白色沉淀,只能说明溶液中含有氯离子,不能说明生成了新物质氯化钠,因为盐酸与硝酸银溶液反应也有白色沉淀 20%
答案第1页,共2页
答案第1页,共2页
同课章节目录
