10.2酸和碱的中和反应同步练习-2021_2022学年九年级化学人教版下册(word版有答案)
文档属性
| 名称 | 10.2酸和碱的中和反应同步练习-2021_2022学年九年级化学人教版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 105.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-24 20:05:38 | ||
图片预览



文档简介
10.2 酸和碱的中和反应 同步练习
一、单选题
1.除去下列各组物质中的杂质(括号内为杂质),所选用的试剂(足量)及操作方法均正确的是( )
选项 物质 选用试剂 操作方法
A Fe2O3(Fe) 盐酸 浸泡、过滤、洗涤、烘干
B CO(CO2) NaOH溶液、浓硫酸 洗气、干燥
C CaO(CaCO3) 水 过滤、烘干
D NaCl(Na2CO3) Ca(NO3)2溶液 溶解、过滤、蒸发、结晶
A.A B.B C.C D.D
2.下列清洁用品中碱性最强的是
A.厕所清洁剂pH=1 B.牙膏pH=8 C.肥皂pH=10 D.炉具清洁剂pH=13
3.证据推理是化学学科核心素养的重要内容,下列推理正确的是
A.酸能使紫色石蕊溶液变色,所以酸也能使无色酚酞溶液变色
B.化合物由不同种元素组成,所以由不同种元素组成的纯净物一定是化合物
C.中和反应是有盐和水生成的反应,所以有盐和水生成的反应一定是中和反应
D.燃烧都伴随有发光、放热现象,所以有发光、放热现象的变化一定是燃烧
4.中和反应在工农业生产和日常生活中有广泛的用途.下列应用一定与中和反应原理无关的是
A.施用熟石灰改良酸性土壤
B.用胃舒平(主要成分氢氧化铝)治疗胃酸过多
C.用熟石灰和硫酸铜配制波尔多液
D.用NaOH溶液洗涤石油产品中的残余硫酸
5.下列有关溶液酸碱性的说法错误的是( )
A.pH=7的溶液呈中性
B.pH>7的溶液一定呈碱性
C.pH<7的雨水一定是酸雨
D.酸溶液的pH越小酸性越强
6.下列做法利用了酸碱中和反应原理的是( )
A.用食醋腌木瓜放入食盐进行调味 B.用稀盐酸除去铁钉上的铁锈
C.焙制蛋糕时加入碳酸氢钠使蛋糕膨松 D.服用含氢氧化铝的药物治疗胃酸过多症
7.下列说法错误的是
A.改良酸性土壤可用烧碱
B.回收废旧金属不仅节约金属资源,还可减少环境污染
C.研究煤炭中硫资源的综合开发和利用是防治酸雨的有效途径之一
D.乙醇汽油的使用可适当节省石油资源,并在一定程度上减少汽车尾气的污染
8.下列有关酸碱盐的说法中,错误的是( )
A.用氢氧化铝治疗胃酸过多是利用了中和反应原理
B.浓盐酸敞口放置在空气中会产生白雾
C.侯氏制碱法中的“碱”是指NaOH
D.治理硫酸厂的污水时,可向该污水中投放适量的生石灰
9.某校化学小组在利用硫酸和氢氧化钾两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图所示。下列说法正确的是
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是K2SO4和H2SO4
C.该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸溶液的烧杯中
D.由c点到d点的变化过程中没有发生化学反应
10.饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
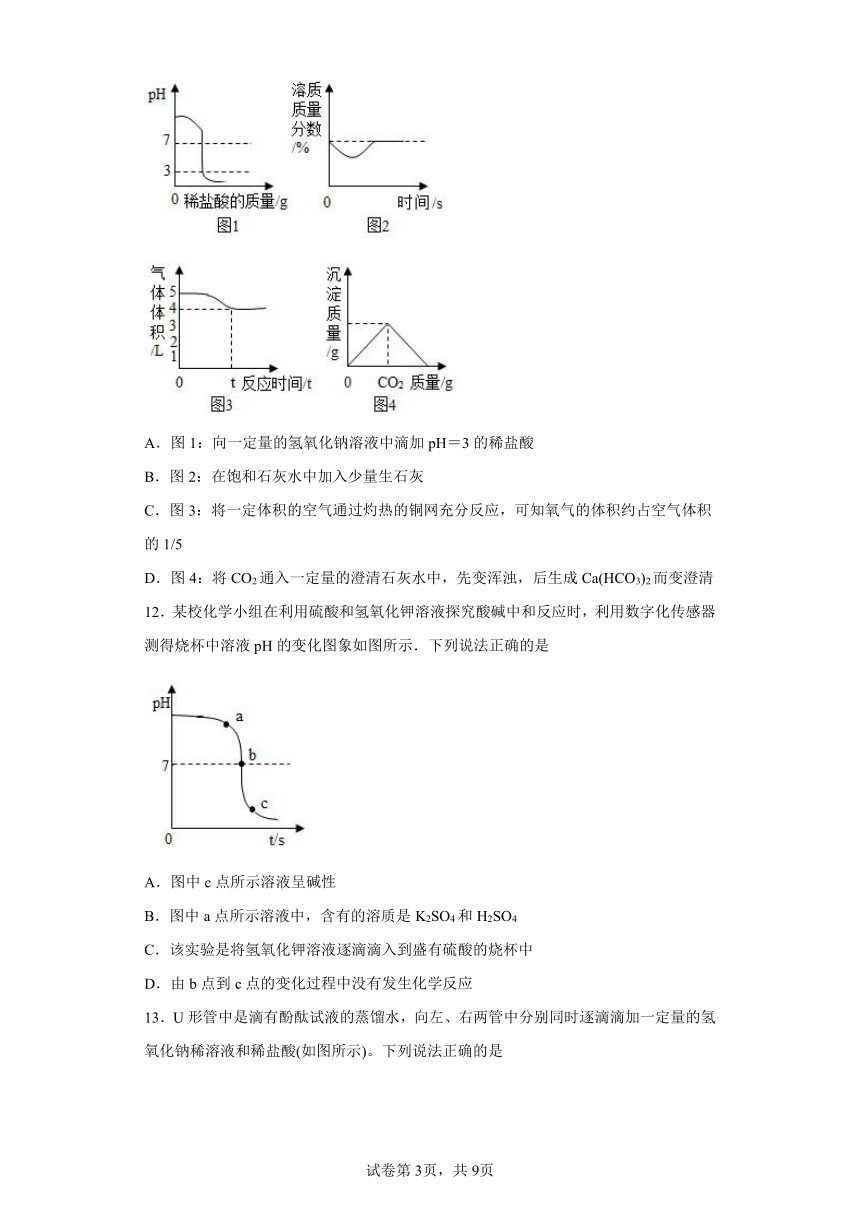
11.观察下列图像,所得结论不正确的是
A.图1:向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
B.图2:在饱和石灰水中加入少量生石灰
C.图3:将一定体积的空气通过灼热的铜网充分反应,可知氧气的体积约占空气体积的1/5
D.图4:将CO2通入一定量的澄清石灰水中,先变浑浊,后生成Ca(HCO3)2而变澄清
12.某校化学小组在利用硫酸和氢氧化钾溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象如图所示.下列说法正确的是
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是K2SO4和H2SO4
C.该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸的烧杯中
D.由b点到c点的变化过程中没有发生化学反应
13.U形管中是滴有酚酞试液的蒸馏水,向左、右两管中分别同时逐滴滴加一定量的氢氧化钠稀溶液和稀盐酸(如图所示)。下列说法正确的是
A.开始时左边溶液呈蓝色,右边溶液呈红色
B.开始时左边溶液呈无色,右边溶液呈红色、
C.充分反应后U形管中溶液可能呈红色
D.充分反应后U形管中溶液一定呈无色
14.下列物质能使紫色石蕊试液变红的是( )
A.胃液 B.氨水 C.蔗糖水 D.pH约为7.8的鸡蛋清
15.类推是化学学习中常用的思维方法.下列类推正确的是( )
A.活泼金属与酸反应有气体产生,则与酸反应产生气体的一定是活泼金属
B.酸与碱发生中和反应生成盐和水,则生成盐和水的反应一定是中和反应
C.单质一定是由同种元素组成的物质,则由同种元素组成的物质一定是单质
D.碱性溶液能使酚酞溶液变红,则能使酚酞溶液变红的溶液一定是碱性溶液
16.一些食物的近似pH如下:
食物 葡萄汁 苹果汁 牛奶 鸡蛋清
pH 3.5~4.5 2.9~3.3 6.3~6.6 7.6~8.0
下列说法中不正确的是A.鸡蛋清和牛奶显碱性 B.苹果汁和葡萄汁显酸性
C.苹果汁比葡萄汁的酸性强 D.胃酸过多的人应少饮苹果汁和葡萄汁
二、综合应用题
17.同学们在实验室做了以下实验,请回答相关问题。
(一)铝片与硫酸铜溶液反应:同学们把打磨光亮的铝片插入硫酸铜溶液中,过一会儿,发现了一个“意外现象”:在铝片表面看到有红色固体析出的同时,还看到有少量的气泡冒出。
(1)写出生成红色固体的化学方程式_____。
【提出问题】该气体是什么呢?
【猜想与假设】猜想一:O2 猜想二:H2 猜想三:CO2 猜想四:SO2
(2)同学们经过讨论,一致认为猜想三不成立,理由是_____。
【实验验证】
(3)有同学闻了一下该气体,发现无气味,证明猜想四也不成立,理由是_____。
(4)将产生的气体经验纯后,用导管导入到点燃的酒精灯火焰上,气体安静燃烧,产生淡蓝色火焰。
【实验结论】_____。
【反思与交流】CuSO4溶液可能显_____性(填“酸”或“碱”或“中”)。
(二)稀氢氧化钠溶液与稀盐酸的反应
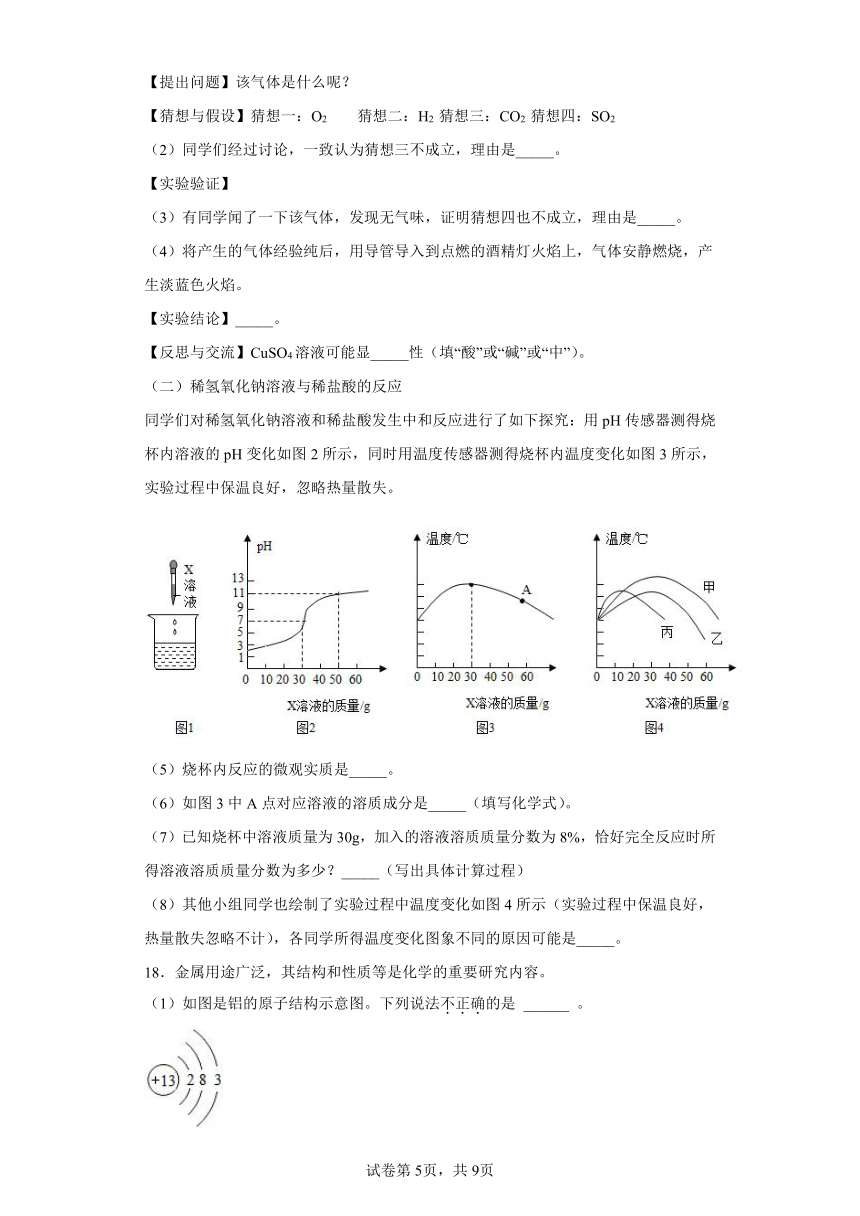
同学们对稀氢氧化钠溶液和稀盐酸发生中和反应进行了如下探究:用pH传感器测得烧杯内溶液的pH变化如图2所示,同时用温度传感器测得烧杯内温度变化如图3所示,实验过程中保温良好,忽略热量散失。
(5)烧杯内反应的微观实质是_____。
(6)如图3中A点对应溶液的溶质成分是_____(填写化学式)。
(7)已知烧杯中溶液质量为30g,加入的溶液溶质质量分数为8%,恰好完全反应时所得溶液溶质质量分数为多少?_____(写出具体计算过程)
(8)其他小组同学也绘制了实验过程中温度变化如图4所示(实验过程中保温良好,热量散失忽略不计),各同学所得温度变化图象不同的原因可能是_____。
18.金属用途广泛,其结构和性质等是化学的重要研究内容。
(1)如图是铝的原子结构示意图。下列说法不正确的是 ______ 。
A铝原子的质子数为13
B在化合物中铝通常显+3价
C铝是地壳中含量最多的元素
D铝可作导线是由于它具有良好的导电性
(2)某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了如图实验, 并对溶液A和固体B的成分进行了分析和实验探究。
【提出问题】溶液A中的溶质可能有哪些?
【作出猜想】①只有Zn(NO3)2;②Zn (NO3)2、AgNO3;③Zn (NO3)2、Cu(NO3)2;④Zn (NO3)2、AgNO3、Cu(NO3)2
【交流讨论】不合理的猜想是 __________ (填标号),其理由是 _________________ 。
【实验探究】若猜想①成立,通过以下实验可确定固体B的成分,请将下表填写完整。
实验步骤 现象 有关反应的化学方程式
取少量固体B,滴加 ________________ 有气泡产生 ____________________
(3)如图是工业炼铁示意图。其中,焦炭的作用是燃烧提供能量和 _______________ ;有铁生成的化学方程式为 ________________ 。
(4)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数 __________ 。
19.氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。已知CuCl难溶于水和乙醇,在潮湿空气中易变质。CuCl的制备流程如下:
(1)“滤液1”中除了Na+、SO42-外,还存在较多的离子是 _______ (写离子符号)。
(2)“反应”中发生的化学变化是2CuCl2+2Na2SO3=2CuCl↓+2NaCl+SO3,产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为 _______________ 。
(3)“操作a”的名称是 ______ 。“醇洗”的目的是 ____________ 。
(4)本流程中可以循环利用的物质(水除外)是 _________ (写化学式)。
(5)320 g CuSO4与足量NaCl经上述制备流程,可生成的CuCl最多是 ____________ g。
20.下图化学反应的溶液颜色变化体现了“魔法世界,魅力化学”,请回答:
(1)溶液X是______________(填“酸”、“碱”),试剂A的名称是________________。
(2)若X是稀硫酸,B是氧化物,则B的化学式为________________;X与B反应的化学方程式为:__________________________,属于基本反应类型 __________________。
(3)若X是稀盐酸,C是单质,则X与C反应的化学方程式___________________________。
(4)若X是稀硫酸,D是碱,则X与D反应的化学方程式为__________________ 。
21.某小组运用数字化仪器进行实验,对中和反应中溶液的pH和温度进行实时测定:向含溶质0.1mol的氢氧化钠溶液中逐滴滴加稀盐酸(开始计时),用数字化仪器采集数据可得到溶液的pH随时间变化的曲线(如图一)、温度随时间变化的曲线(如图二)。
① 根据图一判断中和反应发生的依据是______,根据图二可知中和反应是_______反应(选填“吸热”或“放热”);最终所得溶液的溶质是________。
② 求实验中与0.1mol的氢氧化钠恰好完全反应的HCl的物质的量。(请根据化学方程式列式计算)_______。
③ 请在图三中画出该实验中生成氯化钠的质量随时间变化的曲线_______。
22.学习酸碱中和反应时,很多同学对其产生探究兴趣。
(1)甲同学将固体氢氧化钠放入装有稀硫酸的试管中并振荡,试管壁发烫,于是他得出酸碱中和反应是放热反应的结论。乙同学认为甲同学推理不合理,理由是_______。
(2)配制40g10%的氢氧化钠溶液。
步骤为:_______、称量、量取、溶解、装瓶并贴标签。称量固体时,为了防止腐蚀托盘,应该将氢氧化钠放在_______中称量。
量取水时如俯视读数,则配得的溶液溶质质量分数将_______(填“大于”“小于”或“等于”)10%。
(3)配制好的氢氧化钠溶液要密封保存,否则容易变质,其原因是(写化学方程式):_______。滴加酚酞,不能检验氢氧化钠溶液是否全部变质,原因是_______。
(4)乙同学为了验证甲同学的结论,将实验加以改进:将稀硫酸慢慢入装有40g10%氢氧化钠溶液的烧杯中,用温度计测出反应后液温度随加入稀硫酸质量的变化如图所示:
①B到C的过程中,烧杯内溶液中含有的阳离子为_______(填离子符号)
②恰好完全反应时所得溶液中溶质质量分数?______(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.D
3.B
4.C
5.C
6.D
7.A
8.C
9.D
10.B
11.A
12.D
13.C
14.A
15.D
16.A
17. 2Al+3CuSO4═Al2(SO4)3+3Cu 反应物中不含有碳元素,不能生成二氧化碳 二氧化硫有刺激性气味 猜想二成立 酸 氢氧根离子和氢离子结合生成水分子 NaCl、NaOH 设反应生成氯化钠质量为x,
x=3.51g
恰好完全反应时所得溶液溶质质量分数为:×100%=5.85%,
答:恰好完全反应时所得溶液溶质质量分数为5.85%。 滴加的氢氧化钠溶液浓度、盐酸浓度不同 。
18. C ② 锌先于硝酸银溶液反应,如果溶液中有硝酸银,说明硝酸铜还没开始反应,溶液中一定含有硝酸铜 稀盐酸 Zn+2HCl═ZnCl2+H2↑ 做还原剂制取一氧化碳 Fe2O3+3CO2Fe+3CO2 11.7%
19. Cu2+、Cl- SO3+H2O═H2SO4 过滤 快速除去CuCl固体表面的水分,防止其变质(氧化) NaCl 199
20. 酸 石蕊试液 Fe2O3; Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O 复分解反应 Fe+2HCl = FeCl2+H2↑ H2SO4+Cu(OH)2= CuSO4+2H2O
21. 溶液的pH明显下降直至小于7 放热 NaCl、HCl 0.1mol
22.(1)氢氧化钠固体溶于水也能放出热量
(2) 计算 小烧杯 大于
(3) 碳酸钠溶液和氢氧化钠溶液都显碱性,都能使无色的酚酞溶液变红
(4) Na+和H+ 解:设生成硫酸钠的质量为。
反应后所得溶液的溶质质量分数为:
答:反应后所得溶液的溶质质量分数为7.1%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.除去下列各组物质中的杂质(括号内为杂质),所选用的试剂(足量)及操作方法均正确的是( )
选项 物质 选用试剂 操作方法
A Fe2O3(Fe) 盐酸 浸泡、过滤、洗涤、烘干
B CO(CO2) NaOH溶液、浓硫酸 洗气、干燥
C CaO(CaCO3) 水 过滤、烘干
D NaCl(Na2CO3) Ca(NO3)2溶液 溶解、过滤、蒸发、结晶
A.A B.B C.C D.D
2.下列清洁用品中碱性最强的是
A.厕所清洁剂pH=1 B.牙膏pH=8 C.肥皂pH=10 D.炉具清洁剂pH=13
3.证据推理是化学学科核心素养的重要内容,下列推理正确的是
A.酸能使紫色石蕊溶液变色,所以酸也能使无色酚酞溶液变色
B.化合物由不同种元素组成,所以由不同种元素组成的纯净物一定是化合物
C.中和反应是有盐和水生成的反应,所以有盐和水生成的反应一定是中和反应
D.燃烧都伴随有发光、放热现象,所以有发光、放热现象的变化一定是燃烧
4.中和反应在工农业生产和日常生活中有广泛的用途.下列应用一定与中和反应原理无关的是
A.施用熟石灰改良酸性土壤
B.用胃舒平(主要成分氢氧化铝)治疗胃酸过多
C.用熟石灰和硫酸铜配制波尔多液
D.用NaOH溶液洗涤石油产品中的残余硫酸
5.下列有关溶液酸碱性的说法错误的是( )
A.pH=7的溶液呈中性
B.pH>7的溶液一定呈碱性
C.pH<7的雨水一定是酸雨
D.酸溶液的pH越小酸性越强
6.下列做法利用了酸碱中和反应原理的是( )
A.用食醋腌木瓜放入食盐进行调味 B.用稀盐酸除去铁钉上的铁锈
C.焙制蛋糕时加入碳酸氢钠使蛋糕膨松 D.服用含氢氧化铝的药物治疗胃酸过多症
7.下列说法错误的是
A.改良酸性土壤可用烧碱
B.回收废旧金属不仅节约金属资源,还可减少环境污染
C.研究煤炭中硫资源的综合开发和利用是防治酸雨的有效途径之一
D.乙醇汽油的使用可适当节省石油资源,并在一定程度上减少汽车尾气的污染
8.下列有关酸碱盐的说法中,错误的是( )
A.用氢氧化铝治疗胃酸过多是利用了中和反应原理
B.浓盐酸敞口放置在空气中会产生白雾
C.侯氏制碱法中的“碱”是指NaOH
D.治理硫酸厂的污水时,可向该污水中投放适量的生石灰
9.某校化学小组在利用硫酸和氢氧化钾两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图所示。下列说法正确的是
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是K2SO4和H2SO4
C.该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸溶液的烧杯中
D.由c点到d点的变化过程中没有发生化学反应
10.饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
11.观察下列图像,所得结论不正确的是
A.图1:向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
B.图2:在饱和石灰水中加入少量生石灰
C.图3:将一定体积的空气通过灼热的铜网充分反应,可知氧气的体积约占空气体积的1/5
D.图4:将CO2通入一定量的澄清石灰水中,先变浑浊,后生成Ca(HCO3)2而变澄清
12.某校化学小组在利用硫酸和氢氧化钾溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象如图所示.下列说法正确的是
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是K2SO4和H2SO4
C.该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸的烧杯中
D.由b点到c点的变化过程中没有发生化学反应
13.U形管中是滴有酚酞试液的蒸馏水,向左、右两管中分别同时逐滴滴加一定量的氢氧化钠稀溶液和稀盐酸(如图所示)。下列说法正确的是
A.开始时左边溶液呈蓝色,右边溶液呈红色
B.开始时左边溶液呈无色,右边溶液呈红色、
C.充分反应后U形管中溶液可能呈红色
D.充分反应后U形管中溶液一定呈无色
14.下列物质能使紫色石蕊试液变红的是( )
A.胃液 B.氨水 C.蔗糖水 D.pH约为7.8的鸡蛋清
15.类推是化学学习中常用的思维方法.下列类推正确的是( )
A.活泼金属与酸反应有气体产生,则与酸反应产生气体的一定是活泼金属
B.酸与碱发生中和反应生成盐和水,则生成盐和水的反应一定是中和反应
C.单质一定是由同种元素组成的物质,则由同种元素组成的物质一定是单质
D.碱性溶液能使酚酞溶液变红,则能使酚酞溶液变红的溶液一定是碱性溶液
16.一些食物的近似pH如下:
食物 葡萄汁 苹果汁 牛奶 鸡蛋清
pH 3.5~4.5 2.9~3.3 6.3~6.6 7.6~8.0
下列说法中不正确的是A.鸡蛋清和牛奶显碱性 B.苹果汁和葡萄汁显酸性
C.苹果汁比葡萄汁的酸性强 D.胃酸过多的人应少饮苹果汁和葡萄汁
二、综合应用题
17.同学们在实验室做了以下实验,请回答相关问题。
(一)铝片与硫酸铜溶液反应:同学们把打磨光亮的铝片插入硫酸铜溶液中,过一会儿,发现了一个“意外现象”:在铝片表面看到有红色固体析出的同时,还看到有少量的气泡冒出。
(1)写出生成红色固体的化学方程式_____。
【提出问题】该气体是什么呢?
【猜想与假设】猜想一:O2 猜想二:H2 猜想三:CO2 猜想四:SO2
(2)同学们经过讨论,一致认为猜想三不成立,理由是_____。
【实验验证】
(3)有同学闻了一下该气体,发现无气味,证明猜想四也不成立,理由是_____。
(4)将产生的气体经验纯后,用导管导入到点燃的酒精灯火焰上,气体安静燃烧,产生淡蓝色火焰。
【实验结论】_____。
【反思与交流】CuSO4溶液可能显_____性(填“酸”或“碱”或“中”)。
(二)稀氢氧化钠溶液与稀盐酸的反应
同学们对稀氢氧化钠溶液和稀盐酸发生中和反应进行了如下探究:用pH传感器测得烧杯内溶液的pH变化如图2所示,同时用温度传感器测得烧杯内温度变化如图3所示,实验过程中保温良好,忽略热量散失。
(5)烧杯内反应的微观实质是_____。
(6)如图3中A点对应溶液的溶质成分是_____(填写化学式)。
(7)已知烧杯中溶液质量为30g,加入的溶液溶质质量分数为8%,恰好完全反应时所得溶液溶质质量分数为多少?_____(写出具体计算过程)
(8)其他小组同学也绘制了实验过程中温度变化如图4所示(实验过程中保温良好,热量散失忽略不计),各同学所得温度变化图象不同的原因可能是_____。
18.金属用途广泛,其结构和性质等是化学的重要研究内容。
(1)如图是铝的原子结构示意图。下列说法不正确的是 ______ 。
A铝原子的质子数为13
B在化合物中铝通常显+3价
C铝是地壳中含量最多的元素
D铝可作导线是由于它具有良好的导电性
(2)某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了如图实验, 并对溶液A和固体B的成分进行了分析和实验探究。
【提出问题】溶液A中的溶质可能有哪些?
【作出猜想】①只有Zn(NO3)2;②Zn (NO3)2、AgNO3;③Zn (NO3)2、Cu(NO3)2;④Zn (NO3)2、AgNO3、Cu(NO3)2
【交流讨论】不合理的猜想是 __________ (填标号),其理由是 _________________ 。
【实验探究】若猜想①成立,通过以下实验可确定固体B的成分,请将下表填写完整。
实验步骤 现象 有关反应的化学方程式
取少量固体B,滴加 ________________ 有气泡产生 ____________________
(3)如图是工业炼铁示意图。其中,焦炭的作用是燃烧提供能量和 _______________ ;有铁生成的化学方程式为 ________________ 。
(4)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数 __________ 。
19.氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。已知CuCl难溶于水和乙醇,在潮湿空气中易变质。CuCl的制备流程如下:
(1)“滤液1”中除了Na+、SO42-外,还存在较多的离子是 _______ (写离子符号)。
(2)“反应”中发生的化学变化是2CuCl2+2Na2SO3=2CuCl↓+2NaCl+SO3,产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为 _______________ 。
(3)“操作a”的名称是 ______ 。“醇洗”的目的是 ____________ 。
(4)本流程中可以循环利用的物质(水除外)是 _________ (写化学式)。
(5)320 g CuSO4与足量NaCl经上述制备流程,可生成的CuCl最多是 ____________ g。
20.下图化学反应的溶液颜色变化体现了“魔法世界,魅力化学”,请回答:
(1)溶液X是______________(填“酸”、“碱”),试剂A的名称是________________。
(2)若X是稀硫酸,B是氧化物,则B的化学式为________________;X与B反应的化学方程式为:__________________________,属于基本反应类型 __________________。
(3)若X是稀盐酸,C是单质,则X与C反应的化学方程式___________________________。
(4)若X是稀硫酸,D是碱,则X与D反应的化学方程式为__________________ 。
21.某小组运用数字化仪器进行实验,对中和反应中溶液的pH和温度进行实时测定:向含溶质0.1mol的氢氧化钠溶液中逐滴滴加稀盐酸(开始计时),用数字化仪器采集数据可得到溶液的pH随时间变化的曲线(如图一)、温度随时间变化的曲线(如图二)。
① 根据图一判断中和反应发生的依据是______,根据图二可知中和反应是_______反应(选填“吸热”或“放热”);最终所得溶液的溶质是________。
② 求实验中与0.1mol的氢氧化钠恰好完全反应的HCl的物质的量。(请根据化学方程式列式计算)_______。
③ 请在图三中画出该实验中生成氯化钠的质量随时间变化的曲线_______。
22.学习酸碱中和反应时,很多同学对其产生探究兴趣。
(1)甲同学将固体氢氧化钠放入装有稀硫酸的试管中并振荡,试管壁发烫,于是他得出酸碱中和反应是放热反应的结论。乙同学认为甲同学推理不合理,理由是_______。
(2)配制40g10%的氢氧化钠溶液。
步骤为:_______、称量、量取、溶解、装瓶并贴标签。称量固体时,为了防止腐蚀托盘,应该将氢氧化钠放在_______中称量。
量取水时如俯视读数,则配得的溶液溶质质量分数将_______(填“大于”“小于”或“等于”)10%。
(3)配制好的氢氧化钠溶液要密封保存,否则容易变质,其原因是(写化学方程式):_______。滴加酚酞,不能检验氢氧化钠溶液是否全部变质,原因是_______。
(4)乙同学为了验证甲同学的结论,将实验加以改进:将稀硫酸慢慢入装有40g10%氢氧化钠溶液的烧杯中,用温度计测出反应后液温度随加入稀硫酸质量的变化如图所示:
①B到C的过程中,烧杯内溶液中含有的阳离子为_______(填离子符号)
②恰好完全反应时所得溶液中溶质质量分数?______(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.D
3.B
4.C
5.C
6.D
7.A
8.C
9.D
10.B
11.A
12.D
13.C
14.A
15.D
16.A
17. 2Al+3CuSO4═Al2(SO4)3+3Cu 反应物中不含有碳元素,不能生成二氧化碳 二氧化硫有刺激性气味 猜想二成立 酸 氢氧根离子和氢离子结合生成水分子 NaCl、NaOH 设反应生成氯化钠质量为x,
x=3.51g
恰好完全反应时所得溶液溶质质量分数为:×100%=5.85%,
答:恰好完全反应时所得溶液溶质质量分数为5.85%。 滴加的氢氧化钠溶液浓度、盐酸浓度不同 。
18. C ② 锌先于硝酸银溶液反应,如果溶液中有硝酸银,说明硝酸铜还没开始反应,溶液中一定含有硝酸铜 稀盐酸 Zn+2HCl═ZnCl2+H2↑ 做还原剂制取一氧化碳 Fe2O3+3CO2Fe+3CO2 11.7%
19. Cu2+、Cl- SO3+H2O═H2SO4 过滤 快速除去CuCl固体表面的水分,防止其变质(氧化) NaCl 199
20. 酸 石蕊试液 Fe2O3; Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O 复分解反应 Fe+2HCl = FeCl2+H2↑ H2SO4+Cu(OH)2= CuSO4+2H2O
21. 溶液的pH明显下降直至小于7 放热 NaCl、HCl 0.1mol
22.(1)氢氧化钠固体溶于水也能放出热量
(2) 计算 小烧杯 大于
(3) 碳酸钠溶液和氢氧化钠溶液都显碱性,都能使无色的酚酞溶液变红
(4) Na+和H+ 解:设生成硫酸钠的质量为。
反应后所得溶液的溶质质量分数为:
答:反应后所得溶液的溶质质量分数为7.1%。
答案第1页,共2页
答案第1页,共2页
同课章节目录
