11.1生活中常见的盐同步练习-2021-2022学年九年级化学人教版下册(word版有答案)
文档属性
| 名称 | 11.1生活中常见的盐同步练习-2021-2022学年九年级化学人教版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 140.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-24 20:20:51 | ||
图片预览

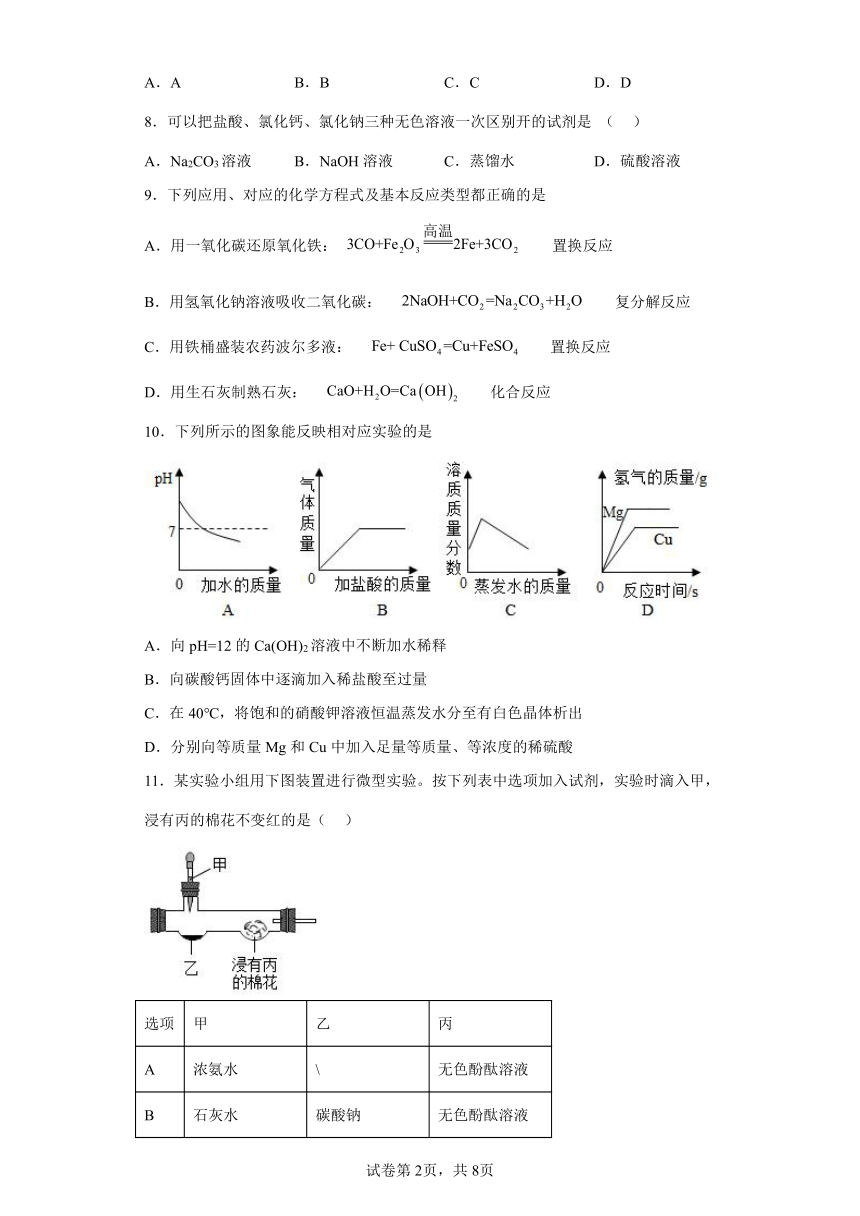
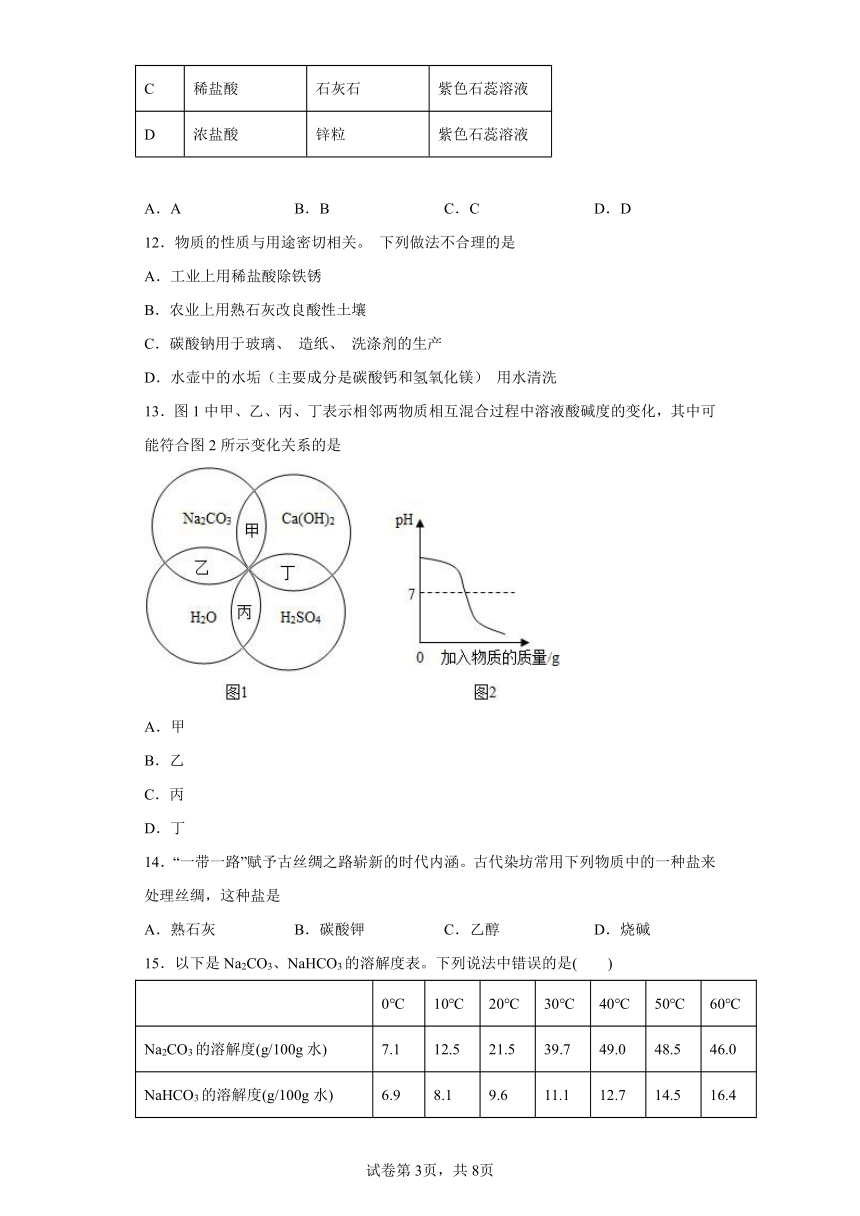


文档简介
11.1 生活中常见的盐 同步练习
一、单选题
1.小明家的甘蔗茎杆细弱,需要追施钾肥,应选择( )
A.KOH B.Ca3(PO4)2 C.K2CO3 D.CO(NH2)2
2.下列做法中一定发生化学变化的是( )
A.用石油分馏制得汽油、柴油等 B.用柠檬酸和小苏打、白糖配置汽水
C.用钢丝球擦除灶具上的污渍 D.用汽油清洗衣服上的油污
3.有关“粗盐中难溶性杂质的去除”实验中说法不正确的是
A.多加水,让粗盐加速溶解
B.玻璃棒用了4次,但作用各不相同
C.粗盐经过溶解、过滤、蒸发、结晶可以得到初步提纯
D.当蒸发皿中出现较多量固体时,停止加热,利用余热使滤液蒸干
4.下列盐的用途中,错误的是
A.用含亚硝酸钠的工业盐制香肠 B.用碳酸钙做补钙剂
C.用氯化钠配制生理盐水 D.用碳酸氢钠做焙制糕点的发酵粉
5.我国制碱工业的先驱——侯德榜先生,1921年留美回国后,潜心研究制碱技术,发明了将制碱与制氨结合起来的联合制碱法(又称侯氏制碱法),为纯碱和氮肥工业技术的发展做出了杰出贡献。下列物质中能与纯碱发生反应的是
A.NaOH B.NaHCO3 C.H2SO4 D.K2SO4
6.下列做法正确的是
A.门捷列夫用定量的方法研究空气的成分
B.生活中可以用煮沸的方法降低水的硬度
C.我国的纯碱资源比较丰富,用纯碱来制取大量食盐
D.发现厨房燃气泄漏时,立即打开排风扇电源开关
7.下列实验设计能达到实验目的是( )
选项 实验目的 实验设计
A 除去氯化镁溶液中少量的硫酸镁 滴加过量的氯化钡溶液,过滤
B 比较Zn、Cu、Ag的金属活动性 将Zn和Ag分别放入CuSO4溶液中
C 检验二氧化碳 将燃着的木条伸入集气瓶内
D 除去CuO中Cu 加足量稀硫酸溶液、过滤
A.A B.B C.C D.D
8.可以把盐酸、氯化钙、氯化钠三种无色溶液一次区别开的试剂是 ( )
A.Na2CO3溶液 B.NaOH溶液 C.蒸馏水 D.硫酸溶液
9.下列应用、对应的化学方程式及基本反应类型都正确的是
A.用一氧化碳还原氧化铁: 置换反应
B.用氢氧化钠溶液吸收二氧化碳: 复分解反应
C.用铁桶盛装农药波尔多液: 置换反应
D.用生石灰制熟石灰: 化合反应
10.下列所示的图象能反映相对应实验的是
A.向pH=12的Ca(OH)2溶液中不断加水稀释
B.向碳酸钙固体中逐滴加入稀盐酸至过量
C.在40℃,将饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出
D.分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
11.某实验小组用下图装置进行微型实验。按下列表中选项加入试剂,实验时滴入甲,浸有丙的棉花不变红的是( )
选项 甲 乙 丙
A 浓氨水 \ 无色酚酞溶液
B 石灰水 碳酸钠 无色酚酞溶液
C 稀盐酸 石灰石 紫色石蕊溶液
D 浓盐酸 锌粒 紫色石蕊溶液
A.A B.B C.C D.D
12.物质的性质与用途密切相关。 下列做法不合理的是
A.工业上用稀盐酸除铁锈
B.农业上用熟石灰改良酸性土壤
C.碳酸钠用于玻璃、 造纸、 洗涤剂的生产
D.水壶中的水垢(主要成分是碳酸钙和氢氧化镁) 用水清洗
13.图1中甲、乙、丙、丁表示相邻两物质相互混合过程中溶液酸碱度的变化,其中可能符合图2所示变化关系的是
A.甲
B.乙
C.丙
D.丁
14.“一带一路”赋予古丝绸之路崭新的时代内涵。古代染坊常用下列物质中的一种盐来处理丝绸,这种盐是
A.熟石灰 B.碳酸钾 C.乙醇 D.烧碱
15.以下是Na2CO3、NaHCO3的溶解度表。下列说法中错误的是( )
0℃ 10℃ 20℃ 30℃ 40℃ 50℃ 60℃
Na2CO3的溶解度(g/100g水) 7.1 12.5 21.5 39.7 49.0 48.5 46.0
NaHCO3的溶解度(g/100g水) 6.9 8.1 9.6 11.1 12.7 14.5 16.4
A.40℃的饱和Na2CO3溶液升温到60℃,会析出晶体
B.60℃的NaHCO3溶液蒸干并充分灼烧,可得到NaHCO3晶体
C.30℃的溶质质量分数为25%的Na2CO3溶液降温到20℃,有晶体析出
D.20℃的饱和Na2CO3溶液中通足量CO2,生成的NaHCO3会部分析出
16.下列除去物质中所含少量杂质的方法错误的是
选项 物质 杂质 除杂质的方法
A 稀硫酸 铜 过滤
B CaSO4溶液 稀硫酸 过量CaCO3 粉末、过滤
C FeCl2溶液 CuCl2 过量铁粉、过滤
D 二氧化碳 一氧化碳 点燃
A.A B.B C.C D.D
二、综合应用题
17.硫酸亚锡()广泛应用于电镀工业,易与氧气反应而变质。工业上用混有盐酸的制取的一种方案如下:
【查阅资料】
反应Ⅰ发生的方程式为:;
回答下列问题:
(1)中Sn的化合价为______。
(2)滤液a中的溶质为______(填化学式)。
(3)获得晶体的部分操作须隔绝空气进行的原因为______。
(4)Sn与稀盐酸反应生成和一种单质,该反应的方程式为______。
(5)实验室用14.6%的盐酸来配制稀盐酸,主要实验步骤为:计算、______、稀释。用量筒量取的盐酸时仰视读数,则所配得稀盐酸的溶质质量分数______(填“偏大”“偏小”或“不变”)。
(6)取溶质质量分数为14.6%的盐酸50g与一定质量的粉末恰好完全反应,计算:(写出计算过程)
①生成二氧化碳的质量______;
②反应后所得溶液中溶质的质量分数______。(计算结果精确到0.1%)
18.元素及其化合物知识是化学研究和学习的重要内容。
(1)氯化钠、氯化钙和氯化镁中都含有氯元素,下图是氯在元素周期表中的相关信息,下列说法不正确的是 _______ (填标号)。
A该元素属于非金属元素
B该原子核内质子数为17
C该元素的原子形成阴离子后,离子结构示意图为
D该元素的相对原子质量为35.45g
根据生活经验,汗水含有的某物质有咸味,构成该物质的微粒是 ________ (填粒子符号)。碳酸氢钠在焙制糕点和炸油条时常用作发泡剂,用化学方程式解释其原理 ______
(4)现有一包白色粉末,其中含有CuSO4、BaCl2、NaOH、Na2CO3中的一种或几种。某化学小组为确定白色粉末的成分,进行了如下实验:(I)取一定量白色粉末,加入足量水,振荡,得到无色透明溶液;(Ⅱ)取少量(I)的溶液,加入足量盐酸,有气泡产生。(提示:BaCO3难溶于水;Na2CO3的水溶液呈碱性)
①该白色粉末中肯定含有什么物质? _______ 可能含有什么物质? ______
②为确定可能含有的物质是否存在,还需要作进一步的实验验证,请写出简要的实验步骤。 _______
(5)食用纯碱中常含有少量的氯化钠。现取某食用纯碱样品20g,加入一定量稀盐酸恰好完全反应,同时产生了6.6g气体。试计算该食用纯碱中碳酸钠的质量分数。(写出计算过程)。 _________
19.现有HCl与CaCl2的混合溶液,为了分析混合溶液中HCl与CaCl2的质量分数,设计了如图所示实验方案:
【实验数据】实验共记录了两组数据:
第①组,气体吸收完全后,NaOH溶液质量增加4.4g。
第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g。
根据实验设计及有关数据进行分析与计算:
(1)混合溶液中HCl的质量分数为______(只写结果)。
(2)混合溶液中CaCl2的质量分数为_____(写出计算过程)?
(3)实验中混合溶液与Na2CO3溶液恰好完全反应,经过滤后所得“滤液”中溶质的质量分数为____(不考虑过滤中的损失。只写结果,保留小数点后一位)。
(4)若在100g混合溶液中不断加入溶质质量分数为10.6%的Na2CO3的溶液,请你在图上画出加入Na2CO3溶液的质量与产生沉淀的质量的关系图。____
20.大气是大自然对人类的恩赐,与人类的生存休戚相关。
(1)大量化石燃料的燃烧会造成较多污染物的排放,这不仅污染大气,还是形成 ______ 的主要原因。
(2)“节能减排”是我国的重要国策,过多的排放会造成 ______ ,为了减缓大气中含量的增加,目前以下建议可行的是 ______ (填字母序号)。
A 开发太阳能、水能、风能、地热能等新能源
B 电解水生产清洁燃料氢气
C 禁止使用煤、石油、天然气等矿物燃料
D 开发燃煤新技术使其充分燃烧
(3)下图是有关等物质的转化关系,其中和均为碳酸盐,是最常用的溶剂,则下列转化涉及的基本反应类型有 ______ 。
21.我国制碱工业先驱——侯德榜先生发明了“侯氏制碱法”,其主要的化学原理如下:;
工业上以半水煤气(主要成分是N2、H2、CO、CO2和H2O)、食盐等为原料制取纯碱的流程见图1。
(1)X的化学式为___________,流程中循环利用的物质有H2O和____________。
(2)实验室从混合气体H2、N2、CO2中分离出CO2的实验装置如图2所示。打开k1,关闭k2时,吸收CO2;打开k2,关闭k1时,产生CO2,则广口瓶和分液漏斗中盛放的药品分别是(用化学式表示其溶质)_____________、____________。
(3)将Na2CO3和NaHCO3的混合物10g充分加热,将生成的气体用浓硫酸充分干燥后,再用澄清石灰水除去剩余气体,至固体混合物的质量不再改变时,称得澄清石灰水的装置增重2.2g。则原混合物中Na2CO3的质量分数是______。
22.依据物质类别和物质中某种元素的化合价构建了初中化学常见物质间的转化关系坐标图(图中“→”表示物质间的转化)
请回答下列问题:
(1)工业上可用化合反应来制备B,且反应时放出大量热,B的俗称为___________,A物质的化学式为___________。
(2)E的固体露置在空气中一段时间后质量会增加,其原因是___________。
(3)G的相对分子质量为160,H为一种金属单质且H、G均可与F溶液反应,可分别生成含该金属元素的两种盐溶液,G与F反应的化学方程式为___________。
(4)在B溶液中加入一定量D溶液,过滤后取滤液,滴入过量F溶液,无明显现象,则滤液中的溶质化学式为___________。
(5)在B溶液中加入一定量D溶液充分反应后过滤,向滤液中滴入过滤F溶液,有气泡产生,则滤液中溶质的化学式为___________,写出有气泡产生的化学反应方程式___________。
(6)质量为150g的烧杯中加入100g过氧化氢溶液,再向其中加入2g二氧化锰。充分反应后,称得烧杯和剩余物质总质量为250.4g。请计算过氧化氢溶液中H2O2的质量___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.B
3.A
4.A
5.C
6.B
7.B
8.A
9.D
10.B
11.B
12.D
13.D
14.B
15.B
16.D
17.(1)+2##+2价
(2)NaCl、Na2CO3
(3)防止SnSO4与O2发生反应而变质
(4)
(5) 量取 偏大
(6) 4.4g
解:设生成CO2的质量为x,生成NaCl 的质量为y,参加反应的Na2CO3的质量为z,
20.8%
反应后所得溶液中溶质的质量分数为
答:生成二氧化碳的质量为4.4g;反应后所得溶液中溶质的质量分数为20.8%。
18. D 2NaHCO3Na2CO3+H2OCO2↑ 取少量(Ⅰ)的溶液,加入足量溶液(或溶液),静置,取上层清液滴加酚酞溶液(或用pH试纸测定pH) 79.5%
19. 7.3% 11.1% 8.2%
20. 酸雨 温室效应 A 分解反应、化合反应、复分解反应
21. NH4Cl CO2 NaOH HCl 84%
22. 熟石灰或消石灰 CaO 潮解并可以与空气中CO2反应 NaOH或NaOH、Ca(OH)2 NaOH、Na2CO3 解:根据质量守恒定律反应生成的氧气质量为
150g+100g+2g-250.4g=1.6g
设过氧化氢溶液中H2O2的质量为x
x=3.4g
答:过氧化氢溶液中过氧化氢的质量为3.4g。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.小明家的甘蔗茎杆细弱,需要追施钾肥,应选择( )
A.KOH B.Ca3(PO4)2 C.K2CO3 D.CO(NH2)2
2.下列做法中一定发生化学变化的是( )
A.用石油分馏制得汽油、柴油等 B.用柠檬酸和小苏打、白糖配置汽水
C.用钢丝球擦除灶具上的污渍 D.用汽油清洗衣服上的油污
3.有关“粗盐中难溶性杂质的去除”实验中说法不正确的是
A.多加水,让粗盐加速溶解
B.玻璃棒用了4次,但作用各不相同
C.粗盐经过溶解、过滤、蒸发、结晶可以得到初步提纯
D.当蒸发皿中出现较多量固体时,停止加热,利用余热使滤液蒸干
4.下列盐的用途中,错误的是
A.用含亚硝酸钠的工业盐制香肠 B.用碳酸钙做补钙剂
C.用氯化钠配制生理盐水 D.用碳酸氢钠做焙制糕点的发酵粉
5.我国制碱工业的先驱——侯德榜先生,1921年留美回国后,潜心研究制碱技术,发明了将制碱与制氨结合起来的联合制碱法(又称侯氏制碱法),为纯碱和氮肥工业技术的发展做出了杰出贡献。下列物质中能与纯碱发生反应的是
A.NaOH B.NaHCO3 C.H2SO4 D.K2SO4
6.下列做法正确的是
A.门捷列夫用定量的方法研究空气的成分
B.生活中可以用煮沸的方法降低水的硬度
C.我国的纯碱资源比较丰富,用纯碱来制取大量食盐
D.发现厨房燃气泄漏时,立即打开排风扇电源开关
7.下列实验设计能达到实验目的是( )
选项 实验目的 实验设计
A 除去氯化镁溶液中少量的硫酸镁 滴加过量的氯化钡溶液,过滤
B 比较Zn、Cu、Ag的金属活动性 将Zn和Ag分别放入CuSO4溶液中
C 检验二氧化碳 将燃着的木条伸入集气瓶内
D 除去CuO中Cu 加足量稀硫酸溶液、过滤
A.A B.B C.C D.D
8.可以把盐酸、氯化钙、氯化钠三种无色溶液一次区别开的试剂是 ( )
A.Na2CO3溶液 B.NaOH溶液 C.蒸馏水 D.硫酸溶液
9.下列应用、对应的化学方程式及基本反应类型都正确的是
A.用一氧化碳还原氧化铁: 置换反应
B.用氢氧化钠溶液吸收二氧化碳: 复分解反应
C.用铁桶盛装农药波尔多液: 置换反应
D.用生石灰制熟石灰: 化合反应
10.下列所示的图象能反映相对应实验的是
A.向pH=12的Ca(OH)2溶液中不断加水稀释
B.向碳酸钙固体中逐滴加入稀盐酸至过量
C.在40℃,将饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出
D.分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
11.某实验小组用下图装置进行微型实验。按下列表中选项加入试剂,实验时滴入甲,浸有丙的棉花不变红的是( )
选项 甲 乙 丙
A 浓氨水 \ 无色酚酞溶液
B 石灰水 碳酸钠 无色酚酞溶液
C 稀盐酸 石灰石 紫色石蕊溶液
D 浓盐酸 锌粒 紫色石蕊溶液
A.A B.B C.C D.D
12.物质的性质与用途密切相关。 下列做法不合理的是
A.工业上用稀盐酸除铁锈
B.农业上用熟石灰改良酸性土壤
C.碳酸钠用于玻璃、 造纸、 洗涤剂的生产
D.水壶中的水垢(主要成分是碳酸钙和氢氧化镁) 用水清洗
13.图1中甲、乙、丙、丁表示相邻两物质相互混合过程中溶液酸碱度的变化,其中可能符合图2所示变化关系的是
A.甲
B.乙
C.丙
D.丁
14.“一带一路”赋予古丝绸之路崭新的时代内涵。古代染坊常用下列物质中的一种盐来处理丝绸,这种盐是
A.熟石灰 B.碳酸钾 C.乙醇 D.烧碱
15.以下是Na2CO3、NaHCO3的溶解度表。下列说法中错误的是( )
0℃ 10℃ 20℃ 30℃ 40℃ 50℃ 60℃
Na2CO3的溶解度(g/100g水) 7.1 12.5 21.5 39.7 49.0 48.5 46.0
NaHCO3的溶解度(g/100g水) 6.9 8.1 9.6 11.1 12.7 14.5 16.4
A.40℃的饱和Na2CO3溶液升温到60℃,会析出晶体
B.60℃的NaHCO3溶液蒸干并充分灼烧,可得到NaHCO3晶体
C.30℃的溶质质量分数为25%的Na2CO3溶液降温到20℃,有晶体析出
D.20℃的饱和Na2CO3溶液中通足量CO2,生成的NaHCO3会部分析出
16.下列除去物质中所含少量杂质的方法错误的是
选项 物质 杂质 除杂质的方法
A 稀硫酸 铜 过滤
B CaSO4溶液 稀硫酸 过量CaCO3 粉末、过滤
C FeCl2溶液 CuCl2 过量铁粉、过滤
D 二氧化碳 一氧化碳 点燃
A.A B.B C.C D.D
二、综合应用题
17.硫酸亚锡()广泛应用于电镀工业,易与氧气反应而变质。工业上用混有盐酸的制取的一种方案如下:
【查阅资料】
反应Ⅰ发生的方程式为:;
回答下列问题:
(1)中Sn的化合价为______。
(2)滤液a中的溶质为______(填化学式)。
(3)获得晶体的部分操作须隔绝空气进行的原因为______。
(4)Sn与稀盐酸反应生成和一种单质,该反应的方程式为______。
(5)实验室用14.6%的盐酸来配制稀盐酸,主要实验步骤为:计算、______、稀释。用量筒量取的盐酸时仰视读数,则所配得稀盐酸的溶质质量分数______(填“偏大”“偏小”或“不变”)。
(6)取溶质质量分数为14.6%的盐酸50g与一定质量的粉末恰好完全反应,计算:(写出计算过程)
①生成二氧化碳的质量______;
②反应后所得溶液中溶质的质量分数______。(计算结果精确到0.1%)
18.元素及其化合物知识是化学研究和学习的重要内容。
(1)氯化钠、氯化钙和氯化镁中都含有氯元素,下图是氯在元素周期表中的相关信息,下列说法不正确的是 _______ (填标号)。
A该元素属于非金属元素
B该原子核内质子数为17
C该元素的原子形成阴离子后,离子结构示意图为
D该元素的相对原子质量为35.45g
根据生活经验,汗水含有的某物质有咸味,构成该物质的微粒是 ________ (填粒子符号)。碳酸氢钠在焙制糕点和炸油条时常用作发泡剂,用化学方程式解释其原理 ______
(4)现有一包白色粉末,其中含有CuSO4、BaCl2、NaOH、Na2CO3中的一种或几种。某化学小组为确定白色粉末的成分,进行了如下实验:(I)取一定量白色粉末,加入足量水,振荡,得到无色透明溶液;(Ⅱ)取少量(I)的溶液,加入足量盐酸,有气泡产生。(提示:BaCO3难溶于水;Na2CO3的水溶液呈碱性)
①该白色粉末中肯定含有什么物质? _______ 可能含有什么物质? ______
②为确定可能含有的物质是否存在,还需要作进一步的实验验证,请写出简要的实验步骤。 _______
(5)食用纯碱中常含有少量的氯化钠。现取某食用纯碱样品20g,加入一定量稀盐酸恰好完全反应,同时产生了6.6g气体。试计算该食用纯碱中碳酸钠的质量分数。(写出计算过程)。 _________
19.现有HCl与CaCl2的混合溶液,为了分析混合溶液中HCl与CaCl2的质量分数,设计了如图所示实验方案:
【实验数据】实验共记录了两组数据:
第①组,气体吸收完全后,NaOH溶液质量增加4.4g。
第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g。
根据实验设计及有关数据进行分析与计算:
(1)混合溶液中HCl的质量分数为______(只写结果)。
(2)混合溶液中CaCl2的质量分数为_____(写出计算过程)?
(3)实验中混合溶液与Na2CO3溶液恰好完全反应,经过滤后所得“滤液”中溶质的质量分数为____(不考虑过滤中的损失。只写结果,保留小数点后一位)。
(4)若在100g混合溶液中不断加入溶质质量分数为10.6%的Na2CO3的溶液,请你在图上画出加入Na2CO3溶液的质量与产生沉淀的质量的关系图。____
20.大气是大自然对人类的恩赐,与人类的生存休戚相关。
(1)大量化石燃料的燃烧会造成较多污染物的排放,这不仅污染大气,还是形成 ______ 的主要原因。
(2)“节能减排”是我国的重要国策,过多的排放会造成 ______ ,为了减缓大气中含量的增加,目前以下建议可行的是 ______ (填字母序号)。
A 开发太阳能、水能、风能、地热能等新能源
B 电解水生产清洁燃料氢气
C 禁止使用煤、石油、天然气等矿物燃料
D 开发燃煤新技术使其充分燃烧
(3)下图是有关等物质的转化关系,其中和均为碳酸盐,是最常用的溶剂,则下列转化涉及的基本反应类型有 ______ 。
21.我国制碱工业先驱——侯德榜先生发明了“侯氏制碱法”,其主要的化学原理如下:;
工业上以半水煤气(主要成分是N2、H2、CO、CO2和H2O)、食盐等为原料制取纯碱的流程见图1。
(1)X的化学式为___________,流程中循环利用的物质有H2O和____________。
(2)实验室从混合气体H2、N2、CO2中分离出CO2的实验装置如图2所示。打开k1,关闭k2时,吸收CO2;打开k2,关闭k1时,产生CO2,则广口瓶和分液漏斗中盛放的药品分别是(用化学式表示其溶质)_____________、____________。
(3)将Na2CO3和NaHCO3的混合物10g充分加热,将生成的气体用浓硫酸充分干燥后,再用澄清石灰水除去剩余气体,至固体混合物的质量不再改变时,称得澄清石灰水的装置增重2.2g。则原混合物中Na2CO3的质量分数是______。
22.依据物质类别和物质中某种元素的化合价构建了初中化学常见物质间的转化关系坐标图(图中“→”表示物质间的转化)
请回答下列问题:
(1)工业上可用化合反应来制备B,且反应时放出大量热,B的俗称为___________,A物质的化学式为___________。
(2)E的固体露置在空气中一段时间后质量会增加,其原因是___________。
(3)G的相对分子质量为160,H为一种金属单质且H、G均可与F溶液反应,可分别生成含该金属元素的两种盐溶液,G与F反应的化学方程式为___________。
(4)在B溶液中加入一定量D溶液,过滤后取滤液,滴入过量F溶液,无明显现象,则滤液中的溶质化学式为___________。
(5)在B溶液中加入一定量D溶液充分反应后过滤,向滤液中滴入过滤F溶液,有气泡产生,则滤液中溶质的化学式为___________,写出有气泡产生的化学反应方程式___________。
(6)质量为150g的烧杯中加入100g过氧化氢溶液,再向其中加入2g二氧化锰。充分反应后,称得烧杯和剩余物质总质量为250.4g。请计算过氧化氢溶液中H2O2的质量___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.B
3.A
4.A
5.C
6.B
7.B
8.A
9.D
10.B
11.B
12.D
13.D
14.B
15.B
16.D
17.(1)+2##+2价
(2)NaCl、Na2CO3
(3)防止SnSO4与O2发生反应而变质
(4)
(5) 量取 偏大
(6) 4.4g
解:设生成CO2的质量为x,生成NaCl 的质量为y,参加反应的Na2CO3的质量为z,
20.8%
反应后所得溶液中溶质的质量分数为
答:生成二氧化碳的质量为4.4g;反应后所得溶液中溶质的质量分数为20.8%。
18. D 2NaHCO3Na2CO3+H2OCO2↑ 取少量(Ⅰ)的溶液,加入足量溶液(或溶液),静置,取上层清液滴加酚酞溶液(或用pH试纸测定pH) 79.5%
19. 7.3% 11.1% 8.2%
20. 酸雨 温室效应 A 分解反应、化合反应、复分解反应
21. NH4Cl CO2 NaOH HCl 84%
22. 熟石灰或消石灰 CaO 潮解并可以与空气中CO2反应 NaOH或NaOH、Ca(OH)2 NaOH、Na2CO3 解:根据质量守恒定律反应生成的氧气质量为
150g+100g+2g-250.4g=1.6g
设过氧化氢溶液中H2O2的质量为x
x=3.4g
答:过氧化氢溶液中过氧化氢的质量为3.4g。
答案第1页,共2页
答案第1页,共2页
同课章节目录
