2021-2022学年人教版初三化学下册第九单元课题3 溶液的浓度 综合训练(word版有答案)
文档属性
| 名称 | 2021-2022学年人教版初三化学下册第九单元课题3 溶液的浓度 综合训练(word版有答案) |  | |
| 格式 | doc | ||
| 文件大小 | 262.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-24 22:47:23 | ||
图片预览

文档简介
2021-2022学年人教版初三化学下册第九单元课题3 溶液的浓度 综合训练
班级__________ 座号_____ 姓名__________ 分数__________
一、选择题
1. (2021广东珠海香洲二模)20 ℃时,甲、乙两固体在水中最多能溶解的质量如图所示。下列描述不正确的是( )
A.20 ℃时,甲的溶解度比乙大
B.20 ℃时,20 g水和40 g水中最多溶解甲的质量不相等,但形成饱和溶液的溶质质量分数相等
C.20 ℃时,a点表示的甲、乙两固体所对应的溶液都是不饱和溶液
D.20 ℃时,乙的溶解度为60 g
2. 保持温度不变,小心蒸发NaCl不饱和溶液(蒸发皿中始终有溶液),则溶液中溶质的质量分数(m%)与时间(t)的关系合理的是( )
A. B.
C. D.
3. 已知某溶液的溶质质量分数为20%,则下列比例正确的是( )
A.溶质质量∶溶液质量=1∶5
B.溶剂质量∶溶液质量=1∶5
C.溶质质量∶溶剂质量=1∶5
D.溶质质量∶溶液质量=4∶5
4. 将 40 g 98%的浓 H2SO4 配制成20% 的稀 H2SO4,需加水的质量为( )
A. 196 g B. 156 g C. 155.2 g D. 8.16 g
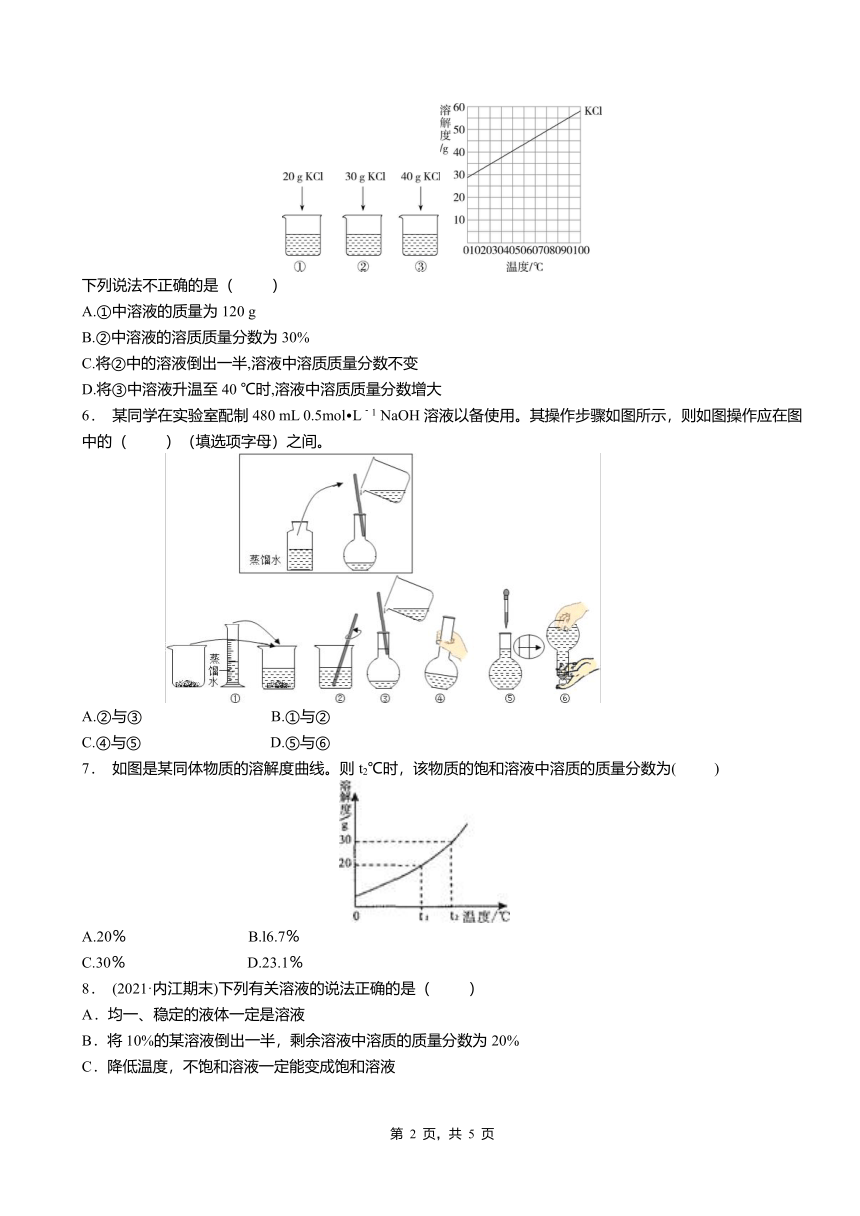
5. (2021北京石景山一模)20 ℃时,向下列3只盛有100 g水的烧杯中,分别加入不同质量的KCl固体,充分溶解。
下列说法不正确的是( )
A.①中溶液的质量为120 g
B.②中溶液的溶质质量分数为30%
C.将②中的溶液倒出一半,溶液中溶质质量分数不变
D.将③中溶液升温至40 ℃时,溶液中溶质质量分数增大
6. 某同学在实验室配制480 mL 0.5mol L﹣1 NaOH溶液以备使用。其操作步骤如图所示,则如图操作应在图中的( )(填选项字母)之间。
A.②与③ B.①与②
C.④与⑤ D.⑤与⑥
7. 如图是某同体物质的溶解度曲线。则t2℃时,该物质的饱和溶液中溶质的质量分数为( )
A.20% B.l6.7%
C.30% D.23.1%
8. (2021·内江期末)下列有关溶液的说法正确的是( )
A.均一、稳定的液体一定是溶液
B.将10%的某溶液倒出一半,剩余溶液中溶质的质量分数为20%
C.降低温度,不饱和溶液一定能变成饱和溶液
D.使用洗洁精洗去餐具上的油污属于乳化现象
9. 要配制一定质量分数的氢氧化钠溶液,正确的操作步骤是( )
A.称量、溶解、计算、装瓶、贴标签
B.称量、计算、溶解、装瓶、贴标签
C.计算、称量、溶解、装瓶、贴标签
D.溶解、计算、称量、装瓶、贴标签
10.(2021·青岛质检)关于20%的硝酸钾溶液的含义,理解正确的是( )
A.100 g水中溶解20 g硝酸钾
B.将30 g硝酸钾溶解到170 g水中
C.将硝酸钾和水按照25∶100的质量比配成溶液
D.将100 g硝酸钾溶液倒出一半剩余溶液的溶质质量分数为10%
二、填空题
11.(2021·龙海一模)全国开展抗击“新冠肺炎”以来大部分地区使用过氧乙酸消毒(过氧乙酸的化学式是CH3COOOH),过氧乙酸消毒液是由CH3COOOH与水配制而成的:
(1)过氧乙酸消毒液中的溶质是__ __;溶剂是__ __。
(2)过氧乙酸分解产生氧气,能有效地氧化病毒,有较强的腐蚀性,配制过氧乙酸应用下列哪种容器__ __。
A.铁制容器 B.铝制容器 C.塑料容器
配制过氧乙酸溶液时应戴橡胶手套,其原因是__ __。
(3)某学校欲用2%的过氧乙酸溶液1 500 g进行教室内喷雾消毒,需要15%的过氧乙酸溶液__ __克。
12.(2021吉林长春二模)硝酸钾、氯化钾的溶解度曲线如图甲所示,回答下列问题:
甲
乙
(1)t1 ℃时硝酸钾的溶解度 氯化钾的溶解度(填“>”“<”或“=”);
(2)t2 ℃时,将60 g 氯化钾放入 g水中,完全溶解后,可得到恰好饱和的溶液;
(3)如图乙是有关硝酸钾溶液的实验操作及变化情况,下列说法正确的是 ;
A.①与②的溶质质量可能相等
B.②与③的溶质质量分数一定相等
C.若将等温度等质量的硝酸钾和氯化钾饱和溶液,恒温蒸发等质量的水,析出的晶体质量:硝酸钾>氯化钾
D.若将等温度等质量的硝酸钾和氯化钾的饱和溶液,降低相同的温度,析出的晶体质量:硝酸钾>氯化钾
(4)用40%的硝酸钾溶液配制100 g 10%的硝酸钾溶液,需要加入水的体积是 。
13.某学校化学兴趣小组用NaCl固体(含有的杂质CaO)来配制一定质量分数的NaCl溶液,实验的流程图如下:
请回答:
(1)写出适量HCl加入到溶液B中所发生反应的化学方程式为________。
(2)操作2的名称是________,在溶液A中加入过量碳酸钠的目的是________。
(3)若要配制100 g质量分数为5.5%的氯化钠溶液,除了用到天平、烧杯、量筒、胶头滴管外,还需用到的玻璃仪器是________,其作用是________。
(4)如果配制后溶液溶质的质量分数低于5.5%,你认为可能的原因是________。(任写一个)
14.溶解性是指________。物质的溶解性主要与________、________和________等因素有关。其中________被称为影响物质溶解性的外部因素;而________和________被称为影响溶解性的内部因素。
15.在溶质质量分数为20%的KNO3溶液中加入3 g KNO3和12 g水完全溶解后,所得溶液中溶质的质量分数为________。
三、计算题
16.某兴趣小组用 73 g 溶质质量分数为 20%盐酸与足量锌粒反应,可制得氢气的质量是多少?
17.如图所示,往水电解器中加入 96 g 蒸馏水和 2 g Na2SO4(Na2SO4 不参与反应,仅起增加水的导电性的作用)组成的混合物,然后进行电解,当负极得到 2 g 气体时,停止实验。
计算:
(1)停止实验时,电解消耗水的质量是多少?
(2)停止实验后,剩余溶液中 Na2SO4的质量分数是多少?
2021-2022学年人教版初三化学下册第九单元课题3 溶液的浓度 综合训练(参考答案)
一、选择题
题号 1 2 3 4 5 6 7 8 9 10
答案 C A A B B C D D C C
二、填空题
11.CH3COOOH H2O C 橡胶的化学性质比较稳定,不易与过氧乙酸发生反应 200
12. (1)= (2)150 (3)ABD (4)75 mL
13.(1)Na2CO3+2HCl═2NaCl+H2O+CO2↑
(2)过滤 充分除尽溶液中的氢氧化钙
(3)玻璃棒 搅拌加快食盐溶解速率
(4)用量筒量取水时错误,如取水时仰视读数、烧杯中有水
14.物质在溶剂里的溶解能力 溶质的性质 溶剂的性质 温度 温度 溶质的性质 溶剂的性质
15.20%
三、计算题
16. 解:设反应生成氢气的质量为 x。
73 g 溶质质量分数为 20%的盐酸中溶质的质量为:73 g×20%=14.6 g
Zn+2HCl ZnCl2+H2↑
73 2
14.6 g x
x=0.4 g
答:可制得氢气的质量是 0.4 g。
17. 解:(1)设生成 2 g 氢气时消耗的水的质量为 x。
2H2O 2H2↑+O2↑
36 4
x 2 g
x=18 g
(2)由于电解过程中硫酸钠仅起增加水的导电性的作用,其质量保持不变,剩余溶液中 Na2SO4 的质量分数为:
×100%=2.5%
答:(1)停止实验时,电解消耗水的质量是18 g。
(2)停止实验后,剩余溶液中 Na2SO4 的质量分数是 2.5%。
PAGE
第 1 页,共 1 页
班级__________ 座号_____ 姓名__________ 分数__________
一、选择题
1. (2021广东珠海香洲二模)20 ℃时,甲、乙两固体在水中最多能溶解的质量如图所示。下列描述不正确的是( )
A.20 ℃时,甲的溶解度比乙大
B.20 ℃时,20 g水和40 g水中最多溶解甲的质量不相等,但形成饱和溶液的溶质质量分数相等
C.20 ℃时,a点表示的甲、乙两固体所对应的溶液都是不饱和溶液
D.20 ℃时,乙的溶解度为60 g
2. 保持温度不变,小心蒸发NaCl不饱和溶液(蒸发皿中始终有溶液),则溶液中溶质的质量分数(m%)与时间(t)的关系合理的是( )
A. B.
C. D.
3. 已知某溶液的溶质质量分数为20%,则下列比例正确的是( )
A.溶质质量∶溶液质量=1∶5
B.溶剂质量∶溶液质量=1∶5
C.溶质质量∶溶剂质量=1∶5
D.溶质质量∶溶液质量=4∶5
4. 将 40 g 98%的浓 H2SO4 配制成20% 的稀 H2SO4,需加水的质量为( )
A. 196 g B. 156 g C. 155.2 g D. 8.16 g
5. (2021北京石景山一模)20 ℃时,向下列3只盛有100 g水的烧杯中,分别加入不同质量的KCl固体,充分溶解。
下列说法不正确的是( )
A.①中溶液的质量为120 g
B.②中溶液的溶质质量分数为30%
C.将②中的溶液倒出一半,溶液中溶质质量分数不变
D.将③中溶液升温至40 ℃时,溶液中溶质质量分数增大
6. 某同学在实验室配制480 mL 0.5mol L﹣1 NaOH溶液以备使用。其操作步骤如图所示,则如图操作应在图中的( )(填选项字母)之间。
A.②与③ B.①与②
C.④与⑤ D.⑤与⑥
7. 如图是某同体物质的溶解度曲线。则t2℃时,该物质的饱和溶液中溶质的质量分数为( )
A.20% B.l6.7%
C.30% D.23.1%
8. (2021·内江期末)下列有关溶液的说法正确的是( )
A.均一、稳定的液体一定是溶液
B.将10%的某溶液倒出一半,剩余溶液中溶质的质量分数为20%
C.降低温度,不饱和溶液一定能变成饱和溶液
D.使用洗洁精洗去餐具上的油污属于乳化现象
9. 要配制一定质量分数的氢氧化钠溶液,正确的操作步骤是( )
A.称量、溶解、计算、装瓶、贴标签
B.称量、计算、溶解、装瓶、贴标签
C.计算、称量、溶解、装瓶、贴标签
D.溶解、计算、称量、装瓶、贴标签
10.(2021·青岛质检)关于20%的硝酸钾溶液的含义,理解正确的是( )
A.100 g水中溶解20 g硝酸钾
B.将30 g硝酸钾溶解到170 g水中
C.将硝酸钾和水按照25∶100的质量比配成溶液
D.将100 g硝酸钾溶液倒出一半剩余溶液的溶质质量分数为10%
二、填空题
11.(2021·龙海一模)全国开展抗击“新冠肺炎”以来大部分地区使用过氧乙酸消毒(过氧乙酸的化学式是CH3COOOH),过氧乙酸消毒液是由CH3COOOH与水配制而成的:
(1)过氧乙酸消毒液中的溶质是__ __;溶剂是__ __。
(2)过氧乙酸分解产生氧气,能有效地氧化病毒,有较强的腐蚀性,配制过氧乙酸应用下列哪种容器__ __。
A.铁制容器 B.铝制容器 C.塑料容器
配制过氧乙酸溶液时应戴橡胶手套,其原因是__ __。
(3)某学校欲用2%的过氧乙酸溶液1 500 g进行教室内喷雾消毒,需要15%的过氧乙酸溶液__ __克。
12.(2021吉林长春二模)硝酸钾、氯化钾的溶解度曲线如图甲所示,回答下列问题:
甲
乙
(1)t1 ℃时硝酸钾的溶解度 氯化钾的溶解度(填“>”“<”或“=”);
(2)t2 ℃时,将60 g 氯化钾放入 g水中,完全溶解后,可得到恰好饱和的溶液;
(3)如图乙是有关硝酸钾溶液的实验操作及变化情况,下列说法正确的是 ;
A.①与②的溶质质量可能相等
B.②与③的溶质质量分数一定相等
C.若将等温度等质量的硝酸钾和氯化钾饱和溶液,恒温蒸发等质量的水,析出的晶体质量:硝酸钾>氯化钾
D.若将等温度等质量的硝酸钾和氯化钾的饱和溶液,降低相同的温度,析出的晶体质量:硝酸钾>氯化钾
(4)用40%的硝酸钾溶液配制100 g 10%的硝酸钾溶液,需要加入水的体积是 。
13.某学校化学兴趣小组用NaCl固体(含有的杂质CaO)来配制一定质量分数的NaCl溶液,实验的流程图如下:
请回答:
(1)写出适量HCl加入到溶液B中所发生反应的化学方程式为________。
(2)操作2的名称是________,在溶液A中加入过量碳酸钠的目的是________。
(3)若要配制100 g质量分数为5.5%的氯化钠溶液,除了用到天平、烧杯、量筒、胶头滴管外,还需用到的玻璃仪器是________,其作用是________。
(4)如果配制后溶液溶质的质量分数低于5.5%,你认为可能的原因是________。(任写一个)
14.溶解性是指________。物质的溶解性主要与________、________和________等因素有关。其中________被称为影响物质溶解性的外部因素;而________和________被称为影响溶解性的内部因素。
15.在溶质质量分数为20%的KNO3溶液中加入3 g KNO3和12 g水完全溶解后,所得溶液中溶质的质量分数为________。
三、计算题
16.某兴趣小组用 73 g 溶质质量分数为 20%盐酸与足量锌粒反应,可制得氢气的质量是多少?
17.如图所示,往水电解器中加入 96 g 蒸馏水和 2 g Na2SO4(Na2SO4 不参与反应,仅起增加水的导电性的作用)组成的混合物,然后进行电解,当负极得到 2 g 气体时,停止实验。
计算:
(1)停止实验时,电解消耗水的质量是多少?
(2)停止实验后,剩余溶液中 Na2SO4的质量分数是多少?
2021-2022学年人教版初三化学下册第九单元课题3 溶液的浓度 综合训练(参考答案)
一、选择题
题号 1 2 3 4 5 6 7 8 9 10
答案 C A A B B C D D C C
二、填空题
11.CH3COOOH H2O C 橡胶的化学性质比较稳定,不易与过氧乙酸发生反应 200
12. (1)= (2)150 (3)ABD (4)75 mL
13.(1)Na2CO3+2HCl═2NaCl+H2O+CO2↑
(2)过滤 充分除尽溶液中的氢氧化钙
(3)玻璃棒 搅拌加快食盐溶解速率
(4)用量筒量取水时错误,如取水时仰视读数、烧杯中有水
14.物质在溶剂里的溶解能力 溶质的性质 溶剂的性质 温度 温度 溶质的性质 溶剂的性质
15.20%
三、计算题
16. 解:设反应生成氢气的质量为 x。
73 g 溶质质量分数为 20%的盐酸中溶质的质量为:73 g×20%=14.6 g
Zn+2HCl ZnCl2+H2↑
73 2
14.6 g x
x=0.4 g
答:可制得氢气的质量是 0.4 g。
17. 解:(1)设生成 2 g 氢气时消耗的水的质量为 x。
2H2O 2H2↑+O2↑
36 4
x 2 g
x=18 g
(2)由于电解过程中硫酸钠仅起增加水的导电性的作用,其质量保持不变,剩余溶液中 Na2SO4 的质量分数为:
×100%=2.5%
答:(1)停止实验时,电解消耗水的质量是18 g。
(2)停止实验后,剩余溶液中 Na2SO4 的质量分数是 2.5%。
PAGE
第 1 页,共 1 页
同课章节目录
