课题3 溶液的浓度
图片预览











文档简介
课件39张PPT。第九单元 溶液课题1 溶液的形成
课题2 溶解度
课题3 溶液的浓度
实验活动5 一定质量分数的氯化钠溶液的配制欢迎各位领导老师光临指导!主讲:陈勇教学目标1、掌握一种溶液浓度的表示方法——溶质的质量分数,掌握溶质质量分数计算公式,能进行溶质质量分数的简单计算。
2.学会有关溶液稀释的计算。
3. 学会配制一定溶质质量分数的溶液。
4.溶质质量分数在化学方程式的应用
课题3 溶液的浓度第1课时:1、溶质质量分数的概念及简单计算。2、溶质质量分数与溶解度的关系。
第2课时:1. 溶液稀释问题的计算2、配制一定溶质质量分数的溶液的方法。
第3课时溶质质量分数在化学方程式的应用农夫自杀 只因果树离奇死亡据《扬子晚报》报道:
2009年7月20日,河南一果农,因用自己全部家当种植的果树离奇死亡而伤心过度,菜农自尽而死,据其家人介绍,他本人不大识字,7月18日晚买来了250千克的液体肥料,他掺入了1000千克的水后进行喷洒两天后,所有果树离奇死亡。经警方调查,结果显示该农民所配肥料浓度过大,导致叶片大面积死亡。喷洒药水飞机喷洒农药要杀死害虫和病菌,如果药液太浓会毒害农作物,药液太稀又不能有效地杀虫灭菌。10.51111.5很浅较浅较深 在三支试管中各加入10mL水,然后分别加入0.5g、1g、1.5g固体硫酸铜。比较溶液颜色?溶液的组成?判断溶液浓稀的依据?实验9-5生理盐水浓度是0.9%,每99.1克水和0.9克氯化钠溶解混合而成。 0.9%表示的意义是什么?
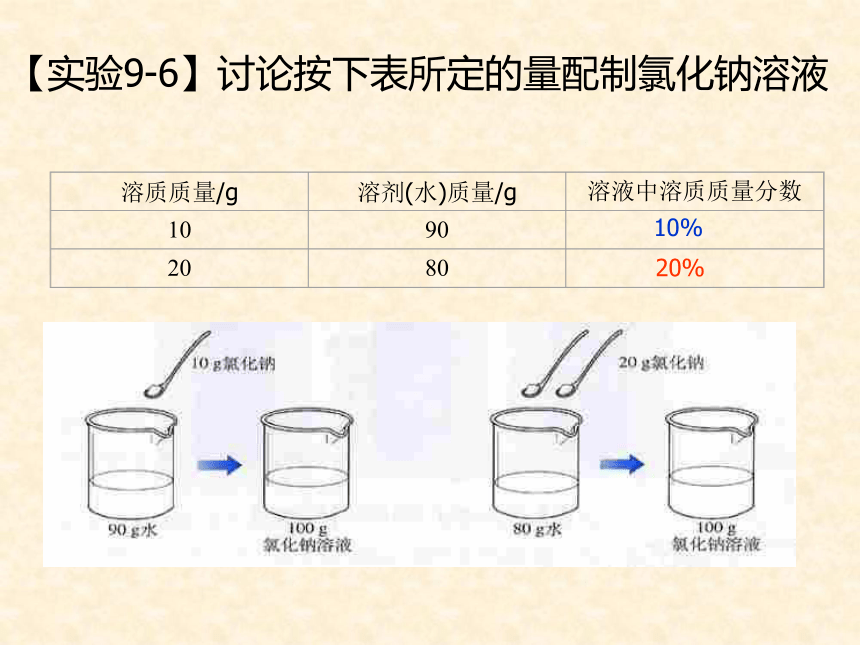
医用酒精浓度是75% ,每3体积的酒精和1体积的蒸馏水混合配制而成的的酒精溶液, 75%表示的意义是什么?是溶质质量与溶液质量之比【实验9-6】讨论按下表所定的量配制氯化钠溶液10%20% 例1:(1)在化学实验中,需要用质量分数为20%的氢氧化钠溶液。现要配制200g这种溶液,需要氢氧化钠和水的质量各多少?(2)如果现在只有20g的氢氧化钠固体可以配制成20%的氢氧化钠溶液多少克?解:[题型一]:溶液中溶质的质量分数基本计算 答;需要40g氢氧化钠,160g的水。 饱和溶液的
溶质质量分数= 溶解度100g+溶解度 溶质的质量分数36% 是指: 100g溶液中含有36g溶质。
溶质200C时溶解度36g是指: 在200C 时,100g水最多溶解该溶质36g。溶质质量分数与溶解度的比较 例2、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。 解:20℃时食盐饱和溶液的溶质质量分数为=26.5%36g100g+36g答:略[题型二]:饱和溶液中溶质的质量分数计算 讨论:在20℃时食盐的溶解度为36g,将20g食盐放入50g水中得到----g食盐溶液,此时溶液中溶质的质量分数----?1826.5% 分析:溶解度即为“溶解的限度”,100克水在20 ℃最多溶解36克NaCl,则溶液中NaCl的质量分数即为饱和溶液的浓度
36 /(100+36)×100% = 18 / (18+50) ×100% ≈ 26.5% 现有100克水和10克氯化钠固体,50克20%的氯化钠溶液、及40克5%的氯化钠溶液,要配制成10%的氯化钠溶液100克你有多少方法?(试剂多少根据需要任意选择)讨论?谈谈你在本节课的收获再见祝同学们学习进步!谢谢同学们的合作!课题3 溶质的质量分数 第2课时
1.溶液稀释问题的计算
2.溶质质量分数的配制
现有100克水和10克氯化钠固体,50克20%的氯化钠溶液、及40克5%的氯化钠溶液,要配制成10%的氯化钠溶液100克你有多少方法?(试剂多少根据需要任意选择)讨论? 向20%的某浓溶液中加水后溶液、溶质和溶剂的质量如何变化? 如何解决有关溶液稀释的计算? ? [题型三] :有关溶液稀释或浓缩的计算计算的依据 : 稀释前溶质质量 = 稀释后溶质质量 浓缩前溶质质量 = 浓缩后溶质质量 例题3 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?分析:解决这道题的关键是什么?解:溶液稀释前后溶质的质量不变如果把50g换成50mL,还需要什么条件?设稀释后溶液的质量为x。50g× 98%=X × 20% X=245g
需要水的质量=245g-50g=195g答:需要水的质量为195g。公式: m浓×c浓%= m稀×c稀%液体质量(克)=液体体积(毫升)×密度(克/毫升)
自学例题3练习:配制10%硫酸98g,要98%硫酸(密度为1.84g/m L )多少mL ?解:设需要98%硫酸的体积为V V?1.84g/mL ?98% = 98g ?10%V = 答:要98%硫酸5.4mL
练习 某工厂化验室配制5000g20%的盐酸,需要38%的盐酸(密度为1.19g/mL)的盐酸多少毫升?解:设需38%的盐酸体积为X5000 g x 20%= 1.19g/mLx 38%X
X=
5000 g x 20%
= 1.19g/mLx 38%=2211.4mL答需38%的盐酸体积为2211.4mL小试牛刀:1、配制100mL密度为1.1g/mL的20%的NaCl溶液
需要多少gNaCl和多少g水?2、配制500m L20%的硫酸溶液(密度为1.14g/mL)
需要98%硫酸溶液(密度为1.84g / mL )多少mL ?解:所需NaCl的质量为:100mL?1.1g/mL?20% = 22g所需水的质量为:100mL? 1.1g/mL – 22g = 88g答:略解:设需要98%硫酸的体积为V500mL? 1.14g/mL?20%= V? 1.84g/mL ?98%V=答:略实验活动5一定质量分数的氯化钠溶液的配制 配制6%的氯化钠溶液 配制3%的氯化钠溶液 从上述解题过程中,你得到什么规律?求溶质的质量分数的关键是什么? 在实验室如何配制50克6%的食盐溶液 ?
1、需要什么仪器,其作用是什么?
2、操作步骤如何?关键是找出溶质和溶液的质量配制溶质质量分数一定的溶液如何配制50g质量分数为6%的氯化钠溶液1、计算:配制时所需NaCl质量为__________,
所需水的质量_____,2、称量(或量取)用托盘天平称3gNaCl固体,倒入烧杯中用量筒量取47m L水的体积,倒入盛有NaCl
的烧杯中3、溶解:用玻璃棒搅拌烧杯中的溶液,使NaCl溶解4、把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签。
(标签上应包括药品名称和溶液中溶质的质量分数)3g47g相当于47m L用固体配制一定溶质质量分数的溶液 主要仪器:托盘天平、烧杯、量筒、玻璃棒、药匙、胶头滴管实验步骤:1、计算所需溶质和溶剂的质量;
2、分别称或量出所需的溶质和溶剂;
3、将溶质和溶剂在烧杯中混合,搅拌至溶质完全溶解。
4、装瓶,贴标签。若用液体配制呢?设需6%的氯化钠溶液质量为x
根据稀释前后溶质质量不变
6%X=50g ×3% x=25g m浓×c浓%= m稀×c稀%需水的质量50 -25g=25g需6%溶液的体积=25g÷1.04g/mL=24.0 mL 需水的体积=25g÷1.0g/mL=25.0 mL (2)量取24.0mL6%的氯化钠溶液和25.0 mL 的水(3)混匀(4)装瓶,贴标签。练习:下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。实验误差分析1.称量时左物右码放反了
2.药品中有杂质
3.量取体积时仰视读数或俯视读数
4.倾倒溶剂水时,洒出烧杯外若俯视则读数偏高,液体的
实际体积<读数仰视,读数偏低,液体的
实际体积>读数3、配制溶质质量分数一定的溶液⑴计算 ⑵称量 ⑶溶解(混匀)⑷装瓶药匙 天平 烧杯 量筒 滴管 玻璃棒溶液稀释公式: m浓×c浓%= m稀×c稀%注意点:溶液是混合物,溶液的质量不能直接代入
化学方程式中计算,必须换算成溶质的质量。(第3课时)与溶液有关化学方程式的计算注意点:溶液是混合物,溶液的质量不能直接代入
化学方程式中计算,必须换算成溶质的质量。例题4:100g 9.8%硫酸跟多少克锌反应?同时生成多少克氢气?解:100g9.8%硫酸中含纯硫酸的质量为:100g?9.8%=9.8g设参加反应的锌质量为X ,生成氢气的质量为YZn + H2SO4 = ZnSO4 + H2?65 98 2X 9.8g YX=6.5g Y=0.2g答:略[题型四]: 有关化学方程式的计算 例4:6.5g锌和100g一定质量分数的稀硫酸恰好完全反应,求:(1)生成氢气的质量?(2)稀硫酸中溶质的质量分数?(3)生成的硫酸锌溶液中溶质的质量分数?解:设生成氢气的质量为x。硫酸的质量为y。生成硫酸锌的质量为z。 Zn+H2SO4 == ZnSO4+H2↑
65 98 161 2
6.5g y z x X=0.2g
y=9.8g
z=16.1g稀硫酸中硫酸的质量分数 = ?100%=9.8%生成的硫酸锌溶液中溶质的质量分数为:
=15.15%答:生成氢气0.2g,稀硫酸中溶质的质量分数为9.8%,生成的硫酸锌溶液溶质的质量分数为15.15%。巩固练习:40g10%NaOH溶液跟多少克10%盐酸完全反应?反应后溶液的溶质的质量分数是多少?解:设稀盐酸的质量为X,反应后生成的NaCl的质量为YNaOH + HCl = NaCl + H2O40g?10% X ?10% Y40 36.5 58.5 X = 36.5gY=5.85gNaCl% = 答:略 (NaOH + HCl = NaCl + H2O)练习: 26g黄铜(Cu-Zn合金)与100g稀硫酸在烧杯中恰好完全反应,反应后测得烧杯中剩余物的总质量为125.8克。求:⑴黄铜中铜的质量分数;⑵反应后所得溶液中溶质质量分数。
(计算结果精确到0.1%2011年四川中考题)解:氢气的质量为0.2克。
设锌的质量为X,
Zn+ H2SO4 = ZnSO4+ H2↑
65 161 2
X Y 0.2g
65:X=2:0.2g X=6.5g
161:Y=2:0.2g Y=16.1g
黄铜中铜的质量分数:(26g-6.5g) / 26 g ×100%=75%
反应后所得溶液中溶质质量分数:16.1 g/ (125.8 g-19.5g ) ×100%=15.1%
答:黄铜中铜的质量分数为75% 反应后所得溶液中溶质质量分数为15.1%作业:为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,洋洋同学取一定质量的黄铜样品放入烧杯中,再取40g稀盐酸分四次加入烧杯中,均充分反应,实验数据如下:
第一次 第二次 第三次 第四次
加入稀盐酸质量(g) 10 10 10 10
剩余固体的质量(g) 9.10 8.45 7.80 7.80
(1)上述反应的化学方程式为 ;
(2)根据锌的质量列出求解第二次生成氢气质量(x)的比例式 ;
(3)所用稀盐酸中溶质的质量分数为 ;
(4)用36.5%的浓盐酸配制40g上述稀盐酸,需要浓盐酸的质量为 ;
(5)黄铜样品中铜的质量分数为 。
(6)第三次完全反应后所得溶液的溶质的质量分数为多少?
1、50g盐酸5与锌完全反应,得0.2g氢气,求盐酸的溶质的质量分数? 2、某盐酸溶液100g,与13g含杂质5%的锌完全反应,这种盐酸的溶质质量分数是多少?溶质质量分数在化学方程式中应用作业再见祝同学们学习进步!
课题2 溶解度
课题3 溶液的浓度
实验活动5 一定质量分数的氯化钠溶液的配制欢迎各位领导老师光临指导!主讲:陈勇教学目标1、掌握一种溶液浓度的表示方法——溶质的质量分数,掌握溶质质量分数计算公式,能进行溶质质量分数的简单计算。
2.学会有关溶液稀释的计算。
3. 学会配制一定溶质质量分数的溶液。
4.溶质质量分数在化学方程式的应用
课题3 溶液的浓度第1课时:1、溶质质量分数的概念及简单计算。2、溶质质量分数与溶解度的关系。
第2课时:1. 溶液稀释问题的计算2、配制一定溶质质量分数的溶液的方法。
第3课时溶质质量分数在化学方程式的应用农夫自杀 只因果树离奇死亡据《扬子晚报》报道:
2009年7月20日,河南一果农,因用自己全部家当种植的果树离奇死亡而伤心过度,菜农自尽而死,据其家人介绍,他本人不大识字,7月18日晚买来了250千克的液体肥料,他掺入了1000千克的水后进行喷洒两天后,所有果树离奇死亡。经警方调查,结果显示该农民所配肥料浓度过大,导致叶片大面积死亡。喷洒药水飞机喷洒农药要杀死害虫和病菌,如果药液太浓会毒害农作物,药液太稀又不能有效地杀虫灭菌。10.51111.5很浅较浅较深 在三支试管中各加入10mL水,然后分别加入0.5g、1g、1.5g固体硫酸铜。比较溶液颜色?溶液的组成?判断溶液浓稀的依据?实验9-5生理盐水浓度是0.9%,每99.1克水和0.9克氯化钠溶解混合而成。 0.9%表示的意义是什么?
医用酒精浓度是75% ,每3体积的酒精和1体积的蒸馏水混合配制而成的的酒精溶液, 75%表示的意义是什么?是溶质质量与溶液质量之比【实验9-6】讨论按下表所定的量配制氯化钠溶液10%20% 例1:(1)在化学实验中,需要用质量分数为20%的氢氧化钠溶液。现要配制200g这种溶液,需要氢氧化钠和水的质量各多少?(2)如果现在只有20g的氢氧化钠固体可以配制成20%的氢氧化钠溶液多少克?解:[题型一]:溶液中溶质的质量分数基本计算 答;需要40g氢氧化钠,160g的水。 饱和溶液的
溶质质量分数= 溶解度100g+溶解度 溶质的质量分数36% 是指: 100g溶液中含有36g溶质。
溶质200C时溶解度36g是指: 在200C 时,100g水最多溶解该溶质36g。溶质质量分数与溶解度的比较 例2、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。 解:20℃时食盐饱和溶液的溶质质量分数为=26.5%36g100g+36g答:略[题型二]:饱和溶液中溶质的质量分数计算 讨论:在20℃时食盐的溶解度为36g,将20g食盐放入50g水中得到----g食盐溶液,此时溶液中溶质的质量分数----?1826.5% 分析:溶解度即为“溶解的限度”,100克水在20 ℃最多溶解36克NaCl,则溶液中NaCl的质量分数即为饱和溶液的浓度
36 /(100+36)×100% = 18 / (18+50) ×100% ≈ 26.5% 现有100克水和10克氯化钠固体,50克20%的氯化钠溶液、及40克5%的氯化钠溶液,要配制成10%的氯化钠溶液100克你有多少方法?(试剂多少根据需要任意选择)讨论?谈谈你在本节课的收获再见祝同学们学习进步!谢谢同学们的合作!课题3 溶质的质量分数 第2课时
1.溶液稀释问题的计算
2.溶质质量分数的配制
现有100克水和10克氯化钠固体,50克20%的氯化钠溶液、及40克5%的氯化钠溶液,要配制成10%的氯化钠溶液100克你有多少方法?(试剂多少根据需要任意选择)讨论? 向20%的某浓溶液中加水后溶液、溶质和溶剂的质量如何变化? 如何解决有关溶液稀释的计算? ? [题型三] :有关溶液稀释或浓缩的计算计算的依据 : 稀释前溶质质量 = 稀释后溶质质量 浓缩前溶质质量 = 浓缩后溶质质量 例题3 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?分析:解决这道题的关键是什么?解:溶液稀释前后溶质的质量不变如果把50g换成50mL,还需要什么条件?设稀释后溶液的质量为x。50g× 98%=X × 20% X=245g
需要水的质量=245g-50g=195g答:需要水的质量为195g。公式: m浓×c浓%= m稀×c稀%液体质量(克)=液体体积(毫升)×密度(克/毫升)
自学例题3练习:配制10%硫酸98g,要98%硫酸(密度为1.84g/m L )多少mL ?解:设需要98%硫酸的体积为V V?1.84g/mL ?98% = 98g ?10%V = 答:要98%硫酸5.4mL
练习 某工厂化验室配制5000g20%的盐酸,需要38%的盐酸(密度为1.19g/mL)的盐酸多少毫升?解:设需38%的盐酸体积为X5000 g x 20%= 1.19g/mLx 38%X
X=
5000 g x 20%
= 1.19g/mLx 38%=2211.4mL答需38%的盐酸体积为2211.4mL小试牛刀:1、配制100mL密度为1.1g/mL的20%的NaCl溶液
需要多少gNaCl和多少g水?2、配制500m L20%的硫酸溶液(密度为1.14g/mL)
需要98%硫酸溶液(密度为1.84g / mL )多少mL ?解:所需NaCl的质量为:100mL?1.1g/mL?20% = 22g所需水的质量为:100mL? 1.1g/mL – 22g = 88g答:略解:设需要98%硫酸的体积为V500mL? 1.14g/mL?20%= V? 1.84g/mL ?98%V=答:略实验活动5一定质量分数的氯化钠溶液的配制 配制6%的氯化钠溶液 配制3%的氯化钠溶液 从上述解题过程中,你得到什么规律?求溶质的质量分数的关键是什么? 在实验室如何配制50克6%的食盐溶液 ?
1、需要什么仪器,其作用是什么?
2、操作步骤如何?关键是找出溶质和溶液的质量配制溶质质量分数一定的溶液如何配制50g质量分数为6%的氯化钠溶液1、计算:配制时所需NaCl质量为__________,
所需水的质量_____,2、称量(或量取)用托盘天平称3gNaCl固体,倒入烧杯中用量筒量取47m L水的体积,倒入盛有NaCl
的烧杯中3、溶解:用玻璃棒搅拌烧杯中的溶液,使NaCl溶解4、把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签。
(标签上应包括药品名称和溶液中溶质的质量分数)3g47g相当于47m L用固体配制一定溶质质量分数的溶液 主要仪器:托盘天平、烧杯、量筒、玻璃棒、药匙、胶头滴管实验步骤:1、计算所需溶质和溶剂的质量;
2、分别称或量出所需的溶质和溶剂;
3、将溶质和溶剂在烧杯中混合,搅拌至溶质完全溶解。
4、装瓶,贴标签。若用液体配制呢?设需6%的氯化钠溶液质量为x
根据稀释前后溶质质量不变
6%X=50g ×3% x=25g m浓×c浓%= m稀×c稀%需水的质量50 -25g=25g需6%溶液的体积=25g÷1.04g/mL=24.0 mL 需水的体积=25g÷1.0g/mL=25.0 mL (2)量取24.0mL6%的氯化钠溶液和25.0 mL 的水(3)混匀(4)装瓶,贴标签。练习:下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。实验误差分析1.称量时左物右码放反了
2.药品中有杂质
3.量取体积时仰视读数或俯视读数
4.倾倒溶剂水时,洒出烧杯外若俯视则读数偏高,液体的
实际体积<读数仰视,读数偏低,液体的
实际体积>读数3、配制溶质质量分数一定的溶液⑴计算 ⑵称量 ⑶溶解(混匀)⑷装瓶药匙 天平 烧杯 量筒 滴管 玻璃棒溶液稀释公式: m浓×c浓%= m稀×c稀%注意点:溶液是混合物,溶液的质量不能直接代入
化学方程式中计算,必须换算成溶质的质量。(第3课时)与溶液有关化学方程式的计算注意点:溶液是混合物,溶液的质量不能直接代入
化学方程式中计算,必须换算成溶质的质量。例题4:100g 9.8%硫酸跟多少克锌反应?同时生成多少克氢气?解:100g9.8%硫酸中含纯硫酸的质量为:100g?9.8%=9.8g设参加反应的锌质量为X ,生成氢气的质量为YZn + H2SO4 = ZnSO4 + H2?65 98 2X 9.8g YX=6.5g Y=0.2g答:略[题型四]: 有关化学方程式的计算 例4:6.5g锌和100g一定质量分数的稀硫酸恰好完全反应,求:(1)生成氢气的质量?(2)稀硫酸中溶质的质量分数?(3)生成的硫酸锌溶液中溶质的质量分数?解:设生成氢气的质量为x。硫酸的质量为y。生成硫酸锌的质量为z。 Zn+H2SO4 == ZnSO4+H2↑
65 98 161 2
6.5g y z x X=0.2g
y=9.8g
z=16.1g稀硫酸中硫酸的质量分数 = ?100%=9.8%生成的硫酸锌溶液中溶质的质量分数为:
=15.15%答:生成氢气0.2g,稀硫酸中溶质的质量分数为9.8%,生成的硫酸锌溶液溶质的质量分数为15.15%。巩固练习:40g10%NaOH溶液跟多少克10%盐酸完全反应?反应后溶液的溶质的质量分数是多少?解:设稀盐酸的质量为X,反应后生成的NaCl的质量为YNaOH + HCl = NaCl + H2O40g?10% X ?10% Y40 36.5 58.5 X = 36.5gY=5.85gNaCl% = 答:略 (NaOH + HCl = NaCl + H2O)练习: 26g黄铜(Cu-Zn合金)与100g稀硫酸在烧杯中恰好完全反应,反应后测得烧杯中剩余物的总质量为125.8克。求:⑴黄铜中铜的质量分数;⑵反应后所得溶液中溶质质量分数。
(计算结果精确到0.1%2011年四川中考题)解:氢气的质量为0.2克。
设锌的质量为X,
Zn+ H2SO4 = ZnSO4+ H2↑
65 161 2
X Y 0.2g
65:X=2:0.2g X=6.5g
161:Y=2:0.2g Y=16.1g
黄铜中铜的质量分数:(26g-6.5g) / 26 g ×100%=75%
反应后所得溶液中溶质质量分数:16.1 g/ (125.8 g-19.5g ) ×100%=15.1%
答:黄铜中铜的质量分数为75% 反应后所得溶液中溶质质量分数为15.1%作业:为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,洋洋同学取一定质量的黄铜样品放入烧杯中,再取40g稀盐酸分四次加入烧杯中,均充分反应,实验数据如下:
第一次 第二次 第三次 第四次
加入稀盐酸质量(g) 10 10 10 10
剩余固体的质量(g) 9.10 8.45 7.80 7.80
(1)上述反应的化学方程式为 ;
(2)根据锌的质量列出求解第二次生成氢气质量(x)的比例式 ;
(3)所用稀盐酸中溶质的质量分数为 ;
(4)用36.5%的浓盐酸配制40g上述稀盐酸,需要浓盐酸的质量为 ;
(5)黄铜样品中铜的质量分数为 。
(6)第三次完全反应后所得溶液的溶质的质量分数为多少?
1、50g盐酸5与锌完全反应,得0.2g氢气,求盐酸的溶质的质量分数? 2、某盐酸溶液100g,与13g含杂质5%的锌完全反应,这种盐酸的溶质质量分数是多少?溶质质量分数在化学方程式中应用作业再见祝同学们学习进步!
同课章节目录
