2021-2022学年高一下学期化学苏教版(2019)必修2专题7第二单元重要的含氮化工原料课件(25张ppt)
文档属性
| 名称 | 2021-2022学年高一下学期化学苏教版(2019)必修2专题7第二单元重要的含氮化工原料课件(25张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 33.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-25 08:41:05 | ||
图片预览






文档简介
(共25张PPT)
重要的含氮
化工原料
专题7 氮与社会可持续发展
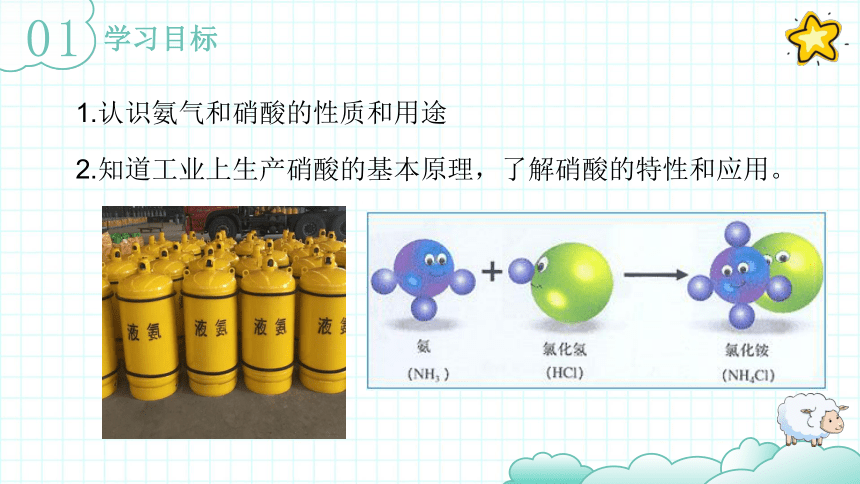
学习目标
01
1.认识氨气和硝酸的性质和用途
2.知道工业上生产硝酸的基本原理,了解硝酸的特性和应用。
重点难点
02
1.理解喷泉实验和氨水显咸性的原因
3.能从不同视角认识含氮化合物之间转化的条件和方式
2.掌握硝酸的重要性质和应用
氨气
03
物理性质:
颜色 气味 密度 溶解性 沸点
无色
刺激性气味
比空气小
极易溶于水
低
用途:
作制冷剂:氨分子间容易形成氢键,这使得氨气容易被液化,在常压下冷却至-33.5 ℃或在常温下加压至 700~800 kPa,氨气就液化成无色液体,同时放出大 量的热。液态氨汽化时要吸收大量的热,使周围的温度急剧下降,所以液态氨在工业上常用来作制冷剂。
氨气
03
化学性质:
(1).氨气与水的反应(喷泉实验):
实验现象 主要结论
烧杯中的溶液由玻璃管进入烧瓶,形成喷泉,瓶内液体呈红色。
氨极易溶于水;其水溶液呈碱性。
思考:氨气喷泉形成的原因是什么?
氨气
03
2.该喷泉实验成功的关键是什么?
延伸:
1.二氧化碳和氢氧化钠能否形成喷泉?为什么?
氢氧化钠会和二氧化碳反应,二氧化碳消耗后,烧瓶内的压力减少。造成水沿著玻璃管上升,如喷泉般喷出於烧瓶中。
(1)装置气密性良好;
(2)圆底烧瓶要干燥;
(3)装置内气体的纯度要高;
(4)气体要充满烧瓶
氨气
03
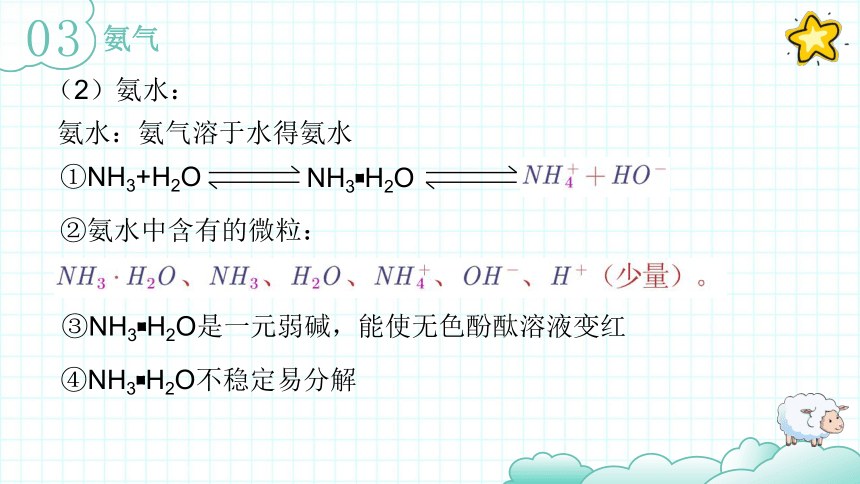
(2)氨水:
①NH3+H2O
NH3 H2O
氨水:氨气溶于水得氨水
②氨水中含有的微粒:
③NH3 H2O是一元弱碱,能使无色酚酞溶液变红
④NH3 H2O不稳定易分解
氨气
03
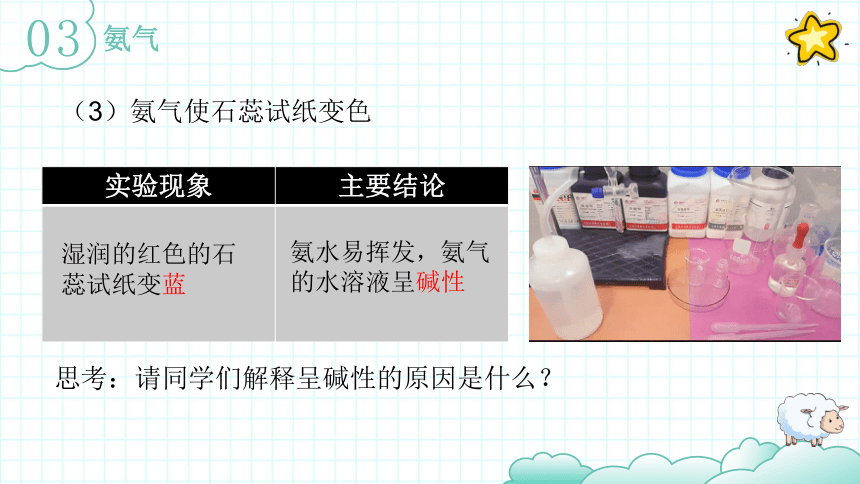
(3)氨气使石蕊试纸变色
实验现象 主要结论
湿润的红色的石蕊试纸变蓝
氨水易挥发,氨气的水溶液呈碱性
思考:请同学们解释呈碱性的原因是什么?
氨气
03
实验现象 主要结论
烧杯中出现白烟
浓氨水、浓盐酸具有挥发性,NH3与HCl结合,有固体NH4Cl生成
(4)氨气与酸的反应
反应方程式:
(用于NH3与挥发性酸的互相检验)
2NH3 + H2SO4=(NH4)2SO4
与硫酸的反应:
氨气
03
(4)氨气与氧气的反应:
4NH3(g) + 5O2(g)=4NO(g) + 6H2O(l) ΔH= -904 kJ·mol-1
NH3是氮的最低价(-3价)化合物,在一定条件下与氧化剂作用时,氨中的N可以失去电子,化合价升高,表现出还原性,作还原剂。在通常情况下,氨与氧气不易反应,但在加热和催化剂(如铂丝或Cr2O3)存在条件下,氨与氧气反应生成一氧化氮和水,并放出热。这一反应叫作氨的催化氧化,是工业制备硝酸的重要反应之一。
在纯氧中燃烧:
氨气
03
思考:
1.氨水作氮肥,有较低的成本,可不可以直接使用到农作物上?
2.液氨和氨水有什么区别?
氨气
03
“氨的催化氧化,是工业制备硝酸的重要反应之一”,工业上由氨气制取硝酸有哪些反应步骤?写出反应过程的化学方程式。
N2
NH3
NO
NO2
HNO3
①
③
②
④
①:
②:
③:
④:
硝酸
04
硝酸的物理性质
①
②
③
④
无色、易挥发、具有刺激性气味的液体;
能与水以任意比互 溶;
沸点为83 ℃,密度为1.42 g·cm-3
常用浓硝酸的质量分数为69%;质量分数为98%以上的硝酸为 “发烟硝酸”
硝酸
04
硝酸的化学性质
(1)硝酸不稳定,在常温下受热或见光会发生分解,生成红棕色的二氧化氮气体:
1.实验室应该如何保存硝酸?
2. 为什么久置的硝酸会略显黄色?
硝酸
04
硝酸的化学性质
实验 实验现象 化学方程式
铜与浓硝酸的反应
铜与浓硝酸的反应 3Cu + 8HNO3(稀)=3Cu(NO3)2 + 2NO↑ + 4H2O
溶液中有气泡产生;试管中充满红棕色气体;烧杯中收集到无色气体。
溶液中有气泡产生;试管烧杯中收集到无色气体。
Cu + 4HNO3(浓)=Cu(NO3)2 + 2NO2↑ + 2H2O
1.硝酸与金属的反应:
硝酸
04
硝酸的化学性质
2.硝酸与非金属的反应:
浓硝酸在加热的条件下,还能与木炭等非金属单质发生氧化还原反应:
C + 4HNO3(浓)= CO2↑ + 4NO2↑ + 2H2O
硝酸——用途
04
硝酸是一种重要的化工原料,常用来制造氮肥、燃料、塑料、炸药、硝酸盐等。
硝酸——归纳总结
04
a.除金、铂等少数金属外和几乎所有金属反应;
b. 与任何金属反应均不生成H2,说明呈现氧化性的不是H+而是HNO3;
c. 与金属反应既体现氧化性,又体现酸性;
d.常温下,浓硝酸能使铝、铁表面形成致密的氧化膜而钝化,所以可以用铝质或铁质容器盛放浓硝酸(与浓硫酸相似);
d. Cu等不活泼金属与浓硝酸反应得NO2,与稀硝酸反应得NO;Mg、Zn等较活泼金属与硝酸反应根据HNO3的浓度不同可得到NO、
N2O、N2、NH4NO3等不同产物。
硝酸——小结
03
请同学们完成下列反应的方程式:
N2
NH3
NO
NO2
HNO3
①
②
③
④
⑤
⑥
⑦
⑧
硝酸——
03
一氧化氮与二氧化氮
物理性质
一氧化氮 二氧化氮
颜色 无色 红棕色
气体 无味 刺激性气味
溶解性 不溶于水 溶于水且与水反应
密度 比空气密度大 比空气大
硝酸——
03
一氧化氮与二氧化氮
一氧化氮 二氧化氮
制备原理
化学性质
收集方法 排水法收集 向上排空气法
检验方法 在试管中接触空气后变红棕色 呈红棕色
制备比较
Cu + 4HNO3(浓)=Cu(NO3)2 + 2NO2↑ + 2H2O
04
练习
1.下列对NO和NO2的描述正确的是( )
A.NO2与水的反应中, NO2既是氧化剂又是还原剂
B. NO2是无色气体,可用向上排空气法收集
C. NO2可由和NO2直接化合得到
D.实验室制取NO2 ,可以通过金属铜与浓硝酸反应制得
A
04
练习
2.下列事实不能说明浓硝酸氧化性比稀硝酸强的是( )
A.浓硝酸遇石蕊试液变红后褪色,稀硝酸遇石蕊试液只变红不褪色
B.浓硝酸能与NO反应生成NO2,而稀硝酸不能与NO反应
C.浓硝酸在加热条件下可与碳单质反应,而稀硝酸则不能
D.足量的铜还原1mol浓硝酸和1mol稀硝酸转移电子数分别为NA和3NA
D
04
练习
3.在下列变化中,能表明硝酸具有氧化性的是( )
A.能使石蕊溶液变红色 B.能跟Ag反应生成
C.能和碳酸钙反应 D.能和CuO反应生成
4.不能使用铁质容器储运的是( )
A.浓盐酸 B.液氯 C.浓硝酸 D.浓硫酸
B
A
04
练习
18.(15分)Ⅰ.目前我国锅炉烟气脱硝技术有新发现,科学家对O3氧化烟气脱硝同时制硝酸进行了实验研究,其生产硝酸的机理如下:
回答下列问题:
(1)NO3分子内存在两个过氧键,且氧均满足8电子稳定结构,请写出NO3中N的化合价______;NO3极不稳定,常温下即可爆炸分解,试从电子成键角度解释NO3不稳定的原因:__________________。
(2)N2O5与O3作用也能生成NO3与氧气,根据反应前后同种元素,价态相同,不参与氧化还原反应的原则,请分析反应N2O5+O3=2NO3+O2中,N2O5的作用是________(填“氧化剂”“还原剂”或“既是氧化剂,又是还原剂”)。
(3)请写出在有水存在时,O3与NO以物质的量之比为3∶2完全反应的总化学方程式___________。
重要的含氮
化工原料
专题7 氮与社会可持续发展
学习目标
01
1.认识氨气和硝酸的性质和用途
2.知道工业上生产硝酸的基本原理,了解硝酸的特性和应用。
重点难点
02
1.理解喷泉实验和氨水显咸性的原因
3.能从不同视角认识含氮化合物之间转化的条件和方式
2.掌握硝酸的重要性质和应用
氨气
03
物理性质:
颜色 气味 密度 溶解性 沸点
无色
刺激性气味
比空气小
极易溶于水
低
用途:
作制冷剂:氨分子间容易形成氢键,这使得氨气容易被液化,在常压下冷却至-33.5 ℃或在常温下加压至 700~800 kPa,氨气就液化成无色液体,同时放出大 量的热。液态氨汽化时要吸收大量的热,使周围的温度急剧下降,所以液态氨在工业上常用来作制冷剂。
氨气
03
化学性质:
(1).氨气与水的反应(喷泉实验):
实验现象 主要结论
烧杯中的溶液由玻璃管进入烧瓶,形成喷泉,瓶内液体呈红色。
氨极易溶于水;其水溶液呈碱性。
思考:氨气喷泉形成的原因是什么?
氨气
03
2.该喷泉实验成功的关键是什么?
延伸:
1.二氧化碳和氢氧化钠能否形成喷泉?为什么?
氢氧化钠会和二氧化碳反应,二氧化碳消耗后,烧瓶内的压力减少。造成水沿著玻璃管上升,如喷泉般喷出於烧瓶中。
(1)装置气密性良好;
(2)圆底烧瓶要干燥;
(3)装置内气体的纯度要高;
(4)气体要充满烧瓶
氨气
03
(2)氨水:
①NH3+H2O
NH3 H2O
氨水:氨气溶于水得氨水
②氨水中含有的微粒:
③NH3 H2O是一元弱碱,能使无色酚酞溶液变红
④NH3 H2O不稳定易分解
氨气
03
(3)氨气使石蕊试纸变色
实验现象 主要结论
湿润的红色的石蕊试纸变蓝
氨水易挥发,氨气的水溶液呈碱性
思考:请同学们解释呈碱性的原因是什么?
氨气
03
实验现象 主要结论
烧杯中出现白烟
浓氨水、浓盐酸具有挥发性,NH3与HCl结合,有固体NH4Cl生成
(4)氨气与酸的反应
反应方程式:
(用于NH3与挥发性酸的互相检验)
2NH3 + H2SO4=(NH4)2SO4
与硫酸的反应:
氨气
03
(4)氨气与氧气的反应:
4NH3(g) + 5O2(g)=4NO(g) + 6H2O(l) ΔH= -904 kJ·mol-1
NH3是氮的最低价(-3价)化合物,在一定条件下与氧化剂作用时,氨中的N可以失去电子,化合价升高,表现出还原性,作还原剂。在通常情况下,氨与氧气不易反应,但在加热和催化剂(如铂丝或Cr2O3)存在条件下,氨与氧气反应生成一氧化氮和水,并放出热。这一反应叫作氨的催化氧化,是工业制备硝酸的重要反应之一。
在纯氧中燃烧:
氨气
03
思考:
1.氨水作氮肥,有较低的成本,可不可以直接使用到农作物上?
2.液氨和氨水有什么区别?
氨气
03
“氨的催化氧化,是工业制备硝酸的重要反应之一”,工业上由氨气制取硝酸有哪些反应步骤?写出反应过程的化学方程式。
N2
NH3
NO
NO2
HNO3
①
③
②
④
①:
②:
③:
④:
硝酸
04
硝酸的物理性质
①
②
③
④
无色、易挥发、具有刺激性气味的液体;
能与水以任意比互 溶;
沸点为83 ℃,密度为1.42 g·cm-3
常用浓硝酸的质量分数为69%;质量分数为98%以上的硝酸为 “发烟硝酸”
硝酸
04
硝酸的化学性质
(1)硝酸不稳定,在常温下受热或见光会发生分解,生成红棕色的二氧化氮气体:
1.实验室应该如何保存硝酸?
2. 为什么久置的硝酸会略显黄色?
硝酸
04
硝酸的化学性质
实验 实验现象 化学方程式
铜与浓硝酸的反应
铜与浓硝酸的反应 3Cu + 8HNO3(稀)=3Cu(NO3)2 + 2NO↑ + 4H2O
溶液中有气泡产生;试管中充满红棕色气体;烧杯中收集到无色气体。
溶液中有气泡产生;试管烧杯中收集到无色气体。
Cu + 4HNO3(浓)=Cu(NO3)2 + 2NO2↑ + 2H2O
1.硝酸与金属的反应:
硝酸
04
硝酸的化学性质
2.硝酸与非金属的反应:
浓硝酸在加热的条件下,还能与木炭等非金属单质发生氧化还原反应:
C + 4HNO3(浓)= CO2↑ + 4NO2↑ + 2H2O
硝酸——用途
04
硝酸是一种重要的化工原料,常用来制造氮肥、燃料、塑料、炸药、硝酸盐等。
硝酸——归纳总结
04
a.除金、铂等少数金属外和几乎所有金属反应;
b. 与任何金属反应均不生成H2,说明呈现氧化性的不是H+而是HNO3;
c. 与金属反应既体现氧化性,又体现酸性;
d.常温下,浓硝酸能使铝、铁表面形成致密的氧化膜而钝化,所以可以用铝质或铁质容器盛放浓硝酸(与浓硫酸相似);
d. Cu等不活泼金属与浓硝酸反应得NO2,与稀硝酸反应得NO;Mg、Zn等较活泼金属与硝酸反应根据HNO3的浓度不同可得到NO、
N2O、N2、NH4NO3等不同产物。
硝酸——小结
03
请同学们完成下列反应的方程式:
N2
NH3
NO
NO2
HNO3
①
②
③
④
⑤
⑥
⑦
⑧
硝酸——
03
一氧化氮与二氧化氮
物理性质
一氧化氮 二氧化氮
颜色 无色 红棕色
气体 无味 刺激性气味
溶解性 不溶于水 溶于水且与水反应
密度 比空气密度大 比空气大
硝酸——
03
一氧化氮与二氧化氮
一氧化氮 二氧化氮
制备原理
化学性质
收集方法 排水法收集 向上排空气法
检验方法 在试管中接触空气后变红棕色 呈红棕色
制备比较
Cu + 4HNO3(浓)=Cu(NO3)2 + 2NO2↑ + 2H2O
04
练习
1.下列对NO和NO2的描述正确的是( )
A.NO2与水的反应中, NO2既是氧化剂又是还原剂
B. NO2是无色气体,可用向上排空气法收集
C. NO2可由和NO2直接化合得到
D.实验室制取NO2 ,可以通过金属铜与浓硝酸反应制得
A
04
练习
2.下列事实不能说明浓硝酸氧化性比稀硝酸强的是( )
A.浓硝酸遇石蕊试液变红后褪色,稀硝酸遇石蕊试液只变红不褪色
B.浓硝酸能与NO反应生成NO2,而稀硝酸不能与NO反应
C.浓硝酸在加热条件下可与碳单质反应,而稀硝酸则不能
D.足量的铜还原1mol浓硝酸和1mol稀硝酸转移电子数分别为NA和3NA
D
04
练习
3.在下列变化中,能表明硝酸具有氧化性的是( )
A.能使石蕊溶液变红色 B.能跟Ag反应生成
C.能和碳酸钙反应 D.能和CuO反应生成
4.不能使用铁质容器储运的是( )
A.浓盐酸 B.液氯 C.浓硝酸 D.浓硫酸
B
A
04
练习
18.(15分)Ⅰ.目前我国锅炉烟气脱硝技术有新发现,科学家对O3氧化烟气脱硝同时制硝酸进行了实验研究,其生产硝酸的机理如下:
回答下列问题:
(1)NO3分子内存在两个过氧键,且氧均满足8电子稳定结构,请写出NO3中N的化合价______;NO3极不稳定,常温下即可爆炸分解,试从电子成键角度解释NO3不稳定的原因:__________________。
(2)N2O5与O3作用也能生成NO3与氧气,根据反应前后同种元素,价态相同,不参与氧化还原反应的原则,请分析反应N2O5+O3=2NO3+O2中,N2O5的作用是________(填“氧化剂”“还原剂”或“既是氧化剂,又是还原剂”)。
(3)请写出在有水存在时,O3与NO以物质的量之比为3∶2完全反应的总化学方程式___________。
