第12章盐同步练习题---2021-2022学年九年级化学京改版(2013)下册(word 含答案)
文档属性
| 名称 | 第12章盐同步练习题---2021-2022学年九年级化学京改版(2013)下册(word 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 143.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-25 14:20:47 | ||
图片预览



文档简介
第12章盐同步练习题2021-2022学年九年级化学京改版(2013)下册
一、单选题
1.氢氧化钙俗称
A.烧碱 B.纯碱 C.熟石灰 D.石灰石
2.某农用物资商店里的化肥有Ca3(PO4)2、K2SO4、CO(NH2)2,其中缺少的肥料品种是
A.氮肥 B.磷肥
C.钾肥 D.复合肥
3.下列各组物质的溶液中,不另加试剂则无法鉴别出来的是
A.H2SO4 NaOH CuSO4
B.HCl NaOH NaCl
C.H2SO4 Ca(OH)2 FeCl3
D.HCl Ca(OH)2 Na2CO3
4.下列有关NaCl的叙述,错误的是
A.不溶于水 B.溶液呈中性
C.是食盐的主要成分 D.可用于配制生理盐水
5.民族英雄于谦的《石灰吟》:“千锤万凿出深山,烈火焚烧若等闲。粉身碎骨浑不怕,要留清白在人间”。请你找出符合诗句中物质变化顺序的选项
A.CaCO3→Ca(OH)2→CaO→CaCO3 B.CaCO3→CaO→Ca(OH)2→CaCO3
C.CaO→Ca(OH)2→CaCl2→CaCO3 D.Ca(OH)2→CaCO3→CaO→Ca(OH)2
6.合理使用化肥,有利于农作物的生长和减少环境污染。下列有关化肥的说法不正确的是
A.为保证高产尽量多施用化肥
B.不能将氯化铵与碱性物质混合施用
C.KNO3是一种常用的复合肥料
D.提倡将农家肥与化肥综合使用
7.利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液的主要流程如下:(反应条件已略去)
已知:
下列说法正确的是
A.步骤II中分离操作必须用到的玻璃仪器是烧杯和漏斗
B.溶液A中溶质是H2SO4、CuSO4
C.上述流程中物质B是锌,物质D是盐酸
D.A~E中都含有铜、锌两种元素的物质有A和C
8.氯化铵(NH4Cl)是“侯氏制碱法”的一种副产品。已知氯化铵的水溶液显酸性,下列关于氯化铵的说法正确的是
A.氯化铵属于酸 B.氯化铵是一种复合肥
C.氯化铵与熟石灰混合使用可提高肥效 D.氯化铵溶液与硝酸银溶液混合会产生白色沉淀
9.河道两旁有甲、乙两厂,它们排放的工业废水中共含有H+、Na+、Ba2+、Cl-、SO、CO六种离子。两厂废水中各含三种离子,其中甲厂的废水明显呈酸性,甲厂废水中的离子是( )
A.H+、Na+、Ba2+
B.H+、Ba2+、Cl-
C.Na+、SO、CO
D.H+、SO、CO
10.下列溶液分别能跟硫酸铜、盐酸、碳酸钠溶液反应,并产生不同现象的是( )
A.Ca(OH)2 B.AgNO3 C.H2SO4 D.NaOH
11.如图所示,滴管中吸入某种液体,平底烧瓶中盛有另一种物质,挤压滴管滴入液体,一段时间后气球明显鼓起。下列选项符合题意的是
选项 滴管内物质 平底烧瓶内物质
A 稀盐酸 锌粒
B 水 氧化钙
C 氢氧化钠溶液 二氧化碳气体
D 碳酸钠溶液 稀硫酸
A.A B.B
C.C D.D
12.下列实验方案不能达到实验目的的是
实验目的 实验方案
A 验证铝、铜、银三种金属的活动性顺序 将洁净的铜丝分别浸入硫酸铝溶液和硝酸银溶液中
B 用一种试剂一次性鉴别出稀硫酸、澄清石灰水和碳酸钠溶液 分别取样,滴加紫色石蕊试液
C 除去炭粉中混有的少量氧化铜 加入足量的稀硫酸,过滤、洗涤、干燥
D 检验露置的氢氧化钠是否变质 取样,加水溶解,滴加氯化钡溶液
A.A B.B C.C D.D
二、简答题
13.碘化钾(KI)是白色固体,保存不当会被氧化为碘单质(I2)而泛黄变质。取适量碘化钾固体暴露于空气中一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,将产生的气体通入澄清石灰水中,澄清石灰水变浑浊。
(1)澄清石灰水变浑浊的化学方程式是_____。
(2)碘化钾变质的化学方程式是_____。
14.化学与我们的生产、生活密切相关,请你用所学习的化学知识回答下列问题。
(1)水是生命之源,水与我们的生产﹑生活等都有密切的关系。
①净化水的操作有:A.过滤B.蒸馏C.静置沉淀等多种,其中净化程度最高的操作是___(填选项字母)。净水器中经常使用活性炭,主要利用活性炭的_____。
②在日常生活中,木柴﹑纸箱等可燃物着火常用洒水灭火,其原理主要是______
(2)我国是一个农业大家,农作物秸秆属于农业生态系统中一种十分宝贵的资源。
①将秸秆还田,可作为农家肥料,但某植物在生长过程中还需要施用复合肥。下列属于复合肥的是___(填选项字母)。
A KNO3
B CO(NH2)2
C NH4H2PO4
D NH4NO3
②以秸秆为原料可生产出可降解塑料餐盒;该塑料属于____(选填“合成有机高分子”、“天然有机高分子”、“合金”)材料。
③在农村,秸秆曾经作为家庭燃料广泛使用,但秸秆不完全燃烧会产生__气体与血液中的血红蛋白结合引起中毒。为了使秸秆能够充分燃烧,火更旺,人们常说“火要虚”, 其原理是___的接触面积。
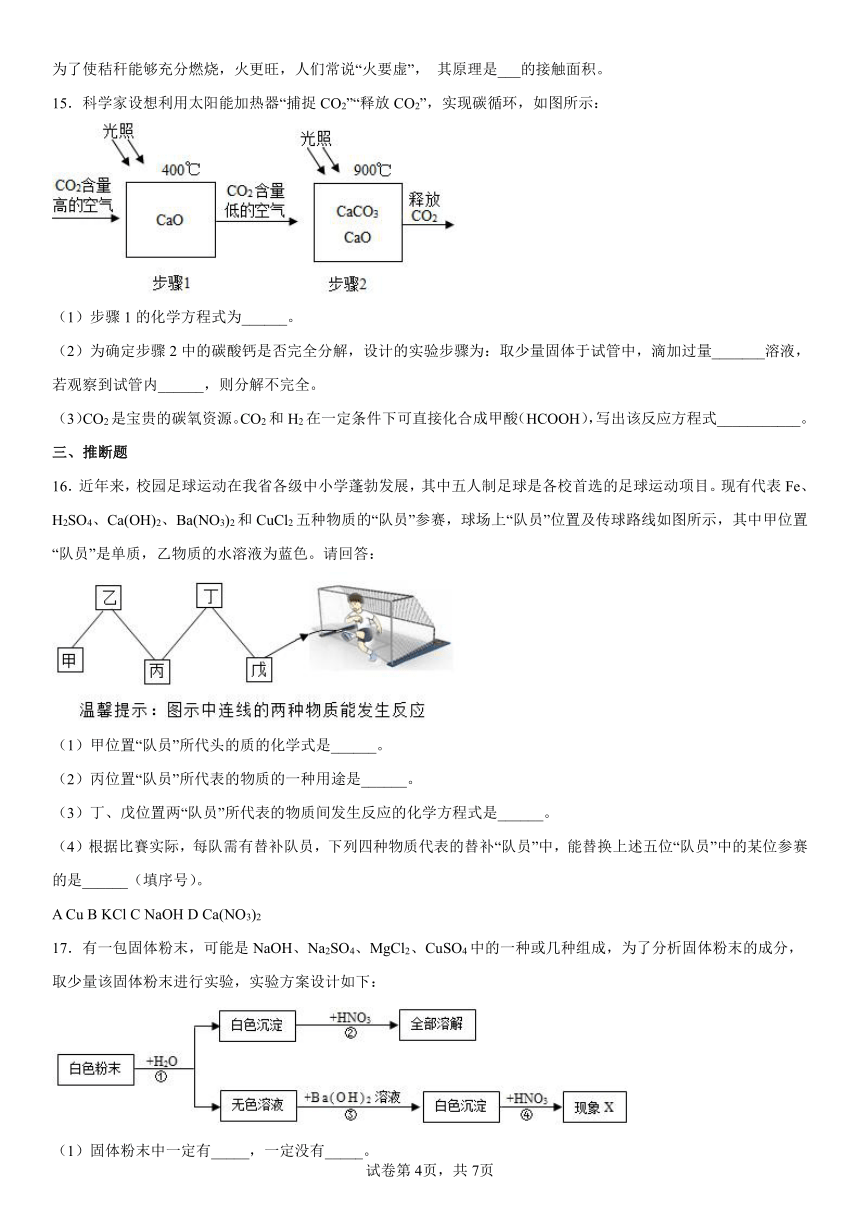
15.科学家设想利用太阳能加热器“捕捉CO2”“释放CO2”,实现碳循环,如图所示:
(1)步骤1的化学方程式为______。
(2)为确定步骤2中的碳酸钙是否完全分解,设计的实验步骤为:取少量固体于试管中,滴加过量_______溶液,若观察到试管内______,则分解不完全。
(3)CO2是宝贵的碳氧资源。CO2和H2在一定条件下可直接化合成甲酸(HCOOH),写出该反应方程式___________。
三、推断题
16.近年来,校园足球运动在我省各级中小学蓬勃发展,其中五人制足球是各校首选的足球运动项目。现有代表Fe、H2SO4、Ca(OH)2、Ba(NO3)2和CuCl2五种物质的“队员”参赛,球场上“队员”位置及传球路线如图所示,其中甲位置“队员”是单质,乙物质的水溶液为蓝色。请回答:
(1)甲位置“队员”所代头的质的化学式是______。
(2)丙位置“队员”所代表的物质的一种用途是______。
(3)丁、戊位置两“队员”所代表的物质间发生反应的化学方程式是______。
(4)根据比賽实际,每队需有替补队员,下列四种物质代表的替补“队员”中,能替换上述五位“队员”中的某位参赛的是______(填序号)。
A Cu B KCl C NaOH D Ca(NO3)2
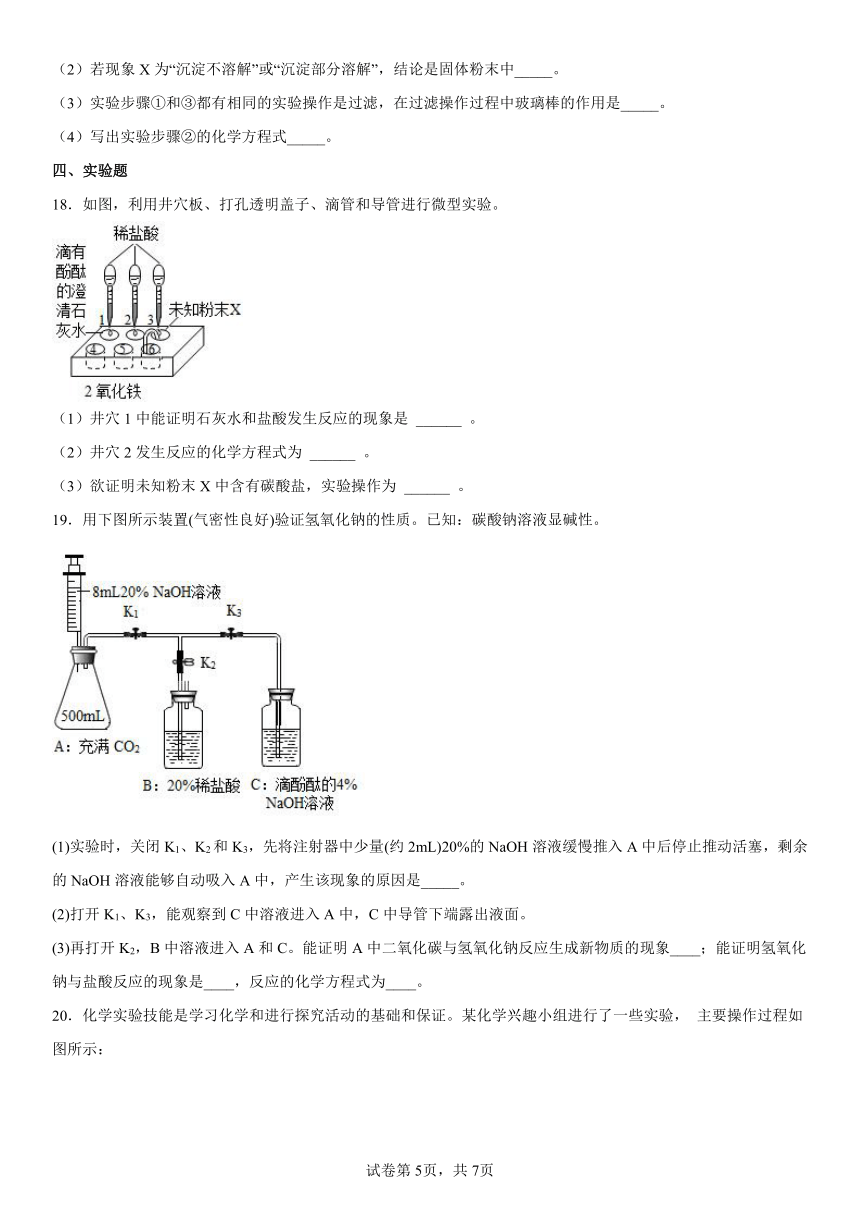
17.有一包固体粉末,可能是NaOH、Na2SO4、MgCl2、CuSO4中的一种或几种组成,为了分析固体粉末的成分,取少量该固体粉末进行实验,实验方案设计如下:
(1)固体粉末中一定有_____,一定没有_____。
(2)若现象X为“沉淀不溶解”或“沉淀部分溶解”,结论是固体粉末中_____。
(3)实验步骤①和③都有相同的实验操作是过滤,在过滤操作过程中玻璃棒的作用是_____。
(4)写出实验步骤②的化学方程式_____。
四、实验题
18.如图,利用井穴板、打孔透明盖子、滴管和导管进行微型实验。
(1)井穴1中能证明石灰水和盐酸发生反应的现象是 ______ 。
(2)井穴2发生反应的化学方程式为 ______ 。
(3)欲证明未知粉末X中含有碳酸盐,实验操作为 ______ 。
19.用下图所示装置(气密性良好)验证氢氧化钠的性质。已知:碳酸钠溶液显碱性。
(1)实验时,关闭K1、K2和K3,先将注射器中少量(约2mL)20%的NaOH溶液缓慢推入A中后停止推动活塞,剩余的NaOH溶液能够自动吸入A中,产生该现象的原因是_____。
(2)打开K1、K3,能观察到C中溶液进入A中,C中导管下端露出液面。
(3)再打开K2,B中溶液进入A和C。能证明A中二氧化碳与氢氧化钠反应生成新物质的现象____;能证明氢氧化钠与盐酸反应的现象是____,反应的化学方程式为____。
20.化学实验技能是学习化学和进行探究活动的基础和保证。某化学兴趣小组进行了一些实验, 主要操作过程如图所示:
请回答下列问题:
(1)实验甲中烧杯内的现象是__________ ;实验所需的硫酸铜溶液,在配制前应先将硫 酸铜晶体放于_______________内将其研碎;
(2)实验乙中的一处明显错误是 __________ ;
(3)实验丙中使用到了玻璃棒。下列实验中也必须使用玻璃棒,且作用类似的是___________(填写字母序号);
A蒸发食盐水 B硫在氧气中燃烧 C溶解食盐
五、计算题
21.纯碱(主要成分为碳酸钠)中常含有少量氯化钠。化学兴趣小组的同学为了测定实验室中某盐酸的溶质质量分数,称取了某品牌纯碱样品12g进行了以下实验:将样品置于烧杯中,取50g此稀盐酸分五次加入其中,测得的有关数据如下表所示。
第一次 第二次 第三次 第四次 第五次
加入稀盐酸质量/ 10 10 10 10 10
烧杯中剩余物的质量/ 20.9 29.8 47.6 57.6
试计算:
(1)表中a的值为______。
(2)实验中产生二氧化碳的总质量为______。
(3)所用稀盐酸中溶质的质量分数。(写出计算过程,计算结果保留一位小数)
22.某化学小组为了探究一瓶久置在空气中的氢氧化钠样品(不含有水分)的变质程度,进行了如下实验:取该氢氧化钠样品13.3 g于烧杯中,加水完全溶解,然后向烧杯中逐渐加入一定溶质质量分数的氯化钡溶液,反应过程中对加入氯化钡溶液的质量与烧杯中产生沉淀的质量进行了记录,部分数据见下表:
加入氯化钡溶液的质量/g 20 40 80 100
生成沉淀的质量/g 1.97 3.94 5.91 5.91
试分析计算:
(1)13.3g氢氧化钠样品中碳酸钠的质量_______;
(2)该氯化钡溶液的质量分数___________。
23.为测定某CuSO4溶液中溶质的质量分数,取150gCuSO4溶液,平均分为三份,每一份样品均按如图所示进行实验,实验数据见下表。请计算:
实验1 实验2 实验3
样品质量/g 50 50 50
NaOH溶液质量/g 20 40 60
m/g 44.9 49.8 49.8
(1)50gCuSO4溶液完全反应时,所得沉淀的质量为______________g。
(2)CuSO4溶液中溶质的质量分数。
24.在100 g的某盐酸中加入硝酸银溶液,反应为AgNO3+HCl=HNO3+AgCl↓,至恰好完全反应,经过滤、洗涤、干燥、称量得到质量为28.7 g的AgCl沉淀,求盐酸的溶质质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.B
4.A
5.B
6.A
7.D
8.D
9.B
10.A
11.C
12.B
13. Ca(OH)2+ CO2 =CaCO3↓ + H2O 4KI+2CO2+O2=2K2CO3+2I2
14. B 吸附性 将温度降低到可燃物的着火点以下 AC 合成有机高分子 CO(或一氧化碳) 增大秸秆与空气
15. CO2+CaO CaCO3 盐酸 有气泡产生 CO2+H2HCOOH
16. Fe 改良酸性土壤等 C
17. NaOH和MgCl2 CuSO4 一定有Na2SO4 引流,防止液体溅出
18. 红色溶液变成无色 6HCl+Fe2O3=2FeCl3 +3H2O 在孔穴6中加入澄清石灰水,将稀盐酸挤入孔穴3
19. CO2与NaOH溶液反应而消耗,使A中压强低于外界大气压,NaOH溶液被压入 A中有气泡产生 C中红色溶液褪为无色 NaOH+HCl=NaCl+H2O
20. 有蓝色沉淀产生 研钵 没有使用玻璃棒引流 A
21.(1)38.7;(2)4.4g
(3)根据反应生成二氧化碳的质量,可求出稀盐酸中溶质的质量,根据溶质质量分数的计算公式计算稀盐酸中溶质的质量分数。
设参加反应的HCl的总质量为x。
x=7.3g
稀盐酸中溶质的质量分数为(其他解法合理即可)
答:所用稀盐酸中溶质的质量分数为。
22.(1)3.18 g(2)7.8%
23.(1)9.8g (2)32%
24.7.3%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.氢氧化钙俗称
A.烧碱 B.纯碱 C.熟石灰 D.石灰石
2.某农用物资商店里的化肥有Ca3(PO4)2、K2SO4、CO(NH2)2,其中缺少的肥料品种是
A.氮肥 B.磷肥
C.钾肥 D.复合肥
3.下列各组物质的溶液中,不另加试剂则无法鉴别出来的是
A.H2SO4 NaOH CuSO4
B.HCl NaOH NaCl
C.H2SO4 Ca(OH)2 FeCl3
D.HCl Ca(OH)2 Na2CO3
4.下列有关NaCl的叙述,错误的是
A.不溶于水 B.溶液呈中性
C.是食盐的主要成分 D.可用于配制生理盐水
5.民族英雄于谦的《石灰吟》:“千锤万凿出深山,烈火焚烧若等闲。粉身碎骨浑不怕,要留清白在人间”。请你找出符合诗句中物质变化顺序的选项
A.CaCO3→Ca(OH)2→CaO→CaCO3 B.CaCO3→CaO→Ca(OH)2→CaCO3
C.CaO→Ca(OH)2→CaCl2→CaCO3 D.Ca(OH)2→CaCO3→CaO→Ca(OH)2
6.合理使用化肥,有利于农作物的生长和减少环境污染。下列有关化肥的说法不正确的是
A.为保证高产尽量多施用化肥
B.不能将氯化铵与碱性物质混合施用
C.KNO3是一种常用的复合肥料
D.提倡将农家肥与化肥综合使用
7.利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液的主要流程如下:(反应条件已略去)
已知:
下列说法正确的是
A.步骤II中分离操作必须用到的玻璃仪器是烧杯和漏斗
B.溶液A中溶质是H2SO4、CuSO4
C.上述流程中物质B是锌,物质D是盐酸
D.A~E中都含有铜、锌两种元素的物质有A和C
8.氯化铵(NH4Cl)是“侯氏制碱法”的一种副产品。已知氯化铵的水溶液显酸性,下列关于氯化铵的说法正确的是
A.氯化铵属于酸 B.氯化铵是一种复合肥
C.氯化铵与熟石灰混合使用可提高肥效 D.氯化铵溶液与硝酸银溶液混合会产生白色沉淀
9.河道两旁有甲、乙两厂,它们排放的工业废水中共含有H+、Na+、Ba2+、Cl-、SO、CO六种离子。两厂废水中各含三种离子,其中甲厂的废水明显呈酸性,甲厂废水中的离子是( )
A.H+、Na+、Ba2+
B.H+、Ba2+、Cl-
C.Na+、SO、CO
D.H+、SO、CO
10.下列溶液分别能跟硫酸铜、盐酸、碳酸钠溶液反应,并产生不同现象的是( )
A.Ca(OH)2 B.AgNO3 C.H2SO4 D.NaOH
11.如图所示,滴管中吸入某种液体,平底烧瓶中盛有另一种物质,挤压滴管滴入液体,一段时间后气球明显鼓起。下列选项符合题意的是
选项 滴管内物质 平底烧瓶内物质
A 稀盐酸 锌粒
B 水 氧化钙
C 氢氧化钠溶液 二氧化碳气体
D 碳酸钠溶液 稀硫酸
A.A B.B
C.C D.D
12.下列实验方案不能达到实验目的的是
实验目的 实验方案
A 验证铝、铜、银三种金属的活动性顺序 将洁净的铜丝分别浸入硫酸铝溶液和硝酸银溶液中
B 用一种试剂一次性鉴别出稀硫酸、澄清石灰水和碳酸钠溶液 分别取样,滴加紫色石蕊试液
C 除去炭粉中混有的少量氧化铜 加入足量的稀硫酸,过滤、洗涤、干燥
D 检验露置的氢氧化钠是否变质 取样,加水溶解,滴加氯化钡溶液
A.A B.B C.C D.D
二、简答题
13.碘化钾(KI)是白色固体,保存不当会被氧化为碘单质(I2)而泛黄变质。取适量碘化钾固体暴露于空气中一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,将产生的气体通入澄清石灰水中,澄清石灰水变浑浊。
(1)澄清石灰水变浑浊的化学方程式是_____。
(2)碘化钾变质的化学方程式是_____。
14.化学与我们的生产、生活密切相关,请你用所学习的化学知识回答下列问题。
(1)水是生命之源,水与我们的生产﹑生活等都有密切的关系。
①净化水的操作有:A.过滤B.蒸馏C.静置沉淀等多种,其中净化程度最高的操作是___(填选项字母)。净水器中经常使用活性炭,主要利用活性炭的_____。
②在日常生活中,木柴﹑纸箱等可燃物着火常用洒水灭火,其原理主要是______
(2)我国是一个农业大家,农作物秸秆属于农业生态系统中一种十分宝贵的资源。
①将秸秆还田,可作为农家肥料,但某植物在生长过程中还需要施用复合肥。下列属于复合肥的是___(填选项字母)。
A KNO3
B CO(NH2)2
C NH4H2PO4
D NH4NO3
②以秸秆为原料可生产出可降解塑料餐盒;该塑料属于____(选填“合成有机高分子”、“天然有机高分子”、“合金”)材料。
③在农村,秸秆曾经作为家庭燃料广泛使用,但秸秆不完全燃烧会产生__气体与血液中的血红蛋白结合引起中毒。为了使秸秆能够充分燃烧,火更旺,人们常说“火要虚”, 其原理是___的接触面积。
15.科学家设想利用太阳能加热器“捕捉CO2”“释放CO2”,实现碳循环,如图所示:
(1)步骤1的化学方程式为______。
(2)为确定步骤2中的碳酸钙是否完全分解,设计的实验步骤为:取少量固体于试管中,滴加过量_______溶液,若观察到试管内______,则分解不完全。
(3)CO2是宝贵的碳氧资源。CO2和H2在一定条件下可直接化合成甲酸(HCOOH),写出该反应方程式___________。
三、推断题
16.近年来,校园足球运动在我省各级中小学蓬勃发展,其中五人制足球是各校首选的足球运动项目。现有代表Fe、H2SO4、Ca(OH)2、Ba(NO3)2和CuCl2五种物质的“队员”参赛,球场上“队员”位置及传球路线如图所示,其中甲位置“队员”是单质,乙物质的水溶液为蓝色。请回答:
(1)甲位置“队员”所代头的质的化学式是______。
(2)丙位置“队员”所代表的物质的一种用途是______。
(3)丁、戊位置两“队员”所代表的物质间发生反应的化学方程式是______。
(4)根据比賽实际,每队需有替补队员,下列四种物质代表的替补“队员”中,能替换上述五位“队员”中的某位参赛的是______(填序号)。
A Cu B KCl C NaOH D Ca(NO3)2
17.有一包固体粉末,可能是NaOH、Na2SO4、MgCl2、CuSO4中的一种或几种组成,为了分析固体粉末的成分,取少量该固体粉末进行实验,实验方案设计如下:
(1)固体粉末中一定有_____,一定没有_____。
(2)若现象X为“沉淀不溶解”或“沉淀部分溶解”,结论是固体粉末中_____。
(3)实验步骤①和③都有相同的实验操作是过滤,在过滤操作过程中玻璃棒的作用是_____。
(4)写出实验步骤②的化学方程式_____。
四、实验题
18.如图,利用井穴板、打孔透明盖子、滴管和导管进行微型实验。
(1)井穴1中能证明石灰水和盐酸发生反应的现象是 ______ 。
(2)井穴2发生反应的化学方程式为 ______ 。
(3)欲证明未知粉末X中含有碳酸盐,实验操作为 ______ 。
19.用下图所示装置(气密性良好)验证氢氧化钠的性质。已知:碳酸钠溶液显碱性。
(1)实验时,关闭K1、K2和K3,先将注射器中少量(约2mL)20%的NaOH溶液缓慢推入A中后停止推动活塞,剩余的NaOH溶液能够自动吸入A中,产生该现象的原因是_____。
(2)打开K1、K3,能观察到C中溶液进入A中,C中导管下端露出液面。
(3)再打开K2,B中溶液进入A和C。能证明A中二氧化碳与氢氧化钠反应生成新物质的现象____;能证明氢氧化钠与盐酸反应的现象是____,反应的化学方程式为____。
20.化学实验技能是学习化学和进行探究活动的基础和保证。某化学兴趣小组进行了一些实验, 主要操作过程如图所示:
请回答下列问题:
(1)实验甲中烧杯内的现象是__________ ;实验所需的硫酸铜溶液,在配制前应先将硫 酸铜晶体放于_______________内将其研碎;
(2)实验乙中的一处明显错误是 __________ ;
(3)实验丙中使用到了玻璃棒。下列实验中也必须使用玻璃棒,且作用类似的是___________(填写字母序号);
A蒸发食盐水 B硫在氧气中燃烧 C溶解食盐
五、计算题
21.纯碱(主要成分为碳酸钠)中常含有少量氯化钠。化学兴趣小组的同学为了测定实验室中某盐酸的溶质质量分数,称取了某品牌纯碱样品12g进行了以下实验:将样品置于烧杯中,取50g此稀盐酸分五次加入其中,测得的有关数据如下表所示。
第一次 第二次 第三次 第四次 第五次
加入稀盐酸质量/ 10 10 10 10 10
烧杯中剩余物的质量/ 20.9 29.8 47.6 57.6
试计算:
(1)表中a的值为______。
(2)实验中产生二氧化碳的总质量为______。
(3)所用稀盐酸中溶质的质量分数。(写出计算过程,计算结果保留一位小数)
22.某化学小组为了探究一瓶久置在空气中的氢氧化钠样品(不含有水分)的变质程度,进行了如下实验:取该氢氧化钠样品13.3 g于烧杯中,加水完全溶解,然后向烧杯中逐渐加入一定溶质质量分数的氯化钡溶液,反应过程中对加入氯化钡溶液的质量与烧杯中产生沉淀的质量进行了记录,部分数据见下表:
加入氯化钡溶液的质量/g 20 40 80 100
生成沉淀的质量/g 1.97 3.94 5.91 5.91
试分析计算:
(1)13.3g氢氧化钠样品中碳酸钠的质量_______;
(2)该氯化钡溶液的质量分数___________。
23.为测定某CuSO4溶液中溶质的质量分数,取150gCuSO4溶液,平均分为三份,每一份样品均按如图所示进行实验,实验数据见下表。请计算:
实验1 实验2 实验3
样品质量/g 50 50 50
NaOH溶液质量/g 20 40 60
m/g 44.9 49.8 49.8
(1)50gCuSO4溶液完全反应时,所得沉淀的质量为______________g。
(2)CuSO4溶液中溶质的质量分数。
24.在100 g的某盐酸中加入硝酸银溶液,反应为AgNO3+HCl=HNO3+AgCl↓,至恰好完全反应,经过滤、洗涤、干燥、称量得到质量为28.7 g的AgCl沉淀,求盐酸的溶质质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.B
4.A
5.B
6.A
7.D
8.D
9.B
10.A
11.C
12.B
13. Ca(OH)2+ CO2 =CaCO3↓ + H2O 4KI+2CO2+O2=2K2CO3+2I2
14. B 吸附性 将温度降低到可燃物的着火点以下 AC 合成有机高分子 CO(或一氧化碳) 增大秸秆与空气
15. CO2+CaO CaCO3 盐酸 有气泡产生 CO2+H2HCOOH
16. Fe 改良酸性土壤等 C
17. NaOH和MgCl2 CuSO4 一定有Na2SO4 引流,防止液体溅出
18. 红色溶液变成无色 6HCl+Fe2O3=2FeCl3 +3H2O 在孔穴6中加入澄清石灰水,将稀盐酸挤入孔穴3
19. CO2与NaOH溶液反应而消耗,使A中压强低于外界大气压,NaOH溶液被压入 A中有气泡产生 C中红色溶液褪为无色 NaOH+HCl=NaCl+H2O
20. 有蓝色沉淀产生 研钵 没有使用玻璃棒引流 A
21.(1)38.7;(2)4.4g
(3)根据反应生成二氧化碳的质量,可求出稀盐酸中溶质的质量,根据溶质质量分数的计算公式计算稀盐酸中溶质的质量分数。
设参加反应的HCl的总质量为x。
x=7.3g
稀盐酸中溶质的质量分数为(其他解法合理即可)
答:所用稀盐酸中溶质的质量分数为。
22.(1)3.18 g(2)7.8%
23.(1)9.8g (2)32%
24.7.3%
答案第1页,共2页
答案第1页,共2页
