第八章常见的酸碱盐综合测试-2021-2022学年九年级化学科粤版(2012)下册(word版 含答案)
文档属性
| 名称 | 第八章常见的酸碱盐综合测试-2021-2022学年九年级化学科粤版(2012)下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 216.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-25 16:15:18 | ||
图片预览


文档简介
第八章《常见的酸碱盐》综合测试
一、单选题
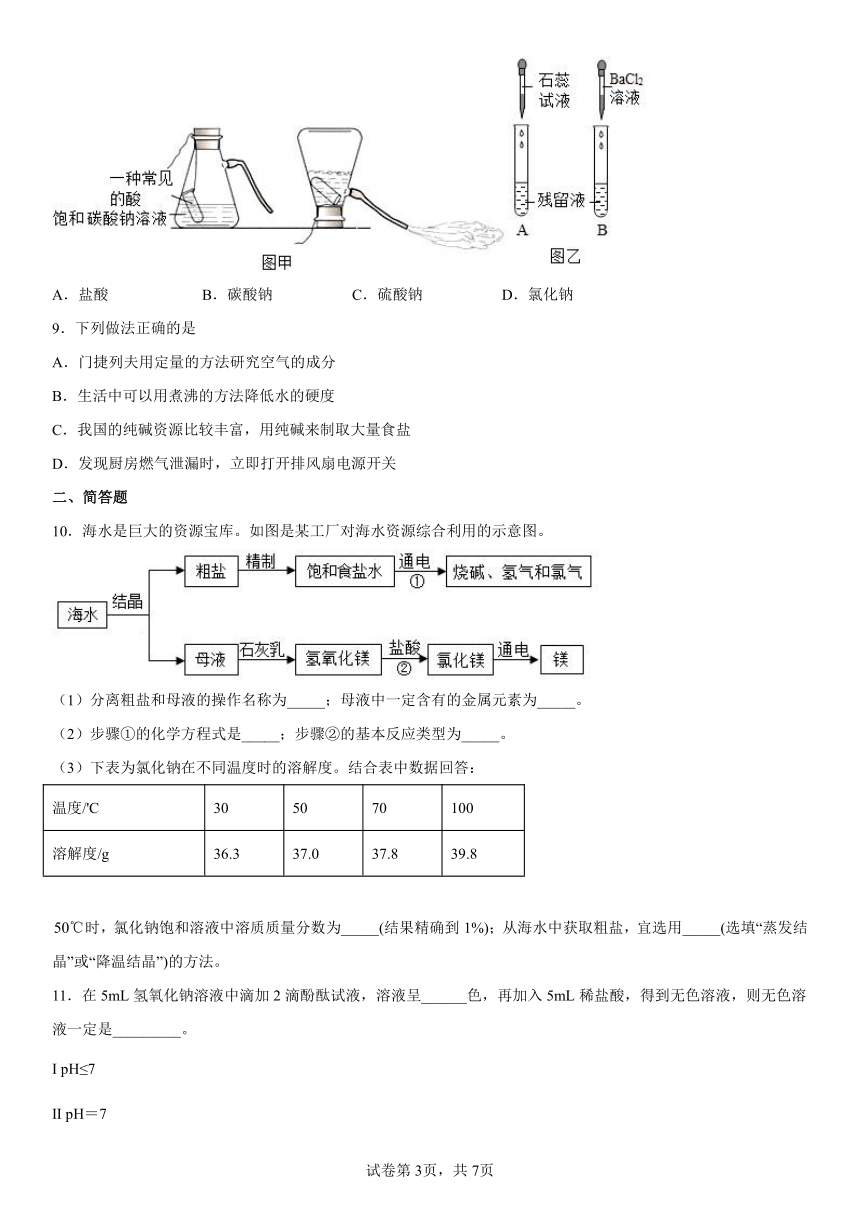
1.下图所示实验操作正确的是( )
A. 点燃酒精灯 B.滴加液体
C. 稀释浓硫酸 D. 读出液体的体积
2.下列生活中常见的物质,呈碱性的是
物质名称
pH 8-9 6-7 3-4 2-3
选项 A B C D
A.A B.B C.C D.D
3.化肥对提高农作物的产量有重要作用。下列有关化肥的说法不正确的是
A.提倡农家肥与化肥综合使用
B.草木灰是一种农家肥,其主要成分中含有钾元素
C.磷肥的主要作用是促进植物茎、叶生长茂盛,叶色浓绿
D.常用作氮肥的化合物有尿素、碳酸氢铵等
4.下列化学方程式中符合题意且书写正确的是
A.正常雨水偏弱酸性原因:SO3+H2O=H2SO4
B.生活中用天然气作燃料:C2H5OH+3O22CO2+3H2O
C.用小苏打治疗胃酸过多症:NaHCO3+HCl=NaCl+CO2↑+H2O
D.工业上用熟石灰制烧碱:Ca(OH)2+2NaNO3=Ca(NO3)2+2NaOH
5.盐酸、稀硫酸在水溶液中都能产生H+,故有许多共同的性质。下列有关叙述正确的是
A.打开盛有浓盐酸和浓硫酸的试剂瓶瓶塞,在瓶口都有白雾
B.稀盐酸和稀硫酸都可用于除铁锈
C.浓盐酸、浓硫酸都可用来干燥氧气
D.在稀盐酸、稀硫酸中滴加氢氧化钡溶液,都有白色沉淀
6.如图所示,U型管内a、b液面相平,当挤压滴管的胶头,使试剂X进入锥形瓶内,一段时间后会观察到a液面高于b液面。则试剂X、Y的组合可能是
A.水、硝酸铵
B.水、烧碱
C.稀硫酸、铁粉
D.稀盐酸、小苏打
7.如图是室温下稀硫酸和氢氧化钠反应过程中的pH变化曲线。下列有关说法正确的是( )
A.图中X是氢氧化钠
B.图中a点的阴离子是OH-
C.向图中c点所示溶液中加入铁粉后,溶液中有气泡产生
D.稀硫酸与氢氧化钠溶液反应的化学方程式为:H2SO4+2NaOH═Na2SO4+H2O
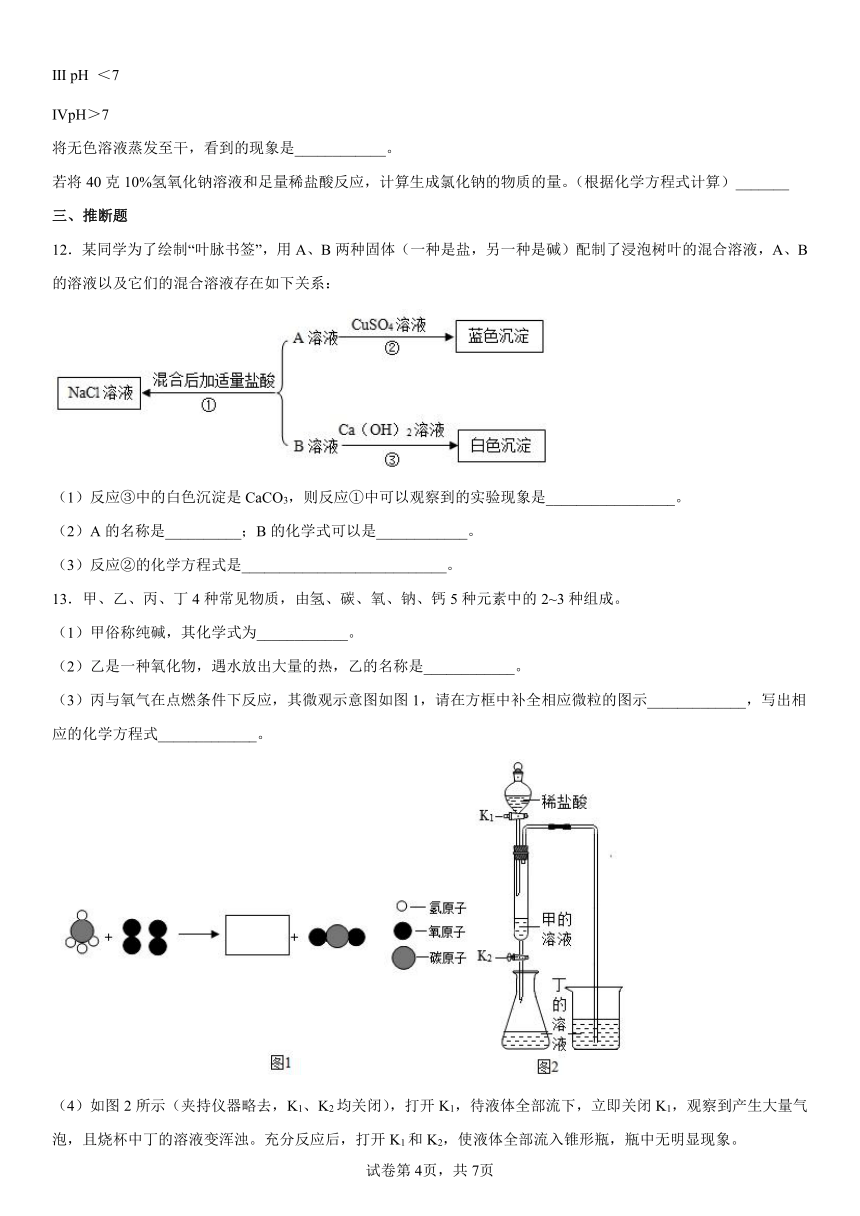
8.利用饱和碳酸钠溶液与酸反应,小科同学制作了如图甲所示的简易酸碱灭火器装置,并进行操作。操作结束后,对瓶中残留液进行如图乙所示的实验。实验现象:A试管溶液变红色,B试管中有白色沉淀生成。则残留液中含有的溶质有
A.盐酸 B.碳酸钠 C.硫酸钠 D.氯化钠
9.下列做法正确的是
A.门捷列夫用定量的方法研究空气的成分
B.生活中可以用煮沸的方法降低水的硬度
C.我国的纯碱资源比较丰富,用纯碱来制取大量食盐
D.发现厨房燃气泄漏时,立即打开排风扇电源开关
二、简答题
10.海水是巨大的资源宝库。如图是某工厂对海水资源综合利用的示意图。
(1)分离粗盐和母液的操作名称为_____;母液中一定含有的金属元素为_____。
(2)步骤①的化学方程式是_____;步骤②的基本反应类型为_____。
(3)下表为氯化钠在不同温度时的溶解度。结合表中数据回答:
温度/'C 30 50 70 100
溶解度/g 36.3 37.0 37.8 39.8
时,氯化钠饱和溶液中溶质质量分数为_____(结果精确到1%);从海水中获取粗盐,宜选用_____(选填“蒸发结晶”或“降温结晶”)的方法。
11.在5mL氢氧化钠溶液中滴加2滴酚酞试液,溶液呈______色,再加入5mL稀盐酸,得到无色溶液,则无色溶液一定是_________。
Ⅰ pH≤7
Ⅱ pH=7
Ⅲ pH <7
ⅣpH>7
将无色溶液蒸发至干,看到的现象是____________。
若将40克10%氢氧化钠溶液和足量稀盐酸反应,计算生成氯化钠的物质的量。(根据化学方程式计算)_______
三、推断题
12.某同学为了绘制“叶脉书签”,用A、B两种固体(一种是盐,另一种是碱)配制了浸泡树叶的混合溶液,A、B的溶液以及它们的混合溶液存在如下关系:
(1)反应③中的白色沉淀是CaCO3,则反应①中可以观察到的实验现象是_________________。
(2)A的名称是__________;B的化学式可以是____________。
(3)反应②的化学方程式是___________________________。
13.甲、乙、丙、丁4种常见物质,由氢、碳、氧、钠、钙5种元素中的2~3种组成。
(1)甲俗称纯碱,其化学式为____________。
(2)乙是一种氧化物,遇水放出大量的热,乙的名称是____________。
(3)丙与氧气在点燃条件下反应,其微观示意图如图1,请在方框中补全相应微粒的图示_____________,写出相应的化学方程式_____________。
(4)如图2所示(夹持仪器略去,K1、K2均关闭),打开K1,待液体全部流下,立即关闭K1,观察到产生大量气泡,且烧杯中丁的溶液变浑浊。充分反应后,打开K1和K2,使液体全部流入锥形瓶,瓶中无明显现象。
①用化学方程式表示烧杯中溶液变浑浊的原因____________。
②取反应后锥形瓶中的溶液,测得pH=3,则该溶液中含有的溶质除HCl外,还有____________。
四、实验题
14.做化学实验要正确使用仪器和规范操作.
(1)小王同学从实验室拿来了下列实验仪器.用仪器A称量物质质量时,应将砝码放在 _____ (填“a”或“b”)盘.用完仪器B后,必须用 _____ 盖灭.要完成过滤操作,除选用上述部分仪器外,还需要用到的玻璃仪器是 _____ .
(2)小华同学按图E配制实验所用的稀硫酸.请你指出他操作的错误:
错误① _____ ;错误② _____ .
15.以下是小方设计的证明分子运动的实验:
小方观察到的现象是________.
产生现象的原因是什么?________.
他可以得到的结论是________.
该实验有什么不足?________.
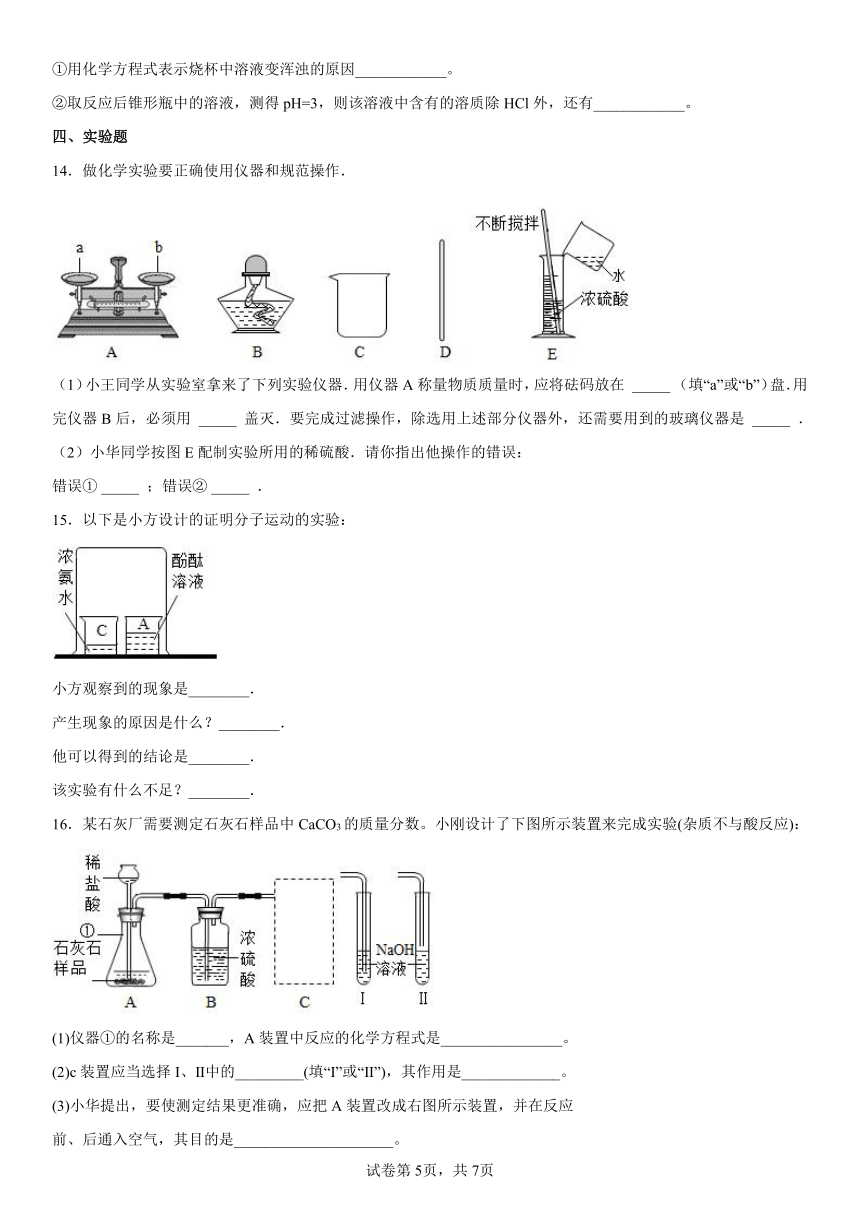
16.某石灰厂需要测定石灰石样品中CaCO3的质量分数。小刚设计了下图所示装置来完成实验(杂质不与酸反应):
(1)仪器①的名称是_______,A装置中反应的化学方程式是________________。
(2)c装置应当选择I、Ⅱ中的_________(填“I”或“Ⅱ”),其作用是_____________。
(3)小华提出,要使测定结果更准确,应把A装置改成右图所示装置,并在反应
前、后通入空气,其目的是_____________________。
五、计算题
17.正常情况下人的胃液pH为0.8~1.5,相应含HCl的溶质质量分数为0.2%~0.4%,胃液中HCl过多与过少都不利于人体健康。某人出现反胃、吐酸水的症状,经检查其胃液中HCl的质量分数为1.49%(胃液密度约为1g/cm3)。
(1)正常情况下,人的胃液显_____性。
(2)人的胃液总量为100mL,正常人胃液中HCl的质量范围是_____g。
(3)服用碱性药品可以治疗胃液中HCl含量过多,你认为该患者_____(填“能”或“不能”)服用氢氧化钠来治疗胃液中过多,理由是_____。
(4)医生给患者开的药品为胃舒平[有效成分是Al(OH)3],每片胃舒平平含Al(OH)3的质量为0.39g。请根据化学方程式计算该患者至少服用多少片的胃舒平,胃液才能恢复正常?(请写出计算过程)_______________
18.某兴趣小组对市售的某钾肥进行了检测,称取2.0g样品放入烧杯中,加入适量的水溶解后,逐滴加入BaCl2溶液,产生沉淀的质量与所加入BaCl2溶液质量的关系如图1所示(假定杂质不参加反应)。通过计算,判断该钾肥中K2SO4的质量分数是否符合图2的包装说明。(写出计算过程)
19.施肥是农业增产的重要手段,CO(NH2)2、(NH4)2HPO4是常用的化学肥料。
回答下列问题:
(1)(NH4)2HPO4中N和H原子的个数比为______ 。
(2)CO(NH2)2的相对分子质量______ 。
(3)经农科所技术人员检测,某农户的农作物缺磷和氮。若需补充磷3.1kg和氮7.0kg,则至少需要施用_________ kg(NH4)2HPO4和__________kg CO(NH2)2。
20.在农业生产中,常用15%~20%的氯化钠溶液选种。为了测定某氯化钠溶液是否符合要求,取该溶液70g,加入一定溶质质量分数的AgNO3溶液100g,恰好完全反应。过滤分离出沉淀的质量为28.7g。
(1)反应后所得溶液的质量为 g。
(2)通过计算确定该氯化钠溶液是否符合选种要求?(计算结果精确到0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.A
3.C
4.C
5.B
6.A
7.C
8.C
9.B
10. 过滤 钠和镁 ↑↑ 复分解反应 27% 蒸发结晶
11. 红 Ⅰ 白色固体 0.1mol
12.(1)有气泡产生(2)氢氧化钠 Na2CO3(3)
13. Na2CO3 氧化钙 NaCl,CaCl2
14. b 灯帽 漏斗 将水倒入浓硫酸中 在量筒中配制溶液
15. A烧杯中酚酞溶液变红 浓氨水具有挥发性,挥发出的氨气分子运动到A烧杯中,溶于水形成氨水,显碱性,酚酞试液遇碱性物质变红 分子在不断运动 没有设置对照实验
16. 锥形瓶 CaCO3+2HCl═CaCl2+H2O+CO2↑ Ⅰ 充分吸收二氧化碳 排除空气中二氧化碳的干扰,使生成的二氧化碳能被充分吸收
17.(1)酸(2)0.2~0.4(3)不能;氢氧化钠有很强的腐蚀性(4)2片
18.符合
19.(1)2:9(2)60(3)13.2;9
20.(1)141.3g
(2)设该氯化钠溶液中NaCl的质量为x
x=11.7g
溶液中NaCl的质量分数:
15%<16.7%<20%,符合要求;
答:该氯化钠溶液符合选种要求。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下图所示实验操作正确的是( )
A. 点燃酒精灯 B.滴加液体
C. 稀释浓硫酸 D. 读出液体的体积
2.下列生活中常见的物质,呈碱性的是
物质名称
pH 8-9 6-7 3-4 2-3
选项 A B C D
A.A B.B C.C D.D
3.化肥对提高农作物的产量有重要作用。下列有关化肥的说法不正确的是
A.提倡农家肥与化肥综合使用
B.草木灰是一种农家肥,其主要成分中含有钾元素
C.磷肥的主要作用是促进植物茎、叶生长茂盛,叶色浓绿
D.常用作氮肥的化合物有尿素、碳酸氢铵等
4.下列化学方程式中符合题意且书写正确的是
A.正常雨水偏弱酸性原因:SO3+H2O=H2SO4
B.生活中用天然气作燃料:C2H5OH+3O22CO2+3H2O
C.用小苏打治疗胃酸过多症:NaHCO3+HCl=NaCl+CO2↑+H2O
D.工业上用熟石灰制烧碱:Ca(OH)2+2NaNO3=Ca(NO3)2+2NaOH
5.盐酸、稀硫酸在水溶液中都能产生H+,故有许多共同的性质。下列有关叙述正确的是
A.打开盛有浓盐酸和浓硫酸的试剂瓶瓶塞,在瓶口都有白雾
B.稀盐酸和稀硫酸都可用于除铁锈
C.浓盐酸、浓硫酸都可用来干燥氧气
D.在稀盐酸、稀硫酸中滴加氢氧化钡溶液,都有白色沉淀
6.如图所示,U型管内a、b液面相平,当挤压滴管的胶头,使试剂X进入锥形瓶内,一段时间后会观察到a液面高于b液面。则试剂X、Y的组合可能是
A.水、硝酸铵
B.水、烧碱
C.稀硫酸、铁粉
D.稀盐酸、小苏打
7.如图是室温下稀硫酸和氢氧化钠反应过程中的pH变化曲线。下列有关说法正确的是( )
A.图中X是氢氧化钠
B.图中a点的阴离子是OH-
C.向图中c点所示溶液中加入铁粉后,溶液中有气泡产生
D.稀硫酸与氢氧化钠溶液反应的化学方程式为:H2SO4+2NaOH═Na2SO4+H2O
8.利用饱和碳酸钠溶液与酸反应,小科同学制作了如图甲所示的简易酸碱灭火器装置,并进行操作。操作结束后,对瓶中残留液进行如图乙所示的实验。实验现象:A试管溶液变红色,B试管中有白色沉淀生成。则残留液中含有的溶质有
A.盐酸 B.碳酸钠 C.硫酸钠 D.氯化钠
9.下列做法正确的是
A.门捷列夫用定量的方法研究空气的成分
B.生活中可以用煮沸的方法降低水的硬度
C.我国的纯碱资源比较丰富,用纯碱来制取大量食盐
D.发现厨房燃气泄漏时,立即打开排风扇电源开关
二、简答题
10.海水是巨大的资源宝库。如图是某工厂对海水资源综合利用的示意图。
(1)分离粗盐和母液的操作名称为_____;母液中一定含有的金属元素为_____。
(2)步骤①的化学方程式是_____;步骤②的基本反应类型为_____。
(3)下表为氯化钠在不同温度时的溶解度。结合表中数据回答:
温度/'C 30 50 70 100
溶解度/g 36.3 37.0 37.8 39.8
时,氯化钠饱和溶液中溶质质量分数为_____(结果精确到1%);从海水中获取粗盐,宜选用_____(选填“蒸发结晶”或“降温结晶”)的方法。
11.在5mL氢氧化钠溶液中滴加2滴酚酞试液,溶液呈______色,再加入5mL稀盐酸,得到无色溶液,则无色溶液一定是_________。
Ⅰ pH≤7
Ⅱ pH=7
Ⅲ pH <7
ⅣpH>7
将无色溶液蒸发至干,看到的现象是____________。
若将40克10%氢氧化钠溶液和足量稀盐酸反应,计算生成氯化钠的物质的量。(根据化学方程式计算)_______
三、推断题
12.某同学为了绘制“叶脉书签”,用A、B两种固体(一种是盐,另一种是碱)配制了浸泡树叶的混合溶液,A、B的溶液以及它们的混合溶液存在如下关系:
(1)反应③中的白色沉淀是CaCO3,则反应①中可以观察到的实验现象是_________________。
(2)A的名称是__________;B的化学式可以是____________。
(3)反应②的化学方程式是___________________________。
13.甲、乙、丙、丁4种常见物质,由氢、碳、氧、钠、钙5种元素中的2~3种组成。
(1)甲俗称纯碱,其化学式为____________。
(2)乙是一种氧化物,遇水放出大量的热,乙的名称是____________。
(3)丙与氧气在点燃条件下反应,其微观示意图如图1,请在方框中补全相应微粒的图示_____________,写出相应的化学方程式_____________。
(4)如图2所示(夹持仪器略去,K1、K2均关闭),打开K1,待液体全部流下,立即关闭K1,观察到产生大量气泡,且烧杯中丁的溶液变浑浊。充分反应后,打开K1和K2,使液体全部流入锥形瓶,瓶中无明显现象。
①用化学方程式表示烧杯中溶液变浑浊的原因____________。
②取反应后锥形瓶中的溶液,测得pH=3,则该溶液中含有的溶质除HCl外,还有____________。
四、实验题
14.做化学实验要正确使用仪器和规范操作.
(1)小王同学从实验室拿来了下列实验仪器.用仪器A称量物质质量时,应将砝码放在 _____ (填“a”或“b”)盘.用完仪器B后,必须用 _____ 盖灭.要完成过滤操作,除选用上述部分仪器外,还需要用到的玻璃仪器是 _____ .
(2)小华同学按图E配制实验所用的稀硫酸.请你指出他操作的错误:
错误① _____ ;错误② _____ .
15.以下是小方设计的证明分子运动的实验:
小方观察到的现象是________.
产生现象的原因是什么?________.
他可以得到的结论是________.
该实验有什么不足?________.
16.某石灰厂需要测定石灰石样品中CaCO3的质量分数。小刚设计了下图所示装置来完成实验(杂质不与酸反应):
(1)仪器①的名称是_______,A装置中反应的化学方程式是________________。
(2)c装置应当选择I、Ⅱ中的_________(填“I”或“Ⅱ”),其作用是_____________。
(3)小华提出,要使测定结果更准确,应把A装置改成右图所示装置,并在反应
前、后通入空气,其目的是_____________________。
五、计算题
17.正常情况下人的胃液pH为0.8~1.5,相应含HCl的溶质质量分数为0.2%~0.4%,胃液中HCl过多与过少都不利于人体健康。某人出现反胃、吐酸水的症状,经检查其胃液中HCl的质量分数为1.49%(胃液密度约为1g/cm3)。
(1)正常情况下,人的胃液显_____性。
(2)人的胃液总量为100mL,正常人胃液中HCl的质量范围是_____g。
(3)服用碱性药品可以治疗胃液中HCl含量过多,你认为该患者_____(填“能”或“不能”)服用氢氧化钠来治疗胃液中过多,理由是_____。
(4)医生给患者开的药品为胃舒平[有效成分是Al(OH)3],每片胃舒平平含Al(OH)3的质量为0.39g。请根据化学方程式计算该患者至少服用多少片的胃舒平,胃液才能恢复正常?(请写出计算过程)_______________
18.某兴趣小组对市售的某钾肥进行了检测,称取2.0g样品放入烧杯中,加入适量的水溶解后,逐滴加入BaCl2溶液,产生沉淀的质量与所加入BaCl2溶液质量的关系如图1所示(假定杂质不参加反应)。通过计算,判断该钾肥中K2SO4的质量分数是否符合图2的包装说明。(写出计算过程)
19.施肥是农业增产的重要手段,CO(NH2)2、(NH4)2HPO4是常用的化学肥料。
回答下列问题:
(1)(NH4)2HPO4中N和H原子的个数比为______ 。
(2)CO(NH2)2的相对分子质量______ 。
(3)经农科所技术人员检测,某农户的农作物缺磷和氮。若需补充磷3.1kg和氮7.0kg,则至少需要施用_________ kg(NH4)2HPO4和__________kg CO(NH2)2。
20.在农业生产中,常用15%~20%的氯化钠溶液选种。为了测定某氯化钠溶液是否符合要求,取该溶液70g,加入一定溶质质量分数的AgNO3溶液100g,恰好完全反应。过滤分离出沉淀的质量为28.7g。
(1)反应后所得溶液的质量为 g。
(2)通过计算确定该氯化钠溶液是否符合选种要求?(计算结果精确到0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.A
3.C
4.C
5.B
6.A
7.C
8.C
9.B
10. 过滤 钠和镁 ↑↑ 复分解反应 27% 蒸发结晶
11. 红 Ⅰ 白色固体 0.1mol
12.(1)有气泡产生(2)氢氧化钠 Na2CO3(3)
13. Na2CO3 氧化钙 NaCl,CaCl2
14. b 灯帽 漏斗 将水倒入浓硫酸中 在量筒中配制溶液
15. A烧杯中酚酞溶液变红 浓氨水具有挥发性,挥发出的氨气分子运动到A烧杯中,溶于水形成氨水,显碱性,酚酞试液遇碱性物质变红 分子在不断运动 没有设置对照实验
16. 锥形瓶 CaCO3+2HCl═CaCl2+H2O+CO2↑ Ⅰ 充分吸收二氧化碳 排除空气中二氧化碳的干扰,使生成的二氧化碳能被充分吸收
17.(1)酸(2)0.2~0.4(3)不能;氢氧化钠有很强的腐蚀性(4)2片
18.符合
19.(1)2:9(2)60(3)13.2;9
20.(1)141.3g
(2)设该氯化钠溶液中NaCl的质量为x
x=11.7g
溶液中NaCl的质量分数:
15%<16.7%<20%,符合要求;
答:该氯化钠溶液符合选种要求。
答案第1页,共2页
答案第1页,共2页
