科粤版九年级化学下册6.2金属的化学性质同步练习(word版有答案)
文档属性
| 名称 | 科粤版九年级化学下册6.2金属的化学性质同步练习(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 240.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-25 16:46:28 | ||
图片预览



文档简介
科粤版九年级化学下册 6.2 金属的化学性质 同步练习
一、单选题
1.下列图示实验中能明显观察到发生化学变化的是
A. B.
C. D.
2.下图所示反应,有关说法的错误的是
A.铝丝需要砂纸打磨
B.溶液由蓝色变为无色
C.金属活动性强弱:Al>Cu
D.反应的化学方程式为:Al+CuSO4=Cu+AlSO4
3.某化学兴趣小组为验证Ag、Fe、Cu三种金属的活动性顺序,设计了如下图所示的实验操作.其中可以达到实验目的的组合是
A.①③ B.②④ C.④⑤ D.②③
4.大气中二氧化碳等气体含量升高,会导致温室效应,如图是将二氧化碳转化为化工原料乙烯(化学式为C2H4)的微观示意图,下列说法正确的是
A.从反应类型看:该反应属于置换反应
B.从微观构成看:四种物质均由原子构成
C.从反应价值看:该反应能获取清洁能源,延缓温室效应
D.从物质的量看:该反应中CO2与C2H4的质量比为22:7
5.下列所示的四个图像,能正确反映对应变化关系的是( )
A.电解水
B.向两份完全相同的稀盐酸中分别加入足量的锌粉和铁粉
C.加热一定质量的氯酸钾和二氧化锰的混合物
D.相同温度下,用两份等质量、等浓度的过氧化氢溶液制氧气,其中一份加入少量MnO2
6.两个烧杯中装有等质量的金属锌和镁,然后分别逐渐加入同浓度的稀硫酸,产生氢气的质量与加入硫酸的质量关系如图所示。下列说法正确的是
A.该图反映出镁比锌的金属活动性强
B.a点时,两个烧杯中的酸都恰好完全反应
C.b点时,两个烧杯中产生氢气的质量相等
D.c点时,两个烧杯中都有金属剩余
7.下列金属中,金属活动性最强的是( )
A.铁 B.镁 C.锌 D.铜
8.某同学为了测定铜镁合金样品中铜的质量分数,将100g稀盐酸分2次加入到盛有5g该样品的烧杯中,所得数据如下表,则下列说法中错误的是
次数 实验前 第1次 第2次
加入稀盐酸的质量/g 0 50 50
剩余固体的质量/g 5 3 2
A.第1次加入稀盐酸后剩余固体中还有镁
B.第2次所加入的稀盐酸未反应完
C.每50g稀盐酸和1g镁恰好完全反应
D.合金样品中铜的质量分数为40%
9.下列关于金属材料的说法中正确的是( )
A.铝制品表面应常用钢刷擦洗
B.可用铁桶盛装农药波尔多液
C.焊锡(锡铅合金)的熔点低,常用来焊接金属
D.钢因为比生铁的含碳量高,所以应用范围更广
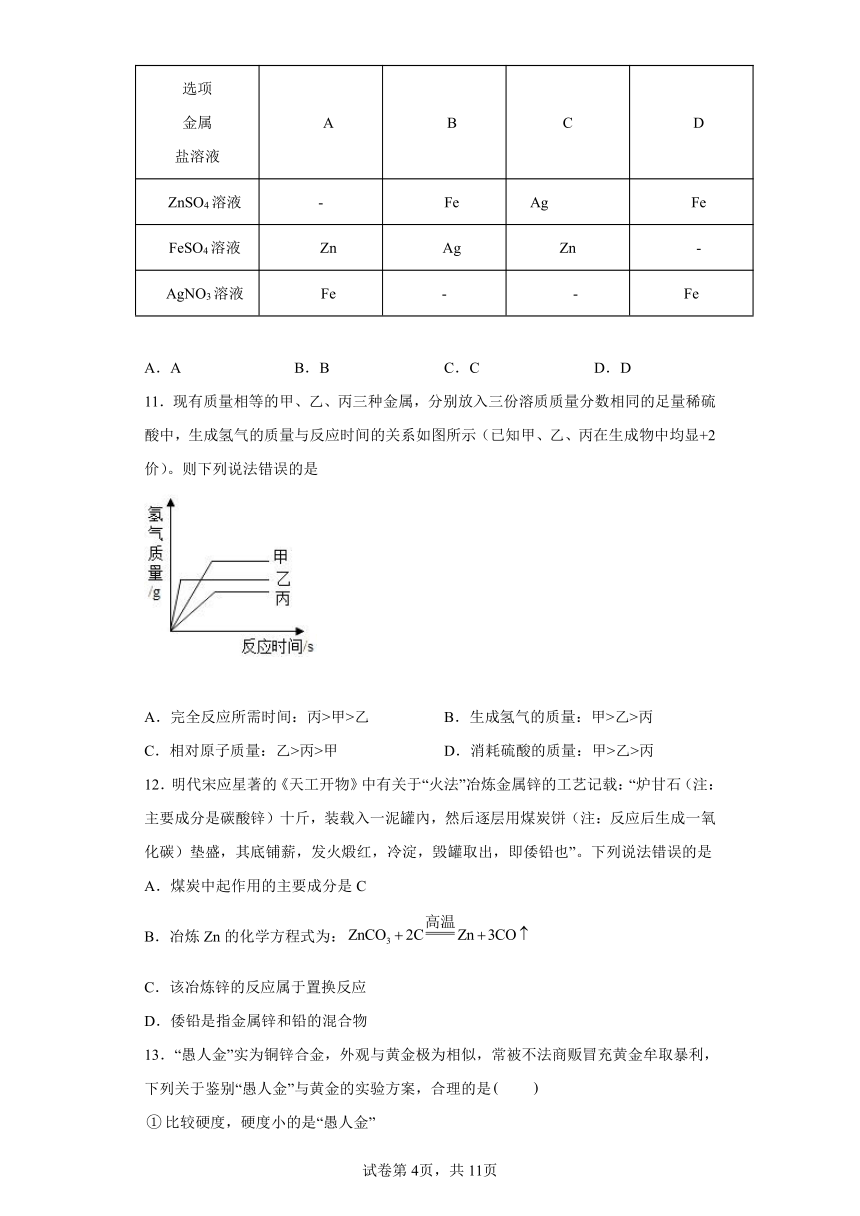
10.下列验证Zn、Fe、Ag三种金属活动性顺序的实验方案中(“-”表示未进行金属与盐溶液之间的实验),不能达到实验目的是
选项 金属 盐溶液 A B C D
ZnSO4溶液 - Fe Ag Fe
FeSO4溶液 Zn Ag Zn -
AgNO3溶液 Fe - - Fe
A.A B.B C.C D.D
11.现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中均显+2价)。则下列说法错误的是
A.完全反应所需时间:丙>甲>乙 B.生成氢气的质量:甲>乙>丙
C.相对原子质量:乙>丙>甲 D.消耗硫酸的质量:甲>乙>丙
12.明代宋应星著的《天工开物》中有关于“火法”冶炼金属锌的工艺记载:“炉甘石(注:主要成分是碳酸锌)十斤,装载入一泥罐內,然后逐层用煤炭饼(注:反应后生成一氧化碳)垫盛,其底铺薪,发火煅红,冷淀,毁罐取出,即倭铅也”。下列说法错误的是
A.煤炭中起作用的主要成分是C
B.冶炼Zn的化学方程式为:
C.该冶炼锌的反应属于置换反应
D.倭铅是指金属锌和铅的混合物
13.“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理的是
比较硬度,硬度小的是“愚人金”
灼烧,表面变色的是“愚人金”
浸没在稀硫酸中,表面有气泡产生的是“愚人金”
浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
A. B. C. D.
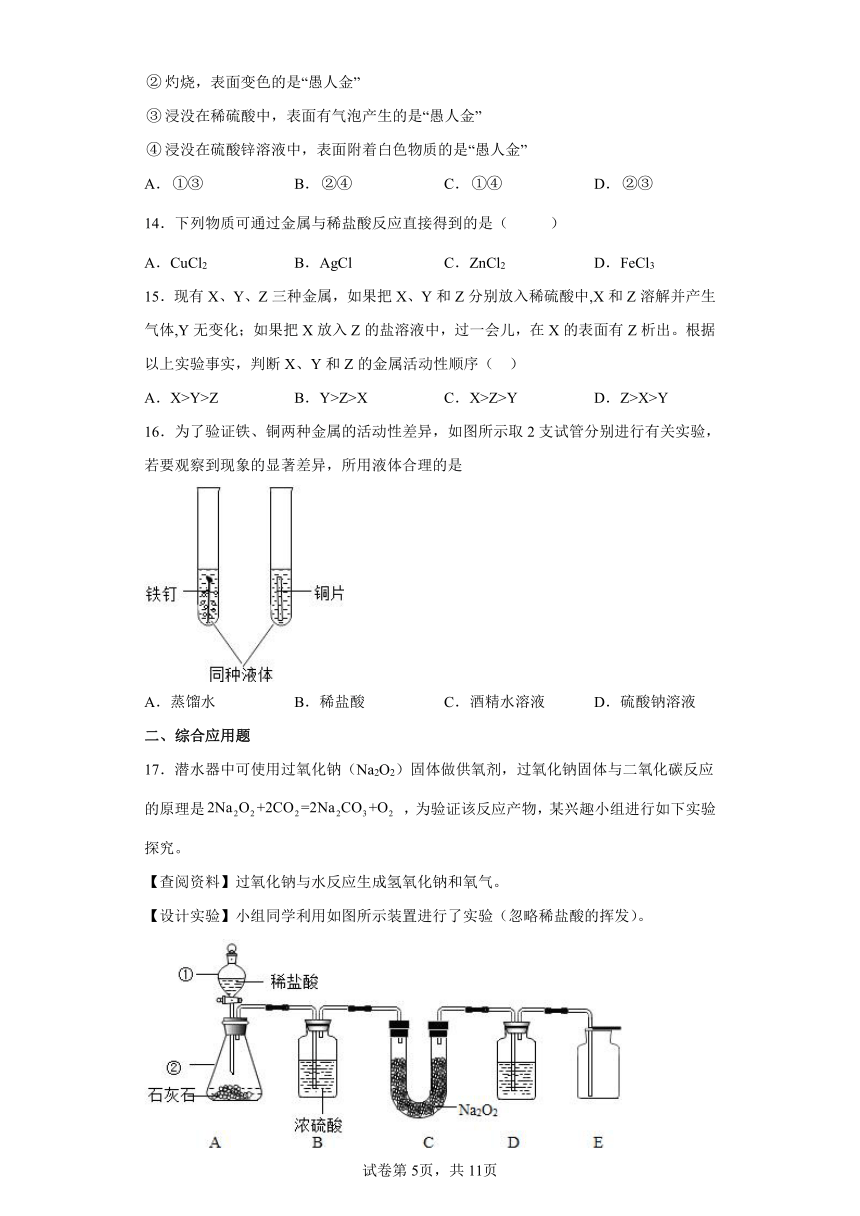
14.下列物质可通过金属与稀盐酸反应直接得到的是( )
A.CuCl2 B.AgCl C.ZnCl2 D.FeCl3
15.现有X、Y、Z三种金属,如果把X、Y和Z分别放入稀硫酸中,X和Z溶解并产生气体,Y无变化;如果把X放入Z的盐溶液中,过一会儿,在X的表面有Z析出。根据以上实验事实,判断X、Y和Z的金属活动性顺序( )
A.X>Y>Z B.Y>Z>X C.X>Z>Y D.Z>X>Y
16.为了验证铁、铜两种金属的活动性差异,如图所示取2支试管分别进行有关实验,若要观察到现象的显著差异,所用液体合理的是
A.蒸馏水 B.稀盐酸 C.酒精水溶液 D.硫酸钠溶液
二、综合应用题
17.潜水器中可使用过氧化钠(Na2O2)固体做供氧剂,过氧化钠固体与二氧化碳反应的原理是 ,为验证该反应产物,某兴趣小组进行如下实验探究。
【查阅资料】过氧化钠与水反应生成氢氧化钠和氧气。
【设计实验】小组同学利用如图所示装置进行了实验(忽略稀盐酸的挥发)。
(1)装置A中标号仪器名称:①______,②______。
(2)装置A中反应的化学方程式为______。
(3)装置B的作用是______。
(4)为防止装置E收集的氧气中混有二氧化碳,装置D中盛放的试剂是______,并写出装置D中反应的化学方程式______。
(5)实验室制取CO2验满的方法是______。
(6)有一份锌粉与铜粉的混合物样品,为确定其组成,某同学将32.5g样品加入100g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示。
试求:所用稀硫酸的溶质质量分数______(写出计算过程)。
18.金属与我们生活关系密切。
(1)铁
①下列物品所使用的主要材料属于合金的是 ____ (填标号,下同)。
A.青花瓷瓶 B.橡胶充气艇 C.不锈钢锅
②生铁和钢是常用的合金,生铁的含碳量比钢的含碳量__________(填“高”或“低”)。 生铁冶炼的主要原理是利用一氧化碳与氧化铁反应,反应的化学方程式为__________________________________。
③生活中常用铁锅做炊具,利用了铁的___________性。
④颗粒大小达到纳米级的单质铁具有很强的反应活性,俗称纳米铁.在高温环境下,用H2和FeCl2反应,可以生成纳米铁和一种易溶于水显强酸性的气体,写出该反应的化学方程式____________________________________。
⑤铁制品锈蚀的过程,实际上是铁与空气中的________和________ 等发生化学反应的过程;回收废钢铁的目的是_______________________ (写一点)。
(2)铜
①黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图所示),纯铜片上留下明显的划痕,说明合金的硬度比组成中的纯金属要 _________ (填“大”、“小”)。
②黄铜渣中约含 Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质。通过流程如下图的方法处理黄铜渣可得到硫酸锌(杂质不溶于水、不参与反应)。
资料:ZnO+H2SO4═ZnSO4+H2O; CuO+H2SO4═CuSO4+H2O
Ⅱ中生成金属单质的化学反应方程式为 _____________________________________ 。该流程最终得到的硫酸锌中锌元素质量 _____ (填“<”、“=”、“>”)黄铜中锌元素质量。
(3)铝
①铝块能制成铝箔是利用了铝的_________性。
②铝比铁活泼,但铝比铁耐腐蚀的原因是______________________________________。
③由铝粉与氧化铁组成的铝热剂在高温下反应,生成另一种氧化物和另一种金属单质,常用于焊接铁轨,试写出该反应的化学方程式:___________________。
(4)锌
锌等金属可以用于生产纽扣电池,下面是某常见纽扣电池中发生的反应:H2O+Zn+HgO=Zn(OH)2+Hg
①该反应后锌元素的化合价为___________。
②将该反应中的反应物进行简单分类,则下面横线上的物质是(填化学式):
纯净物:单质:_____________金属氧化物:_____________
③该电池中通常还加入石墨粉,是因为石墨具有良好的__________性。
④废旧电池不能随意丢弃,由于电池种类不同,应______________回收。
19.化学在生产、生活、交通等方面发挥重要作用。
(1)为了全民的健康,我国推广使用强化铁酱油,这里的“铁”指的是______。(填“单质”、“元素”或“原子”)
(2)许多家庭做饭用罐装的“煤气”作燃料,罐中所装的是液化石油气。
①它是石油化工的一种产品。石油属于______能源(填“可再生”或“不可再生”)。
②若厨房失火时,移走“煤气罐”,这是利用了______原理灭火(填序号)。
A.清除可燃物 B.使可燃物与氧气隔绝 C.降低可燃物的着火点
(3)压缩天然气(CNG)是我县正在推广的出租车燃料,它具有燃烧效率高、污染小的优点,写出天然气主要成分完全燃烧的化学方程式______。
(4)连云港市政府倡导居民骑自行车“低碳出行”,采用碳纤维材料制造的自行车轻便、机械强度大,这应用了碳纤维的______(填“物理”或“化学”)性质;自行车采用铝合金材料,用化学方程式解释金属铝具有较强抗腐蚀性的原因______。
(5)以黄铁矿为原料(主要成分是FeS2)为原料,生产硫酸的简要流程图如下:
①将黄铁矿粉碎,目的是______。
②流程中SO2转化为SO3的化学方程式为______。
③得到的炉渣(Fe2O3)在工业上可用来炼铁,用含Fe2O380%的炉渣200 t,理论上可炼出含有杂质3﹪的生铁______t(精确到0.1t)。
(6)小刚通过实验探究得知以下两组物质均能发生反应:
Ⅰ、铁和硫酸铜溶液 Ⅱ、铝和硫酸亚铁溶液
①Ⅰ中发生反应的化学方程式是______,反应类型为______反应。
②铁、铝、铜的金属活动性由强到弱的顺序是______。
③小刚继续探究某未知金属X与铁、铜的活动性强弱关系,设计了以下实验方案并对实验结果进行预测。下列实验方案及预测如果与事实相符,就可以判断出X、铁、铜金属活动性强弱顺序的有______(填序号)。
A.将X放入CuSO4溶液中能反应
B.将X放入CuSO4溶液中不能反应
C.将X放入FeSO4溶液中能反应
D.将X放入FeSO4溶液中不能反应
E.将X放入FeSO4溶液中不能反应,放入CuSO4溶液中能反应
20.“沉睡三千年,一醒惊天下”,三星堆出土的大量文物中,有青铜纵目面具、青铜神树……。
【查阅资料】I.古代青铜器中含有铜、锡、铅等元素。
II.测定碳14含量可估算古物的年代,计算公式: 年代
III.几种离子生成氢氧化物沉淀的 pH,如下表:
待沉淀的离子 Fe2+ Fe3+ Cu2+ Zn2+ Cd2+ Pb2+
开始沉淀时的pH 6.34 1.48 5.2 6.2 7.2 8.0
完全沉淀时的pH 9.7 3.2 6.4 8.0 9.5 8.8
探究一 青铜器的性质
(1)出土的青铜器保存较好,而更晚出土的铁器腐蚀严重,原因是_____________________。
(2)三星堆某文物测得的n=﹣0.42,则该文物距今约_________ 年。
探究二 模拟青铜降锌
三星堆出土的青铜器中锌的含量很低,而铜矿石中锌的含量较高,可用硫化钠(Na2S)或活性炭降低锌的含量,“降锌”效果如图1、图2所示。
(3)对比图1、图2,“降锌”效果更佳的是________(选填“Na2S”或“活性炭”)。
(4)兴趣小组设计实验方案模拟青铜“降锌”实验:取铁、锌、铜、铬(Cd)、铅(Pb)这几种金属氧化物的混合样品与稀硫酸(H2SO4)反应,得到含不同金属离子的混合溶液,测得pH=1,将该溶液按下列流程实验:
① 步骤Ⅰ中加H2O2的目的是___________________。
② 步骤Ⅱ中加ZnO的作用是将溶液的pH调至_________(填序号)之间。
a.1.48~3.0b.3.2~5.2c.5.2~9.7
③ 由步骤Ⅲ可判断金属活动性:Zn_______Cd(选填“大于”或“小于”)。
21.2017年4月,“航母”下水,开拓中国新蓝海。
(1)“航母”舰体材料为合金钢,国产航母使用的“超级钢”具有极佳的抗压性、延展性和焊接性。合金钢是__(填序号)
a合成材料 b复合材料 c无机材料
(2)“航母”升降机可由铝合金制造,用石墨作电极在高温条件下电解熔融氧化铝,在阴极和阳极区分别得到A1和O2,阳极区使用的石墨易消耗的原因是__。
(3)“航母”螺旋浆可由铜合金制造。铜合金比铜的硬度__(填“大”或“小”),铜比铁在海水中耐腐蚀的原因是__。
(4)由生铁炼钢时,硅(Si)与氧化亚铁在高温条件下反应生成二氧化硅和铁,该反应的化学方程式为__。
22.如图1是实验室制取气体的常用装置。
(1)仪器X的名称是_________________;加热氯化铵和熟石灰的固体混合物可制取氨气(NH3),氨气极易溶于水,则制取氨气应选用的一套装置为_________________(填字母代号)。
(2)若选择A、F组合一套装置制取某气体,请写出有关反应的化学方程式_________________;实验结束时应先撤去导管,后熄灭酒精灯,原因是_________________。
(3)实验室可选择E装置收集二氧化碳,验满的方法是_________________;B和C装置均可制取CO2,与B相比较,C的主要优点是什么?______
(4)若用图2装置采用排水法收集H2,请将方框内的导管补画完整。____
(5)6.5g锌与100g稀硫酸恰好完全反应,求稀硫酸中溶质的质量分数。____
试卷第1页,共3页
试卷第2页,共2页
参考答案:
1.C
2.D
3.D
4.D
5.C
6.D
7.B
8.C
9.C
10.C
11.C
12.D
13.D
14.C
15.C
16.B
17. 分液漏斗 锥形瓶 吸收水蒸气 氢氧化钠溶液 将燃着的木条放在集气瓶口,若木条熄灭,则已集满 设所消耗的稀硫酸中的溶质的质量为x
稀硫酸中溶质的质量分数为
答:所用稀硫酸中溶质的质量分数为19.6%。
18. C 高 3CO+Fe2O32Fe+3CO2 导热 H2+FeCl2Fe+2HCl 氧气 水 节约金属资源 大 CuSO4+Zn=ZnSO4+Cu > 延展 铝与氧气反应表面形成致密氧化膜 2Al+Fe2O3Al2O3+2Fe +2 Zn HgO 导电 分类
19.(1)元素;
(2) 不可再生 A
(3)
(4) 物理
(5) 增大反应面积,使反应充分进行 115.5t
(6) 置换 Al>Fe>Cu BCE
20. 铁的活动性比铜强 3420 Na2S 使Fe2+转化为Fe3+ b 大于
21. c 阳极产生氧气,氧气在高温下与石墨反应而使石墨消耗 大; 铁比铜更为活泼,在海水中更容易锈蚀 Si+2FeOSiO2+2Fe
22. 长颈漏斗 AD 防止水倒流炸裂试管 燃烧的木条放在瓶口,木条熄灭说明满了 可以控制反应的发生与停止 解:设:稀硫酸中溶质的质量分数为x
答:稀硫酸中溶质的质量分数为9.8%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列图示实验中能明显观察到发生化学变化的是
A. B.
C. D.
2.下图所示反应,有关说法的错误的是
A.铝丝需要砂纸打磨
B.溶液由蓝色变为无色
C.金属活动性强弱:Al>Cu
D.反应的化学方程式为:Al+CuSO4=Cu+AlSO4
3.某化学兴趣小组为验证Ag、Fe、Cu三种金属的活动性顺序,设计了如下图所示的实验操作.其中可以达到实验目的的组合是
A.①③ B.②④ C.④⑤ D.②③
4.大气中二氧化碳等气体含量升高,会导致温室效应,如图是将二氧化碳转化为化工原料乙烯(化学式为C2H4)的微观示意图,下列说法正确的是
A.从反应类型看:该反应属于置换反应
B.从微观构成看:四种物质均由原子构成
C.从反应价值看:该反应能获取清洁能源,延缓温室效应
D.从物质的量看:该反应中CO2与C2H4的质量比为22:7
5.下列所示的四个图像,能正确反映对应变化关系的是( )
A.电解水
B.向两份完全相同的稀盐酸中分别加入足量的锌粉和铁粉
C.加热一定质量的氯酸钾和二氧化锰的混合物
D.相同温度下,用两份等质量、等浓度的过氧化氢溶液制氧气,其中一份加入少量MnO2
6.两个烧杯中装有等质量的金属锌和镁,然后分别逐渐加入同浓度的稀硫酸,产生氢气的质量与加入硫酸的质量关系如图所示。下列说法正确的是
A.该图反映出镁比锌的金属活动性强
B.a点时,两个烧杯中的酸都恰好完全反应
C.b点时,两个烧杯中产生氢气的质量相等
D.c点时,两个烧杯中都有金属剩余
7.下列金属中,金属活动性最强的是( )
A.铁 B.镁 C.锌 D.铜
8.某同学为了测定铜镁合金样品中铜的质量分数,将100g稀盐酸分2次加入到盛有5g该样品的烧杯中,所得数据如下表,则下列说法中错误的是
次数 实验前 第1次 第2次
加入稀盐酸的质量/g 0 50 50
剩余固体的质量/g 5 3 2
A.第1次加入稀盐酸后剩余固体中还有镁
B.第2次所加入的稀盐酸未反应完
C.每50g稀盐酸和1g镁恰好完全反应
D.合金样品中铜的质量分数为40%
9.下列关于金属材料的说法中正确的是( )
A.铝制品表面应常用钢刷擦洗
B.可用铁桶盛装农药波尔多液
C.焊锡(锡铅合金)的熔点低,常用来焊接金属
D.钢因为比生铁的含碳量高,所以应用范围更广
10.下列验证Zn、Fe、Ag三种金属活动性顺序的实验方案中(“-”表示未进行金属与盐溶液之间的实验),不能达到实验目的是
选项 金属 盐溶液 A B C D
ZnSO4溶液 - Fe Ag Fe
FeSO4溶液 Zn Ag Zn -
AgNO3溶液 Fe - - Fe
A.A B.B C.C D.D
11.现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中均显+2价)。则下列说法错误的是
A.完全反应所需时间:丙>甲>乙 B.生成氢气的质量:甲>乙>丙
C.相对原子质量:乙>丙>甲 D.消耗硫酸的质量:甲>乙>丙
12.明代宋应星著的《天工开物》中有关于“火法”冶炼金属锌的工艺记载:“炉甘石(注:主要成分是碳酸锌)十斤,装载入一泥罐內,然后逐层用煤炭饼(注:反应后生成一氧化碳)垫盛,其底铺薪,发火煅红,冷淀,毁罐取出,即倭铅也”。下列说法错误的是
A.煤炭中起作用的主要成分是C
B.冶炼Zn的化学方程式为:
C.该冶炼锌的反应属于置换反应
D.倭铅是指金属锌和铅的混合物
13.“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理的是
比较硬度,硬度小的是“愚人金”
灼烧,表面变色的是“愚人金”
浸没在稀硫酸中,表面有气泡产生的是“愚人金”
浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
A. B. C. D.
14.下列物质可通过金属与稀盐酸反应直接得到的是( )
A.CuCl2 B.AgCl C.ZnCl2 D.FeCl3
15.现有X、Y、Z三种金属,如果把X、Y和Z分别放入稀硫酸中,X和Z溶解并产生气体,Y无变化;如果把X放入Z的盐溶液中,过一会儿,在X的表面有Z析出。根据以上实验事实,判断X、Y和Z的金属活动性顺序( )
A.X>Y>Z B.Y>Z>X C.X>Z>Y D.Z>X>Y
16.为了验证铁、铜两种金属的活动性差异,如图所示取2支试管分别进行有关实验,若要观察到现象的显著差异,所用液体合理的是
A.蒸馏水 B.稀盐酸 C.酒精水溶液 D.硫酸钠溶液
二、综合应用题
17.潜水器中可使用过氧化钠(Na2O2)固体做供氧剂,过氧化钠固体与二氧化碳反应的原理是 ,为验证该反应产物,某兴趣小组进行如下实验探究。
【查阅资料】过氧化钠与水反应生成氢氧化钠和氧气。
【设计实验】小组同学利用如图所示装置进行了实验(忽略稀盐酸的挥发)。
(1)装置A中标号仪器名称:①______,②______。
(2)装置A中反应的化学方程式为______。
(3)装置B的作用是______。
(4)为防止装置E收集的氧气中混有二氧化碳,装置D中盛放的试剂是______,并写出装置D中反应的化学方程式______。
(5)实验室制取CO2验满的方法是______。
(6)有一份锌粉与铜粉的混合物样品,为确定其组成,某同学将32.5g样品加入100g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示。
试求:所用稀硫酸的溶质质量分数______(写出计算过程)。
18.金属与我们生活关系密切。
(1)铁
①下列物品所使用的主要材料属于合金的是 ____ (填标号,下同)。
A.青花瓷瓶 B.橡胶充气艇 C.不锈钢锅
②生铁和钢是常用的合金,生铁的含碳量比钢的含碳量__________(填“高”或“低”)。 生铁冶炼的主要原理是利用一氧化碳与氧化铁反应,反应的化学方程式为__________________________________。
③生活中常用铁锅做炊具,利用了铁的___________性。
④颗粒大小达到纳米级的单质铁具有很强的反应活性,俗称纳米铁.在高温环境下,用H2和FeCl2反应,可以生成纳米铁和一种易溶于水显强酸性的气体,写出该反应的化学方程式____________________________________。
⑤铁制品锈蚀的过程,实际上是铁与空气中的________和________ 等发生化学反应的过程;回收废钢铁的目的是_______________________ (写一点)。
(2)铜
①黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图所示),纯铜片上留下明显的划痕,说明合金的硬度比组成中的纯金属要 _________ (填“大”、“小”)。
②黄铜渣中约含 Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质。通过流程如下图的方法处理黄铜渣可得到硫酸锌(杂质不溶于水、不参与反应)。
资料:ZnO+H2SO4═ZnSO4+H2O; CuO+H2SO4═CuSO4+H2O
Ⅱ中生成金属单质的化学反应方程式为 _____________________________________ 。该流程最终得到的硫酸锌中锌元素质量 _____ (填“<”、“=”、“>”)黄铜中锌元素质量。
(3)铝
①铝块能制成铝箔是利用了铝的_________性。
②铝比铁活泼,但铝比铁耐腐蚀的原因是______________________________________。
③由铝粉与氧化铁组成的铝热剂在高温下反应,生成另一种氧化物和另一种金属单质,常用于焊接铁轨,试写出该反应的化学方程式:___________________。
(4)锌
锌等金属可以用于生产纽扣电池,下面是某常见纽扣电池中发生的反应:H2O+Zn+HgO=Zn(OH)2+Hg
①该反应后锌元素的化合价为___________。
②将该反应中的反应物进行简单分类,则下面横线上的物质是(填化学式):
纯净物:单质:_____________金属氧化物:_____________
③该电池中通常还加入石墨粉,是因为石墨具有良好的__________性。
④废旧电池不能随意丢弃,由于电池种类不同,应______________回收。
19.化学在生产、生活、交通等方面发挥重要作用。
(1)为了全民的健康,我国推广使用强化铁酱油,这里的“铁”指的是______。(填“单质”、“元素”或“原子”)
(2)许多家庭做饭用罐装的“煤气”作燃料,罐中所装的是液化石油气。
①它是石油化工的一种产品。石油属于______能源(填“可再生”或“不可再生”)。
②若厨房失火时,移走“煤气罐”,这是利用了______原理灭火(填序号)。
A.清除可燃物 B.使可燃物与氧气隔绝 C.降低可燃物的着火点
(3)压缩天然气(CNG)是我县正在推广的出租车燃料,它具有燃烧效率高、污染小的优点,写出天然气主要成分完全燃烧的化学方程式______。
(4)连云港市政府倡导居民骑自行车“低碳出行”,采用碳纤维材料制造的自行车轻便、机械强度大,这应用了碳纤维的______(填“物理”或“化学”)性质;自行车采用铝合金材料,用化学方程式解释金属铝具有较强抗腐蚀性的原因______。
(5)以黄铁矿为原料(主要成分是FeS2)为原料,生产硫酸的简要流程图如下:
①将黄铁矿粉碎,目的是______。
②流程中SO2转化为SO3的化学方程式为______。
③得到的炉渣(Fe2O3)在工业上可用来炼铁,用含Fe2O380%的炉渣200 t,理论上可炼出含有杂质3﹪的生铁______t(精确到0.1t)。
(6)小刚通过实验探究得知以下两组物质均能发生反应:
Ⅰ、铁和硫酸铜溶液 Ⅱ、铝和硫酸亚铁溶液
①Ⅰ中发生反应的化学方程式是______,反应类型为______反应。
②铁、铝、铜的金属活动性由强到弱的顺序是______。
③小刚继续探究某未知金属X与铁、铜的活动性强弱关系,设计了以下实验方案并对实验结果进行预测。下列实验方案及预测如果与事实相符,就可以判断出X、铁、铜金属活动性强弱顺序的有______(填序号)。
A.将X放入CuSO4溶液中能反应
B.将X放入CuSO4溶液中不能反应
C.将X放入FeSO4溶液中能反应
D.将X放入FeSO4溶液中不能反应
E.将X放入FeSO4溶液中不能反应,放入CuSO4溶液中能反应
20.“沉睡三千年,一醒惊天下”,三星堆出土的大量文物中,有青铜纵目面具、青铜神树……。
【查阅资料】I.古代青铜器中含有铜、锡、铅等元素。
II.测定碳14含量可估算古物的年代,计算公式: 年代
III.几种离子生成氢氧化物沉淀的 pH,如下表:
待沉淀的离子 Fe2+ Fe3+ Cu2+ Zn2+ Cd2+ Pb2+
开始沉淀时的pH 6.34 1.48 5.2 6.2 7.2 8.0
完全沉淀时的pH 9.7 3.2 6.4 8.0 9.5 8.8
探究一 青铜器的性质
(1)出土的青铜器保存较好,而更晚出土的铁器腐蚀严重,原因是_____________________。
(2)三星堆某文物测得的n=﹣0.42,则该文物距今约_________ 年。
探究二 模拟青铜降锌
三星堆出土的青铜器中锌的含量很低,而铜矿石中锌的含量较高,可用硫化钠(Na2S)或活性炭降低锌的含量,“降锌”效果如图1、图2所示。
(3)对比图1、图2,“降锌”效果更佳的是________(选填“Na2S”或“活性炭”)。
(4)兴趣小组设计实验方案模拟青铜“降锌”实验:取铁、锌、铜、铬(Cd)、铅(Pb)这几种金属氧化物的混合样品与稀硫酸(H2SO4)反应,得到含不同金属离子的混合溶液,测得pH=1,将该溶液按下列流程实验:
① 步骤Ⅰ中加H2O2的目的是___________________。
② 步骤Ⅱ中加ZnO的作用是将溶液的pH调至_________(填序号)之间。
a.1.48~3.0b.3.2~5.2c.5.2~9.7
③ 由步骤Ⅲ可判断金属活动性:Zn_______Cd(选填“大于”或“小于”)。
21.2017年4月,“航母”下水,开拓中国新蓝海。
(1)“航母”舰体材料为合金钢,国产航母使用的“超级钢”具有极佳的抗压性、延展性和焊接性。合金钢是__(填序号)
a合成材料 b复合材料 c无机材料
(2)“航母”升降机可由铝合金制造,用石墨作电极在高温条件下电解熔融氧化铝,在阴极和阳极区分别得到A1和O2,阳极区使用的石墨易消耗的原因是__。
(3)“航母”螺旋浆可由铜合金制造。铜合金比铜的硬度__(填“大”或“小”),铜比铁在海水中耐腐蚀的原因是__。
(4)由生铁炼钢时,硅(Si)与氧化亚铁在高温条件下反应生成二氧化硅和铁,该反应的化学方程式为__。
22.如图1是实验室制取气体的常用装置。
(1)仪器X的名称是_________________;加热氯化铵和熟石灰的固体混合物可制取氨气(NH3),氨气极易溶于水,则制取氨气应选用的一套装置为_________________(填字母代号)。
(2)若选择A、F组合一套装置制取某气体,请写出有关反应的化学方程式_________________;实验结束时应先撤去导管,后熄灭酒精灯,原因是_________________。
(3)实验室可选择E装置收集二氧化碳,验满的方法是_________________;B和C装置均可制取CO2,与B相比较,C的主要优点是什么?______
(4)若用图2装置采用排水法收集H2,请将方框内的导管补画完整。____
(5)6.5g锌与100g稀硫酸恰好完全反应,求稀硫酸中溶质的质量分数。____
试卷第1页,共3页
试卷第2页,共2页
参考答案:
1.C
2.D
3.D
4.D
5.C
6.D
7.B
8.C
9.C
10.C
11.C
12.D
13.D
14.C
15.C
16.B
17. 分液漏斗 锥形瓶 吸收水蒸气 氢氧化钠溶液 将燃着的木条放在集气瓶口,若木条熄灭,则已集满 设所消耗的稀硫酸中的溶质的质量为x
稀硫酸中溶质的质量分数为
答:所用稀硫酸中溶质的质量分数为19.6%。
18. C 高 3CO+Fe2O32Fe+3CO2 导热 H2+FeCl2Fe+2HCl 氧气 水 节约金属资源 大 CuSO4+Zn=ZnSO4+Cu > 延展 铝与氧气反应表面形成致密氧化膜 2Al+Fe2O3Al2O3+2Fe +2 Zn HgO 导电 分类
19.(1)元素;
(2) 不可再生 A
(3)
(4) 物理
(5) 增大反应面积,使反应充分进行 115.5t
(6) 置换 Al>Fe>Cu BCE
20. 铁的活动性比铜强 3420 Na2S 使Fe2+转化为Fe3+ b 大于
21. c 阳极产生氧气,氧气在高温下与石墨反应而使石墨消耗 大; 铁比铜更为活泼,在海水中更容易锈蚀 Si+2FeOSiO2+2Fe
22. 长颈漏斗 AD 防止水倒流炸裂试管 燃烧的木条放在瓶口,木条熄灭说明满了 可以控制反应的发生与停止 解:设:稀硫酸中溶质的质量分数为x
答:稀硫酸中溶质的质量分数为9.8%。
答案第1页,共2页
答案第1页,共2页
