科粤版九年级化学下册6.3金属矿物与冶炼同步练习(word版有答案)
文档属性
| 名称 | 科粤版九年级化学下册6.3金属矿物与冶炼同步练习(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 320.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-25 16:49:42 | ||
图片预览



文档简介
科粤版九年级化学下册 6.3 金属矿物与冶炼
一、单选题
1.工业上利用黄铁矿(主要成分是FeS2)生产硫酸。同时还能得到一种副产品氧化铁用于炼铁,其反应原理如下:
①4FeS2+11O22Fe2O3+8SO2 ②2SO2+O22SO3
③SO3+H2O=H2SO4 ④ Fe2O3+3CO2Fe+3CO2
下列说法不正确的是
A.反应①②④均是在高温条件下进行的
B.只有①②发生的是氧化反应
C.反应②③属于化合反应
D.反应①④不属于四种基本反应类型中的任何一种
2.工业炼铁的主要原料中,正确的一组是
①铁矿石;②焦炭;③一氧化碳;④石灰石;⑤空气
A.①②⑤ B.①②④⑤
C.①③④⑤ D.②③④
3.有甲、乙、丙、丁四种金属。只有甲在自然界主要以单质形式存在。丁盐的水溶液不能用乙制的容器盛放,但可用丙制的容器盛放。这四种金属的活动性由强到弱的顺序是
A.甲>乙>丁>丙 B.丙>丁>乙>甲
C.丙>乙>丁>甲 D.乙>丁>丙>甲
4.金属单质家族四兄弟W、X、Y、Z,不小心掉入稀盐酸池,神情如图所示:
则W、X、Y、Z的金属活动性顺序为
A.X>W>Z>Y B.Z>X>W>Y
C.W>X>Y>Z D.Y>Z>X>W
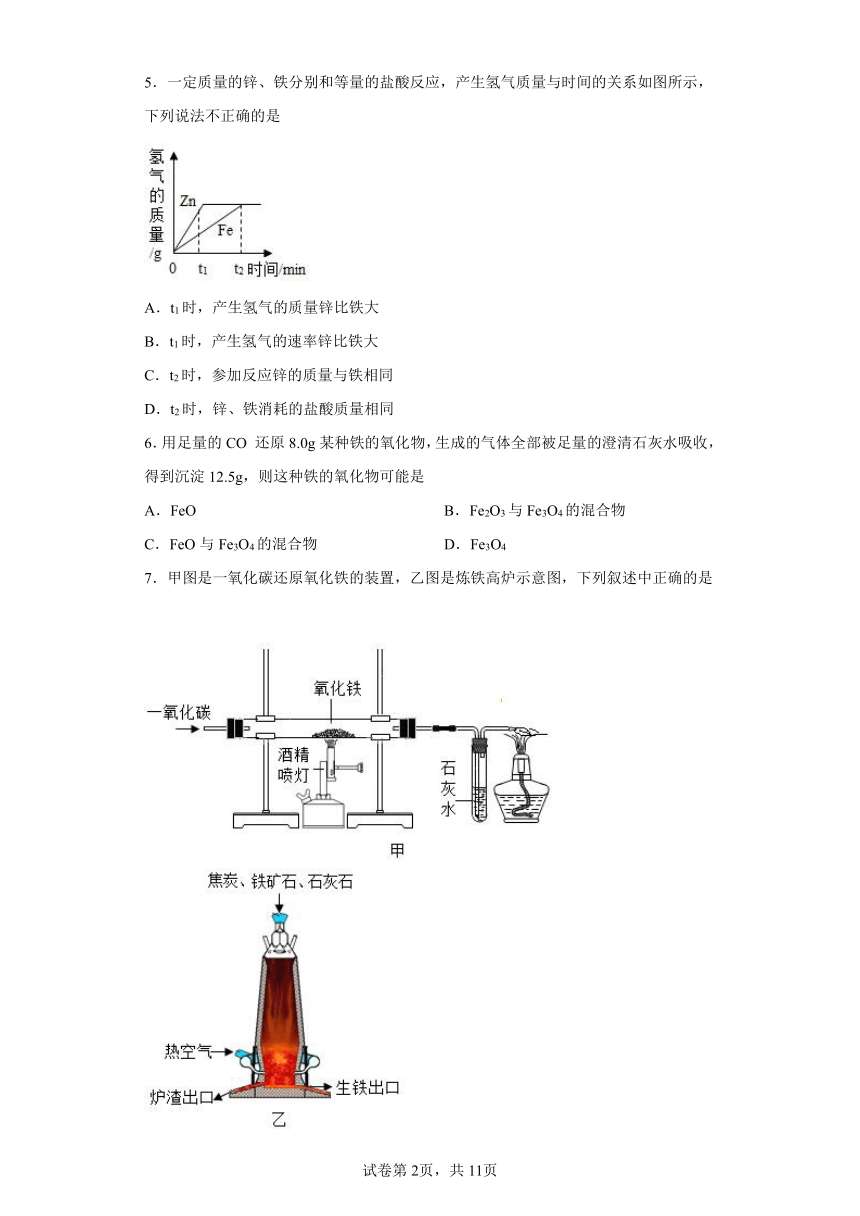
5.一定质量的锌、铁分别和等量的盐酸反应,产生氢气质量与时间的关系如图所示,下列说法不正确的是
A.t1时,产生氢气的质量锌比铁大
B.t1时,产生氢气的速率锌比铁大
C.t2时,参加反应锌的质量与铁相同
D.t2时,锌、铁消耗的盐酸质量相同
6.用足量的CO 还原8.0g某种铁的氧化物,生成的气体全部被足量的澄清石灰水吸收,得到沉淀12.5g,则这种铁的氧化物可能是
A.FeO B.Fe2O3与Fe3O4的混合物
C.FeO与Fe3O4的混合物 D.Fe3O4
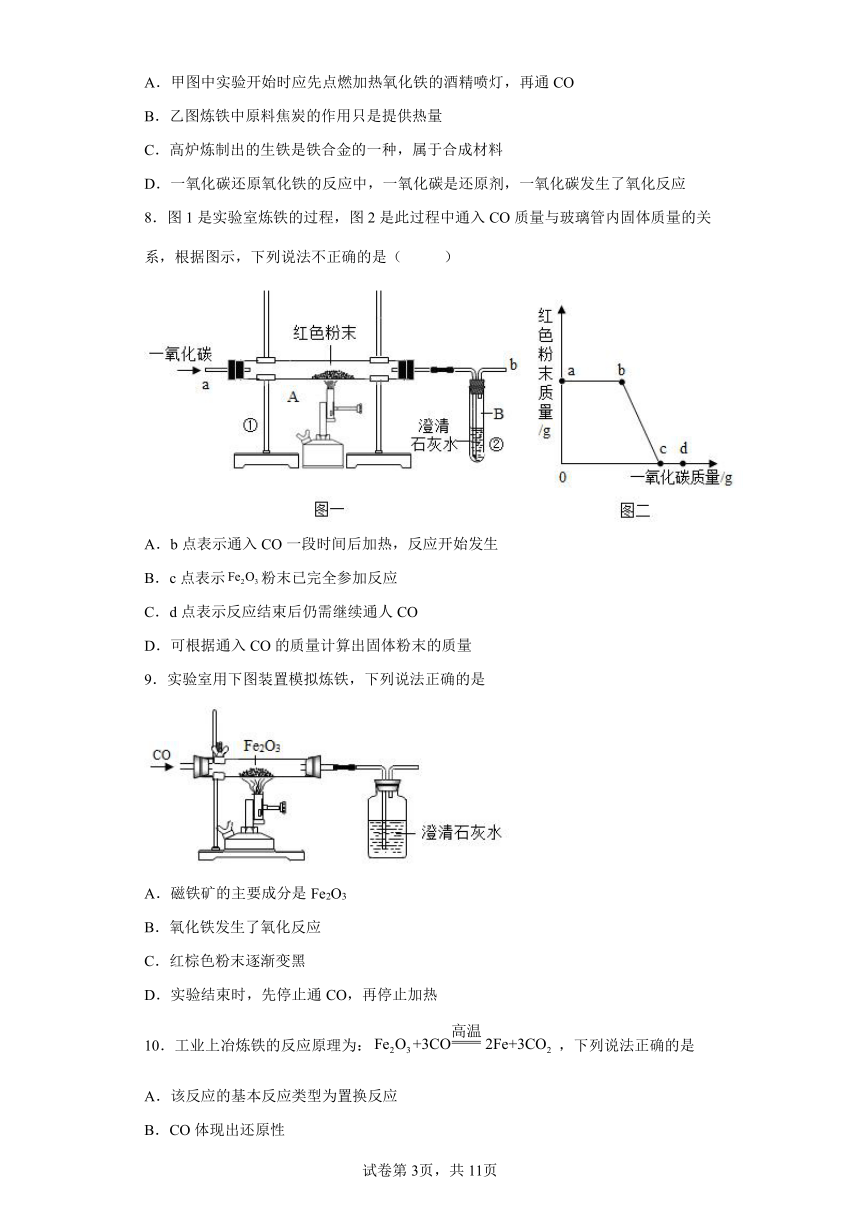
7.甲图是一氧化碳还原氧化铁的装置,乙图是炼铁高炉示意图,下列叙述中正确的是
A.甲图中实验开始时应先点燃加热氧化铁的酒精喷灯,再通CO
B.乙图炼铁中原料焦炭的作用只是提供热量
C.高炉炼制出的生铁是铁合金的一种,属于合成材料
D.一氧化碳还原氧化铁的反应中,一氧化碳是还原剂,一氧化碳发生了氧化反应
8.图1是实验室炼铁的过程,图2是此过程中通入CO质量与玻璃管内固体质量的关系,根据图示,下列说法不正确的是( )
A.b点表示通入CO一段时间后加热,反应开始发生
B.c点表示粉末已完全参加反应
C.d点表示反应结束后仍需继续通人CO
D.可根据通入CO的质量计算出固体粉末的质量
9.实验室用下图装置模拟炼铁,下列说法正确的是
A.磁铁矿的主要成分是Fe2O3
B.氧化铁发生了氧化反应
C.红棕色粉末逐渐变黑
D.实验结束时,先停止通CO,再停止加热
10.工业上冶炼铁的反应原理为: ,下列说法正确的是
A.该反应的基本反应类型为置换反应
B.CO体现出还原性
C.冶炼铁使用的原料Fe2O3是磁铁矿的主要成分
D.工业冶炼铁所产生的尾气可直接排放
11.某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制生铁。若要炼制含铁96%的生铁63 t,假设在炼制过程中损失10%铁元素,则理论上需要含杂质20%的赤铁矿石的质量是
A.120 t B.108 t C.96 t D.84 t
12.有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,而Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上实验事实,判断X、Y和Z的金属活动性顺序是
A.X>Y>Z B.X>Z>Y C.Z>Y>X D.Z>X>Y
13.如图为一氧化碳还原氧化铁实验。下列说法中正确的是( )
A.开始时应先预热玻璃管,后通入一氧化碳
B.实验中玻璃管里粉末由黑色逐渐变成红棕色
C.参加反应的氧化铁和一氧化碳质量比为40:7
D.将尾气点燃或收集,可防止一氧化碳污染空气
14.探究金属活动性顺序时,将锌粒放入硫酸铜溶液中,锌粒表面有紫红色物质析出,还有无色无味气体产生的“异常”现象。推测该气体可能是
A.氢气 B.二氧化硫 C.二氧化碳 D.一氧化碳
15.黄铁矿的主要成分为二硫化亚铁(FeS2),可用于工业上冶炼铁和生产浓硫酸,如图所示。下列说法错误的是( )
A.反应前将黄铁矿粉碎,能提高反应速率
B.反应①②③④中都有元素化合价的变化
C.反应②不属于四种基本反应类型之一
D.该过程回收利用了SO2,能减少酸雨的发生
16.下列家庭小实验中,铁钉被腐蚀速度最慢的是( )
A. B. C. D.
二、综合应用题
17.金属和金属化合物在人类的生产、生活中起着重要的作用。
(1)金属镓有“电子工业脊梁”的美誉,应用于半导体和光电材料等领域。
①镓元素的部分信息如图所示,下列说法错误的是________。
A m=31
B镓元素位于元素周期表的第四周期
C镓元素的化学性质与铝元素相似
D镓原子的相对原子质量为69.72g
②小米手机推出的氮化镓(GaN)充电器,具有体积小、输出效率高、充电速度快等特点。GaN可以由氯化镓与氨气(NH3)在一定条件下反应制得,同时生成氯化氢。该反应的化学方程式是________。
(2)铝合金和钛合金被广泛用于航天工业。
①一般情况下,铝合金的强度和硬度比纯铝的________(填“大”或“小”)。
②钛的金属活动性比铝弱,在工业上可利用置换反应制取金属钛,此反应的化学方程式为:_____
(3)钢铁是基本的结构材料。某化学实验小组利用下图所示装置模拟炼铁过程,并测定某赤铁矿中氧化铁的质量分数(赤铁矿中的杂质不参加反应)
①A装置玻璃管里可观察到的现象为________。
②写出B装置中发生反应的化学方程式________。
③如果没有C装置,会导致测定结果________(填“偏大”、“偏小”或“不变”)。
④实验前称量赤铁矿的质量为10g,通入足量的一氧化碳完全反应后B装置的总质量增加了6.6g,求该赤铁矿中氧化铁的质量分数。______
18.金属材料目前在人类的生产生活中有非常广泛的应用
(一)铁的有关知识
I.人类使用金属经历了青铜、铁器时代,近代才开始大量使用铝材料,这反映出铜、铁、铝这三种金属的活动性由强到弱的顺序是______。
II.工业炼铁多采用赤铁矿、磁铁矿等,以磁铁矿为原料炼铁的化学方程式为____;炼铁一般不采用黄铁矿(FeS2)的原因可能是①黄铁矿含铁量相对低;②________。
III.钢铁材料通常分为生铁和钢,这两种铁合金的主要区别就在于_____,写出成语“百炼成钢”中发生反应的化学方程式________。
(二)金属镁及其化合物的探究
【发现问题】镁是一种银白色有金属光泽的金属。但拿出的镁条总是有一层灰黑色的“外衣",这层灰黑色的外衣是什么物质呢
【查阅资料】(1)Mg(OH)2:白色固体,难溶于水,受热会分解成氧化镁和水;
(2)MgCO3: 白色固体,微溶于水,受热会分解成氧化镁和二氧化碳;
(3)MgCO3的热稳定性比Mg(OH)2的热稳定性更强。
【提出猜想】
小组同学认为该固体不可能是MgO、Mg(OH)2或MgCO3,他们的理由是______;小组同学由铜生锈会产生Cu2(OH)2CO3联想到灰黑色的物质可能是Mg2(OH)2CO3。
【实验分析】
按如图所示装置进行实验,发现试管口有小水滴出现,说明反应产生了______;澄清石灰水变浑浊;同时灰黑色固体完全变为白色。若灰黑色固体是 Mg2(OH)2CO3,请写出Mg2(OH)2CO3受热分解的化学方程式__________。
【组成测定】
工业生产中得到的碱式碳酸镁晶体是xMgCO3 yMg(OH)2 zH2O,为精确测量晶体的组成,小组同学取4.66g该晶体,用热分析仪对固体进行热分解(加热使之逐步分解,首先失去结晶水,然后依次分解,最后完全反应),测定剩余固体质量与分解温度之间关系。
【数据处理】剩余固体质量与加热时间关系如图所示:
请回答下列问题:
(1)0~t1固体质量没有发生变化的原因可能是_____________。
(2)晶体中结晶水的质量为______g。
(3)t3~t4段发生反应的化学方程式为______
(4)t4~t5段固体为______和MgO(写化学式)。
(5)根据图中数据推算xMgCO3 yMg(OH)2 zH2O中x∶y∶z的最简比= ______。
19.化学是以实验为基础的科学。
(1)如图,将注射器中的溶液缓缓推入V形管,反应的化学方程式为______;用80℃的热水加热盛有红磷和白磷的W形管时,发现白磷燃烧而红磷不燃烧,由此可说明燃烧需要的条件是______。
(2)请根据下列各图中有关信息回答问题:
①从图一A到E中选择实验室制取二氧化碳的装置______(填标号);若将其改为图三的发生装置,与原装置相比,其优点是______;若将其改为如图二的收集装置,气体应从______(填“c”或“d”)端通入。
②写出用A装置制取氧气的化学方程式______;酒精灯内酒精完全燃烧的化学方程式______。
(3)某炼铁厂要得到2240t铁,请你根据化学方程式计算:理论上需要含氧化铁80%的赤铁矿的质量是多少?
20.实验室用氧化铁粉末模拟炼铁,装置如图所示。
(1)实验时,先通CO再加热的目的是______。
(2)①硬质玻璃管中观察到的实验现象是______。
②B装置的作用是______。(已知:氢氧化钠、碳酸钠易溶于水,2NaOH+CO2=Na2CO3+H2O)
(3)某同学用以下两组实验对模拟炼铁进行进一步探究。
完全反应后,两组生成物均为黑色粉末(纯净物),分别用两组生成物进行如下实验:
步骤 实验操作 甲组 乙组
1 称量黑色粉末的质量 m1 m2
2 取黑色粉末,用磁铁吸引 能被吸引 能被吸引
3 取黑色粉末,加入稀盐酸 固体全部溶解,有大量气泡 固体不溶解,无气泡产生
4 取黑色粉末,加入足量硫酸铜溶液 有红色物质析出 无红色物质析出
①兴趣小组通过甲、乙两组实验,证明______对CO与Fe2O3反应的产物有影响。
②甲组所得黑色粉末与稀盐酸反应的化学方程式为______。
③查阅资料发现:常温下Fe3O4不与稀盐酸或硫酸铜溶液反应。某同学猜想乙组的生成物为Fe3O4。该同学称量黑色粉末m2=______g,证实了自己的猜想。
(4)某钢铁厂采用赤铁矿(主要成分为Fe2O3)炼铁,日产含铁1.4×104t的生铁,至少需要含Fe2O380%的赤铁矿的质量是多少?______(写出计算过程)
21.(1)下图装置可做一氧化碳还原氧化铁的实验,并检验生成的气体产物。
①B装置玻璃管里可观察到的现象是___________;写出B装置内发生反应的化学方程式___________。
②C装置中反应的化学方程式为___________。
(2)实验室利用如图装置可制取干燥的氧气。
①A中发生反应的的化学方程式为___________。
②试剂X为___________。
③若用C装置收集氧气,请将C装置中导管补画完整___________。
(3)取12.5g石灰石于装置A中,向其中加入100g足量的稀盐酸,充分反应后(杂质不参加反应),A中固液混合物的质量为108.1g,请计算该石灰石中碳酸钙的质量分数___________。
22.用如图装置测定氧化铁和铁的混合物中各成分的质量。小明同学取该混合物mg,放入硬质玻璃管中,通入CO一段时间后加热玻璃管,充分反应后,熄灭酒精喷灯,冷却至室温。已知由一氧化碳发生装置得到的CO中混有杂质CO2和H2O。回答下列问题:
(1)写出B装置玻璃管内反应的化学方程式______。
(2)若测得实验前后B中玻璃管内固体质量减少ng,则样品中氧化铁的质量分数为______(用含m、n的代数式表示)
(3)从环保角度看,此实验装置存在的缺陷是______。
小华同学用另一实验方案测定混合物中铁的质量分数,实验流程如下图所示:
(4)用浓盐酸配置实验中需要的稀盐酸,需要用到的仪器有量筒、烧杯______。
(5)根据小华同学的实验数据,计算混合物中铁的质量分数为______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.B
3.D
4.B
5.C
6.C
7.D
8.D
9.C
10.B
11.A
12.A
13.D
14.A
15.B
16.B
17. D 大 AlCl3 红色固体逐渐变黑色 偏大 设氧化铁的质量为
该赤铁矿中氧化铁的质量分数=
答:该赤铁矿中氧化铁的质量分数80%。
18. 铝〉铁〉铜 黄铁矿炼铁过程中生成有毒的SO2 含碳量不同 MgO、Mg(OH)2或MgCO3均为白色固体,镁条外面是灰黑色 水 温度没有达到分解所需的最低温度 0.72g MgCO3 4:1:4
19.(1) 需要达到可燃物的着火点
(2) BD 控制反应的发生和停止 c
(3)解:设需要赤铁矿的质量为x
答:需要赤铁矿4000t。
20. 将装置内空气排尽,防止发生爆炸 红棕色固体变黑 吸收二氧化碳、收集一氧化碳 温度 4.64 解:设至少需要含Fe2O380%的赤铁矿的质量是x
x=2.5×104t
答:至少需要含Fe2O380%的赤铁矿的质量是2.5×104t。
21. 固体由红棕色逐渐变为黑色 浓硫酸 解:根据质量守恒定律
设石灰石中碳酸钙的质量分数为x
x=80%
答:石灰石中碳酸钙的质量分数为80%。
22. 3CO+Fe2O32Fe+3CO2 没有处理尾气,CO污染空气 胶头滴管、玻璃棒 56%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.工业上利用黄铁矿(主要成分是FeS2)生产硫酸。同时还能得到一种副产品氧化铁用于炼铁,其反应原理如下:
①4FeS2+11O22Fe2O3+8SO2 ②2SO2+O22SO3
③SO3+H2O=H2SO4 ④ Fe2O3+3CO2Fe+3CO2
下列说法不正确的是
A.反应①②④均是在高温条件下进行的
B.只有①②发生的是氧化反应
C.反应②③属于化合反应
D.反应①④不属于四种基本反应类型中的任何一种
2.工业炼铁的主要原料中,正确的一组是
①铁矿石;②焦炭;③一氧化碳;④石灰石;⑤空气
A.①②⑤ B.①②④⑤
C.①③④⑤ D.②③④
3.有甲、乙、丙、丁四种金属。只有甲在自然界主要以单质形式存在。丁盐的水溶液不能用乙制的容器盛放,但可用丙制的容器盛放。这四种金属的活动性由强到弱的顺序是
A.甲>乙>丁>丙 B.丙>丁>乙>甲
C.丙>乙>丁>甲 D.乙>丁>丙>甲
4.金属单质家族四兄弟W、X、Y、Z,不小心掉入稀盐酸池,神情如图所示:
则W、X、Y、Z的金属活动性顺序为
A.X>W>Z>Y B.Z>X>W>Y
C.W>X>Y>Z D.Y>Z>X>W
5.一定质量的锌、铁分别和等量的盐酸反应,产生氢气质量与时间的关系如图所示,下列说法不正确的是
A.t1时,产生氢气的质量锌比铁大
B.t1时,产生氢气的速率锌比铁大
C.t2时,参加反应锌的质量与铁相同
D.t2时,锌、铁消耗的盐酸质量相同
6.用足量的CO 还原8.0g某种铁的氧化物,生成的气体全部被足量的澄清石灰水吸收,得到沉淀12.5g,则这种铁的氧化物可能是
A.FeO B.Fe2O3与Fe3O4的混合物
C.FeO与Fe3O4的混合物 D.Fe3O4
7.甲图是一氧化碳还原氧化铁的装置,乙图是炼铁高炉示意图,下列叙述中正确的是
A.甲图中实验开始时应先点燃加热氧化铁的酒精喷灯,再通CO
B.乙图炼铁中原料焦炭的作用只是提供热量
C.高炉炼制出的生铁是铁合金的一种,属于合成材料
D.一氧化碳还原氧化铁的反应中,一氧化碳是还原剂,一氧化碳发生了氧化反应
8.图1是实验室炼铁的过程,图2是此过程中通入CO质量与玻璃管内固体质量的关系,根据图示,下列说法不正确的是( )
A.b点表示通入CO一段时间后加热,反应开始发生
B.c点表示粉末已完全参加反应
C.d点表示反应结束后仍需继续通人CO
D.可根据通入CO的质量计算出固体粉末的质量
9.实验室用下图装置模拟炼铁,下列说法正确的是
A.磁铁矿的主要成分是Fe2O3
B.氧化铁发生了氧化反应
C.红棕色粉末逐渐变黑
D.实验结束时,先停止通CO,再停止加热
10.工业上冶炼铁的反应原理为: ,下列说法正确的是
A.该反应的基本反应类型为置换反应
B.CO体现出还原性
C.冶炼铁使用的原料Fe2O3是磁铁矿的主要成分
D.工业冶炼铁所产生的尾气可直接排放
11.某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制生铁。若要炼制含铁96%的生铁63 t,假设在炼制过程中损失10%铁元素,则理论上需要含杂质20%的赤铁矿石的质量是
A.120 t B.108 t C.96 t D.84 t
12.有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,而Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上实验事实,判断X、Y和Z的金属活动性顺序是
A.X>Y>Z B.X>Z>Y C.Z>Y>X D.Z>X>Y
13.如图为一氧化碳还原氧化铁实验。下列说法中正确的是( )
A.开始时应先预热玻璃管,后通入一氧化碳
B.实验中玻璃管里粉末由黑色逐渐变成红棕色
C.参加反应的氧化铁和一氧化碳质量比为40:7
D.将尾气点燃或收集,可防止一氧化碳污染空气
14.探究金属活动性顺序时,将锌粒放入硫酸铜溶液中,锌粒表面有紫红色物质析出,还有无色无味气体产生的“异常”现象。推测该气体可能是
A.氢气 B.二氧化硫 C.二氧化碳 D.一氧化碳
15.黄铁矿的主要成分为二硫化亚铁(FeS2),可用于工业上冶炼铁和生产浓硫酸,如图所示。下列说法错误的是( )
A.反应前将黄铁矿粉碎,能提高反应速率
B.反应①②③④中都有元素化合价的变化
C.反应②不属于四种基本反应类型之一
D.该过程回收利用了SO2,能减少酸雨的发生
16.下列家庭小实验中,铁钉被腐蚀速度最慢的是( )
A. B. C. D.
二、综合应用题
17.金属和金属化合物在人类的生产、生活中起着重要的作用。
(1)金属镓有“电子工业脊梁”的美誉,应用于半导体和光电材料等领域。
①镓元素的部分信息如图所示,下列说法错误的是________。
A m=31
B镓元素位于元素周期表的第四周期
C镓元素的化学性质与铝元素相似
D镓原子的相对原子质量为69.72g
②小米手机推出的氮化镓(GaN)充电器,具有体积小、输出效率高、充电速度快等特点。GaN可以由氯化镓与氨气(NH3)在一定条件下反应制得,同时生成氯化氢。该反应的化学方程式是________。
(2)铝合金和钛合金被广泛用于航天工业。
①一般情况下,铝合金的强度和硬度比纯铝的________(填“大”或“小”)。
②钛的金属活动性比铝弱,在工业上可利用置换反应制取金属钛,此反应的化学方程式为:_____
(3)钢铁是基本的结构材料。某化学实验小组利用下图所示装置模拟炼铁过程,并测定某赤铁矿中氧化铁的质量分数(赤铁矿中的杂质不参加反应)
①A装置玻璃管里可观察到的现象为________。
②写出B装置中发生反应的化学方程式________。
③如果没有C装置,会导致测定结果________(填“偏大”、“偏小”或“不变”)。
④实验前称量赤铁矿的质量为10g,通入足量的一氧化碳完全反应后B装置的总质量增加了6.6g,求该赤铁矿中氧化铁的质量分数。______
18.金属材料目前在人类的生产生活中有非常广泛的应用
(一)铁的有关知识
I.人类使用金属经历了青铜、铁器时代,近代才开始大量使用铝材料,这反映出铜、铁、铝这三种金属的活动性由强到弱的顺序是______。
II.工业炼铁多采用赤铁矿、磁铁矿等,以磁铁矿为原料炼铁的化学方程式为____;炼铁一般不采用黄铁矿(FeS2)的原因可能是①黄铁矿含铁量相对低;②________。
III.钢铁材料通常分为生铁和钢,这两种铁合金的主要区别就在于_____,写出成语“百炼成钢”中发生反应的化学方程式________。
(二)金属镁及其化合物的探究
【发现问题】镁是一种银白色有金属光泽的金属。但拿出的镁条总是有一层灰黑色的“外衣",这层灰黑色的外衣是什么物质呢
【查阅资料】(1)Mg(OH)2:白色固体,难溶于水,受热会分解成氧化镁和水;
(2)MgCO3: 白色固体,微溶于水,受热会分解成氧化镁和二氧化碳;
(3)MgCO3的热稳定性比Mg(OH)2的热稳定性更强。
【提出猜想】
小组同学认为该固体不可能是MgO、Mg(OH)2或MgCO3,他们的理由是______;小组同学由铜生锈会产生Cu2(OH)2CO3联想到灰黑色的物质可能是Mg2(OH)2CO3。
【实验分析】
按如图所示装置进行实验,发现试管口有小水滴出现,说明反应产生了______;澄清石灰水变浑浊;同时灰黑色固体完全变为白色。若灰黑色固体是 Mg2(OH)2CO3,请写出Mg2(OH)2CO3受热分解的化学方程式__________。
【组成测定】
工业生产中得到的碱式碳酸镁晶体是xMgCO3 yMg(OH)2 zH2O,为精确测量晶体的组成,小组同学取4.66g该晶体,用热分析仪对固体进行热分解(加热使之逐步分解,首先失去结晶水,然后依次分解,最后完全反应),测定剩余固体质量与分解温度之间关系。
【数据处理】剩余固体质量与加热时间关系如图所示:
请回答下列问题:
(1)0~t1固体质量没有发生变化的原因可能是_____________。
(2)晶体中结晶水的质量为______g。
(3)t3~t4段发生反应的化学方程式为______
(4)t4~t5段固体为______和MgO(写化学式)。
(5)根据图中数据推算xMgCO3 yMg(OH)2 zH2O中x∶y∶z的最简比= ______。
19.化学是以实验为基础的科学。
(1)如图,将注射器中的溶液缓缓推入V形管,反应的化学方程式为______;用80℃的热水加热盛有红磷和白磷的W形管时,发现白磷燃烧而红磷不燃烧,由此可说明燃烧需要的条件是______。
(2)请根据下列各图中有关信息回答问题:
①从图一A到E中选择实验室制取二氧化碳的装置______(填标号);若将其改为图三的发生装置,与原装置相比,其优点是______;若将其改为如图二的收集装置,气体应从______(填“c”或“d”)端通入。
②写出用A装置制取氧气的化学方程式______;酒精灯内酒精完全燃烧的化学方程式______。
(3)某炼铁厂要得到2240t铁,请你根据化学方程式计算:理论上需要含氧化铁80%的赤铁矿的质量是多少?
20.实验室用氧化铁粉末模拟炼铁,装置如图所示。
(1)实验时,先通CO再加热的目的是______。
(2)①硬质玻璃管中观察到的实验现象是______。
②B装置的作用是______。(已知:氢氧化钠、碳酸钠易溶于水,2NaOH+CO2=Na2CO3+H2O)
(3)某同学用以下两组实验对模拟炼铁进行进一步探究。
完全反应后,两组生成物均为黑色粉末(纯净物),分别用两组生成物进行如下实验:
步骤 实验操作 甲组 乙组
1 称量黑色粉末的质量 m1 m2
2 取黑色粉末,用磁铁吸引 能被吸引 能被吸引
3 取黑色粉末,加入稀盐酸 固体全部溶解,有大量气泡 固体不溶解,无气泡产生
4 取黑色粉末,加入足量硫酸铜溶液 有红色物质析出 无红色物质析出
①兴趣小组通过甲、乙两组实验,证明______对CO与Fe2O3反应的产物有影响。
②甲组所得黑色粉末与稀盐酸反应的化学方程式为______。
③查阅资料发现:常温下Fe3O4不与稀盐酸或硫酸铜溶液反应。某同学猜想乙组的生成物为Fe3O4。该同学称量黑色粉末m2=______g,证实了自己的猜想。
(4)某钢铁厂采用赤铁矿(主要成分为Fe2O3)炼铁,日产含铁1.4×104t的生铁,至少需要含Fe2O380%的赤铁矿的质量是多少?______(写出计算过程)
21.(1)下图装置可做一氧化碳还原氧化铁的实验,并检验生成的气体产物。
①B装置玻璃管里可观察到的现象是___________;写出B装置内发生反应的化学方程式___________。
②C装置中反应的化学方程式为___________。
(2)实验室利用如图装置可制取干燥的氧气。
①A中发生反应的的化学方程式为___________。
②试剂X为___________。
③若用C装置收集氧气,请将C装置中导管补画完整___________。
(3)取12.5g石灰石于装置A中,向其中加入100g足量的稀盐酸,充分反应后(杂质不参加反应),A中固液混合物的质量为108.1g,请计算该石灰石中碳酸钙的质量分数___________。
22.用如图装置测定氧化铁和铁的混合物中各成分的质量。小明同学取该混合物mg,放入硬质玻璃管中,通入CO一段时间后加热玻璃管,充分反应后,熄灭酒精喷灯,冷却至室温。已知由一氧化碳发生装置得到的CO中混有杂质CO2和H2O。回答下列问题:
(1)写出B装置玻璃管内反应的化学方程式______。
(2)若测得实验前后B中玻璃管内固体质量减少ng,则样品中氧化铁的质量分数为______(用含m、n的代数式表示)
(3)从环保角度看,此实验装置存在的缺陷是______。
小华同学用另一实验方案测定混合物中铁的质量分数,实验流程如下图所示:
(4)用浓盐酸配置实验中需要的稀盐酸,需要用到的仪器有量筒、烧杯______。
(5)根据小华同学的实验数据,计算混合物中铁的质量分数为______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.B
3.D
4.B
5.C
6.C
7.D
8.D
9.C
10.B
11.A
12.A
13.D
14.A
15.B
16.B
17. D 大 AlCl3 红色固体逐渐变黑色 偏大 设氧化铁的质量为
该赤铁矿中氧化铁的质量分数=
答:该赤铁矿中氧化铁的质量分数80%。
18. 铝〉铁〉铜 黄铁矿炼铁过程中生成有毒的SO2 含碳量不同 MgO、Mg(OH)2或MgCO3均为白色固体,镁条外面是灰黑色 水 温度没有达到分解所需的最低温度 0.72g MgCO3 4:1:4
19.(1) 需要达到可燃物的着火点
(2) BD 控制反应的发生和停止 c
(3)解:设需要赤铁矿的质量为x
答:需要赤铁矿4000t。
20. 将装置内空气排尽,防止发生爆炸 红棕色固体变黑 吸收二氧化碳、收集一氧化碳 温度 4.64 解:设至少需要含Fe2O380%的赤铁矿的质量是x
x=2.5×104t
答:至少需要含Fe2O380%的赤铁矿的质量是2.5×104t。
21. 固体由红棕色逐渐变为黑色 浓硫酸 解:根据质量守恒定律
设石灰石中碳酸钙的质量分数为x
x=80%
答:石灰石中碳酸钙的质量分数为80%。
22. 3CO+Fe2O32Fe+3CO2 没有处理尾气,CO污染空气 胶头滴管、玻璃棒 56%
答案第1页,共2页
答案第1页,共2页
