科粤版九年级化学下册6.4珍惜和保护金属资源同步练习(word版有答案)
文档属性
| 名称 | 科粤版九年级化学下册6.4珍惜和保护金属资源同步练习(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 206.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-25 16:57:00 | ||
图片预览



文档简介
科粤版九年级化学下册 6.4 珍惜和保护金属资源 同步练习
一、单选题
1.下列措施中,不能防止铁制品锈蚀的是( )
A.喷漆
B.镀一层耐腐蚀的金属
C.制成不锈钢
D.存放在潮湿的空气中
2.下列关于资源、能源的说法正确的是
A.回收废旧金属,可节约金属资源,减少对环境的污染
B.可利用的淡水资源取之不尽用之不竭
C.发现家中天然气或者液化气泄漏时,应先开灯检查
D.煤、石油、天然气、沼气都是可再生的能源
3.下列关于金属资源的说法中,不正确的是( )
A.地球上的金属资源是取之不尽的
B.回收利用废旧金属既可以保护环境,又能节约资源和能源
C.合理开采矿藏是保护金属资源的有效途径
D.寻找金属的代用品也是保护金属资源的有效途径
4.化学反应往往需要在一定的条件下进行.通过控制或改变反应条件可以加快、减缓甚至组织反应的行.下列所反映的措施中,能加快其化学反应速率的是
A.铁门表面喷漆
B.冰箱保存食物
C.用扇子扇煤炉火,火会更旺
D.将木头电线杆埋入地下的部分用火微微烧焦
5.为了探究影响铜生锈的因素,设计如下实验,有关分析正确的是
实验① 实验② 实验③ 实验④
铜生锈 无明显现象 无明显现象 无明显现象
A.对比实验①和②可知:影响铜生锈的因素是CO2和H2O
B.对比实验①和③可知:影响铜生锈的因素是H2O和O2
C.对比实验①和④可知:影响铜生锈的因素是CO2和O2
D.此实验设计运用了控制变量的方法
6.下列关于金属材料的说法中,不正确的是
A.生铁、硬铝、焊锡都属于合金
B.铜有良好的导电性,因而大量用于制作电线
C.铝表面易生成致密氧化铝薄膜,因而具有良好的抗腐蚀性
D.锈蚀后的铁制品没有回收价值
7.下列有关金属材料的说法错误的是
A.在潮湿的空气中铁易生锈
B.金属的回收利用是保护金属资源的有效途径之一
C.铝和金都有很好的抗腐蚀性,是因为二者的化学性质都很稳定
D.高炉炼铁的原理是在高温条件下,用一氧化碳把铁从铁矿石里还原出来
8.线上学习,居家实验。小明用三枚洁净无锈的铁钉,设计如右图所示实验,探究铁生锈的条件。下列说法错误的是
A.乙试管中植物油的作用是隔绝空气
B.只有甲试管中的铁钉有明显锈迹
C.乙丙两支试管的实验现象说明铁生锈需要水
D.实验表明铁生锈是铁与空气和水共同作用的结果
9.中国南车株洲时代集团生产的油电双动力公交车因省油、环保而在全国推广,双动力公交车制造需要大量使用金属材料。下列有关金属材料的说法正确的是
A.金属材料中一定不含有非金属元素
B.多数合金的抗腐蚀性能比组成它们的纯金属更好
C.双动力公交车所有部件都是由金属材料制造的
D.地球上的金属资源是取之不尽、用之不竭的
10.金属是重要的资源.下列有关金属制备的说法错误的是( )
A.“湿法炼铜”的化学原理可以表示为:Fe+CuSO4═FeSO4+Cu
B.电解氯化镁可以制备金属镁,该反应为分解反应
C.工业上用一氧化碳还原氧化铁制备铁,该反应属于置换反应
D.金矿中的金是以单质形式存在,用物理方法可以制得
11.据探测卫星发回的数据分析,火星大气中95%是二氧化碳,其余为少量的氮气.氢气,还找到了有液态水存在的证据。根据以上信息,某同学作出如下推断:①火星大气是混合物②火星大气与地球大气成分相似③火星上钢铁不容易生锈 ④火星环境适宜人类生存⑤火星上温室效应显著。你认为正确的是
A.①③⑤ B.②③⑤ C.②③④ D.①④⑤
12.按下图装置进行实验,一周后发现铁钉锈蚀最严重的位置是
A.a处 B.b处 C.c处 D.三处同样严重
13.下列措施中,不宜用于博物馆保存枪支大炮等铁质文物的是
A.定期用湿布擦拭铁制文物 B.提醒观众不要用手触摸文物
C.保持文物储存室内空气的干燥 D.在铁制文物表面涂抹一层保护物质
14.“垃圾是放错了位置的资源”,应该分类回收。生活中废弃的铁锅,铝制易拉罐、铜导线,可归为同一类回收,它们属于
A.金属或合金 B.氧化物 C.矿石 D.有机物
15.下列措施有利于防止铁制品锈蚀的是( )
A.农具上铁锈不及时除去
B.切过酸菜的菜刀不及时清洗
C.工地上的钢管堆放在潮湿的地方
D.家用剪刀不用时,涂上油并放在干燥处
16.建国以来,中国航运经济取得迅猛发展,现在已成为航运大国,正向航运强国迈进。为保证船舶的使用寿命,船舶要进行防锈处理,下列防锈措施不可行的是
A.刷防锈漆
B.用抗锈蚀性能优异的合金制造船舶的零部件
C.给某些部位涂油
D.船体表面镀一层黄金
二、综合应用题
17.掌握科学的研究方法,探索化学世界的奥秘。
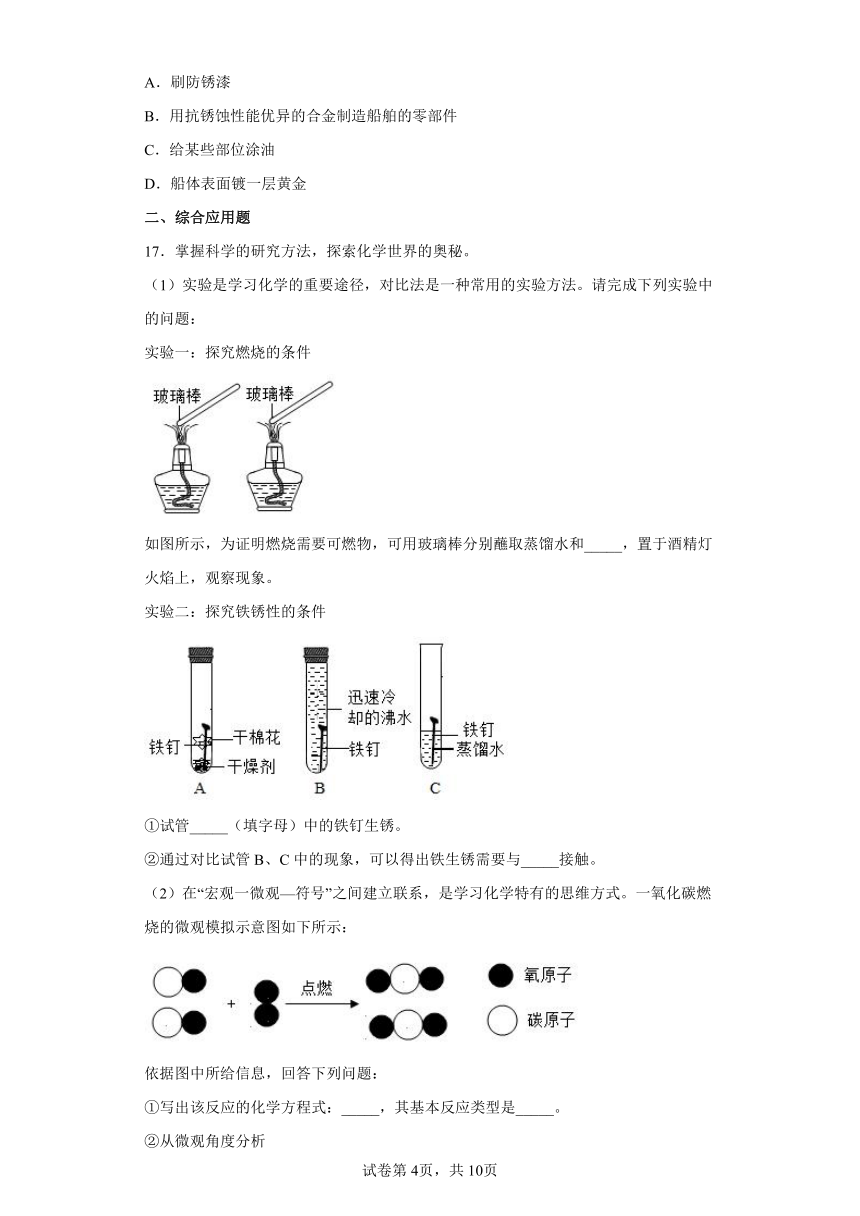
(1)实验是学习化学的重要途径,对比法是一种常用的实验方法。请完成下列实验中的问题:
实验一:探究燃烧的条件
如图所示,为证明燃烧需要可燃物,可用玻璃棒分别蘸取蒸馏水和_____,置于酒精灯火焰上,观察现象。
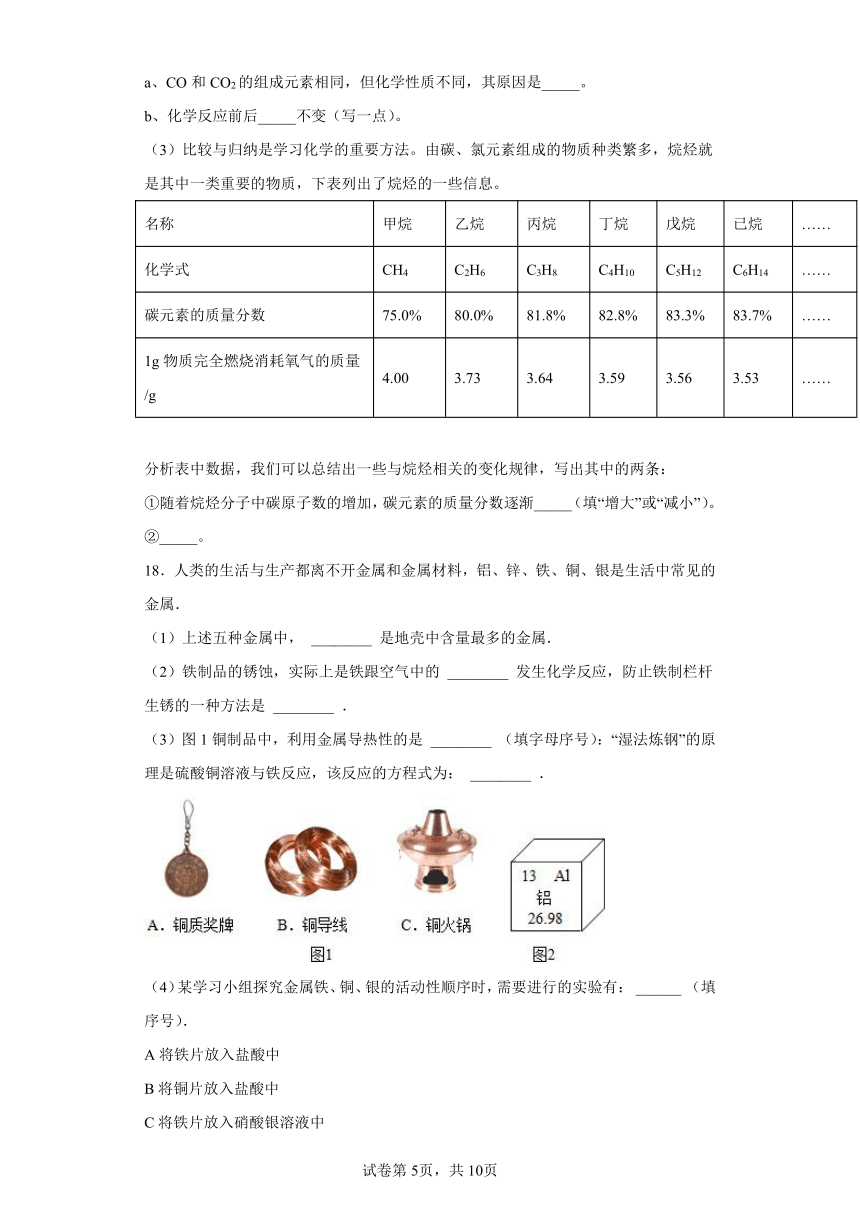
实验二:探究铁锈性的条件
①试管_____(填字母)中的铁钉生锈。
②通过对比试管B、C中的现象,可以得出铁生锈需要与_____接触。
(2)在“宏观一微观—符号”之间建立联系,是学习化学特有的思维方式。一氧化碳燃烧的微观模拟示意图如下所示:
依据图中所给信息,回答下列问题:
①写出该反应的化学方程式:_____,其基本反应类型是_____。
②从微观角度分析
a、CO和CO2的组成元素相同,但化学性质不同,其原因是_____。
b、化学反应前后_____不变(写一点)。
(3)比较与归纳是学习化学的重要方法。由碳、氯元素组成的物质种类繁多,烷烃就是其中一类重要的物质,下表列出了烷烃的一些信息。
名称 甲烷 乙烷 丙烷 丁烷 戊烷 已烷 ……
化学式 CH4 C2H6 C3H8 C4H10 C5H12 C6H14 ……
碳元素的质量分数 75.0% 80.0% 81.8% 82.8% 83.3% 83.7% ……
1g物质完全燃烧消耗氧气的质量/g 4.00 3.73 3.64 3.59 3.56 3.53 ……
分析表中数据,我们可以总结出一些与烷烃相关的变化规律,写出其中的两条:
①随着烷烃分子中碳原子数的增加,碳元素的质量分数逐渐_____(填“增大”或“减小”)。
②_____。
18.人类的生活与生产都离不开金属和金属材料,铝、锌、铁、铜、银是生活中常见的金属.
(1)上述五种金属中, ________ 是地壳中含量最多的金属.
(2)铁制品的锈蚀,实际上是铁跟空气中的 ________ 发生化学反应,防止铁制栏杆生锈的一种方法是 ________ .
(3)图1铜制品中,利用金属导热性的是 ________ (填字母序号):“湿法炼钢”的原理是硫酸铜溶液与铁反应,该反应的方程式为: ________ .
(4)某学习小组探究金属铁、铜、银的活动性顺序时,需要进行的实验有: ______ (填序号).
A将铁片放入盐酸中
B将铜片放入盐酸中
C将铁片放入硝酸银溶液中
D将铜片放入硝酸银溶液中
(5)铝在元素周期表中的某些信息如图2所示,下列有关铝的说法不正确的是 ____ .
A核内质量数是13
B元素符号为
C相对原子质量为16.98g
D原子结构示意图为
(6)合金是生活中广泛使用的金属材料,黄铜是一种由铜和锌组成的合金,为了测定某黄铜样品中通的含量,取样品10g放入足量的稀硫酸中,充分反应后,收集到0.1g氢气,试计算该黄铜样品中通的质量分数 ________ .
19.化学兴趣小组同学参观了某钢铁公司。
I.大家对矿石选取、冶炼和炼钢的工艺流程(如图)、生铁和钢的区别等,有了全新的认识。
(1)钢铁是使用最多的金属材料。生铁和钢是含碳量不同的两种铁合金,其中生铁的含碳量______(填“大于”或“小于”)钢的含碳量。
(2)分析工艺流程,写出三脱装置中P发生反应的化学方程式__________。
(3)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中___________的作用(填一种仪器的名称)。
(4)在钢制成品表面“涂层”的目的是:防止钢制成品中的铁与空气中的________发生化学反应而生锈。
II.兴趣小组同学在化学实验室进行了有关铁的性质的一些基本实验。
(5)某同学收集一瓶氧气做A实验,在引燃的火柴快燃尽时将细铁丝插入集气瓶中,观察到剧烈燃烧、火星四射的现象,写出发生反应的化学方程式_________。
(6)若B中液体为硫酸铜溶液,观察到的现象是_________。
(7)钢铁的使用是人类文明和进步的重要标志。某钢铁公司用500t含氧化铁64%的赤铁矿石进行炼铁,计算这些矿石理论上能炼得铁多少吨________?(请利用化学方程式进行计算,并在答题纸上写出完整的计算过程)
20.2018年5月13日,我国首艘001A型国产航母开始海试,标志着我国在航海及军事领域取得重大突破。
(1)建造航母用到了钛合金,构成金属钛的粒子是___(填“原子”“分子”或“离子”),工业制钛有一种反应为:,X的化学式为___。
(2)航母外壳用涂料覆盖,是为了防止钢铁材料与___接触而锈蚀。
(3)请你用化学方程式表示出探究航母材料中铝、铜两种金属活动性强弱的方法___。
(4)康康为了探究航母中金属锌的化学性质,将一定量的锌粉加入到硝酸亚铁、硝酸银的混合溶液中,溶液最终变为无色。下列图像能表示对应变化关系的是___(填字母序号)。
(5)如图是工业炼铁示意图。
①炼铁的固体原料需经过粉碎,其目的是什么?_____。
②冶炼过程中焦炭的作用是什么?______。
③若要炼制含铁96%的生铁70t,则理论上需要含杂质20%的赤铁矿的质量是多少?_____。
21.人类文明与社会进步同金属材料关系密切。
(一)金属的广泛应用
(1)钢铁材料通常分为生铁和钢,这两种铁合金的主要区别就在于______,写出成语“百炼成钢”中发生反应的化学方程式______。
(2)高铁酸钾是新型净水剂,化学原理是:4K2FeO4+10H2O=4X+3O2+8KOH,X的化学式是______。
(二)金属的锈蚀及防护
(1)下列情况下铁制品最易生锈的是______(填序号)。
a.潮湿空气中 b.干燥空气中 c.部分浸入食盐水中
(2)铁生锈中存在下列转化:Fe(OH)2Fe(OH)3,该反应的化学方程式为______。
(三)铁锈组成分析测定
(1)铁锈中一定含Fe2O3 nH2O,可能含FeCO3(FeCO3和稀盐酸的反应与CaCO3相似)),在某铁锈样品中加稀盐酸,______(填现象),证明不含FeCO3。
(2)另取23.2g只含Fe2O3 nH2O的上述铁锈样品,按下图装置实验。
【查阅资料】
①浓硫酸具有吸水性,碱石灰能吸收水和二氧化碳气体。
②在110℃时,Fe2O3 nH2O完全分解为Fe2O3和H2O。
③500℃时Fe2O3才开始被还原,且温度不同时产物可能是Fe3O4、FeO(黑色)、Fe。
(3)向装置中加入铁锈样品前,须进行的操作是______。
(4)实验时,先通入CO的目的是______。
(5)当加热超过500℃时,观察到A中的现象是______。
(6)下表为加热至700℃时所测数据,下图为A中固体质量和加热温度关系图
反应前 反应后
装置B/g 100.0 107.2
装置C/g 80.0 84.4
回答下列问题
①Fe2O3 nH2O中n的值为______,图中m的值为______。
②若无装置D,则所测n的值______(填“偏大”、“偏小”或“不变”)
③700℃以上时,管内固体产物的化学式为______;
④该装置有一明显缺陷,如何改进______。
22.铁是生活中常用的金属,请你根据学习回答下列问题。
(1)金属元素在自然界中分布很广,铁的矿物主要有赤铁矿、磁铁矿、黄铁矿等,生产生活中常用金属矿物冶炼金属,而一般情况下,不选择黄铁矿(FeS2)来炼铁,原因之一是______,原因二是生成的二氧化硫会污染空气。
(2)冬天使用的“取暖片”中,发热剂的主要成分有铁粉、活性炭、氯化钠、水等,发热剂需接触到空气才会发热,原因是铁要与______等物质共同作用才会“生锈”。
(3)第一种新型材料纳米级Fe粉在空气中易自燃,它能用作高效催化剂。实验室采用还原法制备纳米级Fe粉,其流程如图所示:
①完成上述制作工艺II中发生置换反应的化学方程式(氮气不参与反应):______。
②在制备纳米级Fe粉的工艺流程中,通入N2的目的是______。
(4)为了研究炼铁的主要反应原理,某化学兴趣小组的同学用一氧化碳还原氧化铁做实验。装置如图所示。请回答下列问题:
①组装好仪器后,检查气密性并在玻璃管中装入红色氧化铁粉末后的实验操作顺序为______。
a、通一氧化碳并点燃处理尾气的酒精灯
b、点燃给硬质玻璃管加热的酒精喷灯
c、检验一氧化碳的纯度
②实验中硬质玻璃管内可以观察到的现象为:______。
③某学校研究性学习小组为了测定某炼铁厂生产出来的生铁(铁碳合金, 其中含碳量2~ 4.3%)是否达到要求,取来了一些生铁样品,并取稀盐酸400g,平均分成4份,进行实验,结果如下:
实验 1 2 3 4
稀盐酸的质量/g 100 100 100 100
加入样品的质量/g 3 6 9 12
生成的H2质量/g 0.1 0.2 0.25 m
Ⅰ、上表中的m的数值为______。
Ⅱ、试计算这种生铁样品中碳的质量分数并判断是否达到要求______。
Ⅲ、试计算第2次实验后所得溶液的溶质质量分数。______(Ⅱ、Ⅲ写出计算过程,计算结果保留小数点后一位)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.A
3.A
4.C
5.D
6.D
7.C
8.C
9.B
10.C
11.A
12.B
13.A
14.A
15.D
16.D
17. 酒精(其他合理答案均可) C O2(或空气) 化合反应 分子构成不同(其他合理答案均可) 原子种类(或原子数目)其他合理答案均可 增大 等质量的烷烃完全燃烧时,烷烃中碳元素质量分数越大,消耗氧气的质量越少(其他合理答案均可)
18. 铝 氧气、水 刷漆 C Fe+CuSO4=FeSO4+Cu ABD C 67.5%
19.(1)大于
(2)
(3)玻璃棒
(4)氧气和水
(5)
(6)铁钉表面有红色固体析出,溶液由蓝色变为浅绿色
(7)解:设这些矿石理论上能炼得铁的质量为x
x=224t
答:这些矿石理论上能炼得铁的质量为224t
20.(1) 原子 SO3
(2)空气中的水、氧气
(3)
(4)D
(5) 增大固体与气体的接触面积,加快反应速率 提供热量,生成一氧化碳还原剂 解:设需要该赤铁矿的质量为x。
x=120t
答:理论上需要含杂质20%的赤铁矿120t。
21. 含碳量的不同 C+O2CO2 Fe(OH)3 c 无气泡产生 检查装置的气密性 排装置中的空气,防止加热时发生爆炸 红棕色粉末变成黑色 4 14.4g 不变 FeO 加尾气处理装置(合理答案均给分)
22. 黄铁矿含铁量低 氧气、水 排尽空气,防止铁粉遇到氧气自燃(防止铁粉被氧化) cab 红色固体变为黑色 0.25 根据实验1,3g样品中加入100g稀盐酸,生成0.1g氢气,设生铁样品中铁的质量是x
解得x=2.8g;
碳元素的质量分数为:,所以不符合要求。 第2次实验中,6g样品中加入100g稀盐酸,生成0.2g氢气,由Ⅱ中可知3g样品含杂质为3g-2.8g=0.2g,则6g样品中含杂质0.4g;设溶液中氯化亚铁的质量是y
y=12.7g;
。
答:第二次实验后溶液中的溶质质量分数是12.0%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列措施中,不能防止铁制品锈蚀的是( )
A.喷漆
B.镀一层耐腐蚀的金属
C.制成不锈钢
D.存放在潮湿的空气中
2.下列关于资源、能源的说法正确的是
A.回收废旧金属,可节约金属资源,减少对环境的污染
B.可利用的淡水资源取之不尽用之不竭
C.发现家中天然气或者液化气泄漏时,应先开灯检查
D.煤、石油、天然气、沼气都是可再生的能源
3.下列关于金属资源的说法中,不正确的是( )
A.地球上的金属资源是取之不尽的
B.回收利用废旧金属既可以保护环境,又能节约资源和能源
C.合理开采矿藏是保护金属资源的有效途径
D.寻找金属的代用品也是保护金属资源的有效途径
4.化学反应往往需要在一定的条件下进行.通过控制或改变反应条件可以加快、减缓甚至组织反应的行.下列所反映的措施中,能加快其化学反应速率的是
A.铁门表面喷漆
B.冰箱保存食物
C.用扇子扇煤炉火,火会更旺
D.将木头电线杆埋入地下的部分用火微微烧焦
5.为了探究影响铜生锈的因素,设计如下实验,有关分析正确的是
实验① 实验② 实验③ 实验④
铜生锈 无明显现象 无明显现象 无明显现象
A.对比实验①和②可知:影响铜生锈的因素是CO2和H2O
B.对比实验①和③可知:影响铜生锈的因素是H2O和O2
C.对比实验①和④可知:影响铜生锈的因素是CO2和O2
D.此实验设计运用了控制变量的方法
6.下列关于金属材料的说法中,不正确的是
A.生铁、硬铝、焊锡都属于合金
B.铜有良好的导电性,因而大量用于制作电线
C.铝表面易生成致密氧化铝薄膜,因而具有良好的抗腐蚀性
D.锈蚀后的铁制品没有回收价值
7.下列有关金属材料的说法错误的是
A.在潮湿的空气中铁易生锈
B.金属的回收利用是保护金属资源的有效途径之一
C.铝和金都有很好的抗腐蚀性,是因为二者的化学性质都很稳定
D.高炉炼铁的原理是在高温条件下,用一氧化碳把铁从铁矿石里还原出来
8.线上学习,居家实验。小明用三枚洁净无锈的铁钉,设计如右图所示实验,探究铁生锈的条件。下列说法错误的是
A.乙试管中植物油的作用是隔绝空气
B.只有甲试管中的铁钉有明显锈迹
C.乙丙两支试管的实验现象说明铁生锈需要水
D.实验表明铁生锈是铁与空气和水共同作用的结果
9.中国南车株洲时代集团生产的油电双动力公交车因省油、环保而在全国推广,双动力公交车制造需要大量使用金属材料。下列有关金属材料的说法正确的是
A.金属材料中一定不含有非金属元素
B.多数合金的抗腐蚀性能比组成它们的纯金属更好
C.双动力公交车所有部件都是由金属材料制造的
D.地球上的金属资源是取之不尽、用之不竭的
10.金属是重要的资源.下列有关金属制备的说法错误的是( )
A.“湿法炼铜”的化学原理可以表示为:Fe+CuSO4═FeSO4+Cu
B.电解氯化镁可以制备金属镁,该反应为分解反应
C.工业上用一氧化碳还原氧化铁制备铁,该反应属于置换反应
D.金矿中的金是以单质形式存在,用物理方法可以制得
11.据探测卫星发回的数据分析,火星大气中95%是二氧化碳,其余为少量的氮气.氢气,还找到了有液态水存在的证据。根据以上信息,某同学作出如下推断:①火星大气是混合物②火星大气与地球大气成分相似③火星上钢铁不容易生锈 ④火星环境适宜人类生存⑤火星上温室效应显著。你认为正确的是
A.①③⑤ B.②③⑤ C.②③④ D.①④⑤
12.按下图装置进行实验,一周后发现铁钉锈蚀最严重的位置是
A.a处 B.b处 C.c处 D.三处同样严重
13.下列措施中,不宜用于博物馆保存枪支大炮等铁质文物的是
A.定期用湿布擦拭铁制文物 B.提醒观众不要用手触摸文物
C.保持文物储存室内空气的干燥 D.在铁制文物表面涂抹一层保护物质
14.“垃圾是放错了位置的资源”,应该分类回收。生活中废弃的铁锅,铝制易拉罐、铜导线,可归为同一类回收,它们属于
A.金属或合金 B.氧化物 C.矿石 D.有机物
15.下列措施有利于防止铁制品锈蚀的是( )
A.农具上铁锈不及时除去
B.切过酸菜的菜刀不及时清洗
C.工地上的钢管堆放在潮湿的地方
D.家用剪刀不用时,涂上油并放在干燥处
16.建国以来,中国航运经济取得迅猛发展,现在已成为航运大国,正向航运强国迈进。为保证船舶的使用寿命,船舶要进行防锈处理,下列防锈措施不可行的是
A.刷防锈漆
B.用抗锈蚀性能优异的合金制造船舶的零部件
C.给某些部位涂油
D.船体表面镀一层黄金
二、综合应用题
17.掌握科学的研究方法,探索化学世界的奥秘。
(1)实验是学习化学的重要途径,对比法是一种常用的实验方法。请完成下列实验中的问题:
实验一:探究燃烧的条件
如图所示,为证明燃烧需要可燃物,可用玻璃棒分别蘸取蒸馏水和_____,置于酒精灯火焰上,观察现象。
实验二:探究铁锈性的条件
①试管_____(填字母)中的铁钉生锈。
②通过对比试管B、C中的现象,可以得出铁生锈需要与_____接触。
(2)在“宏观一微观—符号”之间建立联系,是学习化学特有的思维方式。一氧化碳燃烧的微观模拟示意图如下所示:
依据图中所给信息,回答下列问题:
①写出该反应的化学方程式:_____,其基本反应类型是_____。
②从微观角度分析
a、CO和CO2的组成元素相同,但化学性质不同,其原因是_____。
b、化学反应前后_____不变(写一点)。
(3)比较与归纳是学习化学的重要方法。由碳、氯元素组成的物质种类繁多,烷烃就是其中一类重要的物质,下表列出了烷烃的一些信息。
名称 甲烷 乙烷 丙烷 丁烷 戊烷 已烷 ……
化学式 CH4 C2H6 C3H8 C4H10 C5H12 C6H14 ……
碳元素的质量分数 75.0% 80.0% 81.8% 82.8% 83.3% 83.7% ……
1g物质完全燃烧消耗氧气的质量/g 4.00 3.73 3.64 3.59 3.56 3.53 ……
分析表中数据,我们可以总结出一些与烷烃相关的变化规律,写出其中的两条:
①随着烷烃分子中碳原子数的增加,碳元素的质量分数逐渐_____(填“增大”或“减小”)。
②_____。
18.人类的生活与生产都离不开金属和金属材料,铝、锌、铁、铜、银是生活中常见的金属.
(1)上述五种金属中, ________ 是地壳中含量最多的金属.
(2)铁制品的锈蚀,实际上是铁跟空气中的 ________ 发生化学反应,防止铁制栏杆生锈的一种方法是 ________ .
(3)图1铜制品中,利用金属导热性的是 ________ (填字母序号):“湿法炼钢”的原理是硫酸铜溶液与铁反应,该反应的方程式为: ________ .
(4)某学习小组探究金属铁、铜、银的活动性顺序时,需要进行的实验有: ______ (填序号).
A将铁片放入盐酸中
B将铜片放入盐酸中
C将铁片放入硝酸银溶液中
D将铜片放入硝酸银溶液中
(5)铝在元素周期表中的某些信息如图2所示,下列有关铝的说法不正确的是 ____ .
A核内质量数是13
B元素符号为
C相对原子质量为16.98g
D原子结构示意图为
(6)合金是生活中广泛使用的金属材料,黄铜是一种由铜和锌组成的合金,为了测定某黄铜样品中通的含量,取样品10g放入足量的稀硫酸中,充分反应后,收集到0.1g氢气,试计算该黄铜样品中通的质量分数 ________ .
19.化学兴趣小组同学参观了某钢铁公司。
I.大家对矿石选取、冶炼和炼钢的工艺流程(如图)、生铁和钢的区别等,有了全新的认识。
(1)钢铁是使用最多的金属材料。生铁和钢是含碳量不同的两种铁合金,其中生铁的含碳量______(填“大于”或“小于”)钢的含碳量。
(2)分析工艺流程,写出三脱装置中P发生反应的化学方程式__________。
(3)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中___________的作用(填一种仪器的名称)。
(4)在钢制成品表面“涂层”的目的是:防止钢制成品中的铁与空气中的________发生化学反应而生锈。
II.兴趣小组同学在化学实验室进行了有关铁的性质的一些基本实验。
(5)某同学收集一瓶氧气做A实验,在引燃的火柴快燃尽时将细铁丝插入集气瓶中,观察到剧烈燃烧、火星四射的现象,写出发生反应的化学方程式_________。
(6)若B中液体为硫酸铜溶液,观察到的现象是_________。
(7)钢铁的使用是人类文明和进步的重要标志。某钢铁公司用500t含氧化铁64%的赤铁矿石进行炼铁,计算这些矿石理论上能炼得铁多少吨________?(请利用化学方程式进行计算,并在答题纸上写出完整的计算过程)
20.2018年5月13日,我国首艘001A型国产航母开始海试,标志着我国在航海及军事领域取得重大突破。
(1)建造航母用到了钛合金,构成金属钛的粒子是___(填“原子”“分子”或“离子”),工业制钛有一种反应为:,X的化学式为___。
(2)航母外壳用涂料覆盖,是为了防止钢铁材料与___接触而锈蚀。
(3)请你用化学方程式表示出探究航母材料中铝、铜两种金属活动性强弱的方法___。
(4)康康为了探究航母中金属锌的化学性质,将一定量的锌粉加入到硝酸亚铁、硝酸银的混合溶液中,溶液最终变为无色。下列图像能表示对应变化关系的是___(填字母序号)。
(5)如图是工业炼铁示意图。
①炼铁的固体原料需经过粉碎,其目的是什么?_____。
②冶炼过程中焦炭的作用是什么?______。
③若要炼制含铁96%的生铁70t,则理论上需要含杂质20%的赤铁矿的质量是多少?_____。
21.人类文明与社会进步同金属材料关系密切。
(一)金属的广泛应用
(1)钢铁材料通常分为生铁和钢,这两种铁合金的主要区别就在于______,写出成语“百炼成钢”中发生反应的化学方程式______。
(2)高铁酸钾是新型净水剂,化学原理是:4K2FeO4+10H2O=4X+3O2+8KOH,X的化学式是______。
(二)金属的锈蚀及防护
(1)下列情况下铁制品最易生锈的是______(填序号)。
a.潮湿空气中 b.干燥空气中 c.部分浸入食盐水中
(2)铁生锈中存在下列转化:Fe(OH)2Fe(OH)3,该反应的化学方程式为______。
(三)铁锈组成分析测定
(1)铁锈中一定含Fe2O3 nH2O,可能含FeCO3(FeCO3和稀盐酸的反应与CaCO3相似)),在某铁锈样品中加稀盐酸,______(填现象),证明不含FeCO3。
(2)另取23.2g只含Fe2O3 nH2O的上述铁锈样品,按下图装置实验。
【查阅资料】
①浓硫酸具有吸水性,碱石灰能吸收水和二氧化碳气体。
②在110℃时,Fe2O3 nH2O完全分解为Fe2O3和H2O。
③500℃时Fe2O3才开始被还原,且温度不同时产物可能是Fe3O4、FeO(黑色)、Fe。
(3)向装置中加入铁锈样品前,须进行的操作是______。
(4)实验时,先通入CO的目的是______。
(5)当加热超过500℃时,观察到A中的现象是______。
(6)下表为加热至700℃时所测数据,下图为A中固体质量和加热温度关系图
反应前 反应后
装置B/g 100.0 107.2
装置C/g 80.0 84.4
回答下列问题
①Fe2O3 nH2O中n的值为______,图中m的值为______。
②若无装置D,则所测n的值______(填“偏大”、“偏小”或“不变”)
③700℃以上时,管内固体产物的化学式为______;
④该装置有一明显缺陷,如何改进______。
22.铁是生活中常用的金属,请你根据学习回答下列问题。
(1)金属元素在自然界中分布很广,铁的矿物主要有赤铁矿、磁铁矿、黄铁矿等,生产生活中常用金属矿物冶炼金属,而一般情况下,不选择黄铁矿(FeS2)来炼铁,原因之一是______,原因二是生成的二氧化硫会污染空气。
(2)冬天使用的“取暖片”中,发热剂的主要成分有铁粉、活性炭、氯化钠、水等,发热剂需接触到空气才会发热,原因是铁要与______等物质共同作用才会“生锈”。
(3)第一种新型材料纳米级Fe粉在空气中易自燃,它能用作高效催化剂。实验室采用还原法制备纳米级Fe粉,其流程如图所示:
①完成上述制作工艺II中发生置换反应的化学方程式(氮气不参与反应):______。
②在制备纳米级Fe粉的工艺流程中,通入N2的目的是______。
(4)为了研究炼铁的主要反应原理,某化学兴趣小组的同学用一氧化碳还原氧化铁做实验。装置如图所示。请回答下列问题:
①组装好仪器后,检查气密性并在玻璃管中装入红色氧化铁粉末后的实验操作顺序为______。
a、通一氧化碳并点燃处理尾气的酒精灯
b、点燃给硬质玻璃管加热的酒精喷灯
c、检验一氧化碳的纯度
②实验中硬质玻璃管内可以观察到的现象为:______。
③某学校研究性学习小组为了测定某炼铁厂生产出来的生铁(铁碳合金, 其中含碳量2~ 4.3%)是否达到要求,取来了一些生铁样品,并取稀盐酸400g,平均分成4份,进行实验,结果如下:
实验 1 2 3 4
稀盐酸的质量/g 100 100 100 100
加入样品的质量/g 3 6 9 12
生成的H2质量/g 0.1 0.2 0.25 m
Ⅰ、上表中的m的数值为______。
Ⅱ、试计算这种生铁样品中碳的质量分数并判断是否达到要求______。
Ⅲ、试计算第2次实验后所得溶液的溶质质量分数。______(Ⅱ、Ⅲ写出计算过程,计算结果保留小数点后一位)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.A
3.A
4.C
5.D
6.D
7.C
8.C
9.B
10.C
11.A
12.B
13.A
14.A
15.D
16.D
17. 酒精(其他合理答案均可) C O2(或空气) 化合反应 分子构成不同(其他合理答案均可) 原子种类(或原子数目)其他合理答案均可 增大 等质量的烷烃完全燃烧时,烷烃中碳元素质量分数越大,消耗氧气的质量越少(其他合理答案均可)
18. 铝 氧气、水 刷漆 C Fe+CuSO4=FeSO4+Cu ABD C 67.5%
19.(1)大于
(2)
(3)玻璃棒
(4)氧气和水
(5)
(6)铁钉表面有红色固体析出,溶液由蓝色变为浅绿色
(7)解:设这些矿石理论上能炼得铁的质量为x
x=224t
答:这些矿石理论上能炼得铁的质量为224t
20.(1) 原子 SO3
(2)空气中的水、氧气
(3)
(4)D
(5) 增大固体与气体的接触面积,加快反应速率 提供热量,生成一氧化碳还原剂 解:设需要该赤铁矿的质量为x。
x=120t
答:理论上需要含杂质20%的赤铁矿120t。
21. 含碳量的不同 C+O2CO2 Fe(OH)3 c 无气泡产生 检查装置的气密性 排装置中的空气,防止加热时发生爆炸 红棕色粉末变成黑色 4 14.4g 不变 FeO 加尾气处理装置(合理答案均给分)
22. 黄铁矿含铁量低 氧气、水 排尽空气,防止铁粉遇到氧气自燃(防止铁粉被氧化) cab 红色固体变为黑色 0.25 根据实验1,3g样品中加入100g稀盐酸,生成0.1g氢气,设生铁样品中铁的质量是x
解得x=2.8g;
碳元素的质量分数为:,所以不符合要求。 第2次实验中,6g样品中加入100g稀盐酸,生成0.2g氢气,由Ⅱ中可知3g样品含杂质为3g-2.8g=0.2g,则6g样品中含杂质0.4g;设溶液中氯化亚铁的质量是y
y=12.7g;
。
答:第二次实验后溶液中的溶质质量分数是12.0%。
答案第1页,共2页
答案第1页,共2页
