科粤版九年级化学下册8.1溶液的酸碱性 同步练习(word版有答案)
文档属性
| 名称 | 科粤版九年级化学下册8.1溶液的酸碱性 同步练习(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 160.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-25 21:42:27 | ||
图片预览


文档简介
科粤版九年级化学下册 8.1 溶液的酸碱性
一、单选题
1.某同学用pH试纸测定未知溶液的pH时,他先用蒸馏水将pH试纸湿润,然后再测定,则他所测得的未知溶液pH将
A.偏大 B.偏小 C.无影响 D.无法确定
2.下列有关测定氢氧化钠溶液pH的实验操作或描述,你认为正确的是( )
A.用镊子夹取pH试纸直接伸入氢氧化钠溶液中测量
B.先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测量
C.用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照
D.用pH试纸测得该氢氧化钠溶液的
3.一些食物的近似pH如下:
食物 葡萄汁 苹果汁 牛奶 鸡蛋清
pH 3.5~4.5 2.9~3.3 6.3~6.6 7.6~8.0
下列说法中不正确的是A.鸡蛋清和牛奶显碱性 B.苹果汁和葡萄汁显酸性
C.苹果汁比葡萄汁的酸性强 D.胃酸过多的人应少饮苹果汁和葡萄汁
4.一些食物的近似pH如表所示,下列说法正确的是
食物 苹果汁 西瓜汁 牛奶 鸡蛋清
pH 2.9 5.8 6.4 7.6
A.牛奶放置一段时间后变酸,pH变大
B.西瓜汁比苹果汁酸性强
C.鸡蛋清和牛奶都显碱性
D.胃酸过多的人应该少饮苹果汁
5.常温下,下列物质水溶液的pH<7的是
A.KOH B.草木灰 C.生石灰 D.醋酸
6.【2017年山东省青岛市】下表列出了一些常见物质在常温下的 pH 范围, 其中呈碱性的是
物质名称 鸡蛋清 牛奶 西红柿 柠檬汁
pH 范围 7.6~8.0 6.3~6.6 4.0~4.4 2.0~3.0
A.鸡蛋清 B.牛奶 C.西红柿 D.柠檬汁
7.归纳推理是学习化学的一种重要的思维方法,下列归纳推理正确的是( )
A.化合物是由多种元素组成的,则由多种元素组成的物质一定是化合物
B.锌粒和稀硫酸反应会产生氢气,则所以金属都能和稀硫酸反应产生氢气
C.置换反应有单质生成,则有单质生成的反应一定是置换反应
D.常温下,pH大于7的溶液呈碱性,则碱性溶液的pH一定大于7
8.下列清洁用品中碱性最强的是
A.厕所清洁剂pH=1 B.牙膏pH=8 C.肥皂pH=10 D.炉具清洁剂pH=13
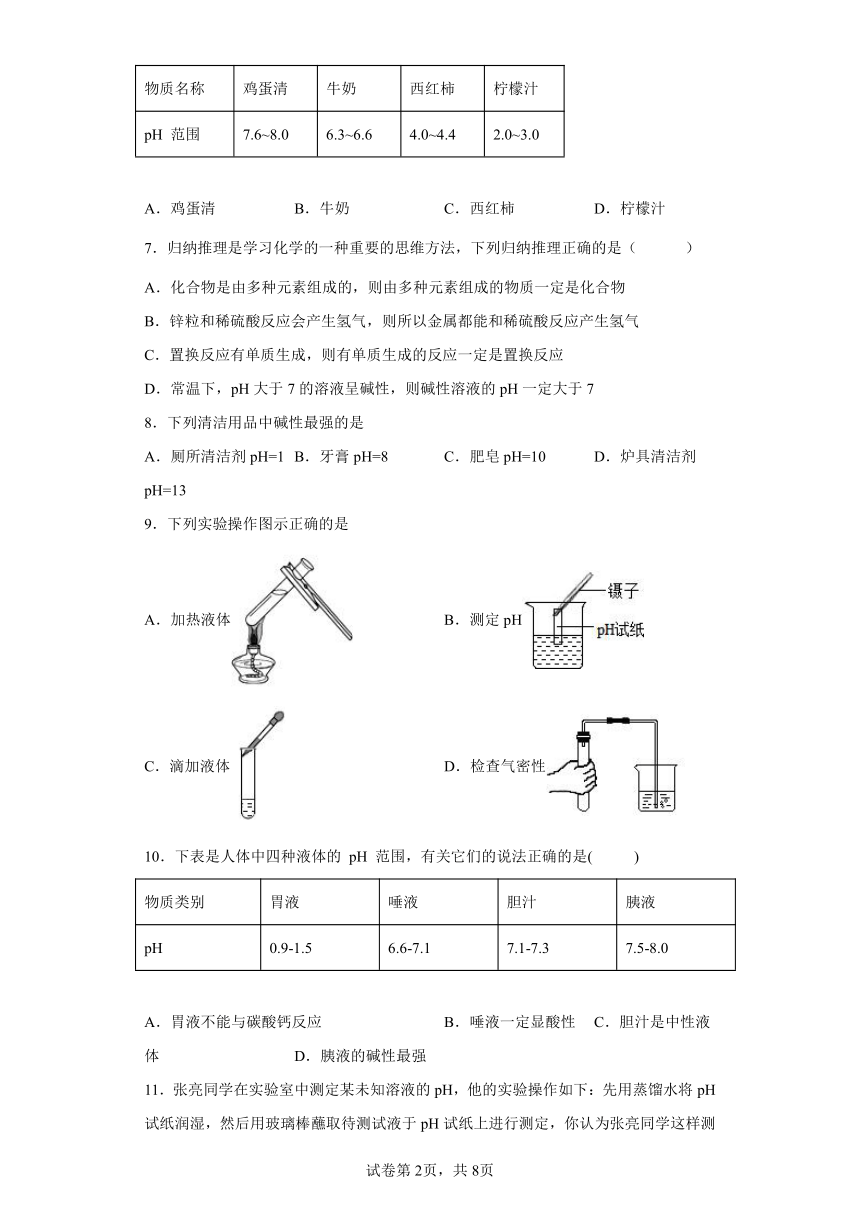
9.下列实验操作图示正确的是
A.加热液体 B.测定pH
C.滴加液体 D.检查气密性
10.下表是人体中四种液体的 pH 范围,有关它们的说法正确的是( )
物质类别 胃液 唾液 胆汁 胰液
pH 0.9-1.5 6.6-7.1 7.1-7.3 7.5-8.0
A.胃液不能与碳酸钙反应 B.唾液一定显酸性 C.胆汁是中性液体 D.胰液的碱性最强
11.张亮同学在实验室中测定某未知溶液的pH,他的实验操作如下:先用蒸馏水将pH试纸润湿,然后用玻璃棒蘸取待测试液于pH试纸上进行测定,你认为张亮同学这样测得的结果与该溶液的实际pH比较
A.不变 B.偏低 C.偏高 D.无法判断
12.下列食物的pH如下:苹果汁(2.9~3.3)、葡萄汁(3.5~4.5)、牛奶(6.3~6.6)、鸡蛋清(7.6~8.0),其中胃酸过多的人最适合吃
A.牛奶 B.鸡蛋清 C.葡萄汁 D.苹果汁
13.下列溶液显碱性的是( )
A.酸雨 B.食醋 C.NaOH溶液 D.盐酸
14.常温下,一些饮料或食物的近似pH如下:
食物 柠檬汁 橙子汁 西瓜汁 鸡蛋清
pH 2.2~2.4 3.6~4.3 5.3~6.1 7.6~8.0
下列说法中正确的是( )A.胃酸过多的人应多喝柠檬汁
B.西瓜汁和鸡蛋清显碱性
C.西瓜汁比柠檬汁酸性强
D.柠檬汁和橙子汁显酸性
15.下列物质呈碱性的是
A.血液,pH为7.35~7.45 B.胃液,pH为0.8~1.5
C.牛奶,pH为6.3~6.6 D.苹果汁,pH为2.9~3.3
16.用pH试纸测溶液的pH,是今年我市化学实验操作考查的题目之一,下列有关pH试纸的使用说法正确的是
A.把pH试纸浸入待测液 B.用湿润的玻璃棒蘸取待测液
C.把显色的pH试纸与标准比色卡对照读数 D.测出石灰水的pH为12.4
二、综合应用题
17.化学是以实验为基础的科学,科学探究是学习化学的重要手段。
(1)写出图中不能用于直接加热的仪器名称__________。
(2)了解溶液的酸碱性,对于生活、生产以及人类的生命活动具有重要的意义。
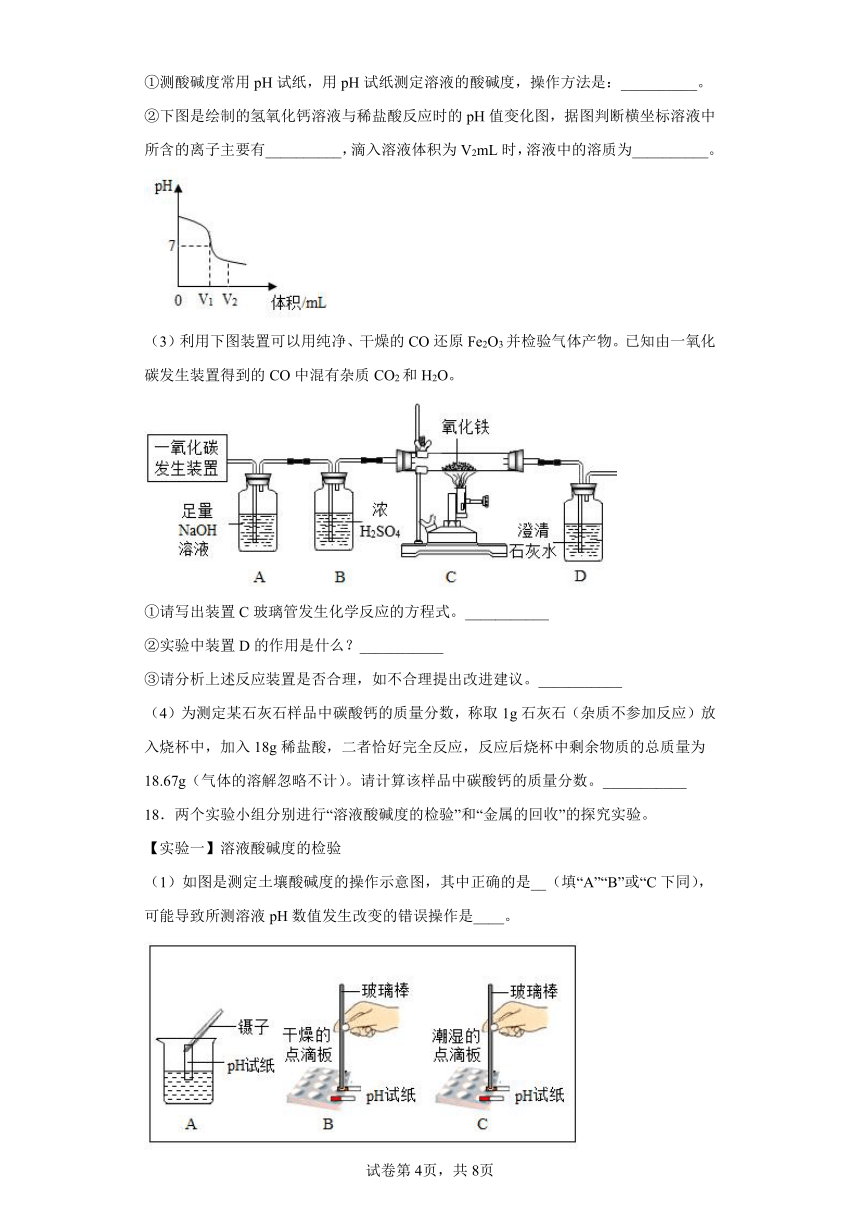
①测酸碱度常用pH试纸,用pH试纸测定溶液的酸碱度,操作方法是:__________。
②下图是绘制的氢氧化钙溶液与稀盐酸反应时的pH值变化图,据图判断横坐标溶液中所含的离子主要有__________,滴入溶液体积为V2mL时,溶液中的溶质为__________。
(3)利用下图装置可以用纯净、干燥的CO还原Fe2O3并检验气体产物。已知由一氧化碳发生装置得到的CO中混有杂质CO2和H2O。
①请写出装置C玻璃管发生化学反应的方程式。___________
②实验中装置D的作用是什么?___________
③请分析上述反应装置是否合理,如不合理提出改进建议。___________
(4)为测定某石灰石样品中碳酸钙的质量分数,称取1g石灰石(杂质不参加反应)放入烧杯中,加入18g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质的总质量为18.67g(气体的溶解忽略不计)。请计算该样品中碳酸钙的质量分数。___________
18.两个实验小组分别进行“溶液酸碱度的检验”和“金属的回收”的探究实验。
【实验一】溶液酸碱度的检验
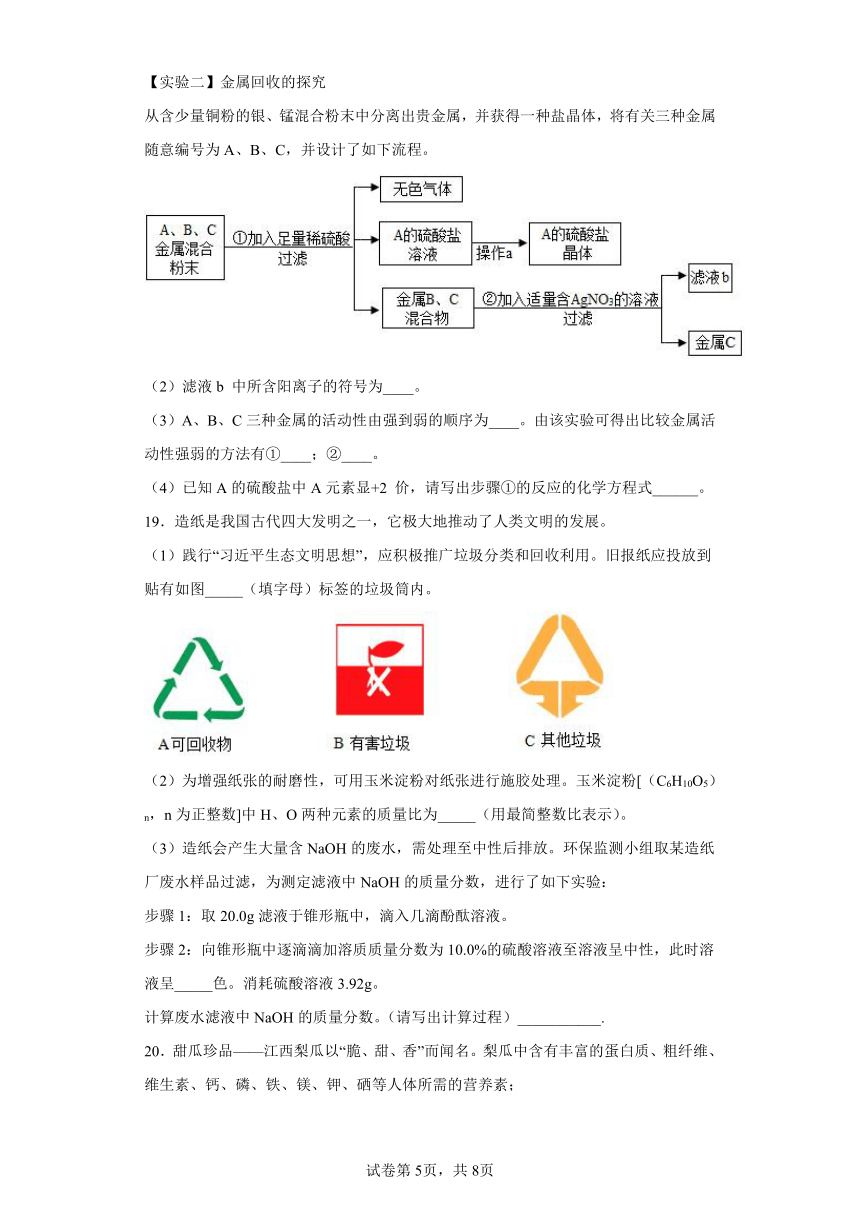
(1)如图是测定土壤酸碱度的操作示意图,其中正确的是__(填“A”“B”或“C下同),可能导致所测溶液pH数值发生改变的错误操作是____。
【实验二】金属回收的探究
从含少量铜粉的银、锰混合粉末中分离出贵金属,并获得一种盐晶体,将有关三种金属随意编号为A、B、C,并设计了如下流程。
(2)滤液b 中所含阳离子的符号为____。
(3)A、B、C三种金属的活动性由强到弱的顺序为____。由该实验可得出比较金属活动性强弱的方法有①____;②____。
(4)已知A的硫酸盐中A元素显+2 价,请写出步骤①的反应的化学方程式______。
19.造纸是我国古代四大发明之一,它极大地推动了人类文明的发展。
(1)践行“习近平生态文明思想”,应积极推广垃圾分类和回收利用。旧报纸应投放到贴有如图_____(填字母)标签的垃圾筒内。
(2)为增强纸张的耐磨性,可用玉米淀粉对纸张进行施胶处理。玉米淀粉[(C6H10O5)n,n为正整数]中H、O两种元素的质量比为_____(用最简整数比表示)。
(3)造纸会产生大量含NaOH的废水,需处理至中性后排放。环保监测小组取某造纸厂废水样品过滤,为测定滤液中NaOH的质量分数,进行了如下实验:
步骤1:取20.0g滤液于锥形瓶中,滴入几滴酚酞溶液。
步骤2:向锥形瓶中逐滴滴加溶质质量分数为10.0%的硫酸溶液至溶液呈中性,此时溶液呈_____色。消耗硫酸溶液3.92g。
计算废水滤液中NaOH的质量分数。(请写出计算过程)___________.
20.甜瓜珍品——江西梨瓜以“脆、甜、香”而闻名。梨瓜中含有丰富的蛋白质、粗纤维、维生素、钙、磷、铁、镁、钾、硒等人体所需的营养素;
(1)梨瓜贮存时常套一个塑料袋,其作用是阻止梨瓜中水分流失,还能隔绝_______防止腐烂;
(2)梨瓜适宜生长在pH为6.0-6.8的土壤中,实验室测定溶液pH的操作方法是_______________;
(3)如图为硒元素的某些信息,硒原子核内有_______个质子,硒原子的相对原子质量是_____,硒原子在化学反应中易_______(填“得到”或“失去”)电子。
21.生活中常见物质的性质、制法等是化学研究的重要内容。
(1)在生活中为了得到软水经常需要除去硬水中过多的______。
A.Mg2+、Ca2+ B.Na+、Ca2+ C.Mg2+、Al3+ D.Al3+、Na+
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示。
①根据图示判断,该实验是将______(填“氢氧化钠” 或“盐酸”)滴加到另一种溶液中。
②p点所示溶液中溶质为______。
(3)实验室可利用下图系列装置制取纯净、干燥的CO,然后用CO还原Fe2O3并检验气体产物。
①A装置中能观察到什么现象?______。
②写出B装置中反应的化学方程式______。
③要达到实验目的,装置中导管接口从左到右的连接顺序为:一氧化碳发生装置接______、______接______、______接______、______接______。
④从环保角度考虑,还需对以上装置进行改进,请简述改进措施______。
(4)工业上可利用“铝热反应”焊接钢轨、冶炼难熔金属等,其原理是在高温下用铝将这些金属从其氧化物中置换出来,若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少?
22.以菱锌矿(主要成分是 ZnCO3,杂质为 Fe2O3、FeO、CuO)为原料制备七水硫酸锌(ZnSO4 7H2O),同时得到铁红副产品,其工艺流程如图,回答下列问题:
(1)若实验室用质量分数为 98%的硫酸配制 200g 质量分数为 24.5%的稀硫酸,需要水( 密度 1g/mL)的体积为______mL,需要用到的玻璃仪器有胶头滴管、玻璃棒、烧杯和 ______。
(2) 物质 X 是______ 确定除铜完成的实验现象是______。
(3)“氧化”中加入 H2O2的目的是在硫酸的作用下将溶液中的 FeSO4转化成 Fe2(SO4)3, 反应的化学方程式:______。
(4)除铁过程中,反应温度、溶液 pH 对除铁效果均有影响,为探究除铁的最佳效果,某同学做了以下的实验并记录了相关数据,请回答问题:
编号 反应温度/℃ 溶液 pH 除铁率/%
a 30 2 91.5
b 30 2.5 93.3
c 40 2.5 95.1
d 40 3.1 Y
e 50 3.1 99.5
①实验______对比,得到的结论为其他条件不变时,反应温度增大,除铁率提高。
②实验 a 和实验 b 对比,得到结论是______。
③最佳的除铁条件为反应温度______℃,溶液 pH______。
(5)流程中获得七水硫酸锌前省略的操作是______ 、冷却结晶、过滤、洗涤和低温烘干;洗涤经常选用 95%的乙醇,优点是______(填一个答案);烘干操作需在低温条件下进行,其原因是______。
(6)取 28.70g ZnSO4 7H2O 加热至不同温度,剩余固体的质量变化如图所示。
ZnSO4 7H2O 加热到 100℃时所得固体的化学式为是______(写出计算过程)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.A
4.D
5.D
6.A
7.D
8.D
9.D
10.D
11.D
12.B
13.C
14.D
15.A
16.C
17. 烧杯 用玻璃棒蘸取待测液滴在pH试纸上,将显示的颜色与标准比色卡对比,即可得到溶液的pH值 H+和Cl- 氯化钙和氯化氢(或CaCl2和HCl) 吸收并证明反应后生成有二氧化碳(合理即可) 不合理,应加装反应后尾气收集或点燃装置(合理即可) 75%
18. B C Cu2+ A>B>C 利用金属和酸的反应判断金属活动性 利用金属和盐溶液的反应判断金属活动性 Mn+H2SO4═MnSO4+H2↑
19. A 1:8 酚酞遇碱变红色,氢氧化钠和硫酸反应生成硫酸钠和水,所以向锥形瓶中逐滴滴加溶质质量分数为10.0%的硫酸溶液至溶液呈中性,此时溶液呈无色; 1.6%
20. 氧气 用玻璃棒蘸取待测液,滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出溶液的pH 34 78.96 得到
21.(1)A
(2) 氢氧化钠 氢氧化钠、氯化钠(或NaOH、NaCl)
(3) 氢氧化钙溶液变浑浊 h
g
e
f
c(或d)
d(或c)
b
在A装置后增加一个尾气处理的装置(合理即可)
(4)10.8kg
解:制取25.2kg铁,理论上需要消耗铝的质量是x,
答:制取25.2kg铁,理论上需要消耗铝的质量是10.8kg。
22. 150mL 量筒 锌 溶液由蓝色变成无色 bc 其他条件不变时,溶液pH越大,除铁率越高 50℃ 3.1 蒸发浓缩 便于干燥或减少晶体溶解损失 防止晶体失去结晶水或防止晶体受热分解
所以化学式为:ZnSO4 H2O
答案第1页,共2页
答案第1页,共2页
一、单选题
1.某同学用pH试纸测定未知溶液的pH时,他先用蒸馏水将pH试纸湿润,然后再测定,则他所测得的未知溶液pH将
A.偏大 B.偏小 C.无影响 D.无法确定
2.下列有关测定氢氧化钠溶液pH的实验操作或描述,你认为正确的是( )
A.用镊子夹取pH试纸直接伸入氢氧化钠溶液中测量
B.先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测量
C.用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照
D.用pH试纸测得该氢氧化钠溶液的
3.一些食物的近似pH如下:
食物 葡萄汁 苹果汁 牛奶 鸡蛋清
pH 3.5~4.5 2.9~3.3 6.3~6.6 7.6~8.0
下列说法中不正确的是A.鸡蛋清和牛奶显碱性 B.苹果汁和葡萄汁显酸性
C.苹果汁比葡萄汁的酸性强 D.胃酸过多的人应少饮苹果汁和葡萄汁
4.一些食物的近似pH如表所示,下列说法正确的是
食物 苹果汁 西瓜汁 牛奶 鸡蛋清
pH 2.9 5.8 6.4 7.6
A.牛奶放置一段时间后变酸,pH变大
B.西瓜汁比苹果汁酸性强
C.鸡蛋清和牛奶都显碱性
D.胃酸过多的人应该少饮苹果汁
5.常温下,下列物质水溶液的pH<7的是
A.KOH B.草木灰 C.生石灰 D.醋酸
6.【2017年山东省青岛市】下表列出了一些常见物质在常温下的 pH 范围, 其中呈碱性的是
物质名称 鸡蛋清 牛奶 西红柿 柠檬汁
pH 范围 7.6~8.0 6.3~6.6 4.0~4.4 2.0~3.0
A.鸡蛋清 B.牛奶 C.西红柿 D.柠檬汁
7.归纳推理是学习化学的一种重要的思维方法,下列归纳推理正确的是( )
A.化合物是由多种元素组成的,则由多种元素组成的物质一定是化合物
B.锌粒和稀硫酸反应会产生氢气,则所以金属都能和稀硫酸反应产生氢气
C.置换反应有单质生成,则有单质生成的反应一定是置换反应
D.常温下,pH大于7的溶液呈碱性,则碱性溶液的pH一定大于7
8.下列清洁用品中碱性最强的是
A.厕所清洁剂pH=1 B.牙膏pH=8 C.肥皂pH=10 D.炉具清洁剂pH=13
9.下列实验操作图示正确的是
A.加热液体 B.测定pH
C.滴加液体 D.检查气密性
10.下表是人体中四种液体的 pH 范围,有关它们的说法正确的是( )
物质类别 胃液 唾液 胆汁 胰液
pH 0.9-1.5 6.6-7.1 7.1-7.3 7.5-8.0
A.胃液不能与碳酸钙反应 B.唾液一定显酸性 C.胆汁是中性液体 D.胰液的碱性最强
11.张亮同学在实验室中测定某未知溶液的pH,他的实验操作如下:先用蒸馏水将pH试纸润湿,然后用玻璃棒蘸取待测试液于pH试纸上进行测定,你认为张亮同学这样测得的结果与该溶液的实际pH比较
A.不变 B.偏低 C.偏高 D.无法判断
12.下列食物的pH如下:苹果汁(2.9~3.3)、葡萄汁(3.5~4.5)、牛奶(6.3~6.6)、鸡蛋清(7.6~8.0),其中胃酸过多的人最适合吃
A.牛奶 B.鸡蛋清 C.葡萄汁 D.苹果汁
13.下列溶液显碱性的是( )
A.酸雨 B.食醋 C.NaOH溶液 D.盐酸
14.常温下,一些饮料或食物的近似pH如下:
食物 柠檬汁 橙子汁 西瓜汁 鸡蛋清
pH 2.2~2.4 3.6~4.3 5.3~6.1 7.6~8.0
下列说法中正确的是( )A.胃酸过多的人应多喝柠檬汁
B.西瓜汁和鸡蛋清显碱性
C.西瓜汁比柠檬汁酸性强
D.柠檬汁和橙子汁显酸性
15.下列物质呈碱性的是
A.血液,pH为7.35~7.45 B.胃液,pH为0.8~1.5
C.牛奶,pH为6.3~6.6 D.苹果汁,pH为2.9~3.3
16.用pH试纸测溶液的pH,是今年我市化学实验操作考查的题目之一,下列有关pH试纸的使用说法正确的是
A.把pH试纸浸入待测液 B.用湿润的玻璃棒蘸取待测液
C.把显色的pH试纸与标准比色卡对照读数 D.测出石灰水的pH为12.4
二、综合应用题
17.化学是以实验为基础的科学,科学探究是学习化学的重要手段。
(1)写出图中不能用于直接加热的仪器名称__________。
(2)了解溶液的酸碱性,对于生活、生产以及人类的生命活动具有重要的意义。
①测酸碱度常用pH试纸,用pH试纸测定溶液的酸碱度,操作方法是:__________。
②下图是绘制的氢氧化钙溶液与稀盐酸反应时的pH值变化图,据图判断横坐标溶液中所含的离子主要有__________,滴入溶液体积为V2mL时,溶液中的溶质为__________。
(3)利用下图装置可以用纯净、干燥的CO还原Fe2O3并检验气体产物。已知由一氧化碳发生装置得到的CO中混有杂质CO2和H2O。
①请写出装置C玻璃管发生化学反应的方程式。___________
②实验中装置D的作用是什么?___________
③请分析上述反应装置是否合理,如不合理提出改进建议。___________
(4)为测定某石灰石样品中碳酸钙的质量分数,称取1g石灰石(杂质不参加反应)放入烧杯中,加入18g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质的总质量为18.67g(气体的溶解忽略不计)。请计算该样品中碳酸钙的质量分数。___________
18.两个实验小组分别进行“溶液酸碱度的检验”和“金属的回收”的探究实验。
【实验一】溶液酸碱度的检验
(1)如图是测定土壤酸碱度的操作示意图,其中正确的是__(填“A”“B”或“C下同),可能导致所测溶液pH数值发生改变的错误操作是____。
【实验二】金属回收的探究
从含少量铜粉的银、锰混合粉末中分离出贵金属,并获得一种盐晶体,将有关三种金属随意编号为A、B、C,并设计了如下流程。
(2)滤液b 中所含阳离子的符号为____。
(3)A、B、C三种金属的活动性由强到弱的顺序为____。由该实验可得出比较金属活动性强弱的方法有①____;②____。
(4)已知A的硫酸盐中A元素显+2 价,请写出步骤①的反应的化学方程式______。
19.造纸是我国古代四大发明之一,它极大地推动了人类文明的发展。
(1)践行“习近平生态文明思想”,应积极推广垃圾分类和回收利用。旧报纸应投放到贴有如图_____(填字母)标签的垃圾筒内。
(2)为增强纸张的耐磨性,可用玉米淀粉对纸张进行施胶处理。玉米淀粉[(C6H10O5)n,n为正整数]中H、O两种元素的质量比为_____(用最简整数比表示)。
(3)造纸会产生大量含NaOH的废水,需处理至中性后排放。环保监测小组取某造纸厂废水样品过滤,为测定滤液中NaOH的质量分数,进行了如下实验:
步骤1:取20.0g滤液于锥形瓶中,滴入几滴酚酞溶液。
步骤2:向锥形瓶中逐滴滴加溶质质量分数为10.0%的硫酸溶液至溶液呈中性,此时溶液呈_____色。消耗硫酸溶液3.92g。
计算废水滤液中NaOH的质量分数。(请写出计算过程)___________.
20.甜瓜珍品——江西梨瓜以“脆、甜、香”而闻名。梨瓜中含有丰富的蛋白质、粗纤维、维生素、钙、磷、铁、镁、钾、硒等人体所需的营养素;
(1)梨瓜贮存时常套一个塑料袋,其作用是阻止梨瓜中水分流失,还能隔绝_______防止腐烂;
(2)梨瓜适宜生长在pH为6.0-6.8的土壤中,实验室测定溶液pH的操作方法是_______________;
(3)如图为硒元素的某些信息,硒原子核内有_______个质子,硒原子的相对原子质量是_____,硒原子在化学反应中易_______(填“得到”或“失去”)电子。
21.生活中常见物质的性质、制法等是化学研究的重要内容。
(1)在生活中为了得到软水经常需要除去硬水中过多的______。
A.Mg2+、Ca2+ B.Na+、Ca2+ C.Mg2+、Al3+ D.Al3+、Na+
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示。
①根据图示判断,该实验是将______(填“氢氧化钠” 或“盐酸”)滴加到另一种溶液中。
②p点所示溶液中溶质为______。
(3)实验室可利用下图系列装置制取纯净、干燥的CO,然后用CO还原Fe2O3并检验气体产物。
①A装置中能观察到什么现象?______。
②写出B装置中反应的化学方程式______。
③要达到实验目的,装置中导管接口从左到右的连接顺序为:一氧化碳发生装置接______、______接______、______接______、______接______。
④从环保角度考虑,还需对以上装置进行改进,请简述改进措施______。
(4)工业上可利用“铝热反应”焊接钢轨、冶炼难熔金属等,其原理是在高温下用铝将这些金属从其氧化物中置换出来,若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少?
22.以菱锌矿(主要成分是 ZnCO3,杂质为 Fe2O3、FeO、CuO)为原料制备七水硫酸锌(ZnSO4 7H2O),同时得到铁红副产品,其工艺流程如图,回答下列问题:
(1)若实验室用质量分数为 98%的硫酸配制 200g 质量分数为 24.5%的稀硫酸,需要水( 密度 1g/mL)的体积为______mL,需要用到的玻璃仪器有胶头滴管、玻璃棒、烧杯和 ______。
(2) 物质 X 是______ 确定除铜完成的实验现象是______。
(3)“氧化”中加入 H2O2的目的是在硫酸的作用下将溶液中的 FeSO4转化成 Fe2(SO4)3, 反应的化学方程式:______。
(4)除铁过程中,反应温度、溶液 pH 对除铁效果均有影响,为探究除铁的最佳效果,某同学做了以下的实验并记录了相关数据,请回答问题:
编号 反应温度/℃ 溶液 pH 除铁率/%
a 30 2 91.5
b 30 2.5 93.3
c 40 2.5 95.1
d 40 3.1 Y
e 50 3.1 99.5
①实验______对比,得到的结论为其他条件不变时,反应温度增大,除铁率提高。
②实验 a 和实验 b 对比,得到结论是______。
③最佳的除铁条件为反应温度______℃,溶液 pH______。
(5)流程中获得七水硫酸锌前省略的操作是______ 、冷却结晶、过滤、洗涤和低温烘干;洗涤经常选用 95%的乙醇,优点是______(填一个答案);烘干操作需在低温条件下进行,其原因是______。
(6)取 28.70g ZnSO4 7H2O 加热至不同温度,剩余固体的质量变化如图所示。
ZnSO4 7H2O 加热到 100℃时所得固体的化学式为是______(写出计算过程)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.A
4.D
5.D
6.A
7.D
8.D
9.D
10.D
11.D
12.B
13.C
14.D
15.A
16.C
17. 烧杯 用玻璃棒蘸取待测液滴在pH试纸上,将显示的颜色与标准比色卡对比,即可得到溶液的pH值 H+和Cl- 氯化钙和氯化氢(或CaCl2和HCl) 吸收并证明反应后生成有二氧化碳(合理即可) 不合理,应加装反应后尾气收集或点燃装置(合理即可) 75%
18. B C Cu2+ A>B>C 利用金属和酸的反应判断金属活动性 利用金属和盐溶液的反应判断金属活动性 Mn+H2SO4═MnSO4+H2↑
19. A 1:8 酚酞遇碱变红色,氢氧化钠和硫酸反应生成硫酸钠和水,所以向锥形瓶中逐滴滴加溶质质量分数为10.0%的硫酸溶液至溶液呈中性,此时溶液呈无色; 1.6%
20. 氧气 用玻璃棒蘸取待测液,滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出溶液的pH 34 78.96 得到
21.(1)A
(2) 氢氧化钠 氢氧化钠、氯化钠(或NaOH、NaCl)
(3) 氢氧化钙溶液变浑浊 h
g
e
f
c(或d)
d(或c)
b
在A装置后增加一个尾气处理的装置(合理即可)
(4)10.8kg
解:制取25.2kg铁,理论上需要消耗铝的质量是x,
答:制取25.2kg铁,理论上需要消耗铝的质量是10.8kg。
22. 150mL 量筒 锌 溶液由蓝色变成无色 bc 其他条件不变时,溶液pH越大,除铁率越高 50℃ 3.1 蒸发浓缩 便于干燥或减少晶体溶解损失 防止晶体失去结晶水或防止晶体受热分解
所以化学式为:ZnSO4 H2O
答案第1页,共2页
答案第1页,共2页
