科粤版九年级化学下册8.1溶液的酸碱性同步练习(word版有答案)
文档属性
| 名称 | 科粤版九年级化学下册8.1溶液的酸碱性同步练习(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 202.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-25 21:44:53 | ||
图片预览




文档简介
科粤版九年级化学下册 8.1 溶液的酸碱性 同步练习
一、单选题
1.类推是学习化学过程中常用的思维方法,下列类推正确的是
A.氧化反应是物质与氧气发生的反应,所以物质与氧气发生的一定是氧化反应
B.氧化物中含有氧元素,所以含有氧元素的化合物一定是氧化物
C.碱溶液能使酚酞溶液变红,所以不能使酚酞溶液变红的溶液一定是酸溶液
D.化合物中含有不同的元素,所以含有不同种元素的物质一定是化合物
2.下列溶液能使紫色石蕊溶液变成蓝色的是
A.澄清石灰水 B.NaCl溶液
C.稀硫酸 D.KNO3溶液
3.下列生活中常见的物质,呈碱性的是
物质名称
pH 8-9 6-7 3-4 2-3
选项 A B C D
A.A B.B C.C D.D
4.中国工程院院士袁隆平宣布了一项重大突破成果——水稻亲本去镉技术,水稻对镉的吸收量与土壤pH关系如图所示。下列物质可用于改良土壤结构,降低水稻对镉吸收量的是( )
A.熟石灰 B.硫酸铜
C.稀盐酸 D.氯化钠
5.有A.B两种酸碱指示剂,它们显示的颜色与溶液明的关系如图1.它们在甲溶液和乙溶液中显示的颜色如图2.下列判断错误的是 ( )
溶液 指示剂 甲 乙
A 黄色 蓝色
B 无色 粉红色
图1
A.甲溶液呈酸性
B.乙溶液的pH可能为11
C.只用A指示剂就可鉴别甲溶液、乙溶液和蒸馏水三种液体
D.在滴有指示剂的甲溶液中不断地加入乙溶液。最后溶液一定呈绿色
6.下列物质中pH最小的是
A.醋酸 B.生理盐水 C.蒸馏水 D.肥皂水
7.下列有关溶液酸碱性的说法错误的是( )
A.pH=7的溶液呈中性
B.pH>7的溶液一定呈碱性
C.pH<7的雨水一定是酸雨
D.酸溶液的pH越小酸性越强
8.生活中一些食物的近似pH如下,其中显碱性的食物是( )
A.柠檬汁(2.0~3.0) B.苹果汁(2.9~3.3)
C.牛奶(6.3~6.6) D.鸡蛋清(7.6~8.0)
9.下表为四种食物的近似pH,你认为胃酸过多的患者不宜多吃的食物是( )
食物 苹果汁 豆浆 玉米粥 鸡蛋清
pH 2.9-3.3 7.4-7.9 6.8-8.0 7.6-8.0
A.苹果汁 B.豆浆 C.玉米粥 D.鸡蛋清
10.小明设计了如图装置探究“微粒是不断运动的”,一段时间后,可观察到紫色石蕊变红,则物质 A是
A.浓氨水 B.浓硫酸 C.浓食盐水 D.浓盐酸
11.以下是室温时测得四种溶液的pH,其中酸性最强的是
A.pH=12 B.pH=8 C.pH=4 D.pH=2
12.某化学课外活动小组开展下列实验活动:取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔5分钟测一次pH,其数据如下表所示。下列对测定结果的分析中正确的是( )
测定时刻 17∶05 17∶10 17∶15 17∶20 17∶25 17∶30 17∶35
pH 4.95 4.94 4.92 4.88 4.86 4.85 4.85
A.在测定期间,该雨水的酸性逐渐减弱
B.该雨水对农作物的生长没有影响
C.若在17:40测定,pH一定小于4.85
D.pH=4.95与某些工厂排放的酸性气体有关
13.如图是X、Y、Z三种液体的对应近似pH,下列判断不正确的是( )
A.X显酸性 B.Y可能是水
C.Z可能是某种盐溶液 D.Z可使紫色石蕊试液变红
14.下列常见物质显碱性的是
A.食醋
B.食盐水
C.肥皂水
D.柠檬水
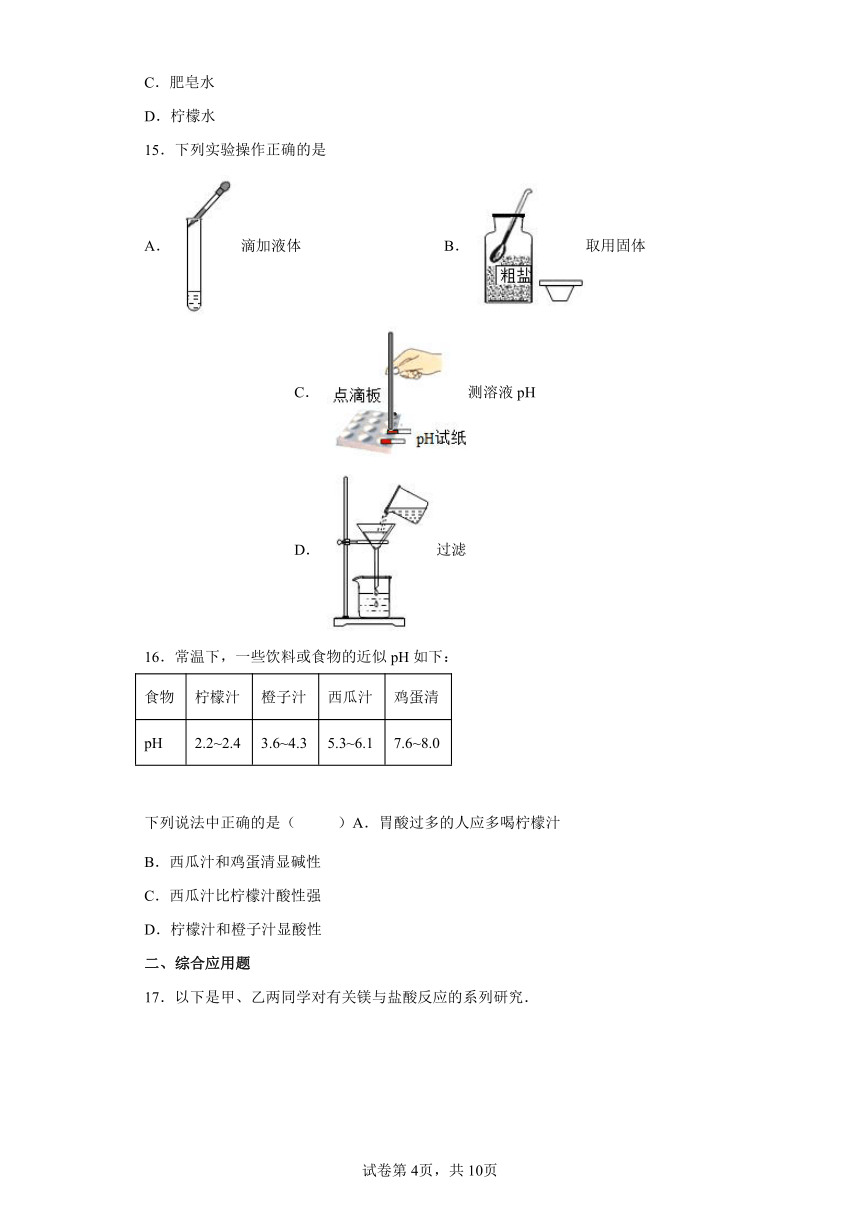
15.下列实验操作正确的是
A. 滴加液体 B. 取用固体 C. 测溶液pH D. 过滤
16.常温下,一些饮料或食物的近似pH如下:
食物 柠檬汁 橙子汁 西瓜汁 鸡蛋清
pH 2.2~2.4 3.6~4.3 5.3~6.1 7.6~8.0
下列说法中正确的是( )A.胃酸过多的人应多喝柠檬汁
B.西瓜汁和鸡蛋清显碱性
C.西瓜汁比柠檬汁酸性强
D.柠檬汁和橙子汁显酸性
二、综合应用题
17.以下是甲、乙两同学对有关镁与盐酸反应的系列研究.
研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:
(1)反应中试管外壁发烫,说明镁与稀盐酸反应是 _____ 反应(填“吸热”或“放热”).
(2)实验测得镁片产生气体的速率(v)与时间(t)的关系如图1所示,则t1-t2时间内反应速率逐渐加快的主要原因是 _____ .
研究二:反应后所得溶液的酸碱性探究:
(3)甲同学反应后用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶液呈 ____ 性(选填“酸”“碱”或“中”).
甲同学:猜想I:稀盐酸过量,使溶液pH小于7;猜想II:氯化镁溶液pH小于7.为验证猜想,甲同学需测定 ________ 溶液的酸碱性,实验表明该溶液显弱酸性.
(4)乙同学重复甲同学实验时,发现反应后所得试管中溶液pH大于7.发现实验与甲同学实验不同的是,反应后的试管中镁条有剩余.乙同学猜想可能是镁与热水反应生成了碱性物质.乙同学为验证猜想,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,请根据实验现象写出镁与水反应的化学反应方程式 ________ .
(5)金属氯化物溶液pH值大小与金属的活动性有关,如氯化钠溶液显中性,氯化镁溶液显弱酸性,则氯化钾溶液显 ________ 性.
(6)活泼金属能与水在一定条件下反应.实验发现钠与冷水剧烈反应,产生大量的气体.由此可见金属与水反应与金属的活动性顺序 _______ (填“有关”或“无关”).
研究三:金属活动性强弱与原子结构的关系:
如图2为镁原子、钙原子和钡原子结构示意图.已知其中Ba的活动性最强,据此推测,金属的活动性除与原子的最外层电子数有关,还与 ________ 有关.
研究四:确定镁条的成分:
称取3.2g表面被氧化的镁条,放入100g稀盐酸中恰好完全反应,生成气体0.2g.求:
(7)此镁条中金属镁的质量. ________ (写出计算过程)
(8)反应后所得溶液中溶质的质量分数 ________ .(计算结果保留一位小数)
18.生活中常见物质的性质、制法等是化学研究的重要内容。
(1)在生活中为了得到软水经常需要除去硬水中过多的______。
A.Mg2+、Ca2+ B.Na+、Ca2+ C.Mg2+、Al3+ D.Al3+、Na+
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示。
①根据图示判断,该实验是将______(填“氢氧化钠” 或“盐酸”)滴加到另一种溶液中。
②p点所示溶液中溶质为______。
(3)实验室可利用下图系列装置制取纯净、干燥的CO,然后用CO还原Fe2O3并检验气体产物。
①A装置中能观察到什么现象?______。
②写出B装置中反应的化学方程式______。
③要达到实验目的,装置中导管接口从左到右的连接顺序为:一氧化碳发生装置接______、______接______、______接______、______接______。
④从环保角度考虑,还需对以上装置进行改进,请简述改进措施______。
(4)工业上可利用“铝热反应”焊接钢轨、冶炼难熔金属等,其原理是在高温下用铝将这些金属从其氧化物中置换出来,若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少?
19.二氧化锰因在工业生产中应用广泛而备受关注,制备二氧化锰是一项有意义的工作,某研究性小组对此展开了系列研究。
Ⅰ.用高锰酸钾制备
资料一:3K2MnO4+2H2SO4=2KMnO4+MnO2↓+2K2SO4+2H2O, K2MnO4易溶于水
(1)实验室加热高锰酸钾制氧气,反应的化学方程式为_____。将反应后的固体剩余物用稀硫酸浸取一段时间后过滤、洗涤、烘干即得MnO2。用稀硫酸而不用水浸取的原因是____。
Ⅱ.用硫酸锰制备
(2)电解MnSO4溶液可制得活性MnO2,同时生成氢气和硫酸,该反应的化学方程式为_____,一段时间后溶液的pH将________(填“变大”、“变小”或“不变”)。
Ⅲ.用废锂电池制备
资料二:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
用废锂电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)制备纳米MnO2,并进行锂资源回收,流程如下:
请回答下列问题:
(3)“滤液”中溶质的主要成分是_________(填化学式)。
(4)在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、_______和_________。
(5) MnO2与碳粉经下列三步反应制得纳米MnO2:
①②MnO+H2SO4=MnSO4+H2O
③3MnSO4+2KMnO4+2H2O=5MnO2↓+K2SO4+2H2SO4
上述涉及元素化合价变化的反应有___________(填序号)。
IV.用碳酸锰制备
控制一定的温度,焙烧MnCO3制取MnO2的装置如下:
(6)实验中观察到澄清石灰水变浑浊,写出石英管中发生反应的化学方程式
(7) MnCO3在空气中加热易转化为锰的不同氧化物,其残留固体质量随温度的变化如上图所示。图中A点(300, 75.65)对应固体成分的化学式为____________。
20.水是生命之源,请回答下列有关水的问题:
⑴水发生部分结冰变化后形成的冰和水混合体系属于____________(填“纯净物”或“混合物”)。
⑵生活中使硬水软化的一种最常用的方法是______________。
⑶若要测定某工业水样的酸碱度,最适合的是( )
A、无色酚酞试液 B、pH试纸 C、紫色石蕊试液
⑷把下列物质分别加入纯净水中,用玻璃棒不断搅拌,能形成无色溶液的是( )
A、泥沙 B、硫酸铜 C、蔗糖 D、花生油
⑸节约用水,人人有责,请你提出一条节约用水的合理化建议:_________________________。
21.化学就在我们身边,它与我们的生活息息相关。
(1)“化学——我们的生活,我们的未来”。
①我们常用洗涤剂清洗餐具上的油污,这是因为洗涤剂具有 __________功能。
②竹子可加工成具有吸附作用的物质,其作用与____________(填物质名称)相似。
③厨房中常用的调味品,能用来除水垢的酸_________________(填化学式)。
④城市生活中常用气体燃料煤气中含有毒气体一氧化碳,其燃烧的反应的化学方程式:__________。
(2)无土栽培是利用营养液栽培作物的一种方法.以下是栽培绿叶菜营养液配方。
肥料成分 用量(毫克/升)
硝酸钙 1260
硝酸钾 255
磷酸二氢钠 350
硫酸镁 537
硫酸铵 235
①肥料成份中属于复合肥的是_____________。
②该营养液中存在的一种阳离子的符号_____。
③某硫酸铵溶液pH=4.5,则硫酸铵溶液显_________(填“酸性”、“碱性”或“中性”)。
④若在实验里配制10升该营养液,需要称取的硫酸镁的质量是____________毫克。
22.化学是以实验为基础的科学,科学探究是学习化学的重要手段。
(1)写出图中不能用于直接加热的仪器名称__________。
(2)了解溶液的酸碱性,对于生活、生产以及人类的生命活动具有重要的意义。
①测酸碱度常用pH试纸,用pH试纸测定溶液的酸碱度,操作方法是:__________。
②下图是绘制的氢氧化钙溶液与稀盐酸反应时的pH值变化图,据图判断横坐标溶液中所含的离子主要有__________,滴入溶液体积为V2mL时,溶液中的溶质为__________。
(3)利用下图装置可以用纯净、干燥的CO还原Fe2O3并检验气体产物。已知由一氧化碳发生装置得到的CO中混有杂质CO2和H2O。
①请写出装置C玻璃管发生化学反应的方程式。___________
②实验中装置D的作用是什么?___________
③请分析上述反应装置是否合理,如不合理提出改进建议。___________
(4)为测定某石灰石样品中碳酸钙的质量分数,称取1g石灰石(杂质不参加反应)放入烧杯中,加入18g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质的总质量为18.67g(气体的溶解忽略不计)。请计算该样品中碳酸钙的质量分数。___________
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.A
3.A
4.A
5.D
6.A
7.C
8.D
9.A
10.D
11.D
12.D
13.D
14.C
15.C
16.D
17. 放热 镁与稀盐酸反应放热,加快反应速率 酸性 氯化镁 Mg+2H2OMg(OH)2↓+H2↑ 中 有关 电子层数 设镁的质量为x,镁与盐酸反应生成氯化镁的质量为y
Mg+2HCl=MgCl2+H2↑
24 95 2
x y 0.2g
x=2.4g 11.1%
18.(1)A
(2) 氢氧化钠 氢氧化钠、氯化钠(或NaOH、NaCl)
(3) 氢氧化钙溶液变浑浊 h
g
e
f
c(或d)
d(或c)
b
在A装置后增加一个尾气处理的装置(合理即可)
(4)10.8kg
解:制取25.2kg铁,理论上需要消耗铝的质量是x,
答:制取25.2kg铁,理论上需要消耗铝的质量是10.8kg。
19. 2KMnO4△K2MnO4+MnO2+O2↑ 使锰酸钾转化得到二氧化锰,获得更多的二氧化锰; 变小 NaAlO2 漏斗和玻璃棒 ①③ MnO2
20. 纯净物 煮沸 B C 答案多样,合理就可以
21. 乳化 活性炭 CH3COOH 2CO + O2 2CO2 硝酸钾 Ca2+ 酸性 5370
22. 烧杯 用玻璃棒蘸取待测液滴在pH试纸上,将显示的颜色与标准比色卡对比,即可得到溶液的pH值 H+和Cl- 氯化钙和氯化氢(或CaCl2和HCl) 吸收并证明反应后生成有二氧化碳(合理即可) 不合理,应加装反应后尾气收集或点燃装置(合理即可) 75%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.类推是学习化学过程中常用的思维方法,下列类推正确的是
A.氧化反应是物质与氧气发生的反应,所以物质与氧气发生的一定是氧化反应
B.氧化物中含有氧元素,所以含有氧元素的化合物一定是氧化物
C.碱溶液能使酚酞溶液变红,所以不能使酚酞溶液变红的溶液一定是酸溶液
D.化合物中含有不同的元素,所以含有不同种元素的物质一定是化合物
2.下列溶液能使紫色石蕊溶液变成蓝色的是
A.澄清石灰水 B.NaCl溶液
C.稀硫酸 D.KNO3溶液
3.下列生活中常见的物质,呈碱性的是
物质名称
pH 8-9 6-7 3-4 2-3
选项 A B C D
A.A B.B C.C D.D
4.中国工程院院士袁隆平宣布了一项重大突破成果——水稻亲本去镉技术,水稻对镉的吸收量与土壤pH关系如图所示。下列物质可用于改良土壤结构,降低水稻对镉吸收量的是( )
A.熟石灰 B.硫酸铜
C.稀盐酸 D.氯化钠
5.有A.B两种酸碱指示剂,它们显示的颜色与溶液明的关系如图1.它们在甲溶液和乙溶液中显示的颜色如图2.下列判断错误的是 ( )
溶液 指示剂 甲 乙
A 黄色 蓝色
B 无色 粉红色
图1
A.甲溶液呈酸性
B.乙溶液的pH可能为11
C.只用A指示剂就可鉴别甲溶液、乙溶液和蒸馏水三种液体
D.在滴有指示剂的甲溶液中不断地加入乙溶液。最后溶液一定呈绿色
6.下列物质中pH最小的是
A.醋酸 B.生理盐水 C.蒸馏水 D.肥皂水
7.下列有关溶液酸碱性的说法错误的是( )
A.pH=7的溶液呈中性
B.pH>7的溶液一定呈碱性
C.pH<7的雨水一定是酸雨
D.酸溶液的pH越小酸性越强
8.生活中一些食物的近似pH如下,其中显碱性的食物是( )
A.柠檬汁(2.0~3.0) B.苹果汁(2.9~3.3)
C.牛奶(6.3~6.6) D.鸡蛋清(7.6~8.0)
9.下表为四种食物的近似pH,你认为胃酸过多的患者不宜多吃的食物是( )
食物 苹果汁 豆浆 玉米粥 鸡蛋清
pH 2.9-3.3 7.4-7.9 6.8-8.0 7.6-8.0
A.苹果汁 B.豆浆 C.玉米粥 D.鸡蛋清
10.小明设计了如图装置探究“微粒是不断运动的”,一段时间后,可观察到紫色石蕊变红,则物质 A是
A.浓氨水 B.浓硫酸 C.浓食盐水 D.浓盐酸
11.以下是室温时测得四种溶液的pH,其中酸性最强的是
A.pH=12 B.pH=8 C.pH=4 D.pH=2
12.某化学课外活动小组开展下列实验活动:取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔5分钟测一次pH,其数据如下表所示。下列对测定结果的分析中正确的是( )
测定时刻 17∶05 17∶10 17∶15 17∶20 17∶25 17∶30 17∶35
pH 4.95 4.94 4.92 4.88 4.86 4.85 4.85
A.在测定期间,该雨水的酸性逐渐减弱
B.该雨水对农作物的生长没有影响
C.若在17:40测定,pH一定小于4.85
D.pH=4.95与某些工厂排放的酸性气体有关
13.如图是X、Y、Z三种液体的对应近似pH,下列判断不正确的是( )
A.X显酸性 B.Y可能是水
C.Z可能是某种盐溶液 D.Z可使紫色石蕊试液变红
14.下列常见物质显碱性的是
A.食醋
B.食盐水
C.肥皂水
D.柠檬水
15.下列实验操作正确的是
A. 滴加液体 B. 取用固体 C. 测溶液pH D. 过滤
16.常温下,一些饮料或食物的近似pH如下:
食物 柠檬汁 橙子汁 西瓜汁 鸡蛋清
pH 2.2~2.4 3.6~4.3 5.3~6.1 7.6~8.0
下列说法中正确的是( )A.胃酸过多的人应多喝柠檬汁
B.西瓜汁和鸡蛋清显碱性
C.西瓜汁比柠檬汁酸性强
D.柠檬汁和橙子汁显酸性
二、综合应用题
17.以下是甲、乙两同学对有关镁与盐酸反应的系列研究.
研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:
(1)反应中试管外壁发烫,说明镁与稀盐酸反应是 _____ 反应(填“吸热”或“放热”).
(2)实验测得镁片产生气体的速率(v)与时间(t)的关系如图1所示,则t1-t2时间内反应速率逐渐加快的主要原因是 _____ .
研究二:反应后所得溶液的酸碱性探究:
(3)甲同学反应后用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶液呈 ____ 性(选填“酸”“碱”或“中”).
甲同学:猜想I:稀盐酸过量,使溶液pH小于7;猜想II:氯化镁溶液pH小于7.为验证猜想,甲同学需测定 ________ 溶液的酸碱性,实验表明该溶液显弱酸性.
(4)乙同学重复甲同学实验时,发现反应后所得试管中溶液pH大于7.发现实验与甲同学实验不同的是,反应后的试管中镁条有剩余.乙同学猜想可能是镁与热水反应生成了碱性物质.乙同学为验证猜想,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,请根据实验现象写出镁与水反应的化学反应方程式 ________ .
(5)金属氯化物溶液pH值大小与金属的活动性有关,如氯化钠溶液显中性,氯化镁溶液显弱酸性,则氯化钾溶液显 ________ 性.
(6)活泼金属能与水在一定条件下反应.实验发现钠与冷水剧烈反应,产生大量的气体.由此可见金属与水反应与金属的活动性顺序 _______ (填“有关”或“无关”).
研究三:金属活动性强弱与原子结构的关系:
如图2为镁原子、钙原子和钡原子结构示意图.已知其中Ba的活动性最强,据此推测,金属的活动性除与原子的最外层电子数有关,还与 ________ 有关.
研究四:确定镁条的成分:
称取3.2g表面被氧化的镁条,放入100g稀盐酸中恰好完全反应,生成气体0.2g.求:
(7)此镁条中金属镁的质量. ________ (写出计算过程)
(8)反应后所得溶液中溶质的质量分数 ________ .(计算结果保留一位小数)
18.生活中常见物质的性质、制法等是化学研究的重要内容。
(1)在生活中为了得到软水经常需要除去硬水中过多的______。
A.Mg2+、Ca2+ B.Na+、Ca2+ C.Mg2+、Al3+ D.Al3+、Na+
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示。
①根据图示判断,该实验是将______(填“氢氧化钠” 或“盐酸”)滴加到另一种溶液中。
②p点所示溶液中溶质为______。
(3)实验室可利用下图系列装置制取纯净、干燥的CO,然后用CO还原Fe2O3并检验气体产物。
①A装置中能观察到什么现象?______。
②写出B装置中反应的化学方程式______。
③要达到实验目的,装置中导管接口从左到右的连接顺序为:一氧化碳发生装置接______、______接______、______接______、______接______。
④从环保角度考虑,还需对以上装置进行改进,请简述改进措施______。
(4)工业上可利用“铝热反应”焊接钢轨、冶炼难熔金属等,其原理是在高温下用铝将这些金属从其氧化物中置换出来,若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少?
19.二氧化锰因在工业生产中应用广泛而备受关注,制备二氧化锰是一项有意义的工作,某研究性小组对此展开了系列研究。
Ⅰ.用高锰酸钾制备
资料一:3K2MnO4+2H2SO4=2KMnO4+MnO2↓+2K2SO4+2H2O, K2MnO4易溶于水
(1)实验室加热高锰酸钾制氧气,反应的化学方程式为_____。将反应后的固体剩余物用稀硫酸浸取一段时间后过滤、洗涤、烘干即得MnO2。用稀硫酸而不用水浸取的原因是____。
Ⅱ.用硫酸锰制备
(2)电解MnSO4溶液可制得活性MnO2,同时生成氢气和硫酸,该反应的化学方程式为_____,一段时间后溶液的pH将________(填“变大”、“变小”或“不变”)。
Ⅲ.用废锂电池制备
资料二:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
用废锂电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)制备纳米MnO2,并进行锂资源回收,流程如下:
请回答下列问题:
(3)“滤液”中溶质的主要成分是_________(填化学式)。
(4)在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、_______和_________。
(5) MnO2与碳粉经下列三步反应制得纳米MnO2:
①②MnO+H2SO4=MnSO4+H2O
③3MnSO4+2KMnO4+2H2O=5MnO2↓+K2SO4+2H2SO4
上述涉及元素化合价变化的反应有___________(填序号)。
IV.用碳酸锰制备
控制一定的温度,焙烧MnCO3制取MnO2的装置如下:
(6)实验中观察到澄清石灰水变浑浊,写出石英管中发生反应的化学方程式
(7) MnCO3在空气中加热易转化为锰的不同氧化物,其残留固体质量随温度的变化如上图所示。图中A点(300, 75.65)对应固体成分的化学式为____________。
20.水是生命之源,请回答下列有关水的问题:
⑴水发生部分结冰变化后形成的冰和水混合体系属于____________(填“纯净物”或“混合物”)。
⑵生活中使硬水软化的一种最常用的方法是______________。
⑶若要测定某工业水样的酸碱度,最适合的是( )
A、无色酚酞试液 B、pH试纸 C、紫色石蕊试液
⑷把下列物质分别加入纯净水中,用玻璃棒不断搅拌,能形成无色溶液的是( )
A、泥沙 B、硫酸铜 C、蔗糖 D、花生油
⑸节约用水,人人有责,请你提出一条节约用水的合理化建议:_________________________。
21.化学就在我们身边,它与我们的生活息息相关。
(1)“化学——我们的生活,我们的未来”。
①我们常用洗涤剂清洗餐具上的油污,这是因为洗涤剂具有 __________功能。
②竹子可加工成具有吸附作用的物质,其作用与____________(填物质名称)相似。
③厨房中常用的调味品,能用来除水垢的酸_________________(填化学式)。
④城市生活中常用气体燃料煤气中含有毒气体一氧化碳,其燃烧的反应的化学方程式:__________。
(2)无土栽培是利用营养液栽培作物的一种方法.以下是栽培绿叶菜营养液配方。
肥料成分 用量(毫克/升)
硝酸钙 1260
硝酸钾 255
磷酸二氢钠 350
硫酸镁 537
硫酸铵 235
①肥料成份中属于复合肥的是_____________。
②该营养液中存在的一种阳离子的符号_____。
③某硫酸铵溶液pH=4.5,则硫酸铵溶液显_________(填“酸性”、“碱性”或“中性”)。
④若在实验里配制10升该营养液,需要称取的硫酸镁的质量是____________毫克。
22.化学是以实验为基础的科学,科学探究是学习化学的重要手段。
(1)写出图中不能用于直接加热的仪器名称__________。
(2)了解溶液的酸碱性,对于生活、生产以及人类的生命活动具有重要的意义。
①测酸碱度常用pH试纸,用pH试纸测定溶液的酸碱度,操作方法是:__________。
②下图是绘制的氢氧化钙溶液与稀盐酸反应时的pH值变化图,据图判断横坐标溶液中所含的离子主要有__________,滴入溶液体积为V2mL时,溶液中的溶质为__________。
(3)利用下图装置可以用纯净、干燥的CO还原Fe2O3并检验气体产物。已知由一氧化碳发生装置得到的CO中混有杂质CO2和H2O。
①请写出装置C玻璃管发生化学反应的方程式。___________
②实验中装置D的作用是什么?___________
③请分析上述反应装置是否合理,如不合理提出改进建议。___________
(4)为测定某石灰石样品中碳酸钙的质量分数,称取1g石灰石(杂质不参加反应)放入烧杯中,加入18g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质的总质量为18.67g(气体的溶解忽略不计)。请计算该样品中碳酸钙的质量分数。___________
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.A
3.A
4.A
5.D
6.A
7.C
8.D
9.A
10.D
11.D
12.D
13.D
14.C
15.C
16.D
17. 放热 镁与稀盐酸反应放热,加快反应速率 酸性 氯化镁 Mg+2H2OMg(OH)2↓+H2↑ 中 有关 电子层数 设镁的质量为x,镁与盐酸反应生成氯化镁的质量为y
Mg+2HCl=MgCl2+H2↑
24 95 2
x y 0.2g
x=2.4g 11.1%
18.(1)A
(2) 氢氧化钠 氢氧化钠、氯化钠(或NaOH、NaCl)
(3) 氢氧化钙溶液变浑浊 h
g
e
f
c(或d)
d(或c)
b
在A装置后增加一个尾气处理的装置(合理即可)
(4)10.8kg
解:制取25.2kg铁,理论上需要消耗铝的质量是x,
答:制取25.2kg铁,理论上需要消耗铝的质量是10.8kg。
19. 2KMnO4△K2MnO4+MnO2+O2↑ 使锰酸钾转化得到二氧化锰,获得更多的二氧化锰; 变小 NaAlO2 漏斗和玻璃棒 ①③ MnO2
20. 纯净物 煮沸 B C 答案多样,合理就可以
21. 乳化 活性炭 CH3COOH 2CO + O2 2CO2 硝酸钾 Ca2+ 酸性 5370
22. 烧杯 用玻璃棒蘸取待测液滴在pH试纸上,将显示的颜色与标准比色卡对比,即可得到溶液的pH值 H+和Cl- 氯化钙和氯化氢(或CaCl2和HCl) 吸收并证明反应后生成有二氧化碳(合理即可) 不合理,应加装反应后尾气收集或点燃装置(合理即可) 75%
答案第1页,共2页
答案第1页,共2页
