科粤版九年级化学下册8.3酸和碱的反应同步练习(word版有答案)
文档属性
| 名称 | 科粤版九年级化学下册8.3酸和碱的反应同步练习(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 132.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-25 22:00:08 | ||
图片预览



文档简介
科粤版九年级化学下册 8.3 酸和碱的反应 同步练习
一、单选题
1.如图所示实验中,①④为用紫色石蕊溶液润湿的棉球,②③为浸过紫色石蕊溶液的干燥棉球。下列能准确描述实验现象的是
A.④比①先红,②、③不变红
B.①比④先红,②、③不变红
C.④变红,①②③不变红
D.①变红,②③④不变红
2.“归纳或类推”是学习化学常用的方法。下列说法正确的是 ( )
A.氧化物中都含有氧元素,含有氧元素的化合物都是氧化物
B.中和反应生成盐和水,有盐和水生成的反应一定是中和反应
C.一氧化碳和氢气都能夺取氧化铜中的氧,它们都具有还原性
D.碱溶液能使酚酞试液变红,所以能使酚酞试液变红的物质一定是碱溶液
3.推理是化学学习的重要方法,下列推理正确的是
A.酸雨的pH小于5.6,则pH小于5.6的雨水一定是酸雨
B.中和反应生成盐和水,则生成盐和水的反应一定是中和反应
C.碱溶液能使酚酞溶液变红,则能使酚酞溶液变红的一定是碱溶液
D.溶液具有均一性和稳定性,则具有均一性和稳定性的液体一定是溶液
4.下列化学反应中,属于复分解反应的是
A.4Al+3O2 = 2Al2O3 B.Ca(OH)2+Na2CO3= CaCO3↓+2NaOH
C.H2CO3=H2O+CO2↑ D.H2+CuOCu + H2O
5.将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图如下。由此分析下列说法正确的是
A.反应前后阴、阳离子的总数目不变
B.反应前后溶剂质量不变
C.反应后溶液呈中性
D.反应前后元素种类发生了变化
6.推理是化学学习中常用的思维方法。下列推理正确的是( )
A.酸碱中和反应有盐和水生成,则有盐和水生成的反应一定是酸碱中和反应
B.碱能使无色酚酞溶液变红,则能使无色酞溶液变红的一定是碱
C.单质是由同种元素组成的,则由同种元素组成的物质一定是单质
D.浓硫酸敞放于空气中浓度会减小,则可证明浓硫酸具有吸水性
7.黄蜂的毒液呈碱性,若被黄蜂蜇了,涂抹下列物质可缓解疼痛的是
A.食盐水(pH≈7 ) B.牙膏(pH≈9) C.肥皂(pH≈10 ) D.米醋(pH≈3)
8.下列反应属于中和反应的是
A.SO2+2NaOHNa2SO3+H2O B.CaO+2HClCaCl2+H2O
C.KOH+HClKCl+H2O D.CaO+H2OCa(OH)2
9.类推是化学学习中常用的思维方法.下列类推正确的是( )
A.活泼金属与酸反应有气体产生,则与酸反应产生气体的一定是活泼金属
B.酸与碱发生中和反应生成盐和水,则生成盐和水的反应一定是中和反应
C.单质一定是由同种元素组成的物质,则由同种元素组成的物质一定是单质
D.碱性溶液能使酚酞溶液变红,则能使酚酞溶液变红的溶液一定是碱性溶液
10.中和反应在生活中有广泛应用。下列应用不属于中和反应的是
A.用盐酸除铁锈 B.服用含有氢氧化镁的药物治疗胃酸过多
C.用熟石灰改良酸性土壤 D.用硫酸处理印染厂含碱废水
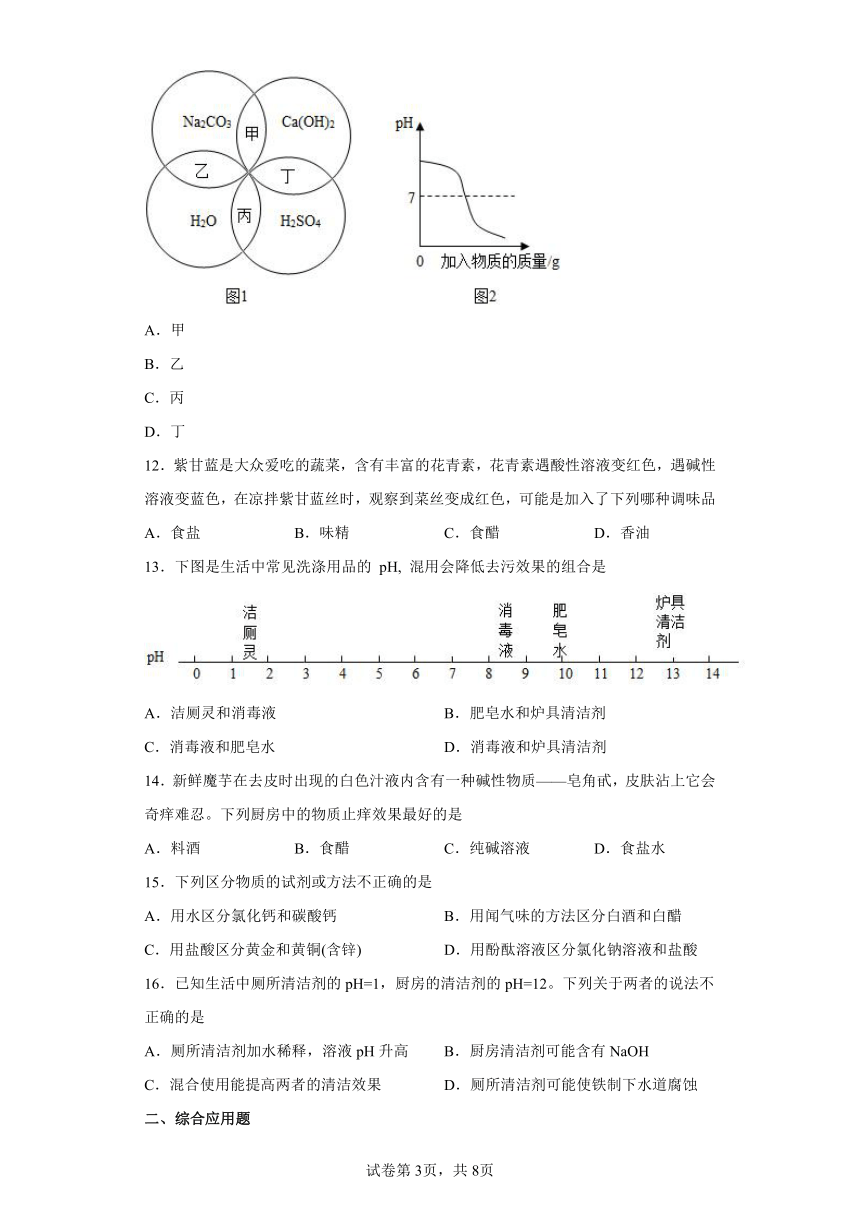
11.图1中甲、乙、丙、丁表示相邻两物质相互混合过程中溶液酸碱度的变化,其中可能符合图2所示变化关系的是
A.甲
B.乙
C.丙
D.丁
12.紫甘蓝是大众爱吃的蔬菜,含有丰富的花青素,花青素遇酸性溶液变红色,遇碱性溶液变蓝色,在凉拌紫甘蓝丝时,观察到菜丝变成红色,可能是加入了下列哪种调味品
A.食盐 B.味精 C.食醋 D.香油
13.下图是生活中常见洗涤用品的 pH, 混用会降低去污效果的组合是
A.洁厕灵和消毒液 B.肥皂水和炉具清洁剂
C.消毒液和肥皂水 D.消毒液和炉具清洁剂
14.新鲜魔芋在去皮时出现的白色汁液内含有一种碱性物质——皂角甙,皮肤沾上它会奇痒难忍。下列厨房中的物质止痒效果最好的是
A.料酒 B.食醋 C.纯碱溶液 D.食盐水
15.下列区分物质的试剂或方法不正确的是
A.用水区分氯化钙和碳酸钙 B.用闻气味的方法区分白酒和白醋
C.用盐酸区分黄金和黄铜(含锌) D.用酚酞溶液区分氯化钠溶液和盐酸
16.已知生活中厕所清洁剂的pH=1,厨房的清洁剂的pH=12。下列关于两者的说法不正确的是
A.厕所清洁剂加水稀释,溶液pH升高 B.厨房清洁剂可能含有NaOH
C.混合使用能提高两者的清洁效果 D.厕所清洁剂可能使铁制下水道腐蚀
二、综合应用题
17.数型图象是研究化学问题的一种常见描述方法,根据下列图象进行回答:
(1)图一是用盐酸和氢氧化钠进行中和反应时,反应过程中溶液的pH变化曲线向盐酸中加入的氢氧化钠溶液质量为mg时,所得溶液中含有的离子为 ______ 填离子符号;
(2)图二是20℃时,取10mL10%的NaOH溶液于烧杯中,逐滴加入10%的盐酸,随着盐酸的加入,烧杯中溶液温度与加入盐酸体积的变化关系.
①由图可知中和反应是放热反应,你的依据为 ______ ;
②甲同学用氢氧化钠固体与稀盐酸反应也能得到相同结论,乙同学认为不严密,因为______ ;
③图三是a、b、c三种物质的溶解度曲线a与c的溶解度相交于P点,据图回答:
①t1℃时,接近饱和的c物质溶液,在不改变溶液质量的条件下,可用 ______ 的方法达到饱和状态;
②将t2℃时,150ga物质的饱和溶液降温到t1℃时,可以析出____g a物质.
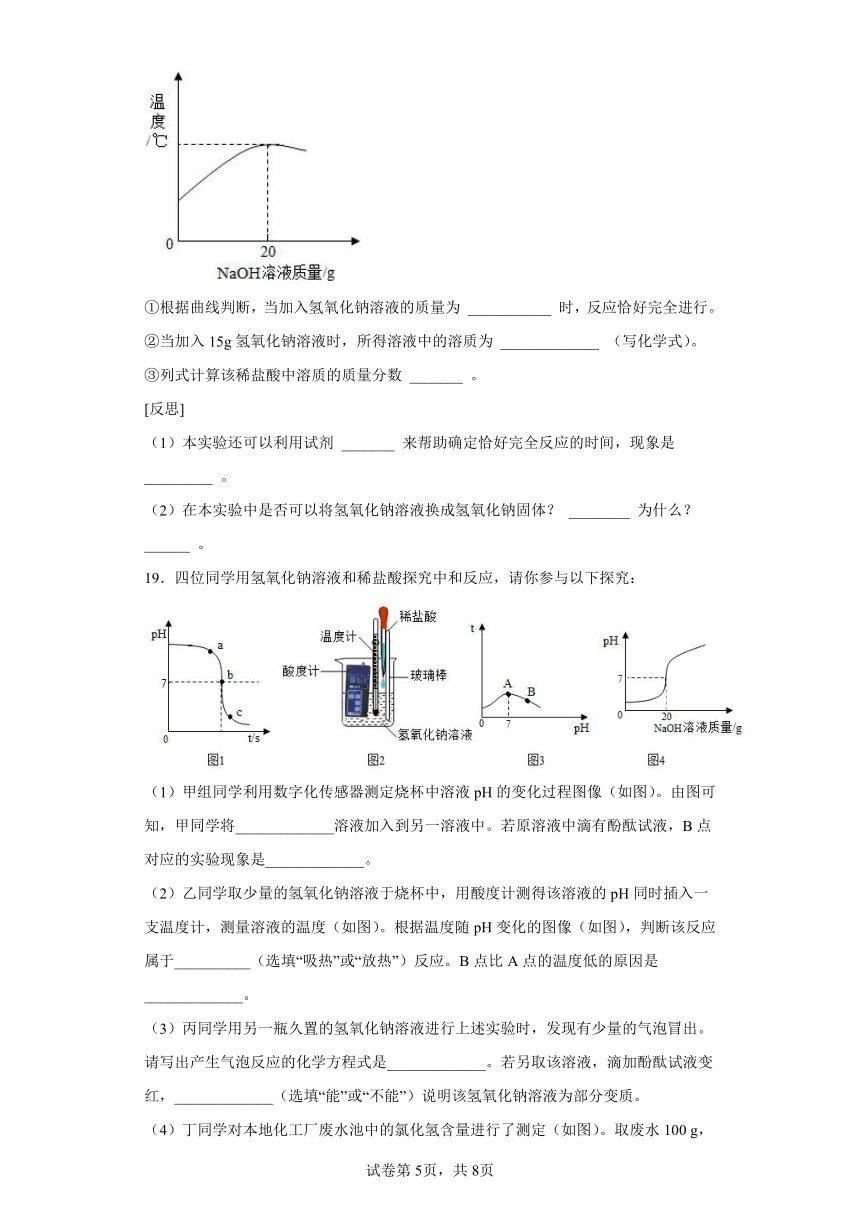
18.某化学兴趣小组的同学们在实验室用溶质质量分数为8%的氢氧化钠溶液,测定某稀盐酸的溶质质量分数。请你参与其中,并完成填空:
[理论分析]计算盐酸的溶质质量分数需要的数据有稀盐酸溶液的质量和其中所含溶质的质量。
[实验步骤]
(1)取20g稀盐酸于小烧杯中。
(2)向其中逐滴滴入氢氧化钠溶液。
(3)记录温度变化,绘制曲线图。
[数据处理]
①根据曲线判断,当加入氢氧化钠溶液的质量为 ___________ 时,反应恰好完全进行。
②当加入15g氢氧化钠溶液时,所得溶液中的溶质为 _____________ (写化学式)。
③列式计算该稀盐酸中溶质的质量分数 _______ 。
[反思]
(1)本实验还可以利用试剂 _______ 来帮助确定恰好完全反应的时间,现象是 _________ 。
(2)在本实验中是否可以将氢氧化钠溶液换成氢氧化钠固体? ________ 为什么? ______ 。
19.四位同学用氢氧化钠溶液和稀盐酸探究中和反应,请你参与以下探究:
(1)甲组同学利用数字化传感器测定烧杯中溶液pH的变化过程图像(如图)。由图可知,甲同学将_____________溶液加入到另一溶液中。若原溶液中滴有酚酞试液,B点对应的实验现象是_____________。
(2)乙同学取少量的氢氧化钠溶液于烧杯中,用酸度计测得该溶液的pH同时插入一支温度计,测量溶液的温度(如图)。根据温度随pH变化的图像(如图),判断该反应属于__________(选填“吸热”或“放热”)反应。B点比A点的温度低的原因是_____________。
(3)丙同学用另一瓶久置的氢氧化钠溶液进行上述实验时,发现有少量的气泡冒出。请写出产生气泡反应的化学方程式是_____________。若另取该溶液,滴加酚酞试液变红,_____________(选填“能”或“不能”)说明该氢氧化钠溶液为部分变质。
(4)丁同学对本地化工厂废水池中的氯化氢含量进行了测定(如图)。取废水100 g,用质量分数为20%的氢氧化钠溶液进行中和,通过计算知道废水中氯化氢的质量分数为_____________。
20.化学是以实验为基础的科学,实验是科学探究的重要手段。
(1)数字化装备正逐步进入校园,利用数字传感器可以测得酸与碱反应过程中溶液pH变化的图象。如图是盐酸与氢氧化钠溶液反应过程中的pH变化的图象。
①反应的化学方程式为_________________________。
②当溶液呈中性时,所消耗氢氧化钠溶液的体积是___________;
③图中b点所示溶液中,含有的溶质是____________。
(2)在“创新实验装置”的竞赛中,某化学兴趣小组设计了如图所示的装置(夹持仪器已略去),引起同学们的兴趣。
①请写出仪器M的名称_________,仪器M的优点_____________;
②打开M的活塞后,装置A中发生的反应方程式为_____________;
③打开M的活塞后,装置C中的现象为_____________________。
(3)实验室里,现有一瓶未知浓度的过氧化氢溶液,取该溶液34g于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是34.4g,将杯内剩余物质过滤、洗涤、干燥后得滤渣2g。计算:瓶内过氧化氢溶液中溶质的质量为____________________。
21.中和反应是一类重要的化学反应,某同学利用图1装置研究稀硫酸与氢氧化钠溶液反应的过程,并用pH和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。
(1)烧杯中发生反应的化学方程式为_____;
(2)仪器A中溶液中的微粒是_____(填符号);
(3)图3中V的数值最接近_____(填“6”、“12”或“16”);
(4)下列说法正确的是_____。
A 图2中b点所示溶液中的溶质是Na2SO4和NaOH;
B 图2中d点所示溶液中的微粒是Na+、SO42﹣、H+;
C 图2中c→d所示溶液中Na2SO4的质量不断增加;
D 图3中e→f变化趋势可说明该反应是放热反应。
(5)如果该实验中所用稀硫酸的质量分数位9.8%(假设这时所用稀硫酸的密度为1.0g/mL)。恰好完全反应时消耗氢氧化钠溶液的质量为8克。
则计算①所用氢氧化钠溶液中溶质的质量分数_____?
②计算恰好完全反应时所得溶液中溶质的质量分数_____?(结果精确至0.1%)
22.某化学兴趣小组三位同学在学习盐酸与氢氧化钠反应后,分别结合自己在实验室中所做的实验,各从不同方面对其进行图象描述。图A是实际操作图,图B是反应过程中溶液的酸碱度变化图,图C是微观粒子结合过程的示意图。按要求回答下列问题:
(1)根据图B的曲线变化,回答下列问题:
①该变化对应的实验操作是将 ___________ 滴加到另一种溶液中;
②当滴入溶液的质量为ag时,溶液中的溶质为___________________(填化学式);
③当溶液的pH=7时,溶液中的主要离子是_______________________(填离子符号);
(2)根据图C的微观粒子结合过程的示意图,可以得出以下结论:从反应前后离子的种类看,有些离子参与了反应,有些离子只是旁观者,该反应中参与反应的离子是_______。该反应的实质为___________。
(3)40g氢氧化钠溶液跟73g溶质质量分数为5%的稀盐酸恰好完全反应。这种氢氧化钠溶液中溶质的质量分数是 ______________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.C
3.A
4.B
5.C
6.D
7.D
8.C
9.D
10.A
11.D
12.C
13.A
14.B
15.D
16.C
17. Na+、Cl﹣、H+ 开始随着反应的进行,溶液温度逐渐升高 氢氧化钠固体溶于水放热 升温 30
18. 20g 、 7.3% 酚酞 无色恰好变成红色 不能 氢氧化钠固体溶于水放热,无法确定恰好反应的时间
19. 稀盐酸 由红色刚好褪为无色 放热 NaOH尚未反应完全 Na2CO3 +2HCl ═ 2NaCl + CO2↑+H2O 不能 3.65%
20. HCl+NaOH==NaCl+H2O 10 NaOH和NaCl 分液漏斗 通过控制液体的滴加速率和用量,能够控制反应发生的速率和产气量 Zn+H2SO4=== ZnSO4+ H2↑ 装置C中有溶液流入,生成蓝色沉淀 3.4g
21. H+、、H2O 12 ABD 12% 8.52%
22. NaOH溶液 HCl、NaCl Na+ 、Cl- H+ 、OH- 酸解离出的H+和碱解离出的OH- 结合生成H2O / H+和OH- 结合生成H2O 10%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.如图所示实验中,①④为用紫色石蕊溶液润湿的棉球,②③为浸过紫色石蕊溶液的干燥棉球。下列能准确描述实验现象的是
A.④比①先红,②、③不变红
B.①比④先红,②、③不变红
C.④变红,①②③不变红
D.①变红,②③④不变红
2.“归纳或类推”是学习化学常用的方法。下列说法正确的是 ( )
A.氧化物中都含有氧元素,含有氧元素的化合物都是氧化物
B.中和反应生成盐和水,有盐和水生成的反应一定是中和反应
C.一氧化碳和氢气都能夺取氧化铜中的氧,它们都具有还原性
D.碱溶液能使酚酞试液变红,所以能使酚酞试液变红的物质一定是碱溶液
3.推理是化学学习的重要方法,下列推理正确的是
A.酸雨的pH小于5.6,则pH小于5.6的雨水一定是酸雨
B.中和反应生成盐和水,则生成盐和水的反应一定是中和反应
C.碱溶液能使酚酞溶液变红,则能使酚酞溶液变红的一定是碱溶液
D.溶液具有均一性和稳定性,则具有均一性和稳定性的液体一定是溶液
4.下列化学反应中,属于复分解反应的是
A.4Al+3O2 = 2Al2O3 B.Ca(OH)2+Na2CO3= CaCO3↓+2NaOH
C.H2CO3=H2O+CO2↑ D.H2+CuOCu + H2O
5.将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图如下。由此分析下列说法正确的是
A.反应前后阴、阳离子的总数目不变
B.反应前后溶剂质量不变
C.反应后溶液呈中性
D.反应前后元素种类发生了变化
6.推理是化学学习中常用的思维方法。下列推理正确的是( )
A.酸碱中和反应有盐和水生成,则有盐和水生成的反应一定是酸碱中和反应
B.碱能使无色酚酞溶液变红,则能使无色酞溶液变红的一定是碱
C.单质是由同种元素组成的,则由同种元素组成的物质一定是单质
D.浓硫酸敞放于空气中浓度会减小,则可证明浓硫酸具有吸水性
7.黄蜂的毒液呈碱性,若被黄蜂蜇了,涂抹下列物质可缓解疼痛的是
A.食盐水(pH≈7 ) B.牙膏(pH≈9) C.肥皂(pH≈10 ) D.米醋(pH≈3)
8.下列反应属于中和反应的是
A.SO2+2NaOHNa2SO3+H2O B.CaO+2HClCaCl2+H2O
C.KOH+HClKCl+H2O D.CaO+H2OCa(OH)2
9.类推是化学学习中常用的思维方法.下列类推正确的是( )
A.活泼金属与酸反应有气体产生,则与酸反应产生气体的一定是活泼金属
B.酸与碱发生中和反应生成盐和水,则生成盐和水的反应一定是中和反应
C.单质一定是由同种元素组成的物质,则由同种元素组成的物质一定是单质
D.碱性溶液能使酚酞溶液变红,则能使酚酞溶液变红的溶液一定是碱性溶液
10.中和反应在生活中有广泛应用。下列应用不属于中和反应的是
A.用盐酸除铁锈 B.服用含有氢氧化镁的药物治疗胃酸过多
C.用熟石灰改良酸性土壤 D.用硫酸处理印染厂含碱废水
11.图1中甲、乙、丙、丁表示相邻两物质相互混合过程中溶液酸碱度的变化,其中可能符合图2所示变化关系的是
A.甲
B.乙
C.丙
D.丁
12.紫甘蓝是大众爱吃的蔬菜,含有丰富的花青素,花青素遇酸性溶液变红色,遇碱性溶液变蓝色,在凉拌紫甘蓝丝时,观察到菜丝变成红色,可能是加入了下列哪种调味品
A.食盐 B.味精 C.食醋 D.香油
13.下图是生活中常见洗涤用品的 pH, 混用会降低去污效果的组合是
A.洁厕灵和消毒液 B.肥皂水和炉具清洁剂
C.消毒液和肥皂水 D.消毒液和炉具清洁剂
14.新鲜魔芋在去皮时出现的白色汁液内含有一种碱性物质——皂角甙,皮肤沾上它会奇痒难忍。下列厨房中的物质止痒效果最好的是
A.料酒 B.食醋 C.纯碱溶液 D.食盐水
15.下列区分物质的试剂或方法不正确的是
A.用水区分氯化钙和碳酸钙 B.用闻气味的方法区分白酒和白醋
C.用盐酸区分黄金和黄铜(含锌) D.用酚酞溶液区分氯化钠溶液和盐酸
16.已知生活中厕所清洁剂的pH=1,厨房的清洁剂的pH=12。下列关于两者的说法不正确的是
A.厕所清洁剂加水稀释,溶液pH升高 B.厨房清洁剂可能含有NaOH
C.混合使用能提高两者的清洁效果 D.厕所清洁剂可能使铁制下水道腐蚀
二、综合应用题
17.数型图象是研究化学问题的一种常见描述方法,根据下列图象进行回答:
(1)图一是用盐酸和氢氧化钠进行中和反应时,反应过程中溶液的pH变化曲线向盐酸中加入的氢氧化钠溶液质量为mg时,所得溶液中含有的离子为 ______ 填离子符号;
(2)图二是20℃时,取10mL10%的NaOH溶液于烧杯中,逐滴加入10%的盐酸,随着盐酸的加入,烧杯中溶液温度与加入盐酸体积的变化关系.
①由图可知中和反应是放热反应,你的依据为 ______ ;
②甲同学用氢氧化钠固体与稀盐酸反应也能得到相同结论,乙同学认为不严密,因为______ ;
③图三是a、b、c三种物质的溶解度曲线a与c的溶解度相交于P点,据图回答:
①t1℃时,接近饱和的c物质溶液,在不改变溶液质量的条件下,可用 ______ 的方法达到饱和状态;
②将t2℃时,150ga物质的饱和溶液降温到t1℃时,可以析出____g a物质.
18.某化学兴趣小组的同学们在实验室用溶质质量分数为8%的氢氧化钠溶液,测定某稀盐酸的溶质质量分数。请你参与其中,并完成填空:
[理论分析]计算盐酸的溶质质量分数需要的数据有稀盐酸溶液的质量和其中所含溶质的质量。
[实验步骤]
(1)取20g稀盐酸于小烧杯中。
(2)向其中逐滴滴入氢氧化钠溶液。
(3)记录温度变化,绘制曲线图。
[数据处理]
①根据曲线判断,当加入氢氧化钠溶液的质量为 ___________ 时,反应恰好完全进行。
②当加入15g氢氧化钠溶液时,所得溶液中的溶质为 _____________ (写化学式)。
③列式计算该稀盐酸中溶质的质量分数 _______ 。
[反思]
(1)本实验还可以利用试剂 _______ 来帮助确定恰好完全反应的时间,现象是 _________ 。
(2)在本实验中是否可以将氢氧化钠溶液换成氢氧化钠固体? ________ 为什么? ______ 。
19.四位同学用氢氧化钠溶液和稀盐酸探究中和反应,请你参与以下探究:
(1)甲组同学利用数字化传感器测定烧杯中溶液pH的变化过程图像(如图)。由图可知,甲同学将_____________溶液加入到另一溶液中。若原溶液中滴有酚酞试液,B点对应的实验现象是_____________。
(2)乙同学取少量的氢氧化钠溶液于烧杯中,用酸度计测得该溶液的pH同时插入一支温度计,测量溶液的温度(如图)。根据温度随pH变化的图像(如图),判断该反应属于__________(选填“吸热”或“放热”)反应。B点比A点的温度低的原因是_____________。
(3)丙同学用另一瓶久置的氢氧化钠溶液进行上述实验时,发现有少量的气泡冒出。请写出产生气泡反应的化学方程式是_____________。若另取该溶液,滴加酚酞试液变红,_____________(选填“能”或“不能”)说明该氢氧化钠溶液为部分变质。
(4)丁同学对本地化工厂废水池中的氯化氢含量进行了测定(如图)。取废水100 g,用质量分数为20%的氢氧化钠溶液进行中和,通过计算知道废水中氯化氢的质量分数为_____________。
20.化学是以实验为基础的科学,实验是科学探究的重要手段。
(1)数字化装备正逐步进入校园,利用数字传感器可以测得酸与碱反应过程中溶液pH变化的图象。如图是盐酸与氢氧化钠溶液反应过程中的pH变化的图象。
①反应的化学方程式为_________________________。
②当溶液呈中性时,所消耗氢氧化钠溶液的体积是___________;
③图中b点所示溶液中,含有的溶质是____________。
(2)在“创新实验装置”的竞赛中,某化学兴趣小组设计了如图所示的装置(夹持仪器已略去),引起同学们的兴趣。
①请写出仪器M的名称_________,仪器M的优点_____________;
②打开M的活塞后,装置A中发生的反应方程式为_____________;
③打开M的活塞后,装置C中的现象为_____________________。
(3)实验室里,现有一瓶未知浓度的过氧化氢溶液,取该溶液34g于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是34.4g,将杯内剩余物质过滤、洗涤、干燥后得滤渣2g。计算:瓶内过氧化氢溶液中溶质的质量为____________________。
21.中和反应是一类重要的化学反应,某同学利用图1装置研究稀硫酸与氢氧化钠溶液反应的过程,并用pH和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。
(1)烧杯中发生反应的化学方程式为_____;
(2)仪器A中溶液中的微粒是_____(填符号);
(3)图3中V的数值最接近_____(填“6”、“12”或“16”);
(4)下列说法正确的是_____。
A 图2中b点所示溶液中的溶质是Na2SO4和NaOH;
B 图2中d点所示溶液中的微粒是Na+、SO42﹣、H+;
C 图2中c→d所示溶液中Na2SO4的质量不断增加;
D 图3中e→f变化趋势可说明该反应是放热反应。
(5)如果该实验中所用稀硫酸的质量分数位9.8%(假设这时所用稀硫酸的密度为1.0g/mL)。恰好完全反应时消耗氢氧化钠溶液的质量为8克。
则计算①所用氢氧化钠溶液中溶质的质量分数_____?
②计算恰好完全反应时所得溶液中溶质的质量分数_____?(结果精确至0.1%)
22.某化学兴趣小组三位同学在学习盐酸与氢氧化钠反应后,分别结合自己在实验室中所做的实验,各从不同方面对其进行图象描述。图A是实际操作图,图B是反应过程中溶液的酸碱度变化图,图C是微观粒子结合过程的示意图。按要求回答下列问题:
(1)根据图B的曲线变化,回答下列问题:
①该变化对应的实验操作是将 ___________ 滴加到另一种溶液中;
②当滴入溶液的质量为ag时,溶液中的溶质为___________________(填化学式);
③当溶液的pH=7时,溶液中的主要离子是_______________________(填离子符号);
(2)根据图C的微观粒子结合过程的示意图,可以得出以下结论:从反应前后离子的种类看,有些离子参与了反应,有些离子只是旁观者,该反应中参与反应的离子是_______。该反应的实质为___________。
(3)40g氢氧化钠溶液跟73g溶质质量分数为5%的稀盐酸恰好完全反应。这种氢氧化钠溶液中溶质的质量分数是 ______________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.C
3.A
4.B
5.C
6.D
7.D
8.C
9.D
10.A
11.D
12.C
13.A
14.B
15.D
16.C
17. Na+、Cl﹣、H+ 开始随着反应的进行,溶液温度逐渐升高 氢氧化钠固体溶于水放热 升温 30
18. 20g 、 7.3% 酚酞 无色恰好变成红色 不能 氢氧化钠固体溶于水放热,无法确定恰好反应的时间
19. 稀盐酸 由红色刚好褪为无色 放热 NaOH尚未反应完全 Na2CO3 +2HCl ═ 2NaCl + CO2↑+H2O 不能 3.65%
20. HCl+NaOH==NaCl+H2O 10 NaOH和NaCl 分液漏斗 通过控制液体的滴加速率和用量,能够控制反应发生的速率和产气量 Zn+H2SO4=== ZnSO4+ H2↑ 装置C中有溶液流入,生成蓝色沉淀 3.4g
21. H+、、H2O 12 ABD 12% 8.52%
22. NaOH溶液 HCl、NaCl Na+ 、Cl- H+ 、OH- 酸解离出的H+和碱解离出的OH- 结合生成H2O / H+和OH- 结合生成H2O 10%
答案第1页,共2页
答案第1页,共2页
