九年级化学沪教版(上海)第二学期 第六单元 常用的金属和盐练习题(word版有答案)
文档属性
| 名称 | 九年级化学沪教版(上海)第二学期 第六单元 常用的金属和盐练习题(word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 327.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-25 23:50:14 | ||
图片预览

文档简介
第6章常用的金属和盐练习题2021-2022学年九年级化学沪教版(上海)第二学期
一、单选题
1.分类是学习和研究化学的一种常见方法,下列分类正确的是
A.混合物:空气、溶液 B.有机物:CO2, CO (NH2)2
C.复合肥料:硝酸钾、硫酸铉 D.合成材料:合金、合成橡胶
2.为了减缓铁制品的锈蚀,下列做法错误的是
A.在车船的表面喷涂油漆
B.将使用后的菜刀用布擦干
C.洗净铁制品表面的油膜
D.在铁制品表面镀上一层锌
3.下列化学方程式中符合题意且书写正确的是
A.正常雨水偏弱酸性原因:SO3+H2O=H2SO4
B.生活中用天然气作燃料:C2H5OH+3O22CO2+3H2O
C.用小苏打治疗胃酸过多症:NaHCO3+HCl=NaCl+CO2↑+H2O
D.工业上用熟石灰制烧碱:Ca(OH)2+2NaNO3=Ca(NO3)2+2NaOH
4.关于复分解反应说法一定正确的是( )
A.反应物为酸和碱 B.伴随有明显现象
C.生成物为盐和水 D.元素化合价不变
5.化学与人类的科学技术、生产生活密切相关。下列说法错误的是( )
A.钛合金可应用于火箭和航天飞机
B.头盔缓冲层中的塑料属于合成材料
C.垃圾分类有利于废旧金属的回收利用
D.霉变的花生经冲洗、蒸煮后仍可食用
6.物质的性质与用途密切相关。 下列做法不合理的是
A.工业上用稀盐酸除铁锈
B.农业上用熟石灰改良酸性土壤
C.碳酸钠用于玻璃、 造纸、 洗涤剂的生产
D.水壶中的水垢(主要成分是碳酸钙和氢氧化镁) 用水清洗
7.下列反应的化学方程式与对应的括号内的现象都完全正确的是( )
A.4p+5O22P2O5(产生白雾)
B.2NaOH+CuCl2═Cu(OH)2↓+2NaCl(产生红褐色沉淀)
C.AgNO3+HCl═AgCl↓+HNO3(产生白色沉淀)
D.H2O2H2O+O2↑(冒气泡)
8.关于"家庭小实验"的下列说法正确的是
A.用自制简易净水器制纯水
B.向洗净的碎鸡蛋壳中加入食醋可产生一氧化碳
C.用白糖、果汁、小苏打、柠檬酸、水自制汽水
D.把钢针烧红放入水中冷却后取出,钢针变得更容易弯曲
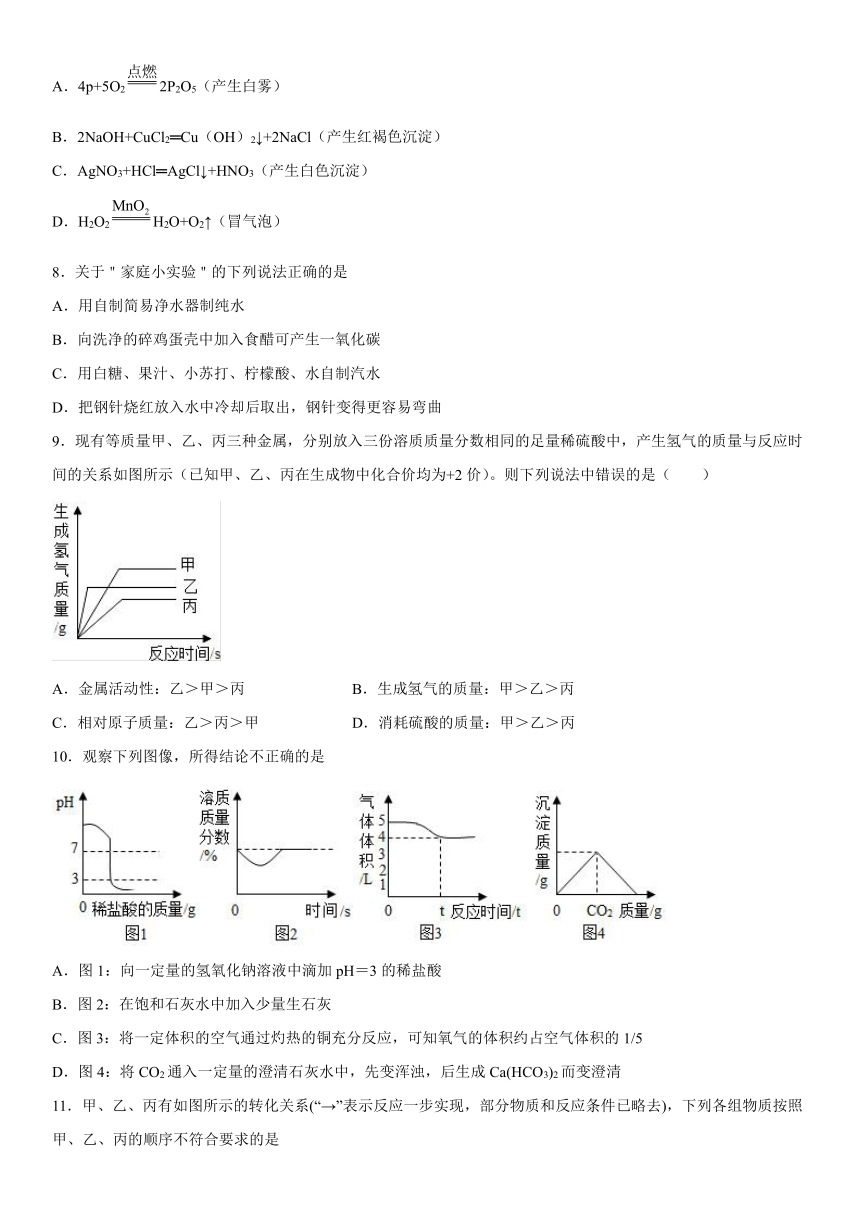
9.现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中化合价均为+2价)。则下列说法中错误的是( )
A.金属活动性:乙>甲>丙 B.生成氢气的质量:甲>乙>丙
C.相对原子质量:乙>丙>甲 D.消耗硫酸的质量:甲>乙>丙
10.观察下列图像,所得结论不正确的是
A.图1:向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
B.图2:在饱和石灰水中加入少量生石灰
C.图3:将一定体积的空气通过灼热的铜充分反应,可知氧气的体积约占空气体积的1/5
D.图4:将CO2通入一定量的澄清石灰水中,先变浑浊,后生成Ca(HCO3)2而变澄清
11.甲、乙、丙有如图所示的转化关系(“→”表示反应一步实现,部分物质和反应条件已略去),下列各组物质按照甲、乙、丙的顺序不符合要求的是
A.C、CO、CO2 B.H2O2、H2O、O2
C.KOH、K2CO3、KNO3 D.Fe2O3、FeCl3、Fe(OH)3
二、简答题
12.铝的化学性质很活泼,为什么通常铝制品却很耐腐蚀?________________为什么不宜用钢刷、沙等来擦洗铝制品?__________________.
13.为了提高农作物的产量,需要庄稼施肥.以玉米为例,每公顷需施用约1吨尿素,其中只有约20%被玉米吸收,其余会随水流入江中.请回答:
(1)说说你对此现象的看法_____;
(2)对此情况你的建议是_____.
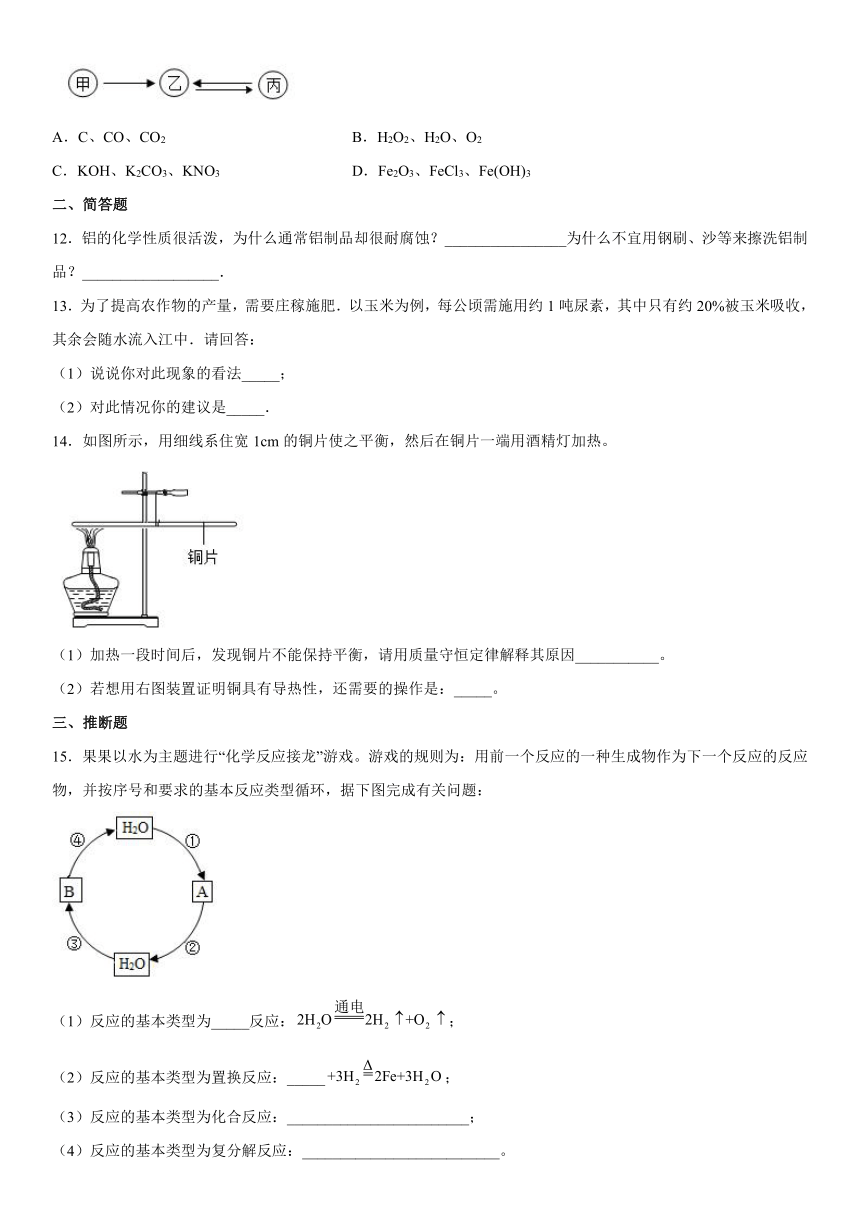
14.如图所示,用细线系住宽1cm的铜片使之平衡,然后在铜片一端用酒精灯加热。
(1)加热一段时间后,发现铜片不能保持平衡,请用质量守恒定律解释其原因___________。
(2)若想用右图装置证明铜具有导热性,还需要的操作是:_____。
三、推断题
15.果果以水为主题进行“化学反应接龙”游戏。游戏的规则为:用前一个反应的一种生成物作为下一个反应的反应物,并按序号和要求的基本反应类型循环,据下图完成有关问题:
(1)反应的基本类型为_____反应:;
(2)反应的基本类型为置换反应:_____;
(3)反应的基本类型为化合反应:________________________;
(4)反应的基本类型为复分解反应:__________________________。
16.A、B、C、D是初中化学常见的纯净物,A、B中只有一种是化合物,其转化关系如图所示,A为黑色粉末,C的相对分子质量小于D(图中反应条件及部分反应物、生成物已省略)。
(1)若B为红色粉末,C、D由人体中含量最多的无机物分解生成,则A的化学式是____________。
(2)若A、C、D均含同一种元素,A中两种元素的质量比为21:8,B为能被磁铁吸引的黑色粉末,C与D的相对分子质量之差为4,则:
①D的化学式是___________;
②A→B的化学方程式是_________________。
四、实验题
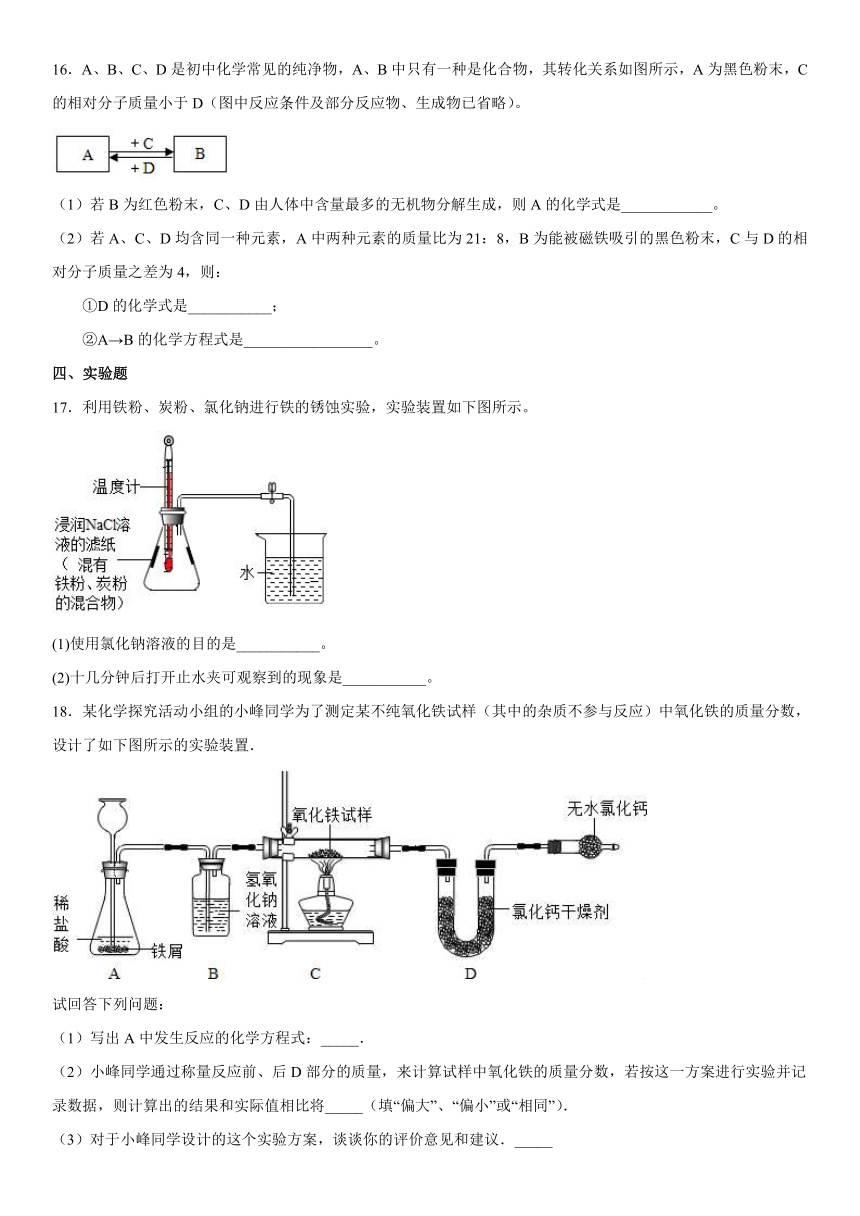
17.利用铁粉、炭粉、氯化钠进行铁的锈蚀实验,实验装置如下图所示。
(1)使用氯化钠溶液的目的是___________。
(2)十几分钟后打开止水夹可观察到的现象是___________。
18.某化学探究活动小组的小峰同学为了测定某不纯氧化铁试样(其中的杂质不参与反应)中氧化铁的质量分数,设计了如下图所示的实验装置.
试回答下列问题:
(1)写出A中发生反应的化学方程式:_____.
(2)小峰同学通过称量反应前、后D部分的质量,来计算试样中氧化铁的质量分数,若按这一方案进行实验并记录数据,则计算出的结果和实际值相比将_____(填“偏大”、“偏小”或“相同”).
(3)对于小峰同学设计的这个实验方案,谈谈你的评价意见和建议._____
19.课外小组同学用两种方法验证Zn、Fe、Cu的金属活动性顺序(如图)。
(1)方法1:向三只试管中加入的溶液A为稀盐酸,得出Zn的金属活动性比Fe强,依据的现象是__________。
(2)方法2:仅向试管①和③中加入溶液A,则A是__________。该过程中发生反应的化学方程式为__________。
五、计算题
20.纯碱(主要成分为碳酸钠)中常含有少量氯化钠。化学兴趣小组的同学为了测定实验室中某盐酸的溶质质量分数,称取了某品牌纯碱样品12g进行了以下实验:将样品置于烧杯中,取50g此稀盐酸分五次加入其中,测得的有关数据如下表所示。
第一次 第二次 第三次 第四次 第五次
加入稀盐酸质量/ 10 10 10 10 10
烧杯中剩余物的质量/ 20.9 29.8 47.6 57.6
试计算:
(1)表中a的值为______。
(2)实验中产生二氧化碳的总质量为______。
(3)所用稀盐酸中溶质的质量分数。(写出计算过程,计算结果保留一位小数)
21.取一定量铜粉、铁粉的混合物,加入足量稀硫酸,完全反应(酸溶)后过滤,将滤渣洗净、烘干后在足量氧气中充分灼烧(金属元素在产物中显+2价)。固体质量与各步实验的时间关系如图。
(1)原混合物中铁粉的质量为 g。
(2)求m的值。(写出计算过程)
(3)若实验过程中所加稀硫酸的量不足,所得m的值会 。(填“偏大”或“不变”或“偏小”)。
22.市售的食用纯碱往往含有少量氯化钠,探究小组以某品牌食用纯碱为样品测定其中Na2CO3的质量分数,实验过程如图:
请分析实验过程,回答:
(1)写出相关反应的化学方程式______。
(2)实验中加入“过量”CaCl2溶液,目的是______。
(3)若取用样品的质量为2.2g,且实验过程中无质量损失,最终得到沉淀的质量为2g。则2.2g纯碱样品中Na2CO3的质量为______克,该品牌食用纯碱中Na2CO3的质量分数为______。
23.常见的化肥的①尿素〔CO(NH2)2〕、②硝酸钾(KNO3)、③碳酸氢铵(NH4HCO3)、④硫酸钾(K2SO4)、⑤磷酸二氢钾(KH2PO4)等。
(1)以上五种肥料中属于复合肥的是_______(填数字序号)。
(2)工业上用液氨和二氧化碳为原料,在高温高压条件下直接合成尿素,化学反应方程式为: ;要合成 90 吨尿素,需要二氧化碳多少吨?
参考答案:
1.A
2.C
3.C
4.D
5.D
6.D
7.C
8.C
9.C
10.A
11.C
12. 铝在常温下与空气中的氧气发生化学反应,使铝的表面生成了一层致密的氧化铝薄膜,从而阻止了内部的铝进一步氧化 用钢刷、沙等来擦洗铝制品,能使铝的表面生成的致密的氧化铝薄膜除掉,起不到保护作用
13. 化肥的过量使用会造成水污染 应合理使用化肥,最好与农家肥混合使用
14. 在加热过程中,因为铜与氧气发生反应,所以反应后固体质量增加,本实验现象与质量守恒定律不矛盾 测试右端的铜片温度是否有升高
15. 分解 Fe2O3 Ca(OH)2+2HCl=CaCl2+2H2O
16. CuO O2 Fe3O4+4CO3Fe+4CO2
17.(1)加快反应速率
(2)水倒吸入锥形瓶中
18. Fe+2HCl═FeCl2+H2↑ 偏大 不正确,应在B和C之间加一个浓硫酸吸水装置
19. 产生气泡的速率①比②快 FeSO4溶液
20.(1)38.7;(2)4.4g
(3)根据反应生成二氧化碳的质量,可求出稀盐酸中溶质的质量,根据溶质质量分数的计算公式计算稀盐酸中溶质的质量分数。
设参加反应的HCl的总质量为x。
x=7.3g
稀盐酸中溶质的质量分数为(其他解法合理即可)
答:所用稀盐酸中溶质的质量分数为。
21.(1)2.6
(2)解:铜充分灼烧后生成氧化铜的质量为x
m即为反应后生成的氧化铜的质量,因此m=2
答:m的值为2
(3)偏大
22.(1)
(2)碳酸钠完全反应,使实验结果更准确
(3)解:设2.2g纯碱样品中碳酸钠的质量为x。
x=2.12g
该品牌食用纯碱中碳酸钠的质量分数=
答:2.2g纯碱样品中碳酸钠的质量是21.2g。该品牌食用纯碱中Na2CO3的质量分数是96.4%。
23.(1)②⑤
(2)设要合成 90 吨尿素,需要二氧化碳的质量为x,
x=66t
答:要合成 90 吨尿素,需要二氧化碳的质量为66t。
一、单选题
1.分类是学习和研究化学的一种常见方法,下列分类正确的是
A.混合物:空气、溶液 B.有机物:CO2, CO (NH2)2
C.复合肥料:硝酸钾、硫酸铉 D.合成材料:合金、合成橡胶
2.为了减缓铁制品的锈蚀,下列做法错误的是
A.在车船的表面喷涂油漆
B.将使用后的菜刀用布擦干
C.洗净铁制品表面的油膜
D.在铁制品表面镀上一层锌
3.下列化学方程式中符合题意且书写正确的是
A.正常雨水偏弱酸性原因:SO3+H2O=H2SO4
B.生活中用天然气作燃料:C2H5OH+3O22CO2+3H2O
C.用小苏打治疗胃酸过多症:NaHCO3+HCl=NaCl+CO2↑+H2O
D.工业上用熟石灰制烧碱:Ca(OH)2+2NaNO3=Ca(NO3)2+2NaOH
4.关于复分解反应说法一定正确的是( )
A.反应物为酸和碱 B.伴随有明显现象
C.生成物为盐和水 D.元素化合价不变
5.化学与人类的科学技术、生产生活密切相关。下列说法错误的是( )
A.钛合金可应用于火箭和航天飞机
B.头盔缓冲层中的塑料属于合成材料
C.垃圾分类有利于废旧金属的回收利用
D.霉变的花生经冲洗、蒸煮后仍可食用
6.物质的性质与用途密切相关。 下列做法不合理的是
A.工业上用稀盐酸除铁锈
B.农业上用熟石灰改良酸性土壤
C.碳酸钠用于玻璃、 造纸、 洗涤剂的生产
D.水壶中的水垢(主要成分是碳酸钙和氢氧化镁) 用水清洗
7.下列反应的化学方程式与对应的括号内的现象都完全正确的是( )
A.4p+5O22P2O5(产生白雾)
B.2NaOH+CuCl2═Cu(OH)2↓+2NaCl(产生红褐色沉淀)
C.AgNO3+HCl═AgCl↓+HNO3(产生白色沉淀)
D.H2O2H2O+O2↑(冒气泡)
8.关于"家庭小实验"的下列说法正确的是
A.用自制简易净水器制纯水
B.向洗净的碎鸡蛋壳中加入食醋可产生一氧化碳
C.用白糖、果汁、小苏打、柠檬酸、水自制汽水
D.把钢针烧红放入水中冷却后取出,钢针变得更容易弯曲
9.现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中化合价均为+2价)。则下列说法中错误的是( )
A.金属活动性:乙>甲>丙 B.生成氢气的质量:甲>乙>丙
C.相对原子质量:乙>丙>甲 D.消耗硫酸的质量:甲>乙>丙
10.观察下列图像,所得结论不正确的是
A.图1:向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
B.图2:在饱和石灰水中加入少量生石灰
C.图3:将一定体积的空气通过灼热的铜充分反应,可知氧气的体积约占空气体积的1/5
D.图4:将CO2通入一定量的澄清石灰水中,先变浑浊,后生成Ca(HCO3)2而变澄清
11.甲、乙、丙有如图所示的转化关系(“→”表示反应一步实现,部分物质和反应条件已略去),下列各组物质按照甲、乙、丙的顺序不符合要求的是
A.C、CO、CO2 B.H2O2、H2O、O2
C.KOH、K2CO3、KNO3 D.Fe2O3、FeCl3、Fe(OH)3
二、简答题
12.铝的化学性质很活泼,为什么通常铝制品却很耐腐蚀?________________为什么不宜用钢刷、沙等来擦洗铝制品?__________________.
13.为了提高农作物的产量,需要庄稼施肥.以玉米为例,每公顷需施用约1吨尿素,其中只有约20%被玉米吸收,其余会随水流入江中.请回答:
(1)说说你对此现象的看法_____;
(2)对此情况你的建议是_____.
14.如图所示,用细线系住宽1cm的铜片使之平衡,然后在铜片一端用酒精灯加热。
(1)加热一段时间后,发现铜片不能保持平衡,请用质量守恒定律解释其原因___________。
(2)若想用右图装置证明铜具有导热性,还需要的操作是:_____。
三、推断题
15.果果以水为主题进行“化学反应接龙”游戏。游戏的规则为:用前一个反应的一种生成物作为下一个反应的反应物,并按序号和要求的基本反应类型循环,据下图完成有关问题:
(1)反应的基本类型为_____反应:;
(2)反应的基本类型为置换反应:_____;
(3)反应的基本类型为化合反应:________________________;
(4)反应的基本类型为复分解反应:__________________________。
16.A、B、C、D是初中化学常见的纯净物,A、B中只有一种是化合物,其转化关系如图所示,A为黑色粉末,C的相对分子质量小于D(图中反应条件及部分反应物、生成物已省略)。
(1)若B为红色粉末,C、D由人体中含量最多的无机物分解生成,则A的化学式是____________。
(2)若A、C、D均含同一种元素,A中两种元素的质量比为21:8,B为能被磁铁吸引的黑色粉末,C与D的相对分子质量之差为4,则:
①D的化学式是___________;
②A→B的化学方程式是_________________。
四、实验题
17.利用铁粉、炭粉、氯化钠进行铁的锈蚀实验,实验装置如下图所示。
(1)使用氯化钠溶液的目的是___________。
(2)十几分钟后打开止水夹可观察到的现象是___________。
18.某化学探究活动小组的小峰同学为了测定某不纯氧化铁试样(其中的杂质不参与反应)中氧化铁的质量分数,设计了如下图所示的实验装置.
试回答下列问题:
(1)写出A中发生反应的化学方程式:_____.
(2)小峰同学通过称量反应前、后D部分的质量,来计算试样中氧化铁的质量分数,若按这一方案进行实验并记录数据,则计算出的结果和实际值相比将_____(填“偏大”、“偏小”或“相同”).
(3)对于小峰同学设计的这个实验方案,谈谈你的评价意见和建议._____
19.课外小组同学用两种方法验证Zn、Fe、Cu的金属活动性顺序(如图)。
(1)方法1:向三只试管中加入的溶液A为稀盐酸,得出Zn的金属活动性比Fe强,依据的现象是__________。
(2)方法2:仅向试管①和③中加入溶液A,则A是__________。该过程中发生反应的化学方程式为__________。
五、计算题
20.纯碱(主要成分为碳酸钠)中常含有少量氯化钠。化学兴趣小组的同学为了测定实验室中某盐酸的溶质质量分数,称取了某品牌纯碱样品12g进行了以下实验:将样品置于烧杯中,取50g此稀盐酸分五次加入其中,测得的有关数据如下表所示。
第一次 第二次 第三次 第四次 第五次
加入稀盐酸质量/ 10 10 10 10 10
烧杯中剩余物的质量/ 20.9 29.8 47.6 57.6
试计算:
(1)表中a的值为______。
(2)实验中产生二氧化碳的总质量为______。
(3)所用稀盐酸中溶质的质量分数。(写出计算过程,计算结果保留一位小数)
21.取一定量铜粉、铁粉的混合物,加入足量稀硫酸,完全反应(酸溶)后过滤,将滤渣洗净、烘干后在足量氧气中充分灼烧(金属元素在产物中显+2价)。固体质量与各步实验的时间关系如图。
(1)原混合物中铁粉的质量为 g。
(2)求m的值。(写出计算过程)
(3)若实验过程中所加稀硫酸的量不足,所得m的值会 。(填“偏大”或“不变”或“偏小”)。
22.市售的食用纯碱往往含有少量氯化钠,探究小组以某品牌食用纯碱为样品测定其中Na2CO3的质量分数,实验过程如图:
请分析实验过程,回答:
(1)写出相关反应的化学方程式______。
(2)实验中加入“过量”CaCl2溶液,目的是______。
(3)若取用样品的质量为2.2g,且实验过程中无质量损失,最终得到沉淀的质量为2g。则2.2g纯碱样品中Na2CO3的质量为______克,该品牌食用纯碱中Na2CO3的质量分数为______。
23.常见的化肥的①尿素〔CO(NH2)2〕、②硝酸钾(KNO3)、③碳酸氢铵(NH4HCO3)、④硫酸钾(K2SO4)、⑤磷酸二氢钾(KH2PO4)等。
(1)以上五种肥料中属于复合肥的是_______(填数字序号)。
(2)工业上用液氨和二氧化碳为原料,在高温高压条件下直接合成尿素,化学反应方程式为: ;要合成 90 吨尿素,需要二氧化碳多少吨?
参考答案:
1.A
2.C
3.C
4.D
5.D
6.D
7.C
8.C
9.C
10.A
11.C
12. 铝在常温下与空气中的氧气发生化学反应,使铝的表面生成了一层致密的氧化铝薄膜,从而阻止了内部的铝进一步氧化 用钢刷、沙等来擦洗铝制品,能使铝的表面生成的致密的氧化铝薄膜除掉,起不到保护作用
13. 化肥的过量使用会造成水污染 应合理使用化肥,最好与农家肥混合使用
14. 在加热过程中,因为铜与氧气发生反应,所以反应后固体质量增加,本实验现象与质量守恒定律不矛盾 测试右端的铜片温度是否有升高
15. 分解 Fe2O3 Ca(OH)2+2HCl=CaCl2+2H2O
16. CuO O2 Fe3O4+4CO3Fe+4CO2
17.(1)加快反应速率
(2)水倒吸入锥形瓶中
18. Fe+2HCl═FeCl2+H2↑ 偏大 不正确,应在B和C之间加一个浓硫酸吸水装置
19. 产生气泡的速率①比②快 FeSO4溶液
20.(1)38.7;(2)4.4g
(3)根据反应生成二氧化碳的质量,可求出稀盐酸中溶质的质量,根据溶质质量分数的计算公式计算稀盐酸中溶质的质量分数。
设参加反应的HCl的总质量为x。
x=7.3g
稀盐酸中溶质的质量分数为(其他解法合理即可)
答:所用稀盐酸中溶质的质量分数为。
21.(1)2.6
(2)解:铜充分灼烧后生成氧化铜的质量为x
m即为反应后生成的氧化铜的质量,因此m=2
答:m的值为2
(3)偏大
22.(1)
(2)碳酸钠完全反应,使实验结果更准确
(3)解:设2.2g纯碱样品中碳酸钠的质量为x。
x=2.12g
该品牌食用纯碱中碳酸钠的质量分数=
答:2.2g纯碱样品中碳酸钠的质量是21.2g。该品牌食用纯碱中Na2CO3的质量分数是96.4%。
23.(1)②⑤
(2)设要合成 90 吨尿素,需要二氧化碳的质量为x,
x=66t
答:要合成 90 吨尿素,需要二氧化碳的质量为66t。
