九年级化学人教版(五四学制)全一册 第四单元盐化肥提高练习(word版 含答案)
文档属性
| 名称 | 九年级化学人教版(五四学制)全一册 第四单元盐化肥提高练习(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 116.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-26 08:52:17 | ||
图片预览



文档简介
第四单元盐化肥提高练习2021-2022学年九年级化学人教版(五四学制)全一册
一、单选题
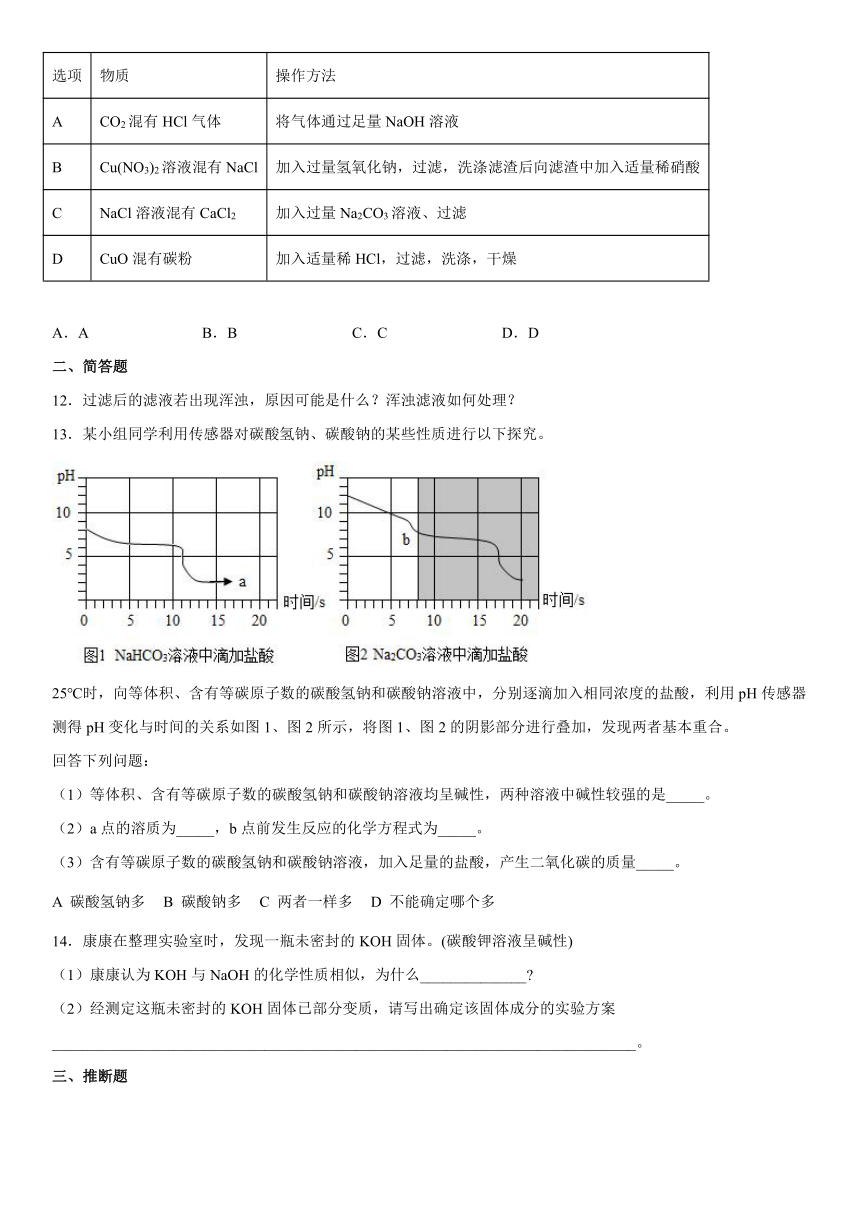
1.下列各组离子在溶液中能大量共存的是( )
A.NH、SO、NO
B.H+、Ba2+、OH-
C.Fe2+、Na+、OH-
D.Ca2+、Cl-、CO
2.下列做法不利于绿色城市创建,不利于保护环境的是( )
A.实行垃圾分类回收再利用
B.城市推广使用公共自行车
C.推广秸秆综合利用,杜绝露天焚烧
D.提高农作物产量,大量使用农药化肥物质
3.某同学总结的Ca(OH)2的化学性质如图。下列说法错误的是
A.向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色
B.反应②为放热反应
C.反应③可用于检验某种温室气体
D.甲一定是碳酸盐
4.下列实验设计能达到实验目的是( )
选项 实验目的 实验设计
A 除去氯化镁溶液中少量的硫酸镁 滴加过量的氯化钡溶液,过滤
B 比较Zn、Cu、Ag的金属活动性 将Zn和Ag分别放入CuSO4溶液中
C 检验二氧化碳 将燃着的木条伸入集气瓶内
D 除去CuO中Cu 加足量稀硫酸溶液、过滤
A.A B.B C.C D.D
5.关于复分解反应说法一定正确的是( )
A.反应物为酸和碱 B.伴随有明显现象
C.生成物为盐和水 D.元素化合价不变
6.下列各组固体物质,不能用水鉴别的是( )
A.KNO3、KCl
B.CaCO3、CaCl2
C.CuSO4、Na2SO4
D.NH4NO3、CaO
7.下列物质的用途是利用其物理性质的是
A.煤用于发电
B.铜丝作导线
C.氮气作保护气
D.小苏打用于发酵
8.下列除去杂质的方法不正确的是( )
A.FeSO4溶液(CuSO4):过量的铁粉过滤 B.H2(H2O):浓硫酸
C.CO2(CO):通过灼热的氧化铜粉末 D.CaO(CaCO3):稀盐酸
9.硝酸铵(NH4NO3)是一种高效化肥,它属于
A.氮肥 B.磷肥 C.钾肥 D.复合肥
10.如图,将胶头滴管中的物质X 滴入装有物质Y 的试管中,两物质充分反应。下列说法错误的是( )
A.X 为稀硫酸,若反应有气泡产生,则生成的气体一定是H2
B.X 为AgNO3溶液,Y 为Cu片,根据现象可判断金属活动性:Cu>Ag
C.X 为BaCl2溶液,Y 为Na2SO4溶液,反应产生白色沉淀
D.X 为稀盐酸,Y 为Al(OH)3,该反应可应用于治疗胃酸过多症
11.除去下列物质中混有的少量杂质所选用的操作方法,正确的是
选项 物质 操作方法
A CO2混有HCl气体 将气体通过足量NaOH溶液
B Cu(NO3)2溶液混有NaCl 加入过量氢氧化钠,过滤,洗涤滤渣后向滤渣中加入适量稀硝酸
C NaCl溶液混有CaCl2 加入过量Na2CO3溶液、过滤
D CuO混有碳粉 加入适量稀HCl,过滤,洗涤,干燥
A.A B.B C.C D.D
二、简答题
12.过滤后的滤液若出现浑浊,原因可能是什么?浑浊滤液如何处理?
13.某小组同学利用传感器对碳酸氢钠、碳酸钠的某些性质进行以下探究。
25℃时,向等体积、含有等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入相同浓度的盐酸,利用pH传感器测得pH变化与时间的关系如图1、图2所示,将图1、图2的阴影部分进行叠加,发现两者基本重合。
回答下列问题:
(1)等体积、含有等碳原子数的碳酸氢钠和碳酸钠溶液均呈碱性,两种溶液中碱性较强的是_____。
(2)a点的溶质为_____,b点前发生反应的化学方程式为_____。
(3)含有等碳原子数的碳酸氢钠和碳酸钠溶液,加入足量的盐酸,产生二氧化碳的质量_____。
A 碳酸氢钠多 B 碳酸钠多 C 两者一样多 D 不能确定哪个多
14.康康在整理实验室时,发现一瓶未密封的KOH固体。(碳酸钾溶液呈碱性)
(1)康康认为KOH与NaOH的化学性质相似,为什么______________
(2)经测定这瓶未密封的KOH固体已部分变质,请写出确定该固体成分的实验方案_____________________________________________________________________________。
三、推断题
15.某白色固体A可能含有碳酸钠、氯化钡、氢氧化钠中的一种或几种,进行如图实验:(流程中每一步都是恰好完全反应)
完成下列填空:
(1)根据上述实验分析,A中一定含有的物质是______,C中一定含有的溶质是______。
(2)为进一步确定固体A中可能存在的物质,对滤液C进行实验,完成下表。
实验操作 现象 结论
______ ______ A中有氢氧化钠
16.实验室有一包粉末状固体,老师说可能含硫酸铜、碳酸钠、硫酸钠、氢氧化钠、氯化钡中的一种或几种。某兴趣小组为探究其成分做了以下实验:
(1)取少量固体于试管中,向其中加入过量稀盐酸,充分反应后,产生气体X,得到无色溶液A。气体X的化学式为_____。
(2)取少量无色溶液A于试管中,向其中滴加过量的硫酸镁溶液,产生沉淀,过滤后得到滤液B。根据操作(1)和(2)的现象可知原固体中一定不含_____;若向滤液B中逐滴滴加氢氧化钠溶液至过量,在此过程中观察到的现象是__________。
(3)另取少量固体,向其中加入足量的水,充分搅拌后过滤,得到滤液C,向滤液C中通入少量二氧化碳,有白色沉淀产生,则滤液C中的溶质肯定含有___________。
通过实验,兴趣小组的同学确定了该固体的组成。
四、实验题
17.某初级中学学生为了探究化学实验室的一种黑色粉末和一瓶标签破损的无色溶液可能是什么物质,大胆猜想并设计实验进行验证.
【发现问题】当把黑色粉末与无色溶液混合时即产生气泡.
【查阅资料】初中化学实验室常见的黑色粉末:氧化铜、二氧化锰、四氧化三铁、铁粉、炭粉.
【提出假设】黑色粉末是______________,无色溶液是______________.
【设计实验】向盛有少许黑色粉末的试管中加入适量的无色溶液,用___________法收集一试管气体;检验该气体___________________.
【实验结论】此气体是______________________,原假设成立.
18.下列是关于盐酸和硫酸性质的研究实验,请回答下列问题。
(1)图1实验过程中的现象是_____。写出A烧杯的溶液中发生反应的化学方程式_____。
(2)图2中电子天平上表面皿中盛有浓H2SO4,放置一段时间,天平示数变化如图乙所示,说明浓硫酸具有_____性。
(3)图3中的操作存在一处错误,请改正:_____。
19.做中和反应实验时,我将稀盐酸滴入氢氧化钠溶液中,意外看到有气泡产生。小伟提醒:是不是拿错了药品?我查验后确认药品没错,只是在瓶口发现有白色粉末状物质。我认为是氢氧化钠溶液变质了。
⑴ 氢氧化钠溶液变质的原因是____________________________________。
⑵ 利用与上述实验不同的原理,我又设计了一个实验再次确认该氢氧化钠溶液已变质。
实验步骤 实验现象 实验结论
取少量氧氧化钠溶液于试管中,滴加 _________________ ______________ 该氢氧化钠溶液已变质
⑶ 该氢氧化钠溶液是部分变质还是全部变质?
实验步骤 实验现象 实验结论
______________________ ____________ 该氢氧化钠 溶液_______变质
写出(3)中所涉及到的一个化学方程式_________________________________
⑷ 如何用该变质的溶液来制取氢氧化钠溶液? 简述实验步骤。_________
五、计算题
20.某化学兴趣活动小组用采集的石灰岩样品进行相关实验。将采集到的样品用水冲洗后晾干,称取20.00g样品平均分成两份,分别与足量相同的稀盐酸反应,测定释放出二氧化碳的质量与反应时间的关系如图所示。
(1)由图中曲线可以看出,固体物质与液体物质反应,当其他条件相同时,接触面积越 ,其反应速率越 。
(2)求样品中碳酸钙的质量分数(假设样品中其他杂质不参加反应,不考虑水、氯化氢逸出)。
21.某兴趣小组同学将100g氢氧化钠溶液分五次加入到139.6g硫酸铜溶液中,测得实验数据如下表所示:
第一次 第二次 第三次 第四次 第五次
氢氧化钠溶液的质量/g 20 20 20 20 20
沉淀质量/g 4.9 9.8 m 19.6 19.6
(1)表格中m的值为多少。
(2)计算恰好完全反应时所得溶液中溶质的质量分数。(写出计算过程)
22.厨房中使用的食用碱(主要成分碳酸钠)中往往含有少量的氯化钠,化学兴趣小组的同学通过实验来测定某品牌的食用碱样品中碳酸钠的质量分数。他们实验的过程和数据如下图所示。
计算:该食用碱中碳酸钠的质量分数是__________ (计算结果精确至0.1%)
23.为测定实验室中某硫酸铜样品中硫酸铜的质量分数(所含杂质溶于水,但不参与反应),进行了图所示的实验。请计算:
(1)a=______。
(2)该样品中硫酸铜的质量分数。
参考答案:
1.A
2.D
3.D
4.B
5.D
6.A
7.B
8.D
9.A
10.A
11.B
12.原因可能是滤纸破损或液面高于滤纸边缘。浑浊滤液应重新过滤。
13. 碳酸钠(或Na2CO3) NaCl、HCl Na2CO3+HCl=NaCl+NaHCO3 C
14. 都含有氢氧根离子 取少量样品,溶于水配成溶液,加入足量CaCl2溶液(或BaCl2溶液等),有沉淀产生,证明有K2CO3;向上层清液滴加几滴酚酞溶液,溶液变成红色,证明有KOH。
15. Na2CO3、BaCl2(或填碳酸钠和氯化钡) NaC1(或填氯化钠) 取少量滤液C于试管中,滴加无色酚酞 滤液变为红色(答案不唯一,合理即可)
16. CO2 CuSO4、Na2SO4 刚开始滴加氢氧化钠无现象,一段时间之后产生白色沉淀 NaOH、BaCl2
17. MnO2 H2O2 排水集气法 用带火星的木条伸入试管中,带火星的木条复燃 O2
18. 大烧杯内出现白雾,A烧杯中出现白色沉淀 吸水 将浓硫酸缓慢注入水中
19. 与空气中的CO2反应 Ba(OH)2 [ 或BaCl2 或Ba(NO3)2或Ca(OH)2 或CaCl2 或Ca(NO3)2] 生成白色沉淀 1.取少量样品于试管中,加入足量的BaCl2溶液[或CaCl2溶液或Ba(NO3)2溶液或Ca(NO3)2溶液……]2.过滤,在滤液中滴加几滴无色酚酞溶液 1.生成白色沉淀.2.酚酞溶液变.红 .
生红褐色沉淀[或不产生红褐色沉淀 部分变质 BaCl2+Na2CO3==BaCO3↓+2NaCl[或 CaCl2+Na2CO3==CaCO3↓+2NaCl、
或Ba(NO3)2+Na2CO3==BaCO3↓+2NaNO3、或Ca(NO3)2+Na2CO3==CaCO3↓+2NaNO3 向溶液中滴加氢氧化钙溶液直至不再产生沉淀为止,过滤,所得滤液为氢氧化钠溶液
20.(1) 大 快 (或 小 慢) (2)75%
21.(1)14.7g;(2)14.2%
22.88.3%
23.(1)10
(2)96%
解:由题意知,硫酸铜样品中所含杂质溶于水,所以滤渣的质量为氢氧化铜的质量,
设参加反应的硫酸铜质量为x,
样品中硫酸铜的质量分数为×100%=96%;
答:样品中硫酸铜的质量分数为96%。
一、单选题
1.下列各组离子在溶液中能大量共存的是( )
A.NH、SO、NO
B.H+、Ba2+、OH-
C.Fe2+、Na+、OH-
D.Ca2+、Cl-、CO
2.下列做法不利于绿色城市创建,不利于保护环境的是( )
A.实行垃圾分类回收再利用
B.城市推广使用公共自行车
C.推广秸秆综合利用,杜绝露天焚烧
D.提高农作物产量,大量使用农药化肥物质
3.某同学总结的Ca(OH)2的化学性质如图。下列说法错误的是
A.向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色
B.反应②为放热反应
C.反应③可用于检验某种温室气体
D.甲一定是碳酸盐
4.下列实验设计能达到实验目的是( )
选项 实验目的 实验设计
A 除去氯化镁溶液中少量的硫酸镁 滴加过量的氯化钡溶液,过滤
B 比较Zn、Cu、Ag的金属活动性 将Zn和Ag分别放入CuSO4溶液中
C 检验二氧化碳 将燃着的木条伸入集气瓶内
D 除去CuO中Cu 加足量稀硫酸溶液、过滤
A.A B.B C.C D.D
5.关于复分解反应说法一定正确的是( )
A.反应物为酸和碱 B.伴随有明显现象
C.生成物为盐和水 D.元素化合价不变
6.下列各组固体物质,不能用水鉴别的是( )
A.KNO3、KCl
B.CaCO3、CaCl2
C.CuSO4、Na2SO4
D.NH4NO3、CaO
7.下列物质的用途是利用其物理性质的是
A.煤用于发电
B.铜丝作导线
C.氮气作保护气
D.小苏打用于发酵
8.下列除去杂质的方法不正确的是( )
A.FeSO4溶液(CuSO4):过量的铁粉过滤 B.H2(H2O):浓硫酸
C.CO2(CO):通过灼热的氧化铜粉末 D.CaO(CaCO3):稀盐酸
9.硝酸铵(NH4NO3)是一种高效化肥,它属于
A.氮肥 B.磷肥 C.钾肥 D.复合肥
10.如图,将胶头滴管中的物质X 滴入装有物质Y 的试管中,两物质充分反应。下列说法错误的是( )
A.X 为稀硫酸,若反应有气泡产生,则生成的气体一定是H2
B.X 为AgNO3溶液,Y 为Cu片,根据现象可判断金属活动性:Cu>Ag
C.X 为BaCl2溶液,Y 为Na2SO4溶液,反应产生白色沉淀
D.X 为稀盐酸,Y 为Al(OH)3,该反应可应用于治疗胃酸过多症
11.除去下列物质中混有的少量杂质所选用的操作方法,正确的是
选项 物质 操作方法
A CO2混有HCl气体 将气体通过足量NaOH溶液
B Cu(NO3)2溶液混有NaCl 加入过量氢氧化钠,过滤,洗涤滤渣后向滤渣中加入适量稀硝酸
C NaCl溶液混有CaCl2 加入过量Na2CO3溶液、过滤
D CuO混有碳粉 加入适量稀HCl,过滤,洗涤,干燥
A.A B.B C.C D.D
二、简答题
12.过滤后的滤液若出现浑浊,原因可能是什么?浑浊滤液如何处理?
13.某小组同学利用传感器对碳酸氢钠、碳酸钠的某些性质进行以下探究。
25℃时,向等体积、含有等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入相同浓度的盐酸,利用pH传感器测得pH变化与时间的关系如图1、图2所示,将图1、图2的阴影部分进行叠加,发现两者基本重合。
回答下列问题:
(1)等体积、含有等碳原子数的碳酸氢钠和碳酸钠溶液均呈碱性,两种溶液中碱性较强的是_____。
(2)a点的溶质为_____,b点前发生反应的化学方程式为_____。
(3)含有等碳原子数的碳酸氢钠和碳酸钠溶液,加入足量的盐酸,产生二氧化碳的质量_____。
A 碳酸氢钠多 B 碳酸钠多 C 两者一样多 D 不能确定哪个多
14.康康在整理实验室时,发现一瓶未密封的KOH固体。(碳酸钾溶液呈碱性)
(1)康康认为KOH与NaOH的化学性质相似,为什么______________
(2)经测定这瓶未密封的KOH固体已部分变质,请写出确定该固体成分的实验方案_____________________________________________________________________________。
三、推断题
15.某白色固体A可能含有碳酸钠、氯化钡、氢氧化钠中的一种或几种,进行如图实验:(流程中每一步都是恰好完全反应)
完成下列填空:
(1)根据上述实验分析,A中一定含有的物质是______,C中一定含有的溶质是______。
(2)为进一步确定固体A中可能存在的物质,对滤液C进行实验,完成下表。
实验操作 现象 结论
______ ______ A中有氢氧化钠
16.实验室有一包粉末状固体,老师说可能含硫酸铜、碳酸钠、硫酸钠、氢氧化钠、氯化钡中的一种或几种。某兴趣小组为探究其成分做了以下实验:
(1)取少量固体于试管中,向其中加入过量稀盐酸,充分反应后,产生气体X,得到无色溶液A。气体X的化学式为_____。
(2)取少量无色溶液A于试管中,向其中滴加过量的硫酸镁溶液,产生沉淀,过滤后得到滤液B。根据操作(1)和(2)的现象可知原固体中一定不含_____;若向滤液B中逐滴滴加氢氧化钠溶液至过量,在此过程中观察到的现象是__________。
(3)另取少量固体,向其中加入足量的水,充分搅拌后过滤,得到滤液C,向滤液C中通入少量二氧化碳,有白色沉淀产生,则滤液C中的溶质肯定含有___________。
通过实验,兴趣小组的同学确定了该固体的组成。
四、实验题
17.某初级中学学生为了探究化学实验室的一种黑色粉末和一瓶标签破损的无色溶液可能是什么物质,大胆猜想并设计实验进行验证.
【发现问题】当把黑色粉末与无色溶液混合时即产生气泡.
【查阅资料】初中化学实验室常见的黑色粉末:氧化铜、二氧化锰、四氧化三铁、铁粉、炭粉.
【提出假设】黑色粉末是______________,无色溶液是______________.
【设计实验】向盛有少许黑色粉末的试管中加入适量的无色溶液,用___________法收集一试管气体;检验该气体___________________.
【实验结论】此气体是______________________,原假设成立.
18.下列是关于盐酸和硫酸性质的研究实验,请回答下列问题。
(1)图1实验过程中的现象是_____。写出A烧杯的溶液中发生反应的化学方程式_____。
(2)图2中电子天平上表面皿中盛有浓H2SO4,放置一段时间,天平示数变化如图乙所示,说明浓硫酸具有_____性。
(3)图3中的操作存在一处错误,请改正:_____。
19.做中和反应实验时,我将稀盐酸滴入氢氧化钠溶液中,意外看到有气泡产生。小伟提醒:是不是拿错了药品?我查验后确认药品没错,只是在瓶口发现有白色粉末状物质。我认为是氢氧化钠溶液变质了。
⑴ 氢氧化钠溶液变质的原因是____________________________________。
⑵ 利用与上述实验不同的原理,我又设计了一个实验再次确认该氢氧化钠溶液已变质。
实验步骤 实验现象 实验结论
取少量氧氧化钠溶液于试管中,滴加 _________________ ______________ 该氢氧化钠溶液已变质
⑶ 该氢氧化钠溶液是部分变质还是全部变质?
实验步骤 实验现象 实验结论
______________________ ____________ 该氢氧化钠 溶液_______变质
写出(3)中所涉及到的一个化学方程式_________________________________
⑷ 如何用该变质的溶液来制取氢氧化钠溶液? 简述实验步骤。_________
五、计算题
20.某化学兴趣活动小组用采集的石灰岩样品进行相关实验。将采集到的样品用水冲洗后晾干,称取20.00g样品平均分成两份,分别与足量相同的稀盐酸反应,测定释放出二氧化碳的质量与反应时间的关系如图所示。
(1)由图中曲线可以看出,固体物质与液体物质反应,当其他条件相同时,接触面积越 ,其反应速率越 。
(2)求样品中碳酸钙的质量分数(假设样品中其他杂质不参加反应,不考虑水、氯化氢逸出)。
21.某兴趣小组同学将100g氢氧化钠溶液分五次加入到139.6g硫酸铜溶液中,测得实验数据如下表所示:
第一次 第二次 第三次 第四次 第五次
氢氧化钠溶液的质量/g 20 20 20 20 20
沉淀质量/g 4.9 9.8 m 19.6 19.6
(1)表格中m的值为多少。
(2)计算恰好完全反应时所得溶液中溶质的质量分数。(写出计算过程)
22.厨房中使用的食用碱(主要成分碳酸钠)中往往含有少量的氯化钠,化学兴趣小组的同学通过实验来测定某品牌的食用碱样品中碳酸钠的质量分数。他们实验的过程和数据如下图所示。
计算:该食用碱中碳酸钠的质量分数是__________ (计算结果精确至0.1%)
23.为测定实验室中某硫酸铜样品中硫酸铜的质量分数(所含杂质溶于水,但不参与反应),进行了图所示的实验。请计算:
(1)a=______。
(2)该样品中硫酸铜的质量分数。
参考答案:
1.A
2.D
3.D
4.B
5.D
6.A
7.B
8.D
9.A
10.A
11.B
12.原因可能是滤纸破损或液面高于滤纸边缘。浑浊滤液应重新过滤。
13. 碳酸钠(或Na2CO3) NaCl、HCl Na2CO3+HCl=NaCl+NaHCO3 C
14. 都含有氢氧根离子 取少量样品,溶于水配成溶液,加入足量CaCl2溶液(或BaCl2溶液等),有沉淀产生,证明有K2CO3;向上层清液滴加几滴酚酞溶液,溶液变成红色,证明有KOH。
15. Na2CO3、BaCl2(或填碳酸钠和氯化钡) NaC1(或填氯化钠) 取少量滤液C于试管中,滴加无色酚酞 滤液变为红色(答案不唯一,合理即可)
16. CO2 CuSO4、Na2SO4 刚开始滴加氢氧化钠无现象,一段时间之后产生白色沉淀 NaOH、BaCl2
17. MnO2 H2O2 排水集气法 用带火星的木条伸入试管中,带火星的木条复燃 O2
18. 大烧杯内出现白雾,A烧杯中出现白色沉淀 吸水 将浓硫酸缓慢注入水中
19. 与空气中的CO2反应 Ba(OH)2 [ 或BaCl2 或Ba(NO3)2或Ca(OH)2 或CaCl2 或Ca(NO3)2] 生成白色沉淀 1.取少量样品于试管中,加入足量的BaCl2溶液[或CaCl2溶液或Ba(NO3)2溶液或Ca(NO3)2溶液……]2.过滤,在滤液中滴加几滴无色酚酞溶液 1.生成白色沉淀.2.酚酞溶液变.红 .
生红褐色沉淀[或不产生红褐色沉淀 部分变质 BaCl2+Na2CO3==BaCO3↓+2NaCl[或 CaCl2+Na2CO3==CaCO3↓+2NaCl、
或Ba(NO3)2+Na2CO3==BaCO3↓+2NaNO3、或Ca(NO3)2+Na2CO3==CaCO3↓+2NaNO3 向溶液中滴加氢氧化钙溶液直至不再产生沉淀为止,过滤,所得滤液为氢氧化钠溶液
20.(1) 大 快 (或 小 慢) (2)75%
21.(1)14.7g;(2)14.2%
22.88.3%
23.(1)10
(2)96%
解:由题意知,硫酸铜样品中所含杂质溶于水,所以滤渣的质量为氢氧化铜的质量,
设参加反应的硫酸铜质量为x,
样品中硫酸铜的质量分数为×100%=96%;
答:样品中硫酸铜的质量分数为96%。
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
