第四单元盐 化肥练习题—2021-2022学年九年级化学人教版(五四学制)全一册(word版 含答案)
文档属性
| 名称 | 第四单元盐 化肥练习题—2021-2022学年九年级化学人教版(五四学制)全一册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 61.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-26 09:32:29 | ||
图片预览


文档简介
第四单元《盐化肥》练习题—2021-2022学年九年级化学人教版(五四学制)全一册
一、单选题
1.磷酸二氢铵(NH4H2PO4)可增强农作物的抗旱能力。这种化肥是
A.钾肥 B.磷肥 C.氮肥 D.复合肥
2.下列对物质颜色的描述不正确的是( )
A.四氧化三铁是黑色的 B.纯铁是黑色的
C.硫酸亚铁溶液是浅绿色的 D.硫酸铜溶液是蓝色的
3.下列说法正确的是
A.NaHCO3俗称苏打
B.CaCO3可用作补钙剂
C.Na2CO3俗称火碱
D.K2CO3属于复合肥
4.下列物质由离子构成的是( )
A.氦气 B.水 C.氯化钠 D.金刚石
5.将珍珠加入稀盐酸中,有气泡产生,生成的气体能使澄清石灰水变浑浊,则珍珠中含有下列离子中的( )
A.氯离子 B.硫酸根离子 C.碳酸根离子 D.氢氧根离子
6.民族英雄于谦的《石灰吟》:“千锤万凿出深山,烈火焚烧若等闲。粉身碎骨浑不怕,要留清白在人间”。请你找出符合诗句中物质变化顺序的选项
A.CaCO3→Ca(OH)2→CaO→CaCO3 B.CaCO3→CaO→Ca(OH)2→CaCO3
C.CaO→Ca(OH)2→CaCl2→CaCO3 D.Ca(OH)2→CaCO3→CaO→Ca(OH)2
7.下列化肥属于复合肥料的是
A.KCl
B.Ca2(PO4)3
C.KNO3
D.CO(NH2)2
8.小明外出游玩,发现路边的小麦叶子发黄、有倒伏现象,他建议田主应该施用一种复合肥料,这种复合肥料是
A.CO(NH2)2
B.KCl
C.KNO3
D.NH4HCO3
9.下列实验设计能达到实验目的是( )
选项 实验目的 实验设计
A 除去氯化镁溶液中少量的硫酸镁 滴加过量的氯化钡溶液,过滤
B 比较Zn、Cu、Ag的金属活动性 将Zn和Ag分别放入CuSO4溶液中
C 检验二氧化碳 将燃着的木条伸入集气瓶内
D 除去CuO中Cu 加足量稀硫酸溶液、过滤
A.A B.B C.C D.D
10.党的十九大提出要加快生态文明体制改革,建设美丽中国。下列做法正确的是
A.为保护环境,把废旧电池深埋处理
B.为增加粮食产量,大量使用农药、化肥
C.为节约水资源,用工业废水直接灌溉农田
D.为节约资源,大力开发新能源替代化石燃料
二、简答题
11.请用化学方程式表示下列原理。
(1)用锡焊接钢板时,焊接处要滴加稀盐酸除锈,其原理方程式:_________; 然后必须用水把残留的酸液冲洗干净的原因是_____(文字表述)。
(2)检验氢氧化钠是否变质的化学反应方程式_____。
12.溶液对于自然界中的生命活动和人类生产活动具有重要的意义,多角度认识溶液有助于指导我们的生活。
(1)关于溶液的说法,正确的是_________(填写标号)
A.溶液中各部分的性质相同B.均一、稳定的液体一定是溶液
C.浓溶液不一定是饱和溶液D.溶液加水稀释后溶质的质量变小
(2)表1是部分物质在20℃时的溶解性;表Ⅱ是氯化钠、碳酸钠在不同温度时的溶解度。
离子 OH- Cl- CO32- SO42-
K+ 溶 溶 溶 溶
Mg2+ 不 溶 微 溶
.Ba2+. 溶 溶 不
温度 (℃) 0 10 20 30 40
氯化钠(g) 35 35.5 36 36.5 37
碳酸钠(g) 6 10 18 36.5 50
表1空格中应填写________;分析表Ⅱ可知,氯化钠和碳酸钠的饱和溶液溶质质量分数相同时的温度是___。
(3)简单解释“夏天晒盐、冬天捞碱”的科学原理__________。
三、推断题
13.现有三种固体:铁粉、铜粉、Cu(OH)2。五种溶液:CuSO4,NaOH,FeSO4,,Na2SO4,稀硫酸。它们之间存在如下关系:
(1)A溶液+C溶液→固体甲+D溶液。
(2)固体乙+B溶液→E溶液+H2↑。
(3)固体甲+B溶液→C溶液+H2O。
试写出上述三个反应的化学方程式。
(1)_______;
(2)_______;
(3)_______。
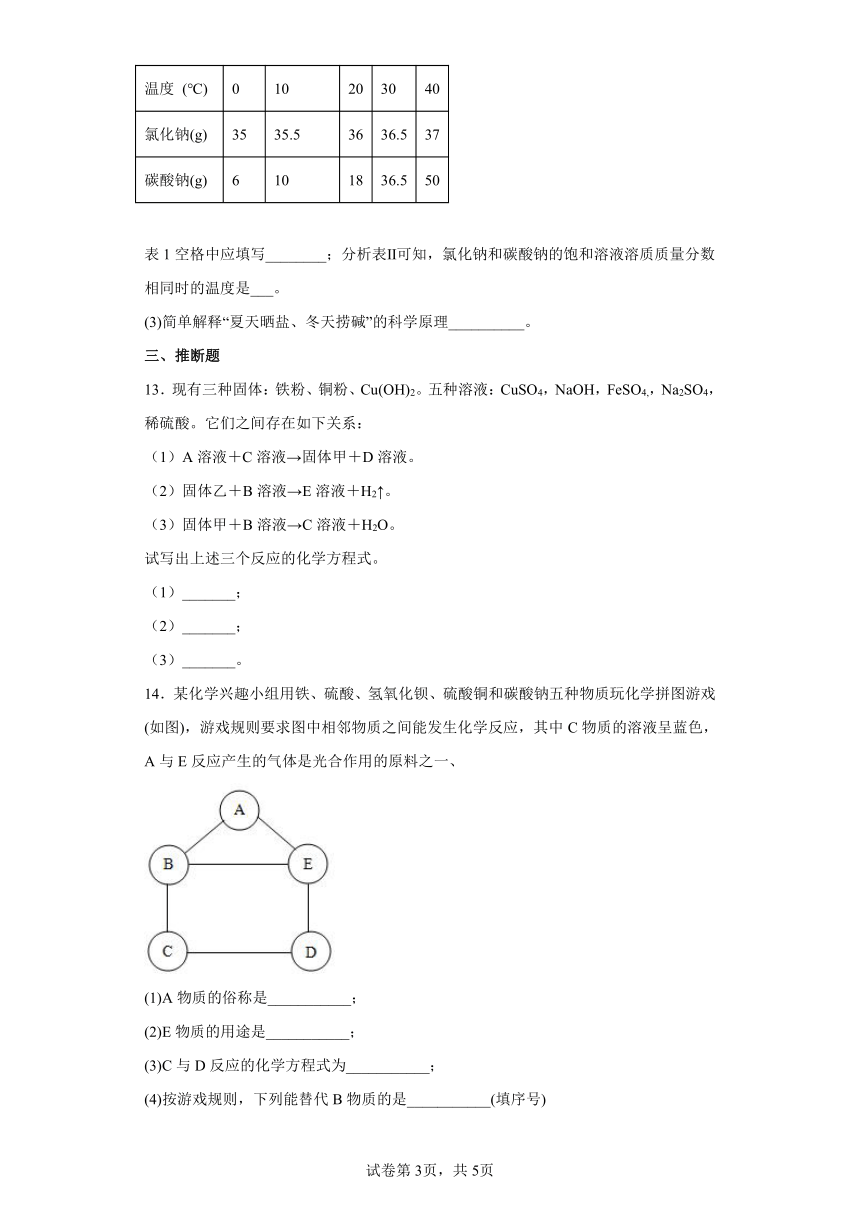
14.某化学兴趣小组用铁、硫酸、氢氧化钡、硫酸铜和碳酸钠五种物质玩化学拼图游戏(如图),游戏规则要求图中相邻物质之间能发生化学反应,其中C物质的溶液呈蓝色,A与E反应产生的气体是光合作用的原料之一、
(1)A物质的俗称是___________;
(2)E物质的用途是___________;
(3)C与D反应的化学方程式为___________;
(4)按游戏规则,下列能替代B物质的是___________(填序号)
①银 ②氯化铁
③氯化钡 ④氧化铜
四、实验题
15.某初级中学学生为了探究化学实验室的一种黑色粉末和一瓶标签破损的无色溶液可能是什么物质,大胆猜想并设计实验进行验证.
【发现问题】当把黑色粉末与无色溶液混合时即产生气泡.
【查阅资料】初中化学实验室常见的黑色粉末:氧化铜、二氧化锰、四氧化三铁、铁粉、炭粉.
【提出假设】黑色粉末是______________,无色溶液是______________.
【设计实验】向盛有少许黑色粉末的试管中加入适量的无色溶液,用___________法收集一试管气体;检验该气体___________________.
【实验结论】此气体是______________________,原假设成立.
16.如图所示,在一只烧杯中进行实验。
请补全实验方案
序号 目的 步骤
A 检验NaCl中混有Na2CO3 ①加入少量样品;②加入适量水至全部溶解; ③加入______
B 验证NaCl不能无限溶解 20°C时①加入100g水;②加入10gNaCl; ③加入_____(已知:20℃时,NaCl的溶解度为36g)
C 配制_____ 加入5gNaCl;②加入95g水;③搅拌至全部溶解
五、计算题
17.某化学小组进行硫酸铜溶液和氢氧化钠溶液相混合的实验实验过程及数据如下图所示:[反应原理为]。
计算氢氧化钠溶液中溶质的质量分数。
18.食盐是我们必不可少的调味品,现在市场上有一种健康平衡盐,适量食用可维持人体Na+、K+等重要离子的平衡。如图是某品牌健康平衡盐的部分说明:
请回答:
(1)在物质分类上,氯化钠和氯化钾都属于 (选填“酸”、“碱”或“盐”)。
(2)中国营养学会推荐成人每天摄入K的质量在2000~4000毫克之间,若一个人每天需要摄入K的质量是2000毫克,其中10%来自该平衡盐,以该平衡盐每100克所含K18克计,他每天需要摄入该平衡盐 克(精确到0.1克)。
19.现有一包含有氯化钠和碳酸钠的固体混合物,为测定其成分,取一定质量的混合物于试管中,加入103g稀盐酸,恰好完全反应,生成的气体全部逸出,得到4.4g气体。将所得溶液冷却至t℃,恰好成为该温度下的饱和溶液,经测定溶液中的溶质含钠元素的质量为13.8g,求所得溶液中溶质的质量分数。(结果精确到0.1%)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.B
3.B
4.C
5.C
6.B
7.C
8.C
9.B
10.D
11. Fe2O3+6HCl=2FeCl3+3H2O 残余的稀盐酸会腐蚀钢板和铁继续反应,生产氯化亚铁和氢气;
12. A、C 不 30 “夏天晒盐”是因为食盐的溶解度受温度变化的影响不大,夏天气温高,水分蒸发快,食盐易结晶析出.“冬天捞碱”,是因为纯碱的溶解度受温度变化的影响较大,冬天气温低,纯碱易结晶析出
13.
14.(1)纯碱或苏打
(2)金属除锈、做化工原料
(3)
(4)③
15. MnO2 H2O2 排水集气法 用带火星的木条伸入试管中,带火星的木条复燃 O2
16. 稀盐酸(或稀硫酸,合理即可) 超过26g的氯化钠(合理即可) 100g溶质质量分数为5%的氯化钠溶液
17.解:设参加反应的氢氧化钠质量为x。
x=4g
×100%=8%
答:氢氧化钠溶液中溶质的质量分数为8%。
18.(1)盐 (2)1.1
19.解:反应后溶液中溶质氯化钠的质量=13.8g÷×100%=35.1g
设原混合物中碳酸钠的质量为x,生成的氯化钠的质量为y
= x=10.6g
= y=11.7g
反应前混合物中氯化钠的质量=35.1g 11.7g=23.4g
反应后溶液的质量=10.6g+23.4g+103g 4.4g=132.6g
所得溶液中溶质的质量分数=×100%≈26.5%
答:所得溶液中溶质的质量分数为26.5%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.磷酸二氢铵(NH4H2PO4)可增强农作物的抗旱能力。这种化肥是
A.钾肥 B.磷肥 C.氮肥 D.复合肥
2.下列对物质颜色的描述不正确的是( )
A.四氧化三铁是黑色的 B.纯铁是黑色的
C.硫酸亚铁溶液是浅绿色的 D.硫酸铜溶液是蓝色的
3.下列说法正确的是
A.NaHCO3俗称苏打
B.CaCO3可用作补钙剂
C.Na2CO3俗称火碱
D.K2CO3属于复合肥
4.下列物质由离子构成的是( )
A.氦气 B.水 C.氯化钠 D.金刚石
5.将珍珠加入稀盐酸中,有气泡产生,生成的气体能使澄清石灰水变浑浊,则珍珠中含有下列离子中的( )
A.氯离子 B.硫酸根离子 C.碳酸根离子 D.氢氧根离子
6.民族英雄于谦的《石灰吟》:“千锤万凿出深山,烈火焚烧若等闲。粉身碎骨浑不怕,要留清白在人间”。请你找出符合诗句中物质变化顺序的选项
A.CaCO3→Ca(OH)2→CaO→CaCO3 B.CaCO3→CaO→Ca(OH)2→CaCO3
C.CaO→Ca(OH)2→CaCl2→CaCO3 D.Ca(OH)2→CaCO3→CaO→Ca(OH)2
7.下列化肥属于复合肥料的是
A.KCl
B.Ca2(PO4)3
C.KNO3
D.CO(NH2)2
8.小明外出游玩,发现路边的小麦叶子发黄、有倒伏现象,他建议田主应该施用一种复合肥料,这种复合肥料是
A.CO(NH2)2
B.KCl
C.KNO3
D.NH4HCO3
9.下列实验设计能达到实验目的是( )
选项 实验目的 实验设计
A 除去氯化镁溶液中少量的硫酸镁 滴加过量的氯化钡溶液,过滤
B 比较Zn、Cu、Ag的金属活动性 将Zn和Ag分别放入CuSO4溶液中
C 检验二氧化碳 将燃着的木条伸入集气瓶内
D 除去CuO中Cu 加足量稀硫酸溶液、过滤
A.A B.B C.C D.D
10.党的十九大提出要加快生态文明体制改革,建设美丽中国。下列做法正确的是
A.为保护环境,把废旧电池深埋处理
B.为增加粮食产量,大量使用农药、化肥
C.为节约水资源,用工业废水直接灌溉农田
D.为节约资源,大力开发新能源替代化石燃料
二、简答题
11.请用化学方程式表示下列原理。
(1)用锡焊接钢板时,焊接处要滴加稀盐酸除锈,其原理方程式:_________; 然后必须用水把残留的酸液冲洗干净的原因是_____(文字表述)。
(2)检验氢氧化钠是否变质的化学反应方程式_____。
12.溶液对于自然界中的生命活动和人类生产活动具有重要的意义,多角度认识溶液有助于指导我们的生活。
(1)关于溶液的说法,正确的是_________(填写标号)
A.溶液中各部分的性质相同B.均一、稳定的液体一定是溶液
C.浓溶液不一定是饱和溶液D.溶液加水稀释后溶质的质量变小
(2)表1是部分物质在20℃时的溶解性;表Ⅱ是氯化钠、碳酸钠在不同温度时的溶解度。
离子 OH- Cl- CO32- SO42-
K+ 溶 溶 溶 溶
Mg2+ 不 溶 微 溶
.Ba2+. 溶 溶 不
温度 (℃) 0 10 20 30 40
氯化钠(g) 35 35.5 36 36.5 37
碳酸钠(g) 6 10 18 36.5 50
表1空格中应填写________;分析表Ⅱ可知,氯化钠和碳酸钠的饱和溶液溶质质量分数相同时的温度是___。
(3)简单解释“夏天晒盐、冬天捞碱”的科学原理__________。
三、推断题
13.现有三种固体:铁粉、铜粉、Cu(OH)2。五种溶液:CuSO4,NaOH,FeSO4,,Na2SO4,稀硫酸。它们之间存在如下关系:
(1)A溶液+C溶液→固体甲+D溶液。
(2)固体乙+B溶液→E溶液+H2↑。
(3)固体甲+B溶液→C溶液+H2O。
试写出上述三个反应的化学方程式。
(1)_______;
(2)_______;
(3)_______。
14.某化学兴趣小组用铁、硫酸、氢氧化钡、硫酸铜和碳酸钠五种物质玩化学拼图游戏(如图),游戏规则要求图中相邻物质之间能发生化学反应,其中C物质的溶液呈蓝色,A与E反应产生的气体是光合作用的原料之一、
(1)A物质的俗称是___________;
(2)E物质的用途是___________;
(3)C与D反应的化学方程式为___________;
(4)按游戏规则,下列能替代B物质的是___________(填序号)
①银 ②氯化铁
③氯化钡 ④氧化铜
四、实验题
15.某初级中学学生为了探究化学实验室的一种黑色粉末和一瓶标签破损的无色溶液可能是什么物质,大胆猜想并设计实验进行验证.
【发现问题】当把黑色粉末与无色溶液混合时即产生气泡.
【查阅资料】初中化学实验室常见的黑色粉末:氧化铜、二氧化锰、四氧化三铁、铁粉、炭粉.
【提出假设】黑色粉末是______________,无色溶液是______________.
【设计实验】向盛有少许黑色粉末的试管中加入适量的无色溶液,用___________法收集一试管气体;检验该气体___________________.
【实验结论】此气体是______________________,原假设成立.
16.如图所示,在一只烧杯中进行实验。
请补全实验方案
序号 目的 步骤
A 检验NaCl中混有Na2CO3 ①加入少量样品;②加入适量水至全部溶解; ③加入______
B 验证NaCl不能无限溶解 20°C时①加入100g水;②加入10gNaCl; ③加入_____(已知:20℃时,NaCl的溶解度为36g)
C 配制_____ 加入5gNaCl;②加入95g水;③搅拌至全部溶解
五、计算题
17.某化学小组进行硫酸铜溶液和氢氧化钠溶液相混合的实验实验过程及数据如下图所示:[反应原理为]。
计算氢氧化钠溶液中溶质的质量分数。
18.食盐是我们必不可少的调味品,现在市场上有一种健康平衡盐,适量食用可维持人体Na+、K+等重要离子的平衡。如图是某品牌健康平衡盐的部分说明:
请回答:
(1)在物质分类上,氯化钠和氯化钾都属于 (选填“酸”、“碱”或“盐”)。
(2)中国营养学会推荐成人每天摄入K的质量在2000~4000毫克之间,若一个人每天需要摄入K的质量是2000毫克,其中10%来自该平衡盐,以该平衡盐每100克所含K18克计,他每天需要摄入该平衡盐 克(精确到0.1克)。
19.现有一包含有氯化钠和碳酸钠的固体混合物,为测定其成分,取一定质量的混合物于试管中,加入103g稀盐酸,恰好完全反应,生成的气体全部逸出,得到4.4g气体。将所得溶液冷却至t℃,恰好成为该温度下的饱和溶液,经测定溶液中的溶质含钠元素的质量为13.8g,求所得溶液中溶质的质量分数。(结果精确到0.1%)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.B
3.B
4.C
5.C
6.B
7.C
8.C
9.B
10.D
11. Fe2O3+6HCl=2FeCl3+3H2O 残余的稀盐酸会腐蚀钢板和铁继续反应,生产氯化亚铁和氢气;
12. A、C 不 30 “夏天晒盐”是因为食盐的溶解度受温度变化的影响不大,夏天气温高,水分蒸发快,食盐易结晶析出.“冬天捞碱”,是因为纯碱的溶解度受温度变化的影响较大,冬天气温低,纯碱易结晶析出
13.
14.(1)纯碱或苏打
(2)金属除锈、做化工原料
(3)
(4)③
15. MnO2 H2O2 排水集气法 用带火星的木条伸入试管中,带火星的木条复燃 O2
16. 稀盐酸(或稀硫酸,合理即可) 超过26g的氯化钠(合理即可) 100g溶质质量分数为5%的氯化钠溶液
17.解:设参加反应的氢氧化钠质量为x。
x=4g
×100%=8%
答:氢氧化钠溶液中溶质的质量分数为8%。
18.(1)盐 (2)1.1
19.解:反应后溶液中溶质氯化钠的质量=13.8g÷×100%=35.1g
设原混合物中碳酸钠的质量为x,生成的氯化钠的质量为y
= x=10.6g
= y=11.7g
反应前混合物中氯化钠的质量=35.1g 11.7g=23.4g
反应后溶液的质量=10.6g+23.4g+103g 4.4g=132.6g
所得溶液中溶质的质量分数=×100%≈26.5%
答:所得溶液中溶质的质量分数为26.5%。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
