第八章常见的酸、碱、盐单元训练-2021-2022学年九年级化学科粤版(2012)下册(word版有答案)
文档属性
| 名称 | 第八章常见的酸、碱、盐单元训练-2021-2022学年九年级化学科粤版(2012)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 161.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-26 10:26:51 | ||
图片预览



文档简介
科粤版(2012)第八章 常见的酸、碱、盐 单元训练
一、单选题
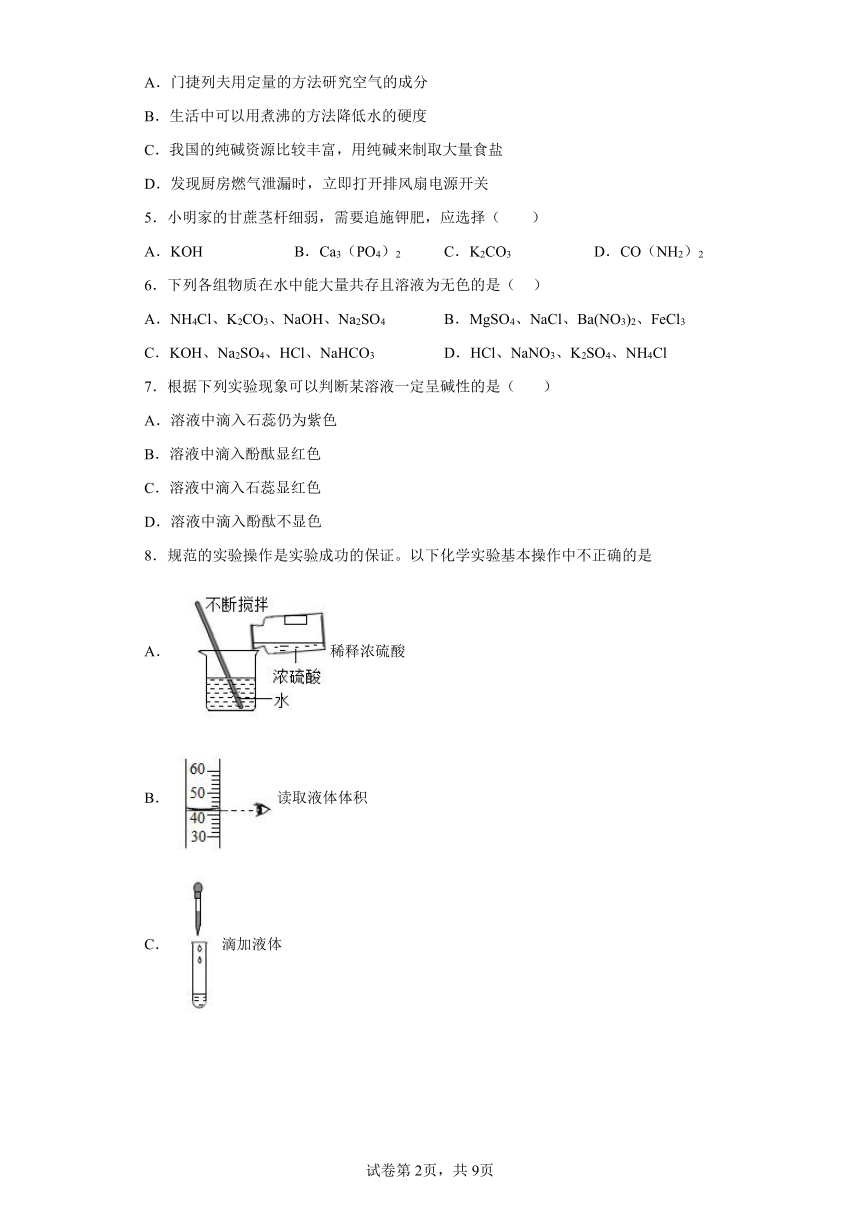
1.下列图示实验操作中,正确的是
A.取用液体 B.稀释浓硫酸
C.收集氧气 D.蒸发结晶
2.通过观察和实验等方法,人们找到物质变化的证据,下列四组研究化学反应快慢的对比实验中,各组所用溶液浓度相同且适宜、所用固体表面积相同,其中现象最不明显的一组是
A. B.
C. D.
3.下列离子能在含有硫酸的溶液中大量共存的是( )
A.Mg2+、
B.Na+、
C.K+、OH-
D.Ba2+、C1-
4.下列做法正确的是
A.门捷列夫用定量的方法研究空气的成分
B.生活中可以用煮沸的方法降低水的硬度
C.我国的纯碱资源比较丰富,用纯碱来制取大量食盐
D.发现厨房燃气泄漏时,立即打开排风扇电源开关
5.小明家的甘蔗茎杆细弱,需要追施钾肥,应选择( )
A.KOH B.Ca3(PO4)2 C.K2CO3 D.CO(NH2)2
6.下列各组物质在水中能大量共存且溶液为无色的是( )
A.NH4Cl、K2CO3、NaOH、Na2SO4 B.MgSO4、NaCl、Ba(NO3)2、FeCl3
C.KOH、Na2SO4、HCl、NaHCO3 D.HCl、NaNO3、K2SO4、NH4Cl
7.根据下列实验现象可以判断某溶液一定呈碱性的是( )
A.溶液中滴入石蕊仍为紫色
B.溶液中滴入酚酞显红色
C.溶液中滴入石蕊显红色
D.溶液中滴入酚酞不显色
8.规范的实验操作是实验成功的保证。以下化学实验基本操作中不正确的是
A.稀释浓硫酸
B.读取液体体积
C.滴加液体
D.过滤
9.下列做法不利于绿色城市创建,不利于保护环境的是( )
A.实行垃圾分类回收再利用
B.城市推广使用公共自行车
C.推广秸秆综合利用,杜绝露天焚烧
D.提高农作物产量,大量使用农药化肥物质
10.下列应用、对应的化学方程式及基本反应类型都正确的是
A.用一氧化碳还原氧化铁: 置换反应
B.用氢氧化钠溶液吸收二氧化碳: 复分解反应
C.用铁桶盛装农药波尔多液: 置换反应
D.用生石灰制熟石灰: 化合反应
11.下列物质的用途,一定涉及化学变化的是
A.金具有黄色金属光泽 制作饰品
B.活性炭具有吸附性 作除味剂
C.生石灰吸收空气中的水分 作干燥剂
D.干冰升华吸收大量的热 作制冷剂
12.下列物质不能与盐酸反应的是( )
A.Mg B.AgNO3 C.Cu(OH)2 D.FeSO4
13.下列有关实验现象描述正确的是
A.硫在氧气中燃烧发出淡蓝色火焰
B.打开浓盐酸试剂瓶瓶塞,瓶口有白雾产生
C.把CO2气体通入氢氧化钠溶液,溶液变浑浊
D.铁在空气中剧烈燃烧,火星四射,生成黑色固体
14.2021年“世界水日”的主题为“珍惜水、爱护水”。下列关于水的说法正确的是
A.过滤能将硬水转化为软水 B.用明矾对自来水进行杀菌消毒
C.用肥皂水区别硬水与软水 D.有水生成的反应一定是中和反应
15.下列变化属于化学变化的是
A.分离液态空气制氧气 B.食品久置发生霉变
C.活性炭吸附除异味 D.浓盐酸敞口产生大量白雾
二、填空题
16.某化学反应的微观示意图如下。
请回答:
(1)A分子中氮、氢原子个数比______。
(2)C为尿素[CO(NH2)2],农业上常用作____(填“氮”、“磷”或“钾”)肥。
(3)上图所示物质中属于氧化物的是_____(填字母序号)。
(4)该反应的化学方程式是______。
17.(2020 郴州) H2SO4是一种重要的化工原料。
(1)H2SO4溶液的pH_____7(填“>”、“<”或“=”),请写出用pH试纸测定稀硫酸pH的正确方法_____。
(2)浓硫酸有吸水性,常用作某些气体的干燥剂,下列气体不能用浓硫酸干燥的是_____(填写序号)。
①H2 ②CO2 ③NH3 ④HCl
(3)实验室常用亚硫酸钠固体(Na2SO3)和70%左右的硫酸溶液发生复分解反应制取SO2,请写出该反应的化学方程式:_____。
18.化学与生活、社会、环境密切相关:
(1)打开可乐瓶盖后,有大量气泡冒出,这种现象说明气体的溶解度与______有关。
(2)制备手机芯片的主要材料是硅,可以利用石英砂(主要成分是SiO2)制得,二氧化硅中硅元素的化合价是______。
(3)防疫期间,人们常用84消毒液【主要成分为次氯酸钠(NaCIO)】对生活场所进行杀菌、消毒。工业上制备 NaClO的反应原理为,则X的化学式为______。
(4)山药中含有碱性皂角素,皮肤沾上会奇痒难忍。你认为可涂厨房中的______(填溶质名称)来止痒。
(5)煤燃烧时放出的二氧化氮、______(填化学式)等污染物,这些气体或气体在空气中发生反应后的生成物溶于雨水,会形成酸雨。
(6)用洗洁精洗去餐具上的植物油时,洗洁精使植物油分散在水中,且不聚集成大的油珠,便于洗涤。这种现象称为______。
19.化学就在我们身边。从①熟石灰②金刚石③氯化钠④干冰四种物质中,选择适当的物质填空(填序号)。
(1)用于炒菜调味的是_____;
(2)用于人工降雨的是_____;
(3)用来裁玻璃的是_____;
(4)用来改良酸性土壤的是_____。
三、综合应用题
20.浩瀚的海洋蕴藏着丰富的化学资源,海水晒盐的主要流程如图所示。
(1)海水晒盐后的“母液”是氯化钠的__________(填“饱和”或“不饱和”)溶液。
(2)上述“母液”的主要溶质是氯化镁、氯化钠、硫酸镁和氯化钾,它们的溶解度曲线如图。氯化钾是低钠盐的主要添加剂,从上述“母液”中可以提取氯化钾,主要流程如图。
固体①的主要成分是氯化钠和硫酸镁,固体②的主要成分是氯化钾和氯化镁,则操作①和操作②依次为_____、________(此两空填“降温结晶”或“蒸发结晶”)。用冷水或饱和_______溶液洗涤固体②,干燥后可得到较纯净的氯化钾。
(3)利用“卤水”也可以制得金属镁等化工原料。下图某盐场1000g“卤水”中部分成分含量柱形图。
试计算:①若使1000g该“卤水”中的氯化镁和硫酸镁完全转化为Mg(OH)2沉淀,至少要20%NaOH溶液多少克?计算过程:_______
②将上述沉淀完全转化为无水MgCl2,并在熔融状态下进行电解,理论上最多可得到金属镁____克。
21.镁被公认为21世纪最有前途的绿色金属材料,广泛应用于火箭、导弹、飞机等领域的生产制造,被誉为“国防元素”,世界各国争相发展海水(含有MgCl2)提镁产业。如图为制取单质镁的过程,试回答下列问题:
(1)上述海水制镁的过程中,属于中和反应的是___________(填步骤序号),该反应的化学方程式为___________。
(2)海水或卤水中含有氯化镁,为什么还要经过“MgCl2→Mg(OH)2→MgCl2”的转化过程?原因是___________。
(3)某兴趣小组的同学取50 g MgCl2溶液,向其中逐滴加入溶质质量分数为2%的NaOH溶液,产生沉淀的质量与加入NaOH溶液的质量关系如图所示,当加入60 g NaOH溶液(即图中B点)时,溶液中的溶质有___________(填化学式)。
(4)当加入40 g NaOH溶液(即图中A点)时,恰好完全反应。通过计算,求此时所得沉淀的质量及所得不饱和溶液的质量。
22.(1)如图A是某趣味实验装置图,挤压胶头滴管后,可观察到气球胀大的现象,化学方程式是____________________。
要探究锥形瓶中溶液是否含有NaOH实验的步骤如下:
①向溶液中加入足量的________________;
②再向溶液中加入________________,若溶液变成红色,说明含有NaOH。
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示。
①下列说法正确的是________。
a m点所示溶液为碱性
b n点所示溶液中加紫色石蕊溶液显红色
c p点所示溶液中溶质为NaCl和NaOH
d 该图所对应操作是将盐酸滴入氢氧化钠溶液中
②m点的溶液蒸干后,得到的物质有________。
③判断氢氧化钠和盐酸发生复分解反应,满足的条件是有________生成。
(3)浓硫酸和浓盐酸敞口放置均会变稀,这是为什么?____________________________________。
(4)将73g质量分数为10%的盐酸与100g氢氧化钠恰好完全中和,试计算氢氧化钠溶质中溶质的质量分数________________________。
23.“氧泡泡”系列产品去污能力强、绿色环保,已成为中国氧系清洁品类领导品牌,其主要成分是过碳酸钠(2Na2CO3·3H2O2)。某化学活动小组对过碳酸钠产生了浓厚的兴趣,决定对其进行探究。
【查阅资料】
Ⅰ.过碳酸钠在水中易离解成Na2CO3和H2O2,其水溶液具有Na2CO3和H2O2的双重性质;
Ⅱ.过碳酸钠能与盐酸反应:2(2Na2CO3·3H2O2)+8HCl=8NaCl+4CO2↑+3O2↑+10H2O;
Ⅲ.过碳酸钠的去污能力主要与其在反应中释放出的“活性氧”有关,“活性氧”含量越高,去污能力越强。
(1)20℃时,测得1%过碳酸钠水溶液的pH为10.5,说明其溶液呈______(选填”酸性”、“中性”或“碱性’" )。
(2)向过碳酸钠水溶液中加入少量MnO2时产生大量气泡,发生反应的化学方程式是_____ 。
(3)过碳酸钠样品中“活性氧”含量可按如下公式计算:
为测定某过碳酸钠样品中“活性氧”含量,取20.0g样品按下图实验装置与足量盐酸反应。(已知样品中杂质不溶于水且不与酸反应,装置气密性良好)
① 将盐酸慢慢滴入A中,反应一段时间,观察到_______,停止滴加盐酸。
② 装置B可吸收生成的CO2,该反应的化学方程式是________________。
③ 甲同学认为若要得出生成氧气的质量,除要记录量筒内液体的读数外,还需要知道的数据是该实验条件下的__________。
④ 将反应后A中所得溶液过滤、蒸发、结晶、烘干,称得固体质量为11.7g,乙同学据此计算出该过碳酸钠样品的“活性氧”含量为_____。
⑤ 完成上述探究后,丙同学提出:称量反应前后装置B的质量,其质量差就是反应生成CO2的质量,据此可计算出样品中“活性氧”含量。但丁同学认为该方案不合理,丁同学的理由是_____________________(填写一条即可)。
试卷第1页,共3页
试卷第2页,共2页
参考答案:
1.D
2.D
3.A
4.B
5.C
6.D
7.B
8.D
9.D
10.D
11.C
12.D
13.B
14.C
15.B
16. 1∶3 氮 BD 2NH3+CO2CO(NH2)2+H2O
17. < 用干燥、洁净的玻璃棒蘸取待测液点在pH试纸上,待显色后,与标准比色卡对照,读出pH值 ③
18. 压强 +4 NaCl 醋酸 SO2 乳化
19. ③ ④ ② ①
20. 饱和 蒸发结晶 降温结晶 氯化钾 600g 48
21.(1) ② Mg(OH)2+2HCl= MgCl2+2H2O
(2)将镁元素富集
(3)NaCl、NaOH
(4)解:设生成的Mg(OH)2的质量为x
40g NaOH溶液中氢氧化钠的质量为40 g×2%=0.8g
x=0.58g
所得不饱和溶液的质量为50g+40g-0.58g=89.42g
答:所得沉淀的质量为0.58g,所得不饱和溶液的质量为89.42g。
22. 酚酞 c NaCl 水 浓盐酸具有挥发性,浓硫酸具有吸水性
23. 碱性 2H2O22H2O+O2↑ 无气泡产生 CO2+2NaOH=Na2CO3+H2O 氧气密度 12% 盐酸挥发出的HCl进入B中(或生成的CO2没有完全被NaOH溶液吸收)
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列图示实验操作中,正确的是
A.取用液体 B.稀释浓硫酸
C.收集氧气 D.蒸发结晶
2.通过观察和实验等方法,人们找到物质变化的证据,下列四组研究化学反应快慢的对比实验中,各组所用溶液浓度相同且适宜、所用固体表面积相同,其中现象最不明显的一组是
A. B.
C. D.
3.下列离子能在含有硫酸的溶液中大量共存的是( )
A.Mg2+、
B.Na+、
C.K+、OH-
D.Ba2+、C1-
4.下列做法正确的是
A.门捷列夫用定量的方法研究空气的成分
B.生活中可以用煮沸的方法降低水的硬度
C.我国的纯碱资源比较丰富,用纯碱来制取大量食盐
D.发现厨房燃气泄漏时,立即打开排风扇电源开关
5.小明家的甘蔗茎杆细弱,需要追施钾肥,应选择( )
A.KOH B.Ca3(PO4)2 C.K2CO3 D.CO(NH2)2
6.下列各组物质在水中能大量共存且溶液为无色的是( )
A.NH4Cl、K2CO3、NaOH、Na2SO4 B.MgSO4、NaCl、Ba(NO3)2、FeCl3
C.KOH、Na2SO4、HCl、NaHCO3 D.HCl、NaNO3、K2SO4、NH4Cl
7.根据下列实验现象可以判断某溶液一定呈碱性的是( )
A.溶液中滴入石蕊仍为紫色
B.溶液中滴入酚酞显红色
C.溶液中滴入石蕊显红色
D.溶液中滴入酚酞不显色
8.规范的实验操作是实验成功的保证。以下化学实验基本操作中不正确的是
A.稀释浓硫酸
B.读取液体体积
C.滴加液体
D.过滤
9.下列做法不利于绿色城市创建,不利于保护环境的是( )
A.实行垃圾分类回收再利用
B.城市推广使用公共自行车
C.推广秸秆综合利用,杜绝露天焚烧
D.提高农作物产量,大量使用农药化肥物质
10.下列应用、对应的化学方程式及基本反应类型都正确的是
A.用一氧化碳还原氧化铁: 置换反应
B.用氢氧化钠溶液吸收二氧化碳: 复分解反应
C.用铁桶盛装农药波尔多液: 置换反应
D.用生石灰制熟石灰: 化合反应
11.下列物质的用途,一定涉及化学变化的是
A.金具有黄色金属光泽 制作饰品
B.活性炭具有吸附性 作除味剂
C.生石灰吸收空气中的水分 作干燥剂
D.干冰升华吸收大量的热 作制冷剂
12.下列物质不能与盐酸反应的是( )
A.Mg B.AgNO3 C.Cu(OH)2 D.FeSO4
13.下列有关实验现象描述正确的是
A.硫在氧气中燃烧发出淡蓝色火焰
B.打开浓盐酸试剂瓶瓶塞,瓶口有白雾产生
C.把CO2气体通入氢氧化钠溶液,溶液变浑浊
D.铁在空气中剧烈燃烧,火星四射,生成黑色固体
14.2021年“世界水日”的主题为“珍惜水、爱护水”。下列关于水的说法正确的是
A.过滤能将硬水转化为软水 B.用明矾对自来水进行杀菌消毒
C.用肥皂水区别硬水与软水 D.有水生成的反应一定是中和反应
15.下列变化属于化学变化的是
A.分离液态空气制氧气 B.食品久置发生霉变
C.活性炭吸附除异味 D.浓盐酸敞口产生大量白雾
二、填空题
16.某化学反应的微观示意图如下。
请回答:
(1)A分子中氮、氢原子个数比______。
(2)C为尿素[CO(NH2)2],农业上常用作____(填“氮”、“磷”或“钾”)肥。
(3)上图所示物质中属于氧化物的是_____(填字母序号)。
(4)该反应的化学方程式是______。
17.(2020 郴州) H2SO4是一种重要的化工原料。
(1)H2SO4溶液的pH_____7(填“>”、“<”或“=”),请写出用pH试纸测定稀硫酸pH的正确方法_____。
(2)浓硫酸有吸水性,常用作某些气体的干燥剂,下列气体不能用浓硫酸干燥的是_____(填写序号)。
①H2 ②CO2 ③NH3 ④HCl
(3)实验室常用亚硫酸钠固体(Na2SO3)和70%左右的硫酸溶液发生复分解反应制取SO2,请写出该反应的化学方程式:_____。
18.化学与生活、社会、环境密切相关:
(1)打开可乐瓶盖后,有大量气泡冒出,这种现象说明气体的溶解度与______有关。
(2)制备手机芯片的主要材料是硅,可以利用石英砂(主要成分是SiO2)制得,二氧化硅中硅元素的化合价是______。
(3)防疫期间,人们常用84消毒液【主要成分为次氯酸钠(NaCIO)】对生活场所进行杀菌、消毒。工业上制备 NaClO的反应原理为,则X的化学式为______。
(4)山药中含有碱性皂角素,皮肤沾上会奇痒难忍。你认为可涂厨房中的______(填溶质名称)来止痒。
(5)煤燃烧时放出的二氧化氮、______(填化学式)等污染物,这些气体或气体在空气中发生反应后的生成物溶于雨水,会形成酸雨。
(6)用洗洁精洗去餐具上的植物油时,洗洁精使植物油分散在水中,且不聚集成大的油珠,便于洗涤。这种现象称为______。
19.化学就在我们身边。从①熟石灰②金刚石③氯化钠④干冰四种物质中,选择适当的物质填空(填序号)。
(1)用于炒菜调味的是_____;
(2)用于人工降雨的是_____;
(3)用来裁玻璃的是_____;
(4)用来改良酸性土壤的是_____。
三、综合应用题
20.浩瀚的海洋蕴藏着丰富的化学资源,海水晒盐的主要流程如图所示。
(1)海水晒盐后的“母液”是氯化钠的__________(填“饱和”或“不饱和”)溶液。
(2)上述“母液”的主要溶质是氯化镁、氯化钠、硫酸镁和氯化钾,它们的溶解度曲线如图。氯化钾是低钠盐的主要添加剂,从上述“母液”中可以提取氯化钾,主要流程如图。
固体①的主要成分是氯化钠和硫酸镁,固体②的主要成分是氯化钾和氯化镁,则操作①和操作②依次为_____、________(此两空填“降温结晶”或“蒸发结晶”)。用冷水或饱和_______溶液洗涤固体②,干燥后可得到较纯净的氯化钾。
(3)利用“卤水”也可以制得金属镁等化工原料。下图某盐场1000g“卤水”中部分成分含量柱形图。
试计算:①若使1000g该“卤水”中的氯化镁和硫酸镁完全转化为Mg(OH)2沉淀,至少要20%NaOH溶液多少克?计算过程:_______
②将上述沉淀完全转化为无水MgCl2,并在熔融状态下进行电解,理论上最多可得到金属镁____克。
21.镁被公认为21世纪最有前途的绿色金属材料,广泛应用于火箭、导弹、飞机等领域的生产制造,被誉为“国防元素”,世界各国争相发展海水(含有MgCl2)提镁产业。如图为制取单质镁的过程,试回答下列问题:
(1)上述海水制镁的过程中,属于中和反应的是___________(填步骤序号),该反应的化学方程式为___________。
(2)海水或卤水中含有氯化镁,为什么还要经过“MgCl2→Mg(OH)2→MgCl2”的转化过程?原因是___________。
(3)某兴趣小组的同学取50 g MgCl2溶液,向其中逐滴加入溶质质量分数为2%的NaOH溶液,产生沉淀的质量与加入NaOH溶液的质量关系如图所示,当加入60 g NaOH溶液(即图中B点)时,溶液中的溶质有___________(填化学式)。
(4)当加入40 g NaOH溶液(即图中A点)时,恰好完全反应。通过计算,求此时所得沉淀的质量及所得不饱和溶液的质量。
22.(1)如图A是某趣味实验装置图,挤压胶头滴管后,可观察到气球胀大的现象,化学方程式是____________________。
要探究锥形瓶中溶液是否含有NaOH实验的步骤如下:
①向溶液中加入足量的________________;
②再向溶液中加入________________,若溶液变成红色,说明含有NaOH。
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示。
①下列说法正确的是________。
a m点所示溶液为碱性
b n点所示溶液中加紫色石蕊溶液显红色
c p点所示溶液中溶质为NaCl和NaOH
d 该图所对应操作是将盐酸滴入氢氧化钠溶液中
②m点的溶液蒸干后,得到的物质有________。
③判断氢氧化钠和盐酸发生复分解反应,满足的条件是有________生成。
(3)浓硫酸和浓盐酸敞口放置均会变稀,这是为什么?____________________________________。
(4)将73g质量分数为10%的盐酸与100g氢氧化钠恰好完全中和,试计算氢氧化钠溶质中溶质的质量分数________________________。
23.“氧泡泡”系列产品去污能力强、绿色环保,已成为中国氧系清洁品类领导品牌,其主要成分是过碳酸钠(2Na2CO3·3H2O2)。某化学活动小组对过碳酸钠产生了浓厚的兴趣,决定对其进行探究。
【查阅资料】
Ⅰ.过碳酸钠在水中易离解成Na2CO3和H2O2,其水溶液具有Na2CO3和H2O2的双重性质;
Ⅱ.过碳酸钠能与盐酸反应:2(2Na2CO3·3H2O2)+8HCl=8NaCl+4CO2↑+3O2↑+10H2O;
Ⅲ.过碳酸钠的去污能力主要与其在反应中释放出的“活性氧”有关,“活性氧”含量越高,去污能力越强。
(1)20℃时,测得1%过碳酸钠水溶液的pH为10.5,说明其溶液呈______(选填”酸性”、“中性”或“碱性’" )。
(2)向过碳酸钠水溶液中加入少量MnO2时产生大量气泡,发生反应的化学方程式是_____ 。
(3)过碳酸钠样品中“活性氧”含量可按如下公式计算:
为测定某过碳酸钠样品中“活性氧”含量,取20.0g样品按下图实验装置与足量盐酸反应。(已知样品中杂质不溶于水且不与酸反应,装置气密性良好)
① 将盐酸慢慢滴入A中,反应一段时间,观察到_______,停止滴加盐酸。
② 装置B可吸收生成的CO2,该反应的化学方程式是________________。
③ 甲同学认为若要得出生成氧气的质量,除要记录量筒内液体的读数外,还需要知道的数据是该实验条件下的__________。
④ 将反应后A中所得溶液过滤、蒸发、结晶、烘干,称得固体质量为11.7g,乙同学据此计算出该过碳酸钠样品的“活性氧”含量为_____。
⑤ 完成上述探究后,丙同学提出:称量反应前后装置B的质量,其质量差就是反应生成CO2的质量,据此可计算出样品中“活性氧”含量。但丁同学认为该方案不合理,丁同学的理由是_____________________(填写一条即可)。
试卷第1页,共3页
试卷第2页,共2页
参考答案:
1.D
2.D
3.A
4.B
5.C
6.D
7.B
8.D
9.D
10.D
11.C
12.D
13.B
14.C
15.B
16. 1∶3 氮 BD 2NH3+CO2CO(NH2)2+H2O
17. < 用干燥、洁净的玻璃棒蘸取待测液点在pH试纸上,待显色后,与标准比色卡对照,读出pH值 ③
18. 压强 +4 NaCl 醋酸 SO2 乳化
19. ③ ④ ② ①
20. 饱和 蒸发结晶 降温结晶 氯化钾 600g 48
21.(1) ② Mg(OH)2+2HCl= MgCl2+2H2O
(2)将镁元素富集
(3)NaCl、NaOH
(4)解:设生成的Mg(OH)2的质量为x
40g NaOH溶液中氢氧化钠的质量为40 g×2%=0.8g
x=0.58g
所得不饱和溶液的质量为50g+40g-0.58g=89.42g
答:所得沉淀的质量为0.58g,所得不饱和溶液的质量为89.42g。
22. 酚酞 c NaCl 水 浓盐酸具有挥发性,浓硫酸具有吸水性
23. 碱性 2H2O22H2O+O2↑ 无气泡产生 CO2+2NaOH=Na2CO3+H2O 氧气密度 12% 盐酸挥发出的HCl进入B中(或生成的CO2没有完全被NaOH溶液吸收)
答案第1页,共2页
答案第1页,共2页
