第12章盐单元巩固—2021-2022学年九年级化学京改版(2013)下册(word版有答案)
文档属性
| 名称 | 第12章盐单元巩固—2021-2022学年九年级化学京改版(2013)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 159.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-26 22:24:36 | ||
图片预览


文档简介
第12章盐单元巩固2021-2022学年九年级化学京改版(2013)下册
一、单选题
1.某农用物资店的货架上待售的化肥有(NH4)2SO4、NH4H2PO4、CO(NH2)2,其中缺少的肥料品种是
A.氮肥
B.磷肥
C.钾肥
D.复合肥料
2.Zn(OH)2是不溶干水的碱,ZnCl2可溶于水。由此推断下列几组物质组合,不能直接反应制取ZnCl2的是
A.锌和稀盐酸 B.氧化锌和稀盐酸
C.氢氧化锌和稀盐酸 D.氢氧化锌和氯化钾溶液
3.草木灰是一种农家肥,其主要成分是K2CO3,它属于( )
A.钾肥 B.磷肥 C.氮肥 D.复合肥
4.下列物质属于碱的是
A.NaHCO3 B.H2O C.NH3·H2O D.CH3COOH
5.下列化学方程式所表示的化学反应能发生的是 ( )
A.Cu+H2SO4=CuSO4+H2↑ B.Fe+ Zn( NO3)2=Fe(NO3)2+Zn↓
C.CuCl2+2NaOH=Cu(OH)2↓+2NaCl D.Na2CO3+2KNO3=K2CO3+ 2NaNO3
6.将珍珠加入稀盐酸中,有气泡产生,生成的气体能使澄清石灰水变浑浊,则珍珠中含有下列离子中的( )
A.氯离子 B.硫酸根离子 C.碳酸根离子 D.氢氧根离子
7.在一个密闭容器中加入四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表:
物质 甲 乙 丙 丁
反应前质量/g 3 5 20 7
反应后质量/g 10 5 8 待测
通过分析,判断下列说法正确的是( )A.测得反应后丁物质的质量为12g
B.乙物质一定是催化剂
C.该反应是化合反应
D.该反应是复分解反应
8.西汉时期,人们就会用石灰水或草木灰水(主要成分是K2CO2)等碱性溶液为丝麻脱胶来造纸。下列物质属于碱的是
A.生石灰 B.水 C.熟石灰 D.草木灰
9.推理是化学常用的思维方法。下列推理正确的是
A.单质是由一种元素组成的,因此由一种元素组成的纯净物一定是单质
B.浓硫酸具有吸水性,因此浓盐酸也具有吸水性
C.铁丝能在氧气中燃烧,空气中有氧气,因此铁丝也能在空气中燃烧
D.由金属离子和酸根离子组成的化合物是盐,因此盐中一定含有金属离子
10.今年夏粮又获丰收,再显中国饭碗自信,其中化肥功不可没。下列说法错误的是( )
A.尿素[CO(NH2)2]能使作物枝叶繁茂、叶色浓绿
B.磷酸二氢铵(NH4H2PO4)属于复合肥
C.含氮量为31.5%的硝酸铵(NH4NO3)化肥样品为纯净物
D.化肥虽好不能滥用,过度施肥会造成土壤退化和水体污染
11.向一定质量的FeCl3溶液中滴加NaOH溶液一段时间后,改为滴加稀盐酸,所得沉淀质量随加入试剂总体积的变化趋势如图所示。下列说法正确的是
A.a点时溶液中一定存在Fe3+
B.c点时所加试剂是NaOH溶液
C.加入试剂总体积为V1时,溶液中不存在NaOH
D.d点时溶液中的溶质不只是盐
12.下列说法正确的是
A.向某固体上滴加稀盐酸,有气泡产生,则该固体一定是碳酸盐
B.把燃着的木条插入某瓶无色气体中,木条熄灭,证明瓶中的气体是二氧化碳
C.取少量溶液于试管中,滴加氯化钡溶液,有白色沉淀生成,证明该溶液中一定有硫酸根离子
D.不用任何试剂就可以把KOH、HNO3、CuSO4、MgCl2四种溶液鉴别出来
二、简答题
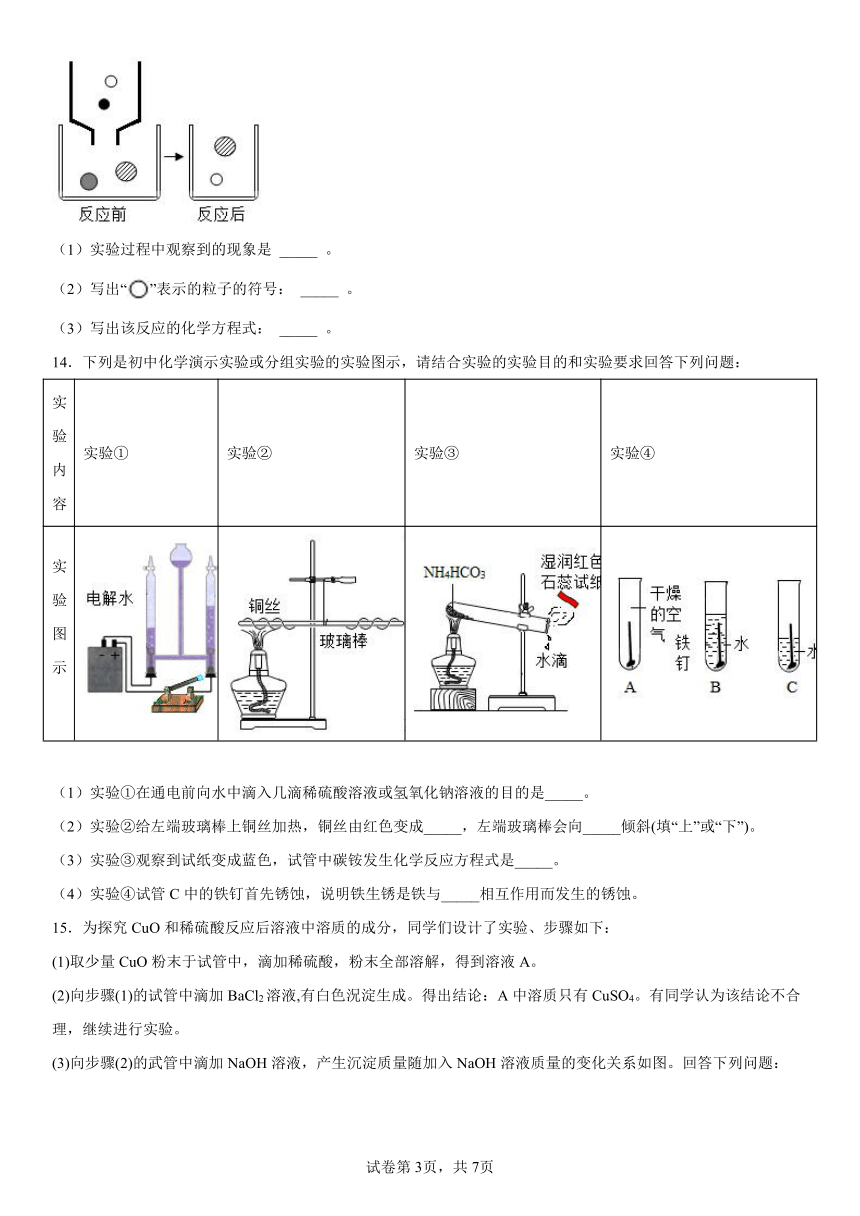
13.向AgNO3溶液中滴入NaCl溶液至恰好完全反应,如图表示反应前后溶液中存在的主要离子。
(1)实验过程中观察到的现象是 _____ 。
(2)写出“”表示的粒子的符号: _____ 。
(3)写出该反应的化学方程式: _____ 。
14.下列是初中化学演示实验或分组实验的实验图示,请结合实验的实验目的和实验要求回答下列问题:
实验内容 实验① 实验② 实验③ 实验④
实 验 图 示
(1)实验①在通电前向水中滴入几滴稀硫酸溶液或氢氧化钠溶液的目的是_____。
(2)实验②给左端玻璃棒上铜丝加热,铜丝由红色变成_____,左端玻璃棒会向_____倾斜(填“上”或“下”)。
(3)实验③观察到试纸变成蓝色,试管中碳铵发生化学反应方程式是_____。
(4)实验④试管C中的铁钉首先锈蚀,说明铁生锈是铁与_____相互作用而发生的锈蚀。
15.为探究CuO和稀硫酸反应后溶液中溶质的成分,同学们设计了实验、步骤如下:
(1)取少量CuO粉末于试管中,滴加稀硫酸,粉末全部溶解,得到溶液A。
(2)向步骤(1)的试管中滴加BaCl2溶液,有白色況淀生成。得出结论:A中溶质只有CuSO4。有同学认为该结论不合理,继续进行实验。
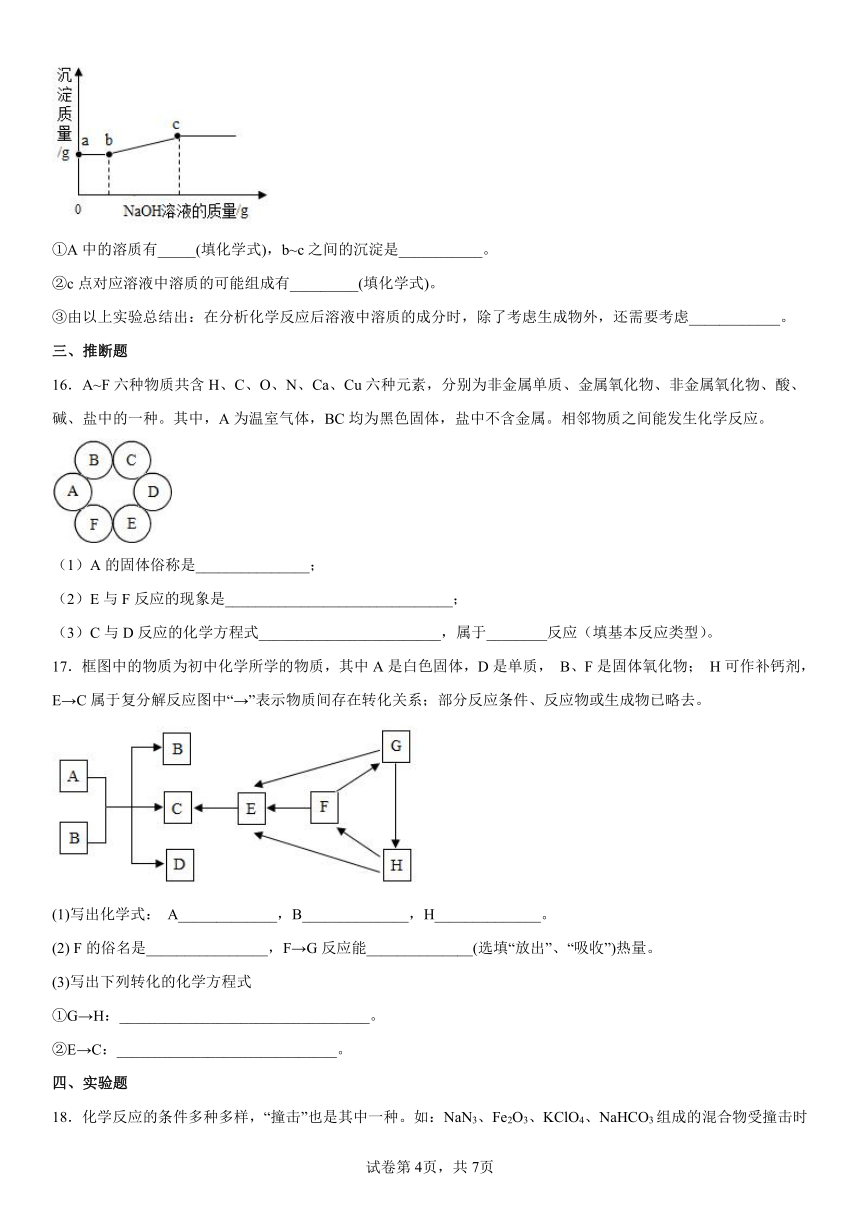
(3)向步骤(2)的武管中滴加NaOH溶液,产生沉淀质量随加入NaOH溶液质量的变化关系如图。回答下列问题:
①A中的溶质有_____(填化学式),b~c之间的沉淀是___________。
②c点对应溶液中溶质的可能组成有_________(填化学式)。
③由以上实验总结出:在分析化学反应后溶液中溶质的成分时,除了考虑生成物外,还需要考虑____________。
三、推断题
16.A~F六种物质共含H、C、O、N、Ca、Cu六种元素,分别为非金属单质、金属氧化物、非金属氧化物、酸、碱、盐中的一种。其中,A为温室气体,BC均为黑色固体,盐中不含金属。相邻物质之间能发生化学反应。
(1)A的固体俗称是_______________;
(2)E与F反应的现象是______________________________;
(3)C与D反应的化学方程式________________________,属于________反应(填基本反应类型)。
17.框图中的物质为初中化学所学的物质,其中A是白色固体,D是单质, B、F是固体氧化物; H可作补钙剂,E→C属于复分解反应图中“→”表示物质间存在转化关系;部分反应条件、反应物或生成物已略去。
(1)写出化学式: A_____________,B______________,H______________。
(2) F的俗名是________________,F→G反应能______________(选填“放出”、“吸收”)热量。
(3)写出下列转化的化学方程式
①G→H:_________________________________。
②E→C:_____________________________。
四、实验题
18.化学反应的条件多种多样,“撞击”也是其中一种。如:NaN3、Fe2O3、KClO4、NaHCO3组成的混合物受撞击时会产生大量气体,因而曾用作汽车安全气囊的产气药剂,其原理如下:
①NaN3(叠氯化钠)受撞击分解产生金属钠和氮气;
②金属钠将Fe2O3中的铁置换出来,同时钠与KClO4反应生成KCl及Na2O;
③NaHCO3受热分解生成碳酸钠及两种氧化物。
请回答下列问题:
(1)以上介绍的产气药剂中金属元素共有______种;写出KClO4(高氯酸钾)中阳离子的符号______。
(2)写出NaN3受撞击发生反应的化学方程式______;NaHCO3受热分解说明NaHCO3与碳酸钠中更稳定的是______(填化学式)
(3)若取100g上述产气药剂进行撞击反应实验(假设各物质均反应完全);
资料1:碱石灰能吸收水和二氧化碳;
资料2:标准状况下,气体的体积与质量有如下关系:
22.4L气体 水蒸气 氮气 氧气 二氧化碳
相应的质量(克) 18 28 32 44
①产气药剂撞击后产生的气体成分有氮气、______及水蒸气。
②将以上气体全部通过足量的碱石灰后体积为33.6L(标准状况),则产气药剂中NaN3的质量分数为______。
(4)已知相关物质的溶解度随温度变化的曲线如图。
①由此可知NaClO4属于______(选填“易溶”或“微溶”或“难溶”)物质。
②实验室称取一定质量的KCl、NaClO4溶解后加热反应、降温结晶、蒸馏水洗涤、真空干燥得到KClO4晶体。检验洗涤是否干净的方法是取最后一次洗涤液______,若观察到______证明还未洗净。
19.通过一年的化学学习,相信你已经初步掌握了实验室制取气体的有关知识。结合图示回答问题。
(1)写出图中标示的仪器名称:①____________,②____________。
(2)甲同学用高锰酸钾制取氧气时应选择的发生装置是________(填代号),用该方法制取氧气的化学方程式为________;用排水法收集氧气,实验结束后,他发现水槽中的水变红了,请你帮她分析可能的原因:__________。
(3)乙同学在实验室想制取CO2气体,她应选用的药品是_______________ 和___________,可用_________(填代号)装置收集CO2;她欲获得干燥纯净的二氧化碳,除了从A-F中选用制取装置外,还选用了装置G两次,装置G中的液体依次是饱和碳酸氢钠溶液和浓硫酸,其作用分别是_____、____,气体应从装置G的(填“a”或“b”) _____端进入。
(4)装置B和装置C都可以用于制取同种气体,装置C的优点是_________。
20.过氧化钠(Na2O2)可作为供氧剂。兴趣小组同学查阅资料发现过氧化钠有如下性质:
a、与二氧化碳反应生成碳酸钠和氧气;b、和水反应生成氢氧化钠和氧气。
实验目的:验证过氧化钠能与二氧化碳反应,并检验生成的碳酸钠和氧气。兴趣小组用如下装置进行实验,其中A处为CO2发生装置。
(1)写出B处过氧化钠与二氧化碳反应的化学方程式___________。
(2)有同学认为应增加一个装置使整套实验装置更符合实验目的。请你阐述需要增加的实验装置的作用是___________,以及添加的位置是___________。
(3)若要检验产物碳酸钠,取B中反应后样品进行实验,请完成下表中空白处的实验方法:
实验步骤 实验方法 现象或结论
一 加入足量的稀盐酸 ____________
二 ____________ ____________,存在碳酸钠
五、计算题
21.某化学小组进行硫酸铜溶液和氢氧化钠溶液相混合的实验实验过程及数据如下图所示:[反应原理为]。
计算氢氧化钠溶液中溶质的质量分数。
22.某食用纯碱中含有少量的氯化钠,为测定纯碱中碳酸钠的含量,现取该纯碱样品12g,加入100g稀盐酸溶液恰好完全反应,测得反应后溶液质量变成107.6g。计算:
(1)反应中产生CO2的质量为 ;
(2)纯碱样品中碳酸钠的质量分数(计算结果精确到0.1%)。
23.化学小组为测定某样品中碳酸钙(杂质不溶于水也不与水反应)的含量,进行了如下实验(水和氯化氢的挥发忽略不计):取25.0g样品粉碎:放入烧杯中,加入一定质量分数的稀盐酸,所加稀盐酸的质量与生成气体的质量关系如图所示。
CaCO3+2HCl═CaCl2+H2O+CO2↑
(1)完全反应生成气体的质量是_____g。
(2)计算样品中碳酸钙的质量分数。_____
24.将NaCl和BaCl2的固体样品40g溶于103.3g水中,加入80g的Na2SO4溶液,恰好完全反应,过滤,得到滤液和23.3g沉淀。请计算:
(1)固体样品中BaCl2的质量分数;
(2)滤液中溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.A
4.C
5.C
6.C
7.A
8.C
9.A
10.C
11.C
12.D
13. 产生白色沉淀 Na+ NaCl+AgNO3═NaNO3+AgCl↓
14. 增强水的导电性 黑色 下 NH4HCO3NH3↑+H2O+CO2↑ 氧气、水
15. CuSO4、H2SO4 BaSO4、Cu(OH)2 NaCl或NaCl、Na2SO4或NaCl、BaCl2 反座物是否有剩余
16. 干冰 有刺激性气味(氨味) CuO+2HNO3==Cu(NO3)2+H2O 复分解
17. KClO3 MnO2 CaCO3 生石灰 放出
18. 三 K+ Na2CO3 二氧化碳 65% 易溶 加入硝酸银溶液 有白色沉淀
19. 铁架台, 锥形瓶, A; 2KMnO4K2MnO4+MnO2+O2↑; 试管口没有塞棉花团。 石灰石 稀盐酸; F; 除去HCl气体; 除去水蒸气; b; 能控制反应的速率。
20.(1)
(2) 干燥二氧化碳 在AB装置之间
(3) 有气泡产生 将气体通入澄清石灰水中 澄清石灰水变浑浊
21.解:设参加反应的氢氧化钠质量为x。
x=4g
×100%=8%
答:氢氧化钠溶液中溶质的质量分数为8%。
22.(1)4.4g;
(2)设纯碱样品中碳酸钠的质量为x,
x=10.6g;
纯碱样品中碳酸钠的质量分数=×100%≈88.3%;
答:纯碱样品中碳酸钠的质量分数为88.3%。
23.(1)8.8(2)80%
24.解:设样品中BaCl2的质量为x,生成NaC1的质量为y
解得x=20.8g
解得y=11.7g
(1)固体样品中BaCl2的质量分数:
(2)滤液中NaCl的质量:
滤液的质量:
滤液中NaCl的质量分数.
答:固体样品中BaCl2的质量分数为52%,滤液中溶质的质量分数为15.45%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.某农用物资店的货架上待售的化肥有(NH4)2SO4、NH4H2PO4、CO(NH2)2,其中缺少的肥料品种是
A.氮肥
B.磷肥
C.钾肥
D.复合肥料
2.Zn(OH)2是不溶干水的碱,ZnCl2可溶于水。由此推断下列几组物质组合,不能直接反应制取ZnCl2的是
A.锌和稀盐酸 B.氧化锌和稀盐酸
C.氢氧化锌和稀盐酸 D.氢氧化锌和氯化钾溶液
3.草木灰是一种农家肥,其主要成分是K2CO3,它属于( )
A.钾肥 B.磷肥 C.氮肥 D.复合肥
4.下列物质属于碱的是
A.NaHCO3 B.H2O C.NH3·H2O D.CH3COOH
5.下列化学方程式所表示的化学反应能发生的是 ( )
A.Cu+H2SO4=CuSO4+H2↑ B.Fe+ Zn( NO3)2=Fe(NO3)2+Zn↓
C.CuCl2+2NaOH=Cu(OH)2↓+2NaCl D.Na2CO3+2KNO3=K2CO3+ 2NaNO3
6.将珍珠加入稀盐酸中,有气泡产生,生成的气体能使澄清石灰水变浑浊,则珍珠中含有下列离子中的( )
A.氯离子 B.硫酸根离子 C.碳酸根离子 D.氢氧根离子
7.在一个密闭容器中加入四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表:
物质 甲 乙 丙 丁
反应前质量/g 3 5 20 7
反应后质量/g 10 5 8 待测
通过分析,判断下列说法正确的是( )A.测得反应后丁物质的质量为12g
B.乙物质一定是催化剂
C.该反应是化合反应
D.该反应是复分解反应
8.西汉时期,人们就会用石灰水或草木灰水(主要成分是K2CO2)等碱性溶液为丝麻脱胶来造纸。下列物质属于碱的是
A.生石灰 B.水 C.熟石灰 D.草木灰
9.推理是化学常用的思维方法。下列推理正确的是
A.单质是由一种元素组成的,因此由一种元素组成的纯净物一定是单质
B.浓硫酸具有吸水性,因此浓盐酸也具有吸水性
C.铁丝能在氧气中燃烧,空气中有氧气,因此铁丝也能在空气中燃烧
D.由金属离子和酸根离子组成的化合物是盐,因此盐中一定含有金属离子
10.今年夏粮又获丰收,再显中国饭碗自信,其中化肥功不可没。下列说法错误的是( )
A.尿素[CO(NH2)2]能使作物枝叶繁茂、叶色浓绿
B.磷酸二氢铵(NH4H2PO4)属于复合肥
C.含氮量为31.5%的硝酸铵(NH4NO3)化肥样品为纯净物
D.化肥虽好不能滥用,过度施肥会造成土壤退化和水体污染
11.向一定质量的FeCl3溶液中滴加NaOH溶液一段时间后,改为滴加稀盐酸,所得沉淀质量随加入试剂总体积的变化趋势如图所示。下列说法正确的是
A.a点时溶液中一定存在Fe3+
B.c点时所加试剂是NaOH溶液
C.加入试剂总体积为V1时,溶液中不存在NaOH
D.d点时溶液中的溶质不只是盐
12.下列说法正确的是
A.向某固体上滴加稀盐酸,有气泡产生,则该固体一定是碳酸盐
B.把燃着的木条插入某瓶无色气体中,木条熄灭,证明瓶中的气体是二氧化碳
C.取少量溶液于试管中,滴加氯化钡溶液,有白色沉淀生成,证明该溶液中一定有硫酸根离子
D.不用任何试剂就可以把KOH、HNO3、CuSO4、MgCl2四种溶液鉴别出来
二、简答题
13.向AgNO3溶液中滴入NaCl溶液至恰好完全反应,如图表示反应前后溶液中存在的主要离子。
(1)实验过程中观察到的现象是 _____ 。
(2)写出“”表示的粒子的符号: _____ 。
(3)写出该反应的化学方程式: _____ 。
14.下列是初中化学演示实验或分组实验的实验图示,请结合实验的实验目的和实验要求回答下列问题:
实验内容 实验① 实验② 实验③ 实验④
实 验 图 示
(1)实验①在通电前向水中滴入几滴稀硫酸溶液或氢氧化钠溶液的目的是_____。
(2)实验②给左端玻璃棒上铜丝加热,铜丝由红色变成_____,左端玻璃棒会向_____倾斜(填“上”或“下”)。
(3)实验③观察到试纸变成蓝色,试管中碳铵发生化学反应方程式是_____。
(4)实验④试管C中的铁钉首先锈蚀,说明铁生锈是铁与_____相互作用而发生的锈蚀。
15.为探究CuO和稀硫酸反应后溶液中溶质的成分,同学们设计了实验、步骤如下:
(1)取少量CuO粉末于试管中,滴加稀硫酸,粉末全部溶解,得到溶液A。
(2)向步骤(1)的试管中滴加BaCl2溶液,有白色況淀生成。得出结论:A中溶质只有CuSO4。有同学认为该结论不合理,继续进行实验。
(3)向步骤(2)的武管中滴加NaOH溶液,产生沉淀质量随加入NaOH溶液质量的变化关系如图。回答下列问题:
①A中的溶质有_____(填化学式),b~c之间的沉淀是___________。
②c点对应溶液中溶质的可能组成有_________(填化学式)。
③由以上实验总结出:在分析化学反应后溶液中溶质的成分时,除了考虑生成物外,还需要考虑____________。
三、推断题
16.A~F六种物质共含H、C、O、N、Ca、Cu六种元素,分别为非金属单质、金属氧化物、非金属氧化物、酸、碱、盐中的一种。其中,A为温室气体,BC均为黑色固体,盐中不含金属。相邻物质之间能发生化学反应。
(1)A的固体俗称是_______________;
(2)E与F反应的现象是______________________________;
(3)C与D反应的化学方程式________________________,属于________反应(填基本反应类型)。
17.框图中的物质为初中化学所学的物质,其中A是白色固体,D是单质, B、F是固体氧化物; H可作补钙剂,E→C属于复分解反应图中“→”表示物质间存在转化关系;部分反应条件、反应物或生成物已略去。
(1)写出化学式: A_____________,B______________,H______________。
(2) F的俗名是________________,F→G反应能______________(选填“放出”、“吸收”)热量。
(3)写出下列转化的化学方程式
①G→H:_________________________________。
②E→C:_____________________________。
四、实验题
18.化学反应的条件多种多样,“撞击”也是其中一种。如:NaN3、Fe2O3、KClO4、NaHCO3组成的混合物受撞击时会产生大量气体,因而曾用作汽车安全气囊的产气药剂,其原理如下:
①NaN3(叠氯化钠)受撞击分解产生金属钠和氮气;
②金属钠将Fe2O3中的铁置换出来,同时钠与KClO4反应生成KCl及Na2O;
③NaHCO3受热分解生成碳酸钠及两种氧化物。
请回答下列问题:
(1)以上介绍的产气药剂中金属元素共有______种;写出KClO4(高氯酸钾)中阳离子的符号______。
(2)写出NaN3受撞击发生反应的化学方程式______;NaHCO3受热分解说明NaHCO3与碳酸钠中更稳定的是______(填化学式)
(3)若取100g上述产气药剂进行撞击反应实验(假设各物质均反应完全);
资料1:碱石灰能吸收水和二氧化碳;
资料2:标准状况下,气体的体积与质量有如下关系:
22.4L气体 水蒸气 氮气 氧气 二氧化碳
相应的质量(克) 18 28 32 44
①产气药剂撞击后产生的气体成分有氮气、______及水蒸气。
②将以上气体全部通过足量的碱石灰后体积为33.6L(标准状况),则产气药剂中NaN3的质量分数为______。
(4)已知相关物质的溶解度随温度变化的曲线如图。
①由此可知NaClO4属于______(选填“易溶”或“微溶”或“难溶”)物质。
②实验室称取一定质量的KCl、NaClO4溶解后加热反应、降温结晶、蒸馏水洗涤、真空干燥得到KClO4晶体。检验洗涤是否干净的方法是取最后一次洗涤液______,若观察到______证明还未洗净。
19.通过一年的化学学习,相信你已经初步掌握了实验室制取气体的有关知识。结合图示回答问题。
(1)写出图中标示的仪器名称:①____________,②____________。
(2)甲同学用高锰酸钾制取氧气时应选择的发生装置是________(填代号),用该方法制取氧气的化学方程式为________;用排水法收集氧气,实验结束后,他发现水槽中的水变红了,请你帮她分析可能的原因:__________。
(3)乙同学在实验室想制取CO2气体,她应选用的药品是_______________ 和___________,可用_________(填代号)装置收集CO2;她欲获得干燥纯净的二氧化碳,除了从A-F中选用制取装置外,还选用了装置G两次,装置G中的液体依次是饱和碳酸氢钠溶液和浓硫酸,其作用分别是_____、____,气体应从装置G的(填“a”或“b”) _____端进入。
(4)装置B和装置C都可以用于制取同种气体,装置C的优点是_________。
20.过氧化钠(Na2O2)可作为供氧剂。兴趣小组同学查阅资料发现过氧化钠有如下性质:
a、与二氧化碳反应生成碳酸钠和氧气;b、和水反应生成氢氧化钠和氧气。
实验目的:验证过氧化钠能与二氧化碳反应,并检验生成的碳酸钠和氧气。兴趣小组用如下装置进行实验,其中A处为CO2发生装置。
(1)写出B处过氧化钠与二氧化碳反应的化学方程式___________。
(2)有同学认为应增加一个装置使整套实验装置更符合实验目的。请你阐述需要增加的实验装置的作用是___________,以及添加的位置是___________。
(3)若要检验产物碳酸钠,取B中反应后样品进行实验,请完成下表中空白处的实验方法:
实验步骤 实验方法 现象或结论
一 加入足量的稀盐酸 ____________
二 ____________ ____________,存在碳酸钠
五、计算题
21.某化学小组进行硫酸铜溶液和氢氧化钠溶液相混合的实验实验过程及数据如下图所示:[反应原理为]。
计算氢氧化钠溶液中溶质的质量分数。
22.某食用纯碱中含有少量的氯化钠,为测定纯碱中碳酸钠的含量,现取该纯碱样品12g,加入100g稀盐酸溶液恰好完全反应,测得反应后溶液质量变成107.6g。计算:
(1)反应中产生CO2的质量为 ;
(2)纯碱样品中碳酸钠的质量分数(计算结果精确到0.1%)。
23.化学小组为测定某样品中碳酸钙(杂质不溶于水也不与水反应)的含量,进行了如下实验(水和氯化氢的挥发忽略不计):取25.0g样品粉碎:放入烧杯中,加入一定质量分数的稀盐酸,所加稀盐酸的质量与生成气体的质量关系如图所示。
CaCO3+2HCl═CaCl2+H2O+CO2↑
(1)完全反应生成气体的质量是_____g。
(2)计算样品中碳酸钙的质量分数。_____
24.将NaCl和BaCl2的固体样品40g溶于103.3g水中,加入80g的Na2SO4溶液,恰好完全反应,过滤,得到滤液和23.3g沉淀。请计算:
(1)固体样品中BaCl2的质量分数;
(2)滤液中溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.A
4.C
5.C
6.C
7.A
8.C
9.A
10.C
11.C
12.D
13. 产生白色沉淀 Na+ NaCl+AgNO3═NaNO3+AgCl↓
14. 增强水的导电性 黑色 下 NH4HCO3NH3↑+H2O+CO2↑ 氧气、水
15. CuSO4、H2SO4 BaSO4、Cu(OH)2 NaCl或NaCl、Na2SO4或NaCl、BaCl2 反座物是否有剩余
16. 干冰 有刺激性气味(氨味) CuO+2HNO3==Cu(NO3)2+H2O 复分解
17. KClO3 MnO2 CaCO3 生石灰 放出
18. 三 K+ Na2CO3 二氧化碳 65% 易溶 加入硝酸银溶液 有白色沉淀
19. 铁架台, 锥形瓶, A; 2KMnO4K2MnO4+MnO2+O2↑; 试管口没有塞棉花团。 石灰石 稀盐酸; F; 除去HCl气体; 除去水蒸气; b; 能控制反应的速率。
20.(1)
(2) 干燥二氧化碳 在AB装置之间
(3) 有气泡产生 将气体通入澄清石灰水中 澄清石灰水变浑浊
21.解:设参加反应的氢氧化钠质量为x。
x=4g
×100%=8%
答:氢氧化钠溶液中溶质的质量分数为8%。
22.(1)4.4g;
(2)设纯碱样品中碳酸钠的质量为x,
x=10.6g;
纯碱样品中碳酸钠的质量分数=×100%≈88.3%;
答:纯碱样品中碳酸钠的质量分数为88.3%。
23.(1)8.8(2)80%
24.解:设样品中BaCl2的质量为x,生成NaC1的质量为y
解得x=20.8g
解得y=11.7g
(1)固体样品中BaCl2的质量分数:
(2)滤液中NaCl的质量:
滤液的质量:
滤液中NaCl的质量分数.
答:固体样品中BaCl2的质量分数为52%,滤液中溶质的质量分数为15.45%。
答案第1页,共2页
答案第1页,共2页
