第6章常用的金属和盐基础练习题—2021-2022学年九年级化学沪教版(上海)第二学期(word版有答案)
文档属性
| 名称 | 第6章常用的金属和盐基础练习题—2021-2022学年九年级化学沪教版(上海)第二学期(word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 241.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-26 22:31:44 | ||
图片预览



文档简介
第6章常用的金属和盐基础练习题2021-2022学年九年级化学沪教版(上海)第二学期
一、单选题
1.下列物质中,属于合金的是
A.不锈钢 B.氧化铁 C.铜 D.石墨
2.现代社会对能源和资源的需求是越来越大,下列说法正确的是
A.提倡大量使用塑料袋 B.石油属于可再生能源
C.提倡回收利用废旧金属 D.提倡使用含硫煤作燃料
3.现有甲、乙、丙三种金属,先将三者分别加入到硫酸亚铁溶液中,只有甲可使溶液中析出铁单质。再将三者加入到硝酸银溶液中,只有乙不能使溶液中析出银单质,则三者的金属活动性从强到弱的顺序是
A.甲>乙>丙 B.乙>甲>丙 C.甲>丙>乙 D.无法判断
4.小明外出游玩,发现路边的小麦叶子发黄、有倒伏现象,他建议田主应该施用一种复合肥料,这种复合肥料是
A.CO(NH2)2
B.KCl
C.KNO3
D.NH4HCO3
5.下列成都出土的文物中,不属于金属材料的是
A.东汉说唱俑 B.“郫”字青铜戈
C.龙纹铅饼币 D.黄金面具
6.将一定量的铁粉放入硝酸银溶液中,充分反应后过滤,下列有关说法错误的是( )
A.滤渣中一定含有银 B.滤渣中可能含有铁
C.滤液一定呈浅绿色 D.滤液中一定不含硝酸银
7.“珍惜资源,保护环境”是每位公民应尽的义务,下列相关做法错误的是
A.我国稀土储量世界第一,可以任意开发利用
B.研发秸秆综合利用技术,避免因直接焚烧造成大气污染
C.利用二氧化碳捕捉技术,减少我国二氧化碳引起的“温室效应”
D.改造城市排水管网,实现雨水和生活用水的分流与处理
8.将质量相等的A、B、C三种金属,同时分别放入三份溶质质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示.根据图中所提供的信息,得出的结论正确的是(已知:A、B、C在生成物中均为+2价)
A.放出H2的质量是B>A>C
B.金属活动性顺序是A>B>C
C.反应速率最大的是A
D.相对原子质量是C>B>A
9.物质的用途与性质密切相关。下列有关说法错误的是
A.铜丝常用做导线,是因为铜有良好的导电性,利用了铜的物理性质
B.磷燃烧能产生大量白烟,因此可以燃烧磷用于布置舞台上的烟雾背景
C.氮气可用于食品防腐,是因为氮气的化学性质不活泼
D.用稀有气体作霓虹灯,是利用了稀有气体的物理性质
10.很多成语、诗词中蕴含着丰富的科学道理,下列说法错误的是
A.“火要虚”是说氧气浓度越高,可燃物燃烧越旺
B.“松叶堪为酒,春来酿几多?”指清香的美酒来自于粮食缓慢氧化
C.“真金不怕火炼”说明黄金的化学性质非常稳定
D.“沙里淘金”与“百炼成钢”蕴含的化学原理不同
11.6.5g镁、锌金属混合物与100g稀硫酸刚好完全反应,生成硫酸盐的总质量可能为
A.13.6g B.15.8g
C.17.5g D.105.8g
12.利用盐酸和硝酸银探究铁、铜、银的金属活动顺序,下列实验可以不需要进行的是
A.铁+稀盐酸 B.铜+稀盐酸 C.银+稀盐酸 D.铜+硝酸银溶液
二、简答题
13.铝在高温条件下能与氧化铁发生置换反应,该反应的化学方程式为________。
14.写出下列化学方程式。
(1)工业上用磁铁矿炼铁:________________。
(2)用稀盐酸除铁锈:___________________。
15.写出镁、铜、氧气、盐酸两两间能发生反应的化学方程式,并注明反应类型。
三、推断题
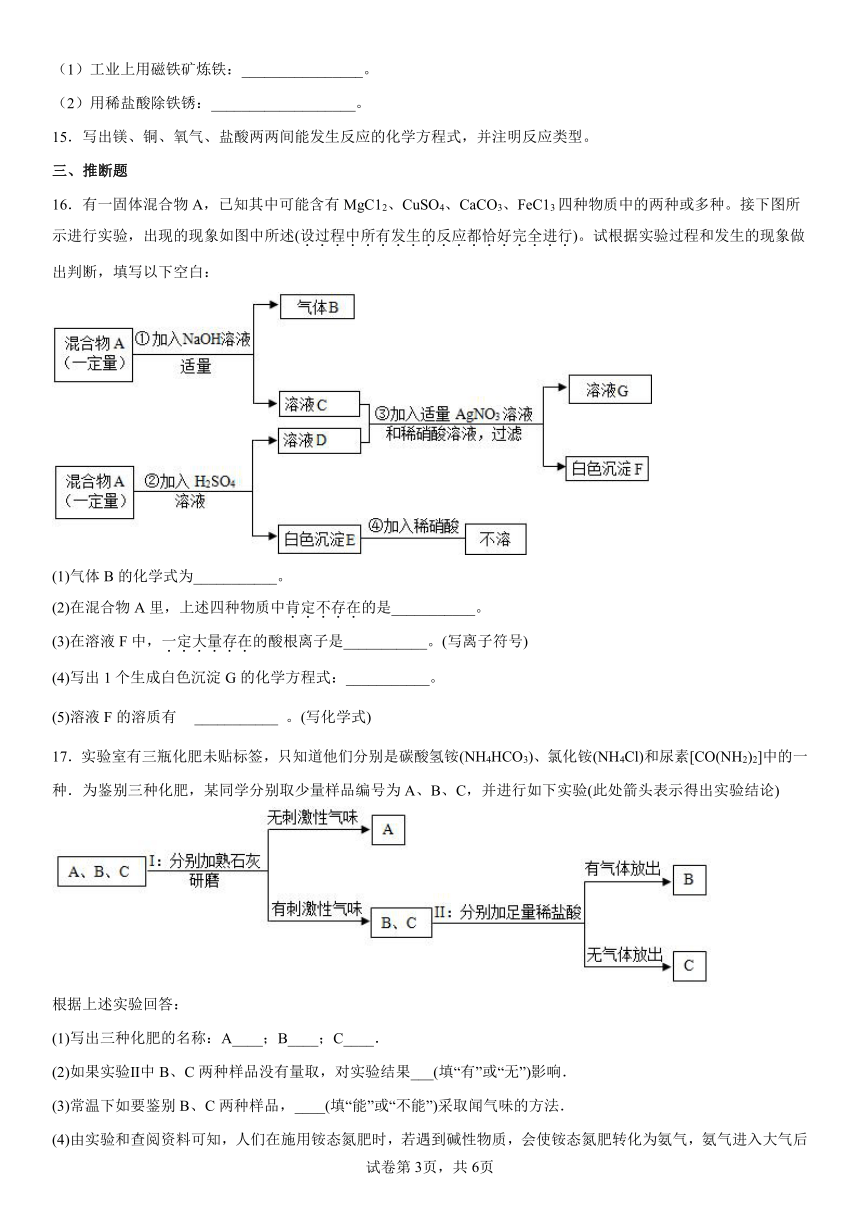
16.有一固体混合物A,已知其中可能含有MgC12、CuSO4、CaCO3、FeC13四种物质中的两种或多种。接下图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全进行)。试根据实验过程和发生的现象做出判断,填写以下空白:
(1)气体B的化学式为___________。
(2)在混合物A里,上述四种物质中肯定不存在的是___________。
(3)在溶液F中,一定大量存在的酸根离子是___________。(写离子符号)
(4)写出1个生成白色沉淀G的化学方程式:___________。
(5)溶液F的溶质有 ___________ 。(写化学式)
17.实验室有三瓶化肥未贴标签,只知道他们分别是碳酸氢铵(NH4HCO3)、氯化铵(NH4Cl)和尿素[CO(NH2)2]中的一种.为鉴别三种化肥,某同学分别取少量样品编号为A、B、C,并进行如下实验(此处箭头表示得出实验结论)
根据上述实验回答:
(1)写出三种化肥的名称:A____;B____;C____.
(2)如果实验Ⅱ中B、C两种样品没有量取,对实验结果___(填“有”或“无”)影响.
(3)常温下如要鉴别B、C两种样品,____(填“能”或“不能”)采取闻气味的方法.
(4)由实验和查阅资料可知,人们在施用铵态氮肥时,若遇到碱性物质,会使铵态氮肥转化为氨气,氨气进入大气后与雨水作用,可能形成“碱雨”.“碱雨”中碱的化学式为___。
四、实验题
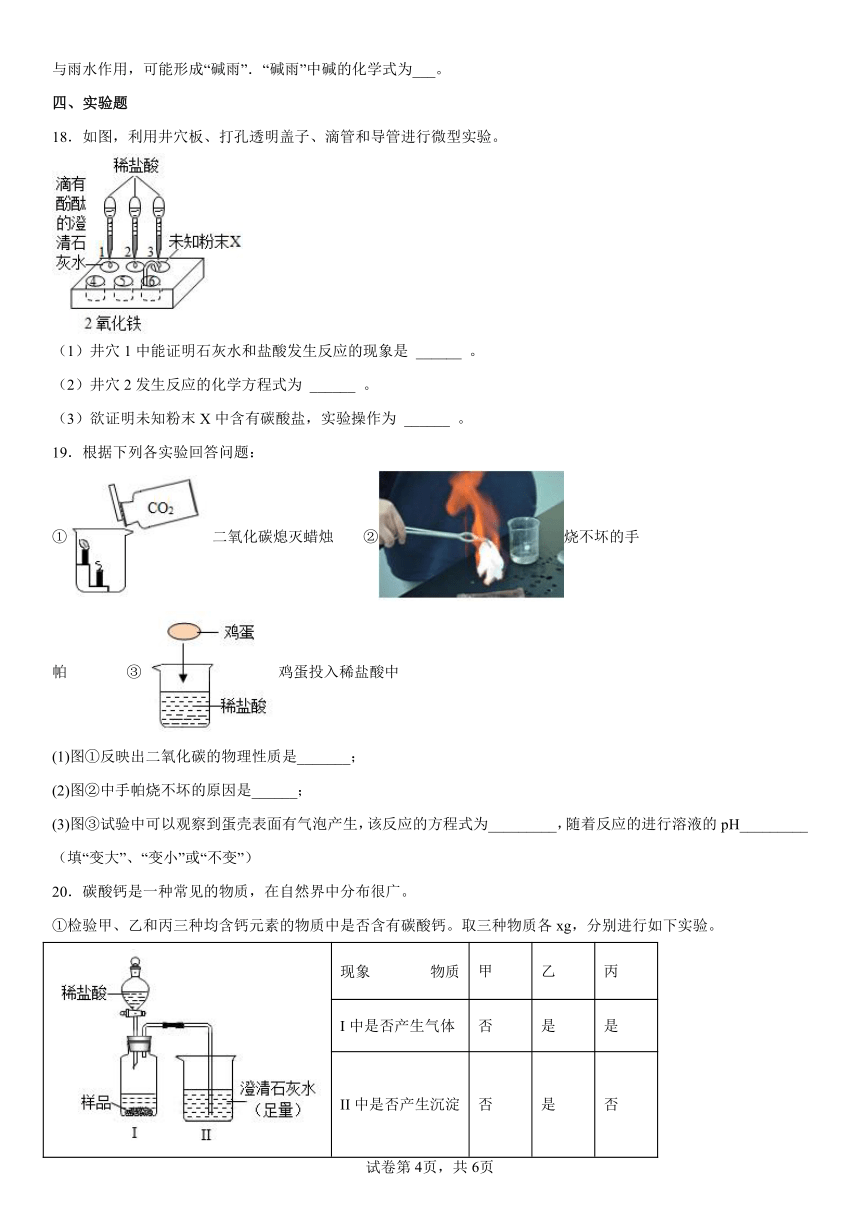
18.如图,利用井穴板、打孔透明盖子、滴管和导管进行微型实验。
(1)井穴1中能证明石灰水和盐酸发生反应的现象是 ______ 。
(2)井穴2发生反应的化学方程式为 ______ 。
(3)欲证明未知粉末X中含有碳酸盐,实验操作为 ______ 。
19.根据下列各实验回答问题:
①二氧化碳熄灭蜡烛 ②烧不坏的手帕 ③鸡蛋投入稀盐酸中
(1)图①反映出二氧化碳的物理性质是_______;
(2)图②中手帕烧不坏的原因是______;
(3)图③试验中可以观察到蛋壳表面有气泡产生,该反应的方程式为_________,随着反应的进行溶液的pH_________(填“变大”、“变小”或“不变”)
20.碳酸钙是一种常见的物质,在自然界中分布很广。
①检验甲、乙和丙三种均含钙元素的物质中是否含有碳酸钙。取三种物质各xg,分别进行如下实验。
现象 物质 甲 乙 丙
I中是否产生气体 否 是 是
II中是否产生沉淀 否 是 否
结论:含有碳酸钙的物质是______(选填“甲”、“乙”或“丙”)。
将xg丙磨成粉末,重复上述实验,观察到的现象是______(选填编号)。
a I中产生气体的量更多 b I中产生气泡的速率更快 c II中产生沉淀
②用石灰石为原料制取二氧化碳。
I实验室制取二氧化碳的化学方程式是______。
II搭建具有启普发生器功能的简易装置,除了长颈漏斗、多孔隔板、橡胶塞、导管、乳胶管、弹簧夹之外,下图可做反应容器的是______(选填编号)。
有同学搭建了如图装置,要使该装置也具有启普发生器的功能,需将块状石灰石放置在______(选填“A”或“B”)处。
III用向上排气法收集二氧化碳,是因为二氧化碳______。
五、计算题
21.尿素〔CO(NH2)2〕是化肥中最主要的一种,其含氮量高,在土壤中不残留任何有害物质,长期施用没有不良影响。
(1)尿素属于化肥中的______肥(填“氮”“钾”或“复合”)。
(2)CO(NH2)2中共含有______(写数字)种元素;
(3)CO(NH2)2的相对分子质量是______
(4)CO(NH2)2中C、H、N、O元素的质量比为______。
22.某同学欲测定生铁中铁的质量分数,他称取样品11.5g,加入足量溶质质量分数为10%的稀硫酸充分反应(杂质不溶于水,也不与稀硫酸反应),产生气体的质量与所加稀硫酸的质量关系如图所示,请回答:
(1)恰好完全反应时生成氢气的质量为 g。
(2)该样品中铁的质量分数?(精确到0.1%)。
(3)图中m的值。
23.巴中某超市卖的纯碱(Na2CO3)产品往往含有少量的氯化钠(NaCl),化学兴趣小组的同学通过实验来测定该纯碱样品中纯碱的质量分数,他们取12g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,共消耗盐酸100g,烧杯中没有残留不溶物,称得反应后溶液的质量为107.6g。
计算:
(1)生成二氧化碳 g。
(2)样品中纯碱的质量分数是多少?(要求写出计算过程,结果精确到0.1%)
24.碳酸钠和碳酸氢钠的混合物共20.0克加热到到质量不再减少,冷却后称量固体质量为16.9克。(已知碳酸氢钠加热分解得到碳酸钠和两种氧化物)
(1)碳酸氢钠俗称______,常用治疗胃酸过多;
(2)求原混合物中碳酸氢钠的质量?(请写出化学方程式和必要的过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.C
3.C
4.C
5.A
6.D
7.A
8.D
9.B
10.A
11.C
12.C
13.
14. Fe3O4+4CO3Fe+4CO2 Fe2O3+6HCl=2FeCl3+3H2O
15. 化合反应
置换反应
化合反应
16. CO2 CuSO4、FeCl3 NaCl+AgNO3=AgCl↓+NaNO3 或 CaCl2+2AgNO3=2AgCl↓+Ca(NO3)2 Ca(NO3)2 、NaNO3
17. 尿素 碳酸氢铵 氯化铵 无 不能 NH3.H2O
18. 红色溶液变成无色 6HCl+Fe2O3=2FeCl3 +3H2O 在孔穴6中加入澄清石灰水,将稀盐酸挤入孔穴3
19. 密度大于空气 水汽化吸热,温度低于手帕的着火点
变大
20. 乙 b ac A 二氧化碳能溶于水、密度比空气大
21.(1)尿素中含有氮元素,属于化肥中的氮肥。
(2)CO(NH2)2中共含有C、O、N、H,4种元素;
(3)CO(NH2)2的相对分子质量是12+16+(14+1×2)×2=60;
(4)CO(NH2)2中C、H、N、O元素的质量比为12:(1×4):(14×2):16=3:1:7:4。
22.(1)0.4;
(2)解:设该样品中铁的质量分数为x,消耗硫酸的质量为y
x≈97.4%
y=19.6g;
(3)图中m=19.6g÷10%=196g。
答:该样品中铁的质量分数为97.4%,m=196g。
23.(1)4.4
(2)设样品中纯碱的质量为x
x=10.6g
所以样品中纯碱的质量分数是。
答:样品中纯碱的质量分数是88.3%。
24.(1)小苏打(2)碳酸氢钠加热分解得到碳酸钠和两种氧化物,根据质量守恒定律可知,碳酸氢钠加热分解生成碳酸钠、水和二氧化碳,设原混合物中碳酸氢钠的质量为x,
解得x=8.4g;
答:原混合物中碳酸氢钠的质量8.4g。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列物质中,属于合金的是
A.不锈钢 B.氧化铁 C.铜 D.石墨
2.现代社会对能源和资源的需求是越来越大,下列说法正确的是
A.提倡大量使用塑料袋 B.石油属于可再生能源
C.提倡回收利用废旧金属 D.提倡使用含硫煤作燃料
3.现有甲、乙、丙三种金属,先将三者分别加入到硫酸亚铁溶液中,只有甲可使溶液中析出铁单质。再将三者加入到硝酸银溶液中,只有乙不能使溶液中析出银单质,则三者的金属活动性从强到弱的顺序是
A.甲>乙>丙 B.乙>甲>丙 C.甲>丙>乙 D.无法判断
4.小明外出游玩,发现路边的小麦叶子发黄、有倒伏现象,他建议田主应该施用一种复合肥料,这种复合肥料是
A.CO(NH2)2
B.KCl
C.KNO3
D.NH4HCO3
5.下列成都出土的文物中,不属于金属材料的是
A.东汉说唱俑 B.“郫”字青铜戈
C.龙纹铅饼币 D.黄金面具
6.将一定量的铁粉放入硝酸银溶液中,充分反应后过滤,下列有关说法错误的是( )
A.滤渣中一定含有银 B.滤渣中可能含有铁
C.滤液一定呈浅绿色 D.滤液中一定不含硝酸银
7.“珍惜资源,保护环境”是每位公民应尽的义务,下列相关做法错误的是
A.我国稀土储量世界第一,可以任意开发利用
B.研发秸秆综合利用技术,避免因直接焚烧造成大气污染
C.利用二氧化碳捕捉技术,减少我国二氧化碳引起的“温室效应”
D.改造城市排水管网,实现雨水和生活用水的分流与处理
8.将质量相等的A、B、C三种金属,同时分别放入三份溶质质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示.根据图中所提供的信息,得出的结论正确的是(已知:A、B、C在生成物中均为+2价)
A.放出H2的质量是B>A>C
B.金属活动性顺序是A>B>C
C.反应速率最大的是A
D.相对原子质量是C>B>A
9.物质的用途与性质密切相关。下列有关说法错误的是
A.铜丝常用做导线,是因为铜有良好的导电性,利用了铜的物理性质
B.磷燃烧能产生大量白烟,因此可以燃烧磷用于布置舞台上的烟雾背景
C.氮气可用于食品防腐,是因为氮气的化学性质不活泼
D.用稀有气体作霓虹灯,是利用了稀有气体的物理性质
10.很多成语、诗词中蕴含着丰富的科学道理,下列说法错误的是
A.“火要虚”是说氧气浓度越高,可燃物燃烧越旺
B.“松叶堪为酒,春来酿几多?”指清香的美酒来自于粮食缓慢氧化
C.“真金不怕火炼”说明黄金的化学性质非常稳定
D.“沙里淘金”与“百炼成钢”蕴含的化学原理不同
11.6.5g镁、锌金属混合物与100g稀硫酸刚好完全反应,生成硫酸盐的总质量可能为
A.13.6g B.15.8g
C.17.5g D.105.8g
12.利用盐酸和硝酸银探究铁、铜、银的金属活动顺序,下列实验可以不需要进行的是
A.铁+稀盐酸 B.铜+稀盐酸 C.银+稀盐酸 D.铜+硝酸银溶液
二、简答题
13.铝在高温条件下能与氧化铁发生置换反应,该反应的化学方程式为________。
14.写出下列化学方程式。
(1)工业上用磁铁矿炼铁:________________。
(2)用稀盐酸除铁锈:___________________。
15.写出镁、铜、氧气、盐酸两两间能发生反应的化学方程式,并注明反应类型。
三、推断题
16.有一固体混合物A,已知其中可能含有MgC12、CuSO4、CaCO3、FeC13四种物质中的两种或多种。接下图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全进行)。试根据实验过程和发生的现象做出判断,填写以下空白:
(1)气体B的化学式为___________。
(2)在混合物A里,上述四种物质中肯定不存在的是___________。
(3)在溶液F中,一定大量存在的酸根离子是___________。(写离子符号)
(4)写出1个生成白色沉淀G的化学方程式:___________。
(5)溶液F的溶质有 ___________ 。(写化学式)
17.实验室有三瓶化肥未贴标签,只知道他们分别是碳酸氢铵(NH4HCO3)、氯化铵(NH4Cl)和尿素[CO(NH2)2]中的一种.为鉴别三种化肥,某同学分别取少量样品编号为A、B、C,并进行如下实验(此处箭头表示得出实验结论)
根据上述实验回答:
(1)写出三种化肥的名称:A____;B____;C____.
(2)如果实验Ⅱ中B、C两种样品没有量取,对实验结果___(填“有”或“无”)影响.
(3)常温下如要鉴别B、C两种样品,____(填“能”或“不能”)采取闻气味的方法.
(4)由实验和查阅资料可知,人们在施用铵态氮肥时,若遇到碱性物质,会使铵态氮肥转化为氨气,氨气进入大气后与雨水作用,可能形成“碱雨”.“碱雨”中碱的化学式为___。
四、实验题
18.如图,利用井穴板、打孔透明盖子、滴管和导管进行微型实验。
(1)井穴1中能证明石灰水和盐酸发生反应的现象是 ______ 。
(2)井穴2发生反应的化学方程式为 ______ 。
(3)欲证明未知粉末X中含有碳酸盐,实验操作为 ______ 。
19.根据下列各实验回答问题:
①二氧化碳熄灭蜡烛 ②烧不坏的手帕 ③鸡蛋投入稀盐酸中
(1)图①反映出二氧化碳的物理性质是_______;
(2)图②中手帕烧不坏的原因是______;
(3)图③试验中可以观察到蛋壳表面有气泡产生,该反应的方程式为_________,随着反应的进行溶液的pH_________(填“变大”、“变小”或“不变”)
20.碳酸钙是一种常见的物质,在自然界中分布很广。
①检验甲、乙和丙三种均含钙元素的物质中是否含有碳酸钙。取三种物质各xg,分别进行如下实验。
现象 物质 甲 乙 丙
I中是否产生气体 否 是 是
II中是否产生沉淀 否 是 否
结论:含有碳酸钙的物质是______(选填“甲”、“乙”或“丙”)。
将xg丙磨成粉末,重复上述实验,观察到的现象是______(选填编号)。
a I中产生气体的量更多 b I中产生气泡的速率更快 c II中产生沉淀
②用石灰石为原料制取二氧化碳。
I实验室制取二氧化碳的化学方程式是______。
II搭建具有启普发生器功能的简易装置,除了长颈漏斗、多孔隔板、橡胶塞、导管、乳胶管、弹簧夹之外,下图可做反应容器的是______(选填编号)。
有同学搭建了如图装置,要使该装置也具有启普发生器的功能,需将块状石灰石放置在______(选填“A”或“B”)处。
III用向上排气法收集二氧化碳,是因为二氧化碳______。
五、计算题
21.尿素〔CO(NH2)2〕是化肥中最主要的一种,其含氮量高,在土壤中不残留任何有害物质,长期施用没有不良影响。
(1)尿素属于化肥中的______肥(填“氮”“钾”或“复合”)。
(2)CO(NH2)2中共含有______(写数字)种元素;
(3)CO(NH2)2的相对分子质量是______
(4)CO(NH2)2中C、H、N、O元素的质量比为______。
22.某同学欲测定生铁中铁的质量分数,他称取样品11.5g,加入足量溶质质量分数为10%的稀硫酸充分反应(杂质不溶于水,也不与稀硫酸反应),产生气体的质量与所加稀硫酸的质量关系如图所示,请回答:
(1)恰好完全反应时生成氢气的质量为 g。
(2)该样品中铁的质量分数?(精确到0.1%)。
(3)图中m的值。
23.巴中某超市卖的纯碱(Na2CO3)产品往往含有少量的氯化钠(NaCl),化学兴趣小组的同学通过实验来测定该纯碱样品中纯碱的质量分数,他们取12g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,共消耗盐酸100g,烧杯中没有残留不溶物,称得反应后溶液的质量为107.6g。
计算:
(1)生成二氧化碳 g。
(2)样品中纯碱的质量分数是多少?(要求写出计算过程,结果精确到0.1%)
24.碳酸钠和碳酸氢钠的混合物共20.0克加热到到质量不再减少,冷却后称量固体质量为16.9克。(已知碳酸氢钠加热分解得到碳酸钠和两种氧化物)
(1)碳酸氢钠俗称______,常用治疗胃酸过多;
(2)求原混合物中碳酸氢钠的质量?(请写出化学方程式和必要的过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.C
3.C
4.C
5.A
6.D
7.A
8.D
9.B
10.A
11.C
12.C
13.
14. Fe3O4+4CO3Fe+4CO2 Fe2O3+6HCl=2FeCl3+3H2O
15. 化合反应
置换反应
化合反应
16. CO2 CuSO4、FeCl3 NaCl+AgNO3=AgCl↓+NaNO3 或 CaCl2+2AgNO3=2AgCl↓+Ca(NO3)2 Ca(NO3)2 、NaNO3
17. 尿素 碳酸氢铵 氯化铵 无 不能 NH3.H2O
18. 红色溶液变成无色 6HCl+Fe2O3=2FeCl3 +3H2O 在孔穴6中加入澄清石灰水,将稀盐酸挤入孔穴3
19. 密度大于空气 水汽化吸热,温度低于手帕的着火点
变大
20. 乙 b ac A 二氧化碳能溶于水、密度比空气大
21.(1)尿素中含有氮元素,属于化肥中的氮肥。
(2)CO(NH2)2中共含有C、O、N、H,4种元素;
(3)CO(NH2)2的相对分子质量是12+16+(14+1×2)×2=60;
(4)CO(NH2)2中C、H、N、O元素的质量比为12:(1×4):(14×2):16=3:1:7:4。
22.(1)0.4;
(2)解:设该样品中铁的质量分数为x,消耗硫酸的质量为y
x≈97.4%
y=19.6g;
(3)图中m=19.6g÷10%=196g。
答:该样品中铁的质量分数为97.4%,m=196g。
23.(1)4.4
(2)设样品中纯碱的质量为x
x=10.6g
所以样品中纯碱的质量分数是。
答:样品中纯碱的质量分数是88.3%。
24.(1)小苏打(2)碳酸氢钠加热分解得到碳酸钠和两种氧化物,根据质量守恒定律可知,碳酸氢钠加热分解生成碳酸钠、水和二氧化碳,设原混合物中碳酸氢钠的质量为x,
解得x=8.4g;
答:原混合物中碳酸氢钠的质量8.4g。
答案第1页,共2页
答案第1页,共2页
