7.4结晶现象同步练习—2021-2022学年九年级化学科粤版下册(word版含答案)
文档属性
| 名称 | 7.4结晶现象同步练习—2021-2022学年九年级化学科粤版下册(word版含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 383.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-27 20:31:12 | ||
图片预览


文档简介
科粤版九年级化学下册 7.4 结晶现象 同步练习
一、单选题
1.氢氧化钙的溶解度随温度升高而减小。要想把一瓶接近饱和的石灰水变成饱和,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水。
其中措施正确的是
A.①②④ B.①③④ C.①③⑤ D.①②⑤
2.将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列有关量随时间变化趋势的图像不正确的是
A. B.
C. D.
3.下列有关溶液的说法中,正确的是
A.饱和溶液就是不能继续溶解溶质的溶液
B.同一溶质的饱和溶液一定比其不饱和溶液浓
C.溶液中的溶质以分子或离子的形式均匀分散在溶剂中保持静止不动,所以溶液具有均一性和稳定性
D.改变条件,能够使饱和溶液与不饱和溶液相互转化
4.甲、乙两种物质的溶解度曲线如图,下列说法正确的是
A.时,甲、乙两种物质溶液的溶解度相等
B.时,乙物质饱和溶液降温到,溶质质量分数升高
C.时,甲、乙两种物质饱和溶液的溶质质量分数相等
D.时,甲物质溶液的质量分数一定大于乙物质溶液的质量分数
5.中医药在治疗新冠肺炎中,为全球抗击疫情贡献了中国智慧。下列中药煎制步骤与实验室过滤操作原理相同的是( )
A.冷水浸泡 B.加热煎制
C.取液弃渣 D.装袋保存
6.如图是a、b、c三种固体物质的溶解度曲线图,下列说法不正确的是
A.P点对应的a、c两种溶液中溶质的质量相等
B.升高温度可使接近饱和的c溶液变为饱和溶液
C.t2℃时,将30ga加入50g水中,充分搅拌后得到75g溶液
D.将t2℃时等质量的a、b、c三种饱和溶液分别降至t1℃,析出a最多
7.除去混在白糖中的少量泥沙,需采取的正确操作是
A.溶解、过滤、蒸发 B.溶解、加热、结晶
C.溶解、蒸发、振荡 D.搅拌、溶解、称量
8.水是生命之源,关于水的说法正确的是
A.明矾可以净水 B.煮沸不能降低硬水的硬度
C.活性炭能使海水淡化 D.通过过滤可以除去水中所有的杂质
9.下列中草药煎制步骤中,属于过滤操作的是
A.冷水浸泡 B.加热煎制 C.箅渣取液 D.灌装保存
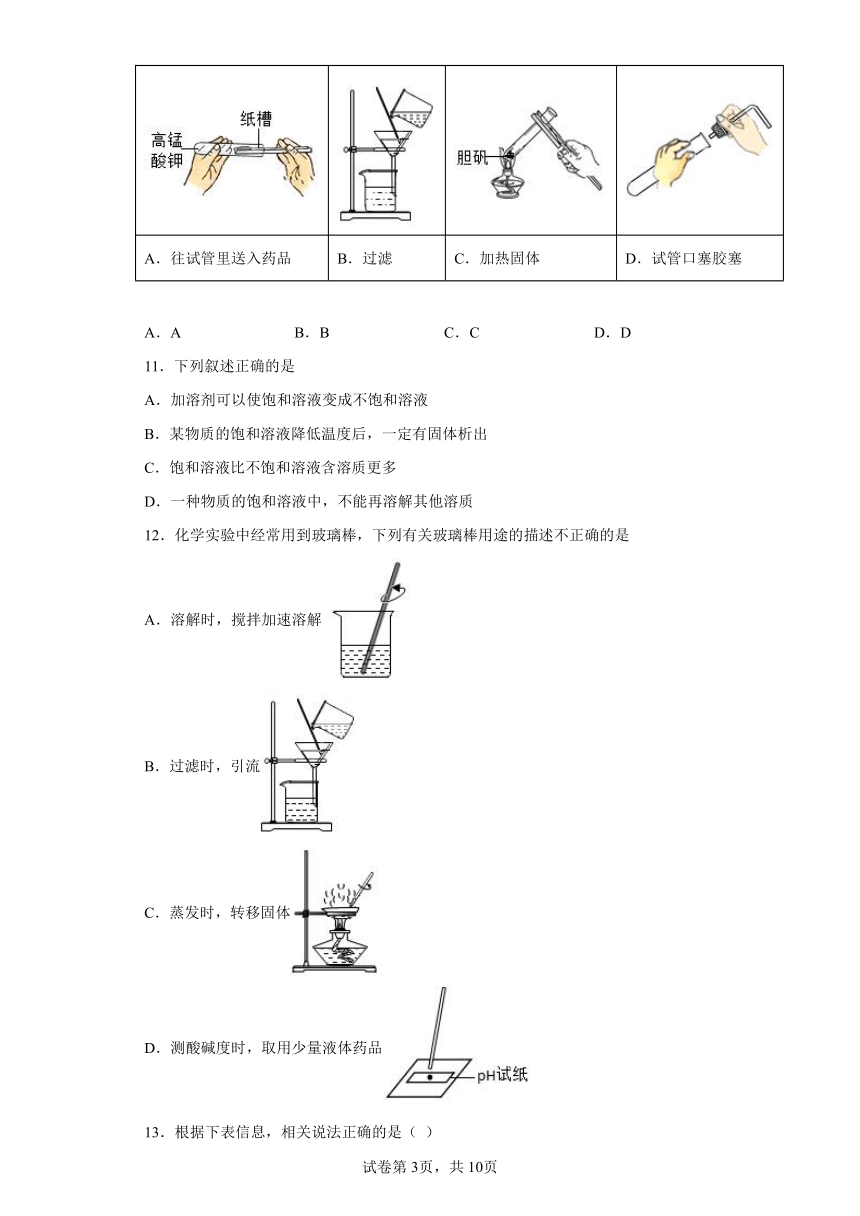
10.下图是中考实验操作考查中,某些学生的实验操作示意图,其中不正确的是
A.往试管里送入药品 B.过滤 C.加热固体 D.试管口塞胶塞
A.A B.B C.C D.D
11.下列叙述正确的是
A.加溶剂可以使饱和溶液变成不饱和溶液
B.某物质的饱和溶液降低温度后,一定有固体析出
C.饱和溶液比不饱和溶液含溶质更多
D.一种物质的饱和溶液中,不能再溶解其他溶质
12.化学实验中经常用到玻璃棒,下列有关玻璃棒用途的描述不正确的是
A.溶解时,搅拌加速溶解
B.过滤时,引流
C.蒸发时,转移固体
D.测酸碱度时,取用少量液体药品
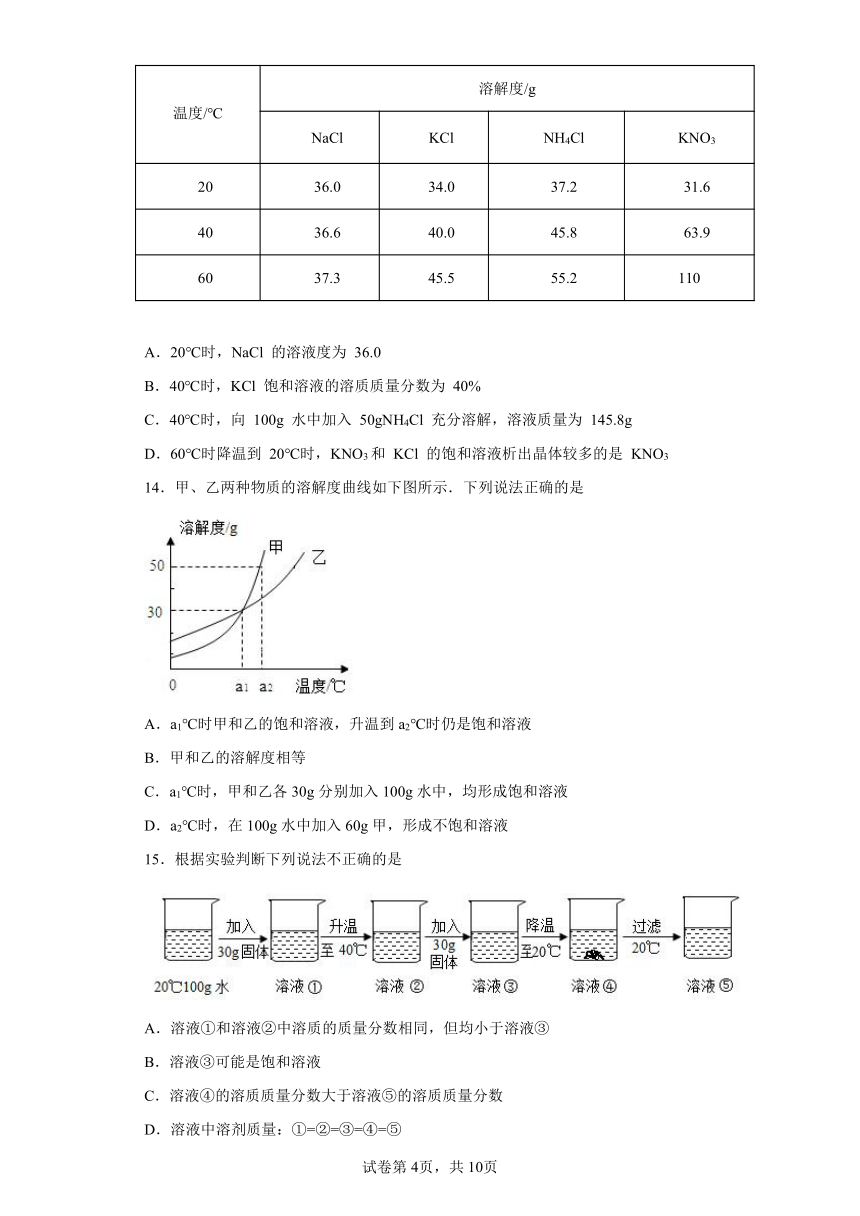
13.根据下表信息,相关说法正确的是( )
温度/℃ 溶解度/g
NaCl KCl NH4Cl KNO3
20 36.0 34.0 37.2 31.6
40 36.6 40.0 45.8 63.9
60 37.3 45.5 55.2 110
A.20℃时,NaCl 的溶液度为 36.0
B.40℃时,KCl 饱和溶液的溶质质量分数为 40%
C.40℃时,向 100g 水中加入 50gNH4Cl 充分溶解,溶液质量为 145.8g
D.60℃时降温到 20℃时,KNO3和 KCl 的饱和溶液析出晶体较多的是 KNO3
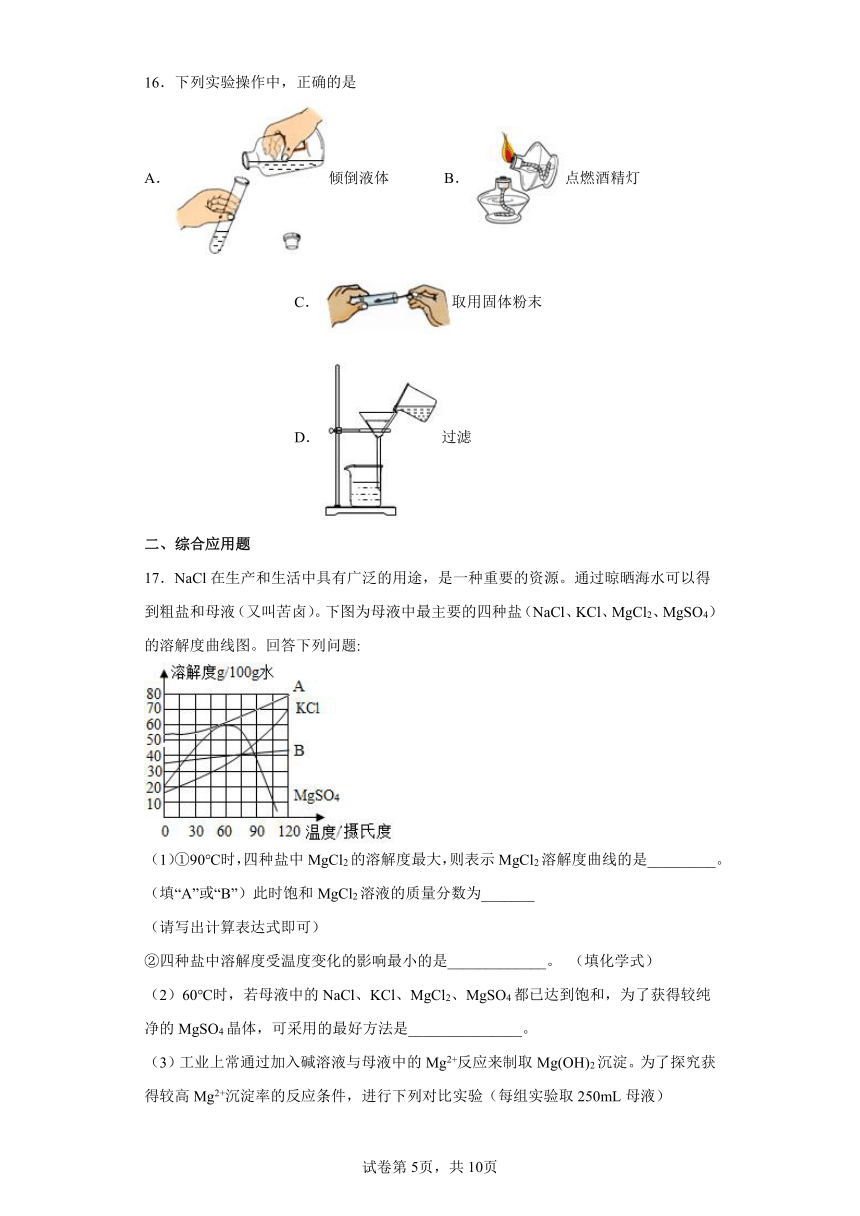
14.甲、乙两种物质的溶解度曲线如下图所示.下列说法正确的是
A.a1℃时甲和乙的饱和溶液,升温到a2℃时仍是饱和溶液
B.甲和乙的溶解度相等
C.a1℃时,甲和乙各30g分别加入100g水中,均形成饱和溶液
D.a2℃时,在100g水中加入60g甲,形成不饱和溶液
15.根据实验判断下列说法不正确的是
A.溶液①和溶液②中溶质的质量分数相同,但均小于溶液③
B.溶液③可能是饱和溶液
C.溶液④的溶质质量分数大于溶液⑤的溶质质量分数
D.溶液中溶剂质量:①=②=③=④=⑤
16.下列实验操作中,正确的是
A.倾倒液体 B.点燃酒精灯 C.取用固体粉末 D.过滤
二、综合应用题
17.NaCl在生产和生活中具有广泛的用途,是一种重要的资源。通过晾晒海水可以得到粗盐和母液(又叫苦卤)。下图为母液中最主要的四种盐(NaCl、KCl、MgCl2、MgSO4)的溶解度曲线图。回答下列问题:
(1)①90℃时,四种盐中MgCl2的溶解度最大,则表示MgCl2溶解度曲线的是_________。(填“A”或“B”)此时饱和MgCl2溶液的质量分数为_______
(请写出计算表达式即可)
②四种盐中溶解度受温度变化的影响最小的是_____________。 (填化学式)
(2)60℃时,若母液中的NaCl、KCl、MgCl2、MgSO4都已达到饱和,为了获得较纯净的MgSO4晶体,可采用的最好方法是_______________。
(3)工业上常通过加入碱溶液与母液中的Mg2+反应来制取Mg(OH)2沉淀。为了探究获得较高Mg2+沉淀率的反应条件,进行下列对比实验(每组实验取250mL母液)
实验序号 反应温度/℃ 反应时间/min 反应pH值 Mg2+的沉淀率/%
a 40 60 10 90.1
b 40 60 12 92.7
c 40 90 12 93.6
d 50 60 12 96.4
e 50 90 12 X
①本实验研究了哪些因素对Mg2+的沉淀率的影响_______
②实验a和b对比,可得到的结论是_______
③表格中x的数值可能为__________(填字母)。
A 95.8 B 92.1 C 97.2 D 93.1
18.某实验小组用加热氯酸钾(KClO3)和二氧化锰(催化剂)的混合物制取氧气,并分离提纯实验反应后的固体剩余物,操作流程如下,按要求回答下列问题(忽略实验过程中的损耗)∶
(1)步骤一中发生反应的化学方程式为________。
(2)步骤二中操作X所用到的玻璃仪器有________、烧杯、玻璃棒,其中玻璃棒的作用是________,操作Y的名称是_________。
(3)实验前所加二氧化锰的质量为_________克。
(4)试计算该实验小组所取氯酸钾的质量。(写出计算过程)
19.根据下图中甲、乙、丙三种固体物质的溶解度曲线,回答下列问题。
(1)温度为__________℃时,甲、乙物质的溶解度相等。
(2)甲、乙、丙三种物质中,__________的溶解度受温度影响最小。
(3)甲中混有少量的乙,提纯甲的方法是________。
(4)分别将100g甲、丙的饱和溶液从t3℃降温到t1℃时,对所得溶液的叙述正确的 (填序号)
A.甲、丙都是饱和溶液
B.所含溶剂质量:甲=丙
C.溶液的质量:甲>丙
D.溶质的质量分数:甲>丙
20.下图是实验室制取氧气可能用到的装置
①写出带标号仪器的名称:①________、②__________;
②向气体发生装置内加入药品前,应该进行的操作是_____________;
③若用无水醋酸钠和碱石灰两种固体药品加热制取甲烷气体,可选用的发生装置是图___________;写出实验室以图B为发生装置制取氧气的化学方程式:_____________;
④收集氧气选用的装置是图E或图_____________,选择E的理由是_____________;下图收集装置中也可于收集氧气的是_____________(填编号);
⑤某同学制取氧气后回收提纯氯化钾和二氧化锰的流程如下图
操作m的名称是____________,操作n的名称是_________,操作m、n中都用到的玻璃仪器是__________,操作m中该仪器的作用是______________;
⑥加热氯酸钾和二氧化锰的混合物得到0.3 mol氧气,求所需的氯酸钾的物质的量 _______________。(根据化学方程式列式计算)
21.“宏观-微观-符号”之间建立联系是化学学科重要的思维方式。请根据示意图回答问题:
I.如图A、B分别是水蒸气液化,水通电分解的微观变化示意图,C图为电解水实验图:
请回答下列问题:
(1)从微观角度分析可得图A中水分子本身没有改变,只是______发生改变,分析图B可知,_______是化学变化中最小粒子。
(2)图C是小明同学探究水的组成实验,实验结束后_______试管中产生的气体具有可燃性,若负极产生的气体体积为16mL,则正极产生的气体体积为_______mL。
(3)该实验发生反应的化学方程式为_________。
II.净水机可以将水厂原水直接净化为饮用水,其中处理流程如下图所示:
(4)步骤①中固体具有_______作用,②中超滤膜可起到过滤不溶性杂质的作用,实验室过滤操作需要的玻璃仪器有玻璃棒、烧杯、__________。其中玻璃棒的作用是______。
(5)高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂,K2FeO4中铁元素的化合价是______。
22.水是我们熟悉的物质。
①为了测定水的组成,进行如下探究:
甲方案:电解水时玻璃管内的现象是____________;b管内生成的气体是______________;检验a管内产生气体的方法是___________。生成气体的体积比是___________,该实验说明水是由氢、氧元素组成的理论依据是__________;
电解水时,常加入少量氢氧化钠使电解水反应容易进行,而氢氧化钠本身的质量和化学性质不发生变化。若水电解装置中盛有一定量的氢氧化钠溶液,通电一段时间后,产生了16g氧气,管内溶液中氢氧化钠的质量分数由 2.7%变为3.0%。试计算
Ⅰ.参加反应的水的物质的量____________mol(根据化学方程式列式计算)。
Ⅱ.电解前氢氧化钠溶液的质量为________________g。
乙方案:该方案的实验目的是____________________,氢气在氧气中燃烧,反应的化学方程式是_________________,现象__________;该实验能否达到实验目的,并阐述理由___________。
②下表是KNO3 、NaCl在不同温度下的部分溶解度数据。
温度(℃) 0 10 20 30 40 50 60 70 80 90 100
KNO3 13.3 20.9 32.0 45.8 64.0 85.5 110.0 138.0 169.0 202.0 246.0
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8
Ⅰ. 以上两种物质溶解度的变化受温度影响较小的是___________。
Ⅱ. 在40℃时,将40gKNO3溶解在50g水中,形成溶液的质量是_______g。若升温至60℃,形成的溶液为________(填“饱和”或“不饱和”)溶液,该溶液的溶质质量分数为_______。
Ⅲ.根据表中数据,找出60.0g水能够溶解66.0g KNO3的温度范围是___________。
Ⅳ. 固体KNO3中混有少量NaCl,欲提纯KNO3所需的实验步骤为________。
Ⅴ.气体在水中的溶解度也有一定的变化规律。下图为不同温度下,某气体的溶解度与温度的关系。
图中P1与P2表示气压,则P1与P2的关系是________。
A P1>P2
B P1=P2
C P1<P2
D 无法确定
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.D
3.D
4.C
5.C
6.A
7.A
8.A
9.C
10.C
11.A
12.C
13.C
14.C
15.C
16.C
17. A NaCl 升高温度 反应温度、反应时间、反应pH值 在反应温度和反应时间相同时,反应pH值越大,Mg2+的沉淀率越大 C
18.(1)2KClO32KCl+3O2↑
(2) 漏斗 引流 蒸发
(3)3.0
(4)解:设该实验小组所取氯酸钾的质量为x。
x=9.8g
答:该实验小组所取氯酸钾的质量为9.8g。
19.(1)t2
(2)乙
(3)降温结晶(或冷却热饱和溶液)
(4)D
20. 铁架台 水槽 检查装置的气密性 A
D 氧气不易溶于水,且与水不反应 ① 过滤 蒸发结晶 玻璃棒 引流 解:设所需氯酸钾的物质的量为x
x=0.2 mol
答:所需氯酸钾的物质的量为0.2 mol。
21.(1) 分子之间的间隔 原子
(2) 甲 8
(3)
(4) 吸附 漏斗 引流
(5)+6##+6价
22. 有大量气泡,液面下降 氢气或H2 将带火星的木条伸到尖嘴导管处,余烬木条复燃 V(H2):V (O2)=2:1 (合理得分) 质量守恒定律 1 mol 180g 用化合的方法测定水的组成 2H2+O22H2O 剧烈燃烧,产生蓝色(淡蓝色)火焰,集气瓶内壁有水珠 不能,因为用排水法收集氧气,会带有大量水分。(前后对应正确,给分) 氯化钠或NaCl 82 不饱和 4/9或44.4% t≥60℃ 溶解、蒸发浓缩、冷却热饱和溶液、过滤(洗涤)、烘干 C
答案第1页,共2页
答案第1页,共2页
一、单选题
1.氢氧化钙的溶解度随温度升高而减小。要想把一瓶接近饱和的石灰水变成饱和,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水。
其中措施正确的是
A.①②④ B.①③④ C.①③⑤ D.①②⑤
2.将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列有关量随时间变化趋势的图像不正确的是
A. B.
C. D.
3.下列有关溶液的说法中,正确的是
A.饱和溶液就是不能继续溶解溶质的溶液
B.同一溶质的饱和溶液一定比其不饱和溶液浓
C.溶液中的溶质以分子或离子的形式均匀分散在溶剂中保持静止不动,所以溶液具有均一性和稳定性
D.改变条件,能够使饱和溶液与不饱和溶液相互转化
4.甲、乙两种物质的溶解度曲线如图,下列说法正确的是
A.时,甲、乙两种物质溶液的溶解度相等
B.时,乙物质饱和溶液降温到,溶质质量分数升高
C.时,甲、乙两种物质饱和溶液的溶质质量分数相等
D.时,甲物质溶液的质量分数一定大于乙物质溶液的质量分数
5.中医药在治疗新冠肺炎中,为全球抗击疫情贡献了中国智慧。下列中药煎制步骤与实验室过滤操作原理相同的是( )
A.冷水浸泡 B.加热煎制
C.取液弃渣 D.装袋保存
6.如图是a、b、c三种固体物质的溶解度曲线图,下列说法不正确的是
A.P点对应的a、c两种溶液中溶质的质量相等
B.升高温度可使接近饱和的c溶液变为饱和溶液
C.t2℃时,将30ga加入50g水中,充分搅拌后得到75g溶液
D.将t2℃时等质量的a、b、c三种饱和溶液分别降至t1℃,析出a最多
7.除去混在白糖中的少量泥沙,需采取的正确操作是
A.溶解、过滤、蒸发 B.溶解、加热、结晶
C.溶解、蒸发、振荡 D.搅拌、溶解、称量
8.水是生命之源,关于水的说法正确的是
A.明矾可以净水 B.煮沸不能降低硬水的硬度
C.活性炭能使海水淡化 D.通过过滤可以除去水中所有的杂质
9.下列中草药煎制步骤中,属于过滤操作的是
A.冷水浸泡 B.加热煎制 C.箅渣取液 D.灌装保存
10.下图是中考实验操作考查中,某些学生的实验操作示意图,其中不正确的是
A.往试管里送入药品 B.过滤 C.加热固体 D.试管口塞胶塞
A.A B.B C.C D.D
11.下列叙述正确的是
A.加溶剂可以使饱和溶液变成不饱和溶液
B.某物质的饱和溶液降低温度后,一定有固体析出
C.饱和溶液比不饱和溶液含溶质更多
D.一种物质的饱和溶液中,不能再溶解其他溶质
12.化学实验中经常用到玻璃棒,下列有关玻璃棒用途的描述不正确的是
A.溶解时,搅拌加速溶解
B.过滤时,引流
C.蒸发时,转移固体
D.测酸碱度时,取用少量液体药品
13.根据下表信息,相关说法正确的是( )
温度/℃ 溶解度/g
NaCl KCl NH4Cl KNO3
20 36.0 34.0 37.2 31.6
40 36.6 40.0 45.8 63.9
60 37.3 45.5 55.2 110
A.20℃时,NaCl 的溶液度为 36.0
B.40℃时,KCl 饱和溶液的溶质质量分数为 40%
C.40℃时,向 100g 水中加入 50gNH4Cl 充分溶解,溶液质量为 145.8g
D.60℃时降温到 20℃时,KNO3和 KCl 的饱和溶液析出晶体较多的是 KNO3
14.甲、乙两种物质的溶解度曲线如下图所示.下列说法正确的是
A.a1℃时甲和乙的饱和溶液,升温到a2℃时仍是饱和溶液
B.甲和乙的溶解度相等
C.a1℃时,甲和乙各30g分别加入100g水中,均形成饱和溶液
D.a2℃时,在100g水中加入60g甲,形成不饱和溶液
15.根据实验判断下列说法不正确的是
A.溶液①和溶液②中溶质的质量分数相同,但均小于溶液③
B.溶液③可能是饱和溶液
C.溶液④的溶质质量分数大于溶液⑤的溶质质量分数
D.溶液中溶剂质量:①=②=③=④=⑤
16.下列实验操作中,正确的是
A.倾倒液体 B.点燃酒精灯 C.取用固体粉末 D.过滤
二、综合应用题
17.NaCl在生产和生活中具有广泛的用途,是一种重要的资源。通过晾晒海水可以得到粗盐和母液(又叫苦卤)。下图为母液中最主要的四种盐(NaCl、KCl、MgCl2、MgSO4)的溶解度曲线图。回答下列问题:
(1)①90℃时,四种盐中MgCl2的溶解度最大,则表示MgCl2溶解度曲线的是_________。(填“A”或“B”)此时饱和MgCl2溶液的质量分数为_______
(请写出计算表达式即可)
②四种盐中溶解度受温度变化的影响最小的是_____________。 (填化学式)
(2)60℃时,若母液中的NaCl、KCl、MgCl2、MgSO4都已达到饱和,为了获得较纯净的MgSO4晶体,可采用的最好方法是_______________。
(3)工业上常通过加入碱溶液与母液中的Mg2+反应来制取Mg(OH)2沉淀。为了探究获得较高Mg2+沉淀率的反应条件,进行下列对比实验(每组实验取250mL母液)
实验序号 反应温度/℃ 反应时间/min 反应pH值 Mg2+的沉淀率/%
a 40 60 10 90.1
b 40 60 12 92.7
c 40 90 12 93.6
d 50 60 12 96.4
e 50 90 12 X
①本实验研究了哪些因素对Mg2+的沉淀率的影响_______
②实验a和b对比,可得到的结论是_______
③表格中x的数值可能为__________(填字母)。
A 95.8 B 92.1 C 97.2 D 93.1
18.某实验小组用加热氯酸钾(KClO3)和二氧化锰(催化剂)的混合物制取氧气,并分离提纯实验反应后的固体剩余物,操作流程如下,按要求回答下列问题(忽略实验过程中的损耗)∶
(1)步骤一中发生反应的化学方程式为________。
(2)步骤二中操作X所用到的玻璃仪器有________、烧杯、玻璃棒,其中玻璃棒的作用是________,操作Y的名称是_________。
(3)实验前所加二氧化锰的质量为_________克。
(4)试计算该实验小组所取氯酸钾的质量。(写出计算过程)
19.根据下图中甲、乙、丙三种固体物质的溶解度曲线,回答下列问题。
(1)温度为__________℃时,甲、乙物质的溶解度相等。
(2)甲、乙、丙三种物质中,__________的溶解度受温度影响最小。
(3)甲中混有少量的乙,提纯甲的方法是________。
(4)分别将100g甲、丙的饱和溶液从t3℃降温到t1℃时,对所得溶液的叙述正确的 (填序号)
A.甲、丙都是饱和溶液
B.所含溶剂质量:甲=丙
C.溶液的质量:甲>丙
D.溶质的质量分数:甲>丙
20.下图是实验室制取氧气可能用到的装置
①写出带标号仪器的名称:①________、②__________;
②向气体发生装置内加入药品前,应该进行的操作是_____________;
③若用无水醋酸钠和碱石灰两种固体药品加热制取甲烷气体,可选用的发生装置是图___________;写出实验室以图B为发生装置制取氧气的化学方程式:_____________;
④收集氧气选用的装置是图E或图_____________,选择E的理由是_____________;下图收集装置中也可于收集氧气的是_____________(填编号);
⑤某同学制取氧气后回收提纯氯化钾和二氧化锰的流程如下图
操作m的名称是____________,操作n的名称是_________,操作m、n中都用到的玻璃仪器是__________,操作m中该仪器的作用是______________;
⑥加热氯酸钾和二氧化锰的混合物得到0.3 mol氧气,求所需的氯酸钾的物质的量 _______________。(根据化学方程式列式计算)
21.“宏观-微观-符号”之间建立联系是化学学科重要的思维方式。请根据示意图回答问题:
I.如图A、B分别是水蒸气液化,水通电分解的微观变化示意图,C图为电解水实验图:
请回答下列问题:
(1)从微观角度分析可得图A中水分子本身没有改变,只是______发生改变,分析图B可知,_______是化学变化中最小粒子。
(2)图C是小明同学探究水的组成实验,实验结束后_______试管中产生的气体具有可燃性,若负极产生的气体体积为16mL,则正极产生的气体体积为_______mL。
(3)该实验发生反应的化学方程式为_________。
II.净水机可以将水厂原水直接净化为饮用水,其中处理流程如下图所示:
(4)步骤①中固体具有_______作用,②中超滤膜可起到过滤不溶性杂质的作用,实验室过滤操作需要的玻璃仪器有玻璃棒、烧杯、__________。其中玻璃棒的作用是______。
(5)高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂,K2FeO4中铁元素的化合价是______。
22.水是我们熟悉的物质。
①为了测定水的组成,进行如下探究:
甲方案:电解水时玻璃管内的现象是____________;b管内生成的气体是______________;检验a管内产生气体的方法是___________。生成气体的体积比是___________,该实验说明水是由氢、氧元素组成的理论依据是__________;
电解水时,常加入少量氢氧化钠使电解水反应容易进行,而氢氧化钠本身的质量和化学性质不发生变化。若水电解装置中盛有一定量的氢氧化钠溶液,通电一段时间后,产生了16g氧气,管内溶液中氢氧化钠的质量分数由 2.7%变为3.0%。试计算
Ⅰ.参加反应的水的物质的量____________mol(根据化学方程式列式计算)。
Ⅱ.电解前氢氧化钠溶液的质量为________________g。
乙方案:该方案的实验目的是____________________,氢气在氧气中燃烧,反应的化学方程式是_________________,现象__________;该实验能否达到实验目的,并阐述理由___________。
②下表是KNO3 、NaCl在不同温度下的部分溶解度数据。
温度(℃) 0 10 20 30 40 50 60 70 80 90 100
KNO3 13.3 20.9 32.0 45.8 64.0 85.5 110.0 138.0 169.0 202.0 246.0
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8
Ⅰ. 以上两种物质溶解度的变化受温度影响较小的是___________。
Ⅱ. 在40℃时,将40gKNO3溶解在50g水中,形成溶液的质量是_______g。若升温至60℃,形成的溶液为________(填“饱和”或“不饱和”)溶液,该溶液的溶质质量分数为_______。
Ⅲ.根据表中数据,找出60.0g水能够溶解66.0g KNO3的温度范围是___________。
Ⅳ. 固体KNO3中混有少量NaCl,欲提纯KNO3所需的实验步骤为________。
Ⅴ.气体在水中的溶解度也有一定的变化规律。下图为不同温度下,某气体的溶解度与温度的关系。
图中P1与P2表示气压,则P1与P2的关系是________。
A P1>P2
B P1=P2
C P1<P2
D 无法确定
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.D
3.D
4.C
5.C
6.A
7.A
8.A
9.C
10.C
11.A
12.C
13.C
14.C
15.C
16.C
17. A NaCl 升高温度 反应温度、反应时间、反应pH值 在反应温度和反应时间相同时,反应pH值越大,Mg2+的沉淀率越大 C
18.(1)2KClO32KCl+3O2↑
(2) 漏斗 引流 蒸发
(3)3.0
(4)解:设该实验小组所取氯酸钾的质量为x。
x=9.8g
答:该实验小组所取氯酸钾的质量为9.8g。
19.(1)t2
(2)乙
(3)降温结晶(或冷却热饱和溶液)
(4)D
20. 铁架台 水槽 检查装置的气密性 A
D 氧气不易溶于水,且与水不反应 ① 过滤 蒸发结晶 玻璃棒 引流 解:设所需氯酸钾的物质的量为x
x=0.2 mol
答:所需氯酸钾的物质的量为0.2 mol。
21.(1) 分子之间的间隔 原子
(2) 甲 8
(3)
(4) 吸附 漏斗 引流
(5)+6##+6价
22. 有大量气泡,液面下降 氢气或H2 将带火星的木条伸到尖嘴导管处,余烬木条复燃 V(H2):V (O2)=2:1 (合理得分) 质量守恒定律 1 mol 180g 用化合的方法测定水的组成 2H2+O22H2O 剧烈燃烧,产生蓝色(淡蓝色)火焰,集气瓶内壁有水珠 不能,因为用排水法收集氧气,会带有大量水分。(前后对应正确,给分) 氯化钠或NaCl 82 不饱和 4/9或44.4% t≥60℃ 溶解、蒸发浓缩、冷却热饱和溶液、过滤(洗涤)、烘干 C
答案第1页,共2页
答案第1页,共2页
