9.2溶液组成的定量表示基础训练—2021—2022学年九年级化学京改版(2013)下册(word版含解析)
文档属性
| 名称 | 9.2溶液组成的定量表示基础训练—2021—2022学年九年级化学京改版(2013)下册(word版含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 296.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-27 00:00:00 | ||
图片预览




文档简介
9.2 溶液组成的定量表示
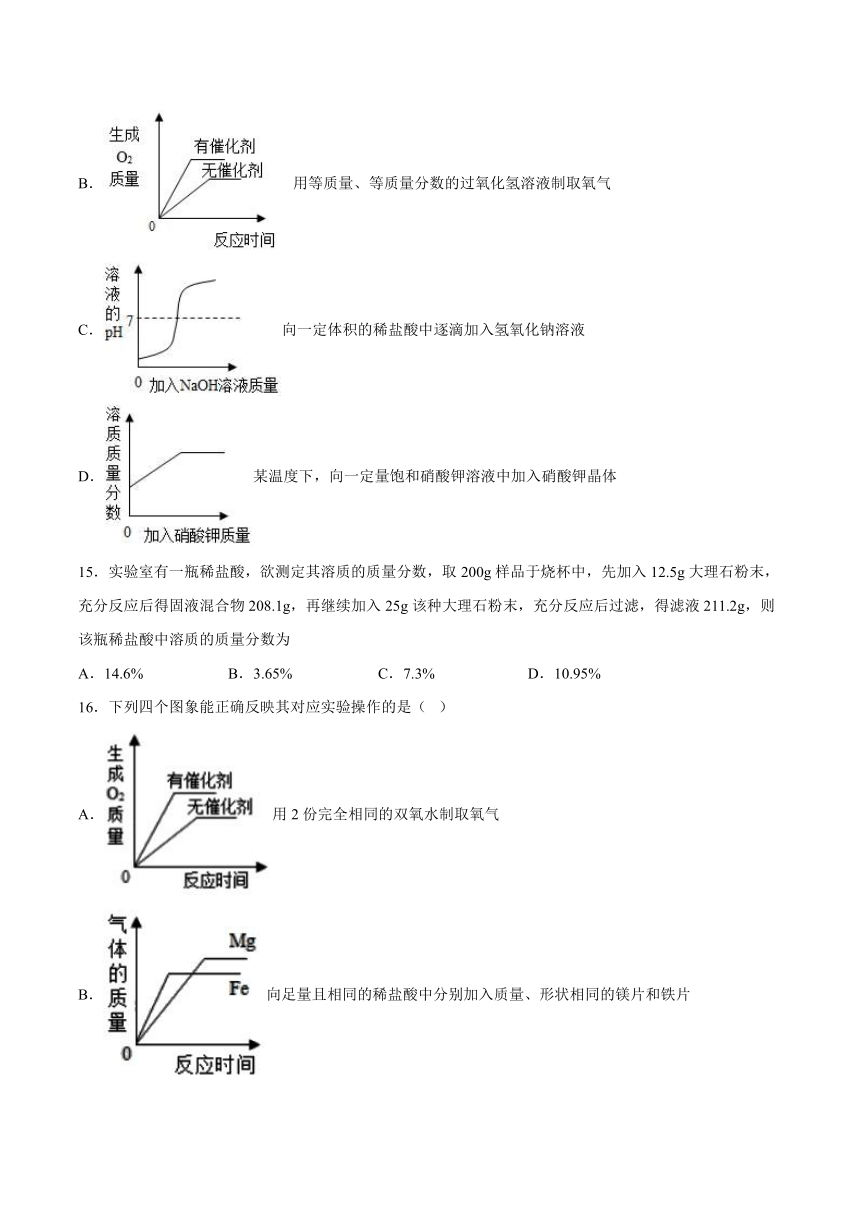
一、选择题(共16题)
1.实验室配制100g10%的氯化钠溶液,有关实验操作不正确的是
A.用托盘天平称取10.0g氯化钠
B.用量筒量取90.0mL 的水
C.将称取的氯化钠倒入量筒中溶解
D.将配制的溶液装入试剂瓶中,贴上标签
2.往100 g 20%的食盐溶液中加入100 g水,则稀释前后
A.溶剂的质量不变 B.溶液的质量不变
C.溶质的质量不变 D.溶液中溶质的质量分数不变
3.将100g 5%的氢氧化钠溶液,分别进行下述操作,所得溶液中溶质的质量分数最大的是
A.蒸发掉20 g水,无晶体析出 B.加入20g 5%的氢氧化钠溶液
C.加入20 g固体氢氧化钠,使之完全溶解 D.加入20g水
4.配制100 g溶质质量分数为10%的硝酸钾溶液,不需要的仪器是
A.量筒 B.烧杯 C.酒精灯 D.玻璃棒
5.给10%的硫酸溶液通电(实质为电解水,硫酸不发生化学变化)以测定水的组成,下
面四组数据是实验后获得的,你认为其中最接近理论值的一组是:
氧气的质量(g) 氢气的质量(g) 硫酸的质量分数
A 64 8 10%
B 10 2 10%
C 16 2 11%
D 16 32 11%
A.A B.B C.C D.D
6.电解氢氧化钠稀溶液与电解水的原理均可表示为:2H2O2H2↑+O2↑。电解一定质量氢氧化钠稀溶液的过程中,下列说法正确的是
A.溶液氢氧化钠的质量分数减小 B.溶液中氢元素质量分数减少
C.溶液中钠元素质量变大 D.溶液中氢、氧元素质量比不变
7.下列关于“相等”的说法不正确的是
A.化学反应前后分子个数一定相等
B.原子中核外电子数与核内质子数一定相等
C.浓溶液在加水稀释前后溶质的质量一定相等
D.参加化学反应的各物质的质量总和与反应后生成的各物质的质量总和一定相等
8.下图是配制100 g溶质质量分数为5%的氯化钠溶液的操作过程。以下说法错误的是
A.该实验操作顺序为③②④⑤①
B.称量时如果发现指针偏向右边,应减少右盘中的砝码
C.配制该溶液需要称取5g氯化钠,量取95mL水
D.操作①中玻璃棒的作用是搅拌,加快溶解的速率
9.某同学配制100g质量分数为11%的葡萄糖溶液,下列操作会导致所配溶液浓度偏高的是
A.用托盘天平称葡萄糖时,砝码放在左盘 B.转移葡萄糖时,纸上有少量残留
C.用量筒量取水时,俯视液面 D.配好溶液装入试剂瓶时,有少量洒出
10.如图图象能正确反映其对应关系的是( )
A.常温下,稀释氢氧化钠溶液
B.浓硫酸露置空气中
C.向饱和石灰水中加入生石灰
D.电解水生成气体的质量关系
11.实验室要配制50g10%的氯化钠溶液,下列步骤中操作方法错误的是
A.计算:计算所需氯化钠的质量为5g,水的体积为45mL
B.称量:在托盘天平左盘加5g砝码,在右盘添加氯化钠至天平平衡,再将氯化钠倒入烧杯中
C.量取:用50mL量筒量取45mL水,倒入上述烧杯中
D.溶解:用玻璃棒搅拌,使氯化钠完全溶解
12.下列溶液中溶质的质量分数最大的是
A.10g溶质溶于100g水中
B.10g溶质配成100mL溶液,该溶液的密度是1.15g/cm3
C.100g25%的某溶液加水稀释到200g
D.100g10%的某溶液,又溶解了10g溶质
13.某学生只有下列仪器和用具:烧杯、试管、硬质玻璃管、圆底烧瓶、量筒、铁架台(带铁夹)、酒精灯、集气瓶、玻璃片、水槽、导气管、橡皮塞、橡皮管、玻璃棒、药匙、火柴。从缺少仪器 或用具的角度看,该学生不能进行的实验操作是
①制取氢气;②粗盐提纯;③用木炭还原氧化铜;④配制一定溶质质量分数的氯化钠溶液
A.① ② B.② ③ C.① ③ D.②④
14.下列四个图象,能正确反映其对应实验操作的是( )
A. 高温煅烧石灰石
B. 用等质量、等质量分数的过氧化氢溶液制取氧气
C.向一定体积的稀盐酸中逐滴加入氢氧化钠溶液
D.某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体
15.实验室有一瓶稀盐酸,欲测定其溶质的质量分数,取200g样品于烧杯中,先加入12.5g大理石粉末,充分反应后得固液混合物208.1g,再继续加入25g该种大理石粉末,充分反应后过滤,得滤液211.2g,则该瓶稀盐酸中溶质的质量分数为
A.14.6% B.3.65% C.7.3% D.10.95%
16.下列四个图象能正确反映其对应实验操作的是( )
A.用2份完全相同的双氧水制取氧气
B.向足量且相同的稀盐酸中分别加入质量、形状相同的镁片和铁片
C.向某温度下不饱和硝酸钾溶液中加入硝酸钾晶体(温度不变)
D.向一定质量FeCl2和CuCl2的混合溶液中逐渐加入足量锌粒
二、综合题(共6题)
17.北京冬奥会将于2022年2月4日开幕。北京冬奥会的理念是“绿色、低碳、可持续发展”。
(1)北京冬奥会的理念中的“低碳”指的是较低的_________
(2)为实现北京冬奥会“碳中和”目标,通过张北柔性直流电网工程,将张北地区的风能、太阳能等生产的绿电输入北京,赛事期间北京冬奥会所有场馆将实现100%绿电供应。北京冬奥会境内接力火炬将全部应用氢燃料。
①请写出火炬接力时,奥运圣火燃烧的化学方程式_________。
②北京冬奥会场馆使用绿电与使用燃煤发电相比,其优点是什么_________?(答一条即可)
(3)以玉米、薯类及秸秆等可再生资源为原材料生产的可降解餐具,将代替塑料制品为冬奥会提供相关服务。玉米、薯类不仅可用于做餐具,而且发酵可制得乙醇,写出乙醇燃烧的化学方程式_________。
(4)作为北京市区唯一新建的场馆国家速滑馆“冰丝带”,采用世界跨度最大的单层双向正交马鞍形索网屋面,用钢量仅为传统屋面的四分之一。炼钢的原材料是生铁。写出工业上用赤铁矿(主要成分是氧化铁)冶炼生铁的化学方程式_________。
(5)国家速滑馆、五棵松体育中心等冬奥场馆,选用二氧化碳跨临界制冷系统,冰面温差控制在0.5℃以内,碳排量接近于零。实验室可用大理石与稀盐酸反应制取CO2。
①选用的发生和收集装置依次是_________。你选择上述发生装置的理由是_________。
②向盛有12g大理石(杂质不参与反应)的反应容器中,加入100g稀盐酸,恰好完全反应后,反应容器内固体与溶液的总质量为107.6g,请计算稀盐酸的溶质质量分数_________。(忽略二氧化碳溶于水的质量)
18.请结合图示,回答下列问题:
①写出有标号的仪器名称:M_______,N_______。
②实验室制取O2、CO2均可用的发生装置是________(填字母),用此装置制取氧气的化学方程式为____________________。可用装置E收集O2的依据是____________。
③实验室用C装置制CO2的优点是_________。用图示D装置收集CO2应从____端通入(选填“a”或“b”)。
④实验室用25g石灰石与一定量稀盐酸制取CO2(杂质不参加反应)。加入稀盐酸的质量与反应得到气体的质量变化关系如图所示。计算:
Ⅰ.总共产生CO2的物质的量为______mol;
Ⅱ.所用稀盐酸溶质的质量分数为________(根据化学方程式列式计算)
19.在做实验时,欣欣需要用到200g溶质质量分数为15%的氯化钠溶液,但实验室只有50g溶质质量分数为30%的氯化钠溶液,于是她便自己动手并利用已有的溶液来配制所需的氯化钠溶液。
(1)在称量时,她需要把氯化钠固体放到天垫有纸片的______(选填“左侧”或“右侧”)托盘中,并且应当称量______g氯化钠固体。
(2)她把称量好的氯化钠和实验室中现有的氯化钠溶液全都转移到一个大烧杯中,并应向其中加入体积为______mL的水,边加水边搅拌。(水的密度为1.0g/mL)
(3)如表是氯化钠在不同温度下的溶解度,假如她想通过升高溶液的温度来得到氯化钠晶体,则你认为她的做法______(选填“可行”或“不可行”)。
温度/℃ 20 40 60 80
溶解度/g 36.0 36.6 37.3 38.4
20.钠及其化合物是中学化学学习和研究的重要内容.
(1)如图1是钠的原子结构示意图,钠在反应中失电子后形成离子的符号是_____.
(2)钠在氯气中燃烧生成氯化钠,化学方程式为_____.
(3)配制一瓶符合如图2所示的氯化钠溶液,需氯化钠_____g;小明同学配制的氯化钠溶液质量分数偏小了,请写出他操作中可能出现的错误(提示:1g以下用游码,至少答出两点)_____.
(4)如何测定一瓶苏打水的酸碱度(写出实验操作步骤)_____.
(5)小苏打受热分解生成碳酸钠、二氧化碳和水,化学方程式为_____.
(6)钛和钛合金性能优良,广泛用于航空、造船和化学工作中.工业上常用钠来制取钛,在高温时,钠与四氯化钛(TiCl4)反应生成氯化钠和钛.若用该方法制取2.4kg钛,理论上需要钠的质量是多少_____?
21.小明在实验室加热57g氯酸钾和二氧化锰的混合物一段时间后,剩余固体的质量为47.4g。小明继续加热剩余固体至完全反应,又收集到一些氧气。为了回收催化剂,进行了如图所示实验:
请回答下列问题:
(1)实验过程中发生反应的化学方程式为____________________________________;
(2)第一次加热后收集到的氧气质量为______________________________________;
(3)列出求解两次总共参加反应的氯酸钾质量X的比例式_____________________;
(4)小明两次加热过程中,消耗氯酸钾的质量比为____________________________;
(5)如将所得溶液制成溶质质量分数为10%的溶液,需加入水的质量是__________。
22.在一次实验操作考查时,教师制定了三个考签:①的制取:②配制50gl0%的溶液:③粗盐提纯。每个同学抽取一个考签进行实验。
I.甲同学抽签后来到实验室,发现本组实验桌上准备了下列仪器和药品:
图中仪器A的名称_______,仪器C的名称_______,仪器E的名称___________,甲同学抽到的考签是的制取,该实验的原理为_______(用化学方程式表示),二氧化锰的作用___________,可选用的发生装置组合有_______(填字母代号)。若用100g该双氧水溶液制取得到氧气16g,请求出该双氧水的溶质质量分数(列式计算)。_________
Ⅱ.乙同学抽到“配制50g10%的溶液”。通过计算,需称量______g,量取水需要选取的合适量筒是_______(填“”或“”或“”)。
Ⅲ.丙同学抽到的考签为粗盐提纯。
操作②的名称为______,该操作过程中玻璃棒的作用______,若提纯所得晶体的质量比实际值偏低,则可能的原因是______。
试卷第1页,共3页
参考答案:
1.C
【详解】
A.用托盘天平称取10.0g氯化钠是正确的叙述; B.用量筒量取90.0mL 的水是正确的叙述;C.将称取的氯化钠倒入量筒中溶解是错误的叙述,因为量筒不能做任何反应容器; D.将配制的溶液装入试剂瓶中,贴上标签 是正确的叙述,故答案选择C
2.C
【详解】
往100g20%的食盐溶液中加入100g水,稀释后,溶质的质量不变,溶剂的质量增加,溶液的质量等于溶质和溶剂质量之和,故溶液的质量增加,溶液中溶质的质量分数变小。
故选:C。
3.C
【详解】
A、100g5%的氢氧化钠溶液中有溶质100g×5%=5g,有溶剂100g-5g=95g。蒸发掉50g水后的溶质质量分数为。
B、加入20g 5%的氢氧化钠溶液因为溶质质量分数与原溶液相同,所以溶质质量分数不变。
C、加入20 g固体氢氧化钠,溶质质量分数变为。
D、加入20g水,溶质质量分数变小。
C得到的溶液中溶质质量分数最大,故选C。
4.C
【详解】
A、量筒,用于配制溶液时量取水的体积,故A需要;B、烧杯,用于溶解硝酸钾,故B需要;C、酒精灯,用于加热的仪器,而配制溶液的过程中不需要进行加热,故C不需要;D、玻璃棒在溶解时用于搅拌,加速溶解,故D需要。故选C。
5.C
【详解】
因为水中氢元素和氧元素的质量之比是1:8,所以得到的氢气和氧气的质量之比也是1:8.故选C.
6.B
【详解】
A、电解氢氧化钠稀溶液,水电解为氢气和氧气,溶液质量减少,氢氧化钠的质量分数增大,故A错误;B、水电解为氢气和氧气,溶液中氢元素质量减少,溶液中氢元素质量分数减少,故B正确;C、根据质量守恒定律,钠元素质量不变,故C错误;D、氢氧化钠中氢氧元素质量比1:16,水中氢氧元素质量比为1:8,因此水电解后溶液中氢、氧元素质量比改变,故D错误。故选B。
7.A
【详解】
A、化学反应前后分子个数不一定相等,如2H2+O22H2O,错误;
B、原子中核外电子数与核内质子数一定相等,整个原子不显电性,正确;
C、浓溶液在加水稀释前后溶质的质量一定相等,变化的是溶剂的质量,正确;
D、根据质量守恒定律,参加化学反应的各物质的质量总和与反应后生成的各物质的质量总和一定相等,正确;
故选A。
8.B
【详解】
A、配制一定溶质质量分数的氯化钠溶液的操作步骤为:计算(计算所需的氯化钠和水的质量)→称量(所需的氯化钠)→量取(所需的水)→溶解,故顺序为:③②④⑤①,不符合题意;
B、托盘天平相当于一个等臂杠杆,称量时如果发现指针偏向右边,说明氯化钠的质量不够,应向左边继续添加氯化钠,符合题意;
C、配制该溶液需要称取100g×5%=5g氯化钠,量取100g-5g=95g,也就是95mL水,不符合题意;
D、操作①中玻璃棒的作用是搅拌,加快溶解的速率,说法正确,不符合题意。
故选B。
9.C
【详解】
A、配制100g质量分数为11%的葡萄糖溶液,所需葡萄糖为:100g×11%=11g,需要用到游码,用托盘天平称量葡萄糖时,砝码放在左盘,左盘质量=右盘质量+游码质量,故葡萄糖质量=砝码质量-游码质量,会导致溶质质量偏小,配制溶液的浓度偏低,不符合题意;
B、转移葡萄糖时,纸上有少量残留,会导致溶质质量偏小,溶液浓度偏低,不符合题意;
C、用量筒量取水时,俯视液面,读取数字大于实际数值,会使量取水的体积偏小,溶液质量偏小,溶液浓度偏大,符合题意;
D、配好溶液装入试剂瓶时,有少量洒出,溶液具有均一性,不影响溶液的浓度,不符合题意。
故选C。
10.D
【详解】
A.氢氧化钠溶液加水稀释仍显碱性,pH>7,故错误;
B.浓硫酸具有吸水性,溶质的质量分数变小,但不会为零,故错误;
C.氧化钙和水反应生成氢氧化钙,所以一定温度下,向一定量的饱和石灰水中加入生石灰,溶剂质量减小,溶质质量也相应的减小,溶液质量减小,故错误;
D.电解水生成氢气与氧气的质量比为1:8,故正确。
故选D。
11.B
【详解】
A、根据配制要求,所需氯化钠的质量为50g×10%=5g,水的质量是50g-5g=45g,水的密度是1g/cm3,因此水的体积是45mL,选项A正确;
B、利用托盘天平称量氯化钠的质量时,应该是“左物右码”,选项B不正确;
C、为减少误差,用量程为50mL量筒量取45mL水,倒入上述烧杯中,选项C正确;
D、使用玻璃棒搅拌,加速氯化钠的溶解速度,选项D正确。
故选B。
12.D
【详解】
A、10g溶质溶于100g水中,溶质质量分数 ;
B、10g溶质配成100mL溶液,该溶液的密度是1.15g/cm3,溶质质量分数 ;
C、100g25%的某溶液加水稀释到200g,溶质质量分数;
D、100g10%的某溶液,又溶解了10g溶质,溶质质量分数 。
溶液中溶质的质量分数最大的是D。故选:D。
13.D
【详解】
①制取氢气需用试管、药匙、铁架台、带导管的橡皮塞、集气瓶、玻璃片,这些仪器都有,能完成制氢气;②粗盐提纯的步骤是溶解、过滤、蒸发,溶解中要用的烧杯、玻璃棒,药匙、过滤中还要用的漏斗、铁架台、玻璃棒、烧杯,蒸发中还要用到蒸发皿、酒精灯、玻璃棒,粗盐提纯需用到的仪器是:烧杯、玻璃棒、药匙、漏斗、蒸发皿、酒精灯、铁架台。提供的仪器中缺少漏斗、蒸发皿,不能完成粗盐提纯;③用木炭还原氧化铜时,要用到的仪器是:酒精灯、药匙、铁架台、试管、带导管的橡皮塞。这些仪器都具有,可以完成实验;④用固体物质配制一定质量分数溶液的步骤是计算、称量、溶解。称量中要用的托盘天平没有,不能完成实验。根据上述分析不能完成的实验是②④。故选D。
14.C
【详解】
A、石灰石的主要成分是碳酸钙,含有杂质,高温煅烧生成氧化钙和二氧化碳,完全反应后固体质量不可能为0,故A不能正确反映其对应实验操作;
B、用等质量、等质量分数的过氧化氢溶液制取氧气,使用催化剂能加快反应速率,但不影响生成氧气的质量,故B不能正确反映其对应实验操作;
C、稀盐酸显酸性,pH小于7;向一定体积的稀盐酸中逐滴加入氢氧化钠溶液,氢氧化钠与稀盐酸反应生成氯化钠和水,完全反应时,溶液显中性,pH等于7;继续加入氢氧化钠溶液,溶液显碱性,pH大于7;pH值的变化是从小于7逐渐的增大到大于7,故C能正确反映其对应实验操作;
D、某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体,不能继续溶解硝酸钾,溶液中溶质质量分数不变,故D不能正确反映其对应实验操作。
故选C。
15.C
【详解】
设200g稀盐酸样品中氯化氢的质量为
该瓶稀盐酸中溶质的质量分数=
答:该瓶稀盐酸中溶质的质量分数为7.3%。
16.C
【详解】
A、过氧化氢分解生成水和氧气时,利用催化剂时反应速率快,需要时间短,但是等质量的过氧化氢完全反应后得到的氧气质量相等,故不符合题意;
B、向足量且相同的稀盐酸中分别加入质量、形状相同的镁片和铁片时,镁和稀盐酸反应速率快,反应需要时间短,并且镁和稀盐酸反应生成的氢气比铁多,故不符合题意;
C、向某温度下不饱和硝酸钾溶液中加入硝酸钾晶体时,随着硝酸钾的加入,溶质质量分数增大,当达到饱和状态时,溶质质量分数不再变化,故符合题意;
D、锌和氯化亚铁反应生成氯化锌和铁,和氯化铜反应生成氯化锌和铜,反应的化学方程式为及其质量关系为:
由以上质量关系可知,向一定质量FeCl2和CuCl2的混合溶液中逐渐加入足量锌粒时,完全反应前应该是一条直线,不应该出现弯折,故不符合题意。
17.(1)二氧化碳排放
(2) 无污染
(3)
(4)
(5) BC 固体和液体反应,不需加热 解:生成二氧化碳的质量=(100g+12g)-107.6g=4.4g
设:稀盐酸的溶质质量为x。
答:稀盐酸的溶质质量分数为7.3%。
【解析】
(1)
所谓“低碳”,就是较低的二氧化碳排放。
(2)
氢燃料燃烧只生成水,化学方程式:。
使用绿电与使用燃煤发电相比,其优点是“低碳”、无污染、节约化石燃料等。
(3)
乙醇燃烧生成水和二氧化碳,化学方程式。
(4)
业上用赤铁矿(主要成分是氧化铁)冶炼生铁是氧化铁与一氧化碳在高温条件下反应生成铁和二氧化碳,化学方程式。
(5)
①稀盐酸是液体,大理石是固体,反应条件是常温,选择固体液体常温装置,二氧化碳能溶于水,密度比空气大,选择向上排空气法收集。
②见答案。
18. 试管 长颈漏斗 B 2H2O22H2O+O2↑ 难溶于水且不与水反应 能够随时控制反应的开始与停止 a 0.2 10%
【详解】
①仪器M为试管,N是长颈漏斗;
②实验室中制取二氧化碳常用大理石或石灰石和稀盐酸反应来制取,属于固液常温型发生装置,可选择B装置来制取,过氧化氢溶液制氧气也属于固液常温型,可选择B装置来制取,化学方程式为:2H2O22H2O+O2↑;由于氧气难溶于水也不与水反应,可以用排水取气法收集;
③该装置的多孔隔板可以放置石灰石,通过控制开关可以利用气压控制反应物的接触与分离,从而控制反应的发生和停止;由于二氧化碳的密度大于空气,用向下排空气法收集,CO2应从a端通入。
④根据图可知生成的二氧化碳的质量为8.8g,CO2的物质的量为=0.2mol;
解:设稀盐酸中HCl的质量为x,
得x=14.6g
则所用稀盐酸中溶质的质量分数为×100%=10%,
答:所用稀盐酸中溶质的质量分数为×100%=10%。
19. 左侧 15 135 不可行
【详解】
(1)药品应放在天平的左盘上,氯化钠的质量=200g×15%-50g×30%=15g;故填:左侧;15;
(2)水的质量为:200g-50g-15g=135g,水的体积为:135g÷1g/mL=135mL;故填:135;
(3)20℃时,氯化钠的溶解度为36.0g,此温度下的饱和溶液中,溶质的质量分数为: ≈26.5%,所以欣欣配置的溶液是不饱和溶液;氯化钠的溶解度随着温度的升高慢慢增大,所以不能用升温的方法来实现,可通过蒸发溶剂的方法来实现。故填:不可行。
20. Na+ 2Na+Cl22NaCl 4.5 称量时砝码和试剂放反了,量取水时仰视读数,溶解前用蒸馏水润洗了烧杯 用干燥的玻璃棒蘸取(或胶头滴管吸取)少量的待测溶液,并滴在放在干燥的玻璃皿或白瓷板上的干燥pH试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的Ph 2NaHCO3 Na2CO3+H2O+CO2↑ 4.6kg
【详解】
(1)钠元素的最外层有1个电子,容易失去电子,形成钠离子Na+;
(2)钠和氯气在点燃的条件下生成氯化钠,故答案为2Na+Cl22NaCl;
(3)氯化钠的质量为:500mL×1g/mL×0.9%=4.5g,小明同学配制的氯化钠溶液质量分数偏小了,可能是称量时砝码和试剂放反了,量取水时仰视读数,溶解前用蒸馏水润洗了烧杯;
(4)测定溶液酸碱度的方法:用干燥的玻璃棒蘸取(或胶头滴管吸取)少量的待测溶液,并滴在放在干燥的玻璃皿或白瓷板上的干燥pH试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的pH;
(5)碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,化学方程式为:
2NaHCO3Na2CO3+H2O+CO2↑;
(6)设理论上需要钠的质量是x,则
所以制取2.4kg钛,理论上需要钠的质量是4.6kg。
21. 2KClO32KCl + 3O2 ↑ 9.6g 1:1 98g
【详解】
(1)氯酸钾在二氧化锰的催化作用下受热生成氯化钾和氧气,化学方程式为: 2KClO32KCl + 3O2 ↑;
(2)生成氧气的质量就是固态混合物减少的质量,第一次加热后收集到的氧气质量为:57g-47.4g=9.6克;
(3)根据题意可知,反应生成的氯化钾的质量=200g×14.9%=29.8g;
设两次总共参加反应的氯酸钾质量X
X=49g
(4)设第一次分解的氯酸钾的质量为y。
y=24.5g;
小明两次加热过程中,消耗氯酸钾的质量比=24.5g:(49g-24.5g)=1:1;
(5)设需加入水的质量是z。
溶液稀释过程中,溶质的质量不变,则有:
200g×14.9%=(200g+z)×10% z=98g,即需加入水的质量是98g。
22. 锥形瓶 集气瓶 分液漏斗 催化作用 (或) 34% 5g 50mL 过滤 引流 蒸发时没有用玻璃棒搅拌导致晶体飞溅(其它原因合理即可)
【详解】
Ⅰ.甲同学抽到的考签应该是氧气的制取;应选用的仪器:A是锥形瓶、C是集气瓶、E是分液漏斗,该实验的原理为:过氧化氢在二氧化锰作催化剂的条件下生成水和氧气,化学方程式为:;可选用的发生装置组合有AG(或AEF)。
若用100g该双氧水溶液制取得到氧气16g,设该双氧水中溶质的质量为x。
解得x=34g,,
该双氧水的溶质质量分数为
故填:锥形瓶; 集气瓶 ; 分液漏斗;;催化作用; AG(或AEF);34%。
Ⅱ.需要氯化钠的质量为:50g×10%=5g,水的质量为45g,体积为45mL,故选择50mL量筒。故填:5;50mL.
Ⅲ.过滤可将不溶性杂质分离,操作②的名称为过滤,玻璃棒的作用是引流,提纯所得晶体的质量比实际值偏低,则可能的原因是:加入的水少氯化钠没有完全被溶解;蒸发时没有用玻璃棒搅拌导致晶体飞溅等。
故填:过滤;引流;蒸发时没有用玻璃棒搅拌导致晶体飞溅。
答案第1页,共2页
一、选择题(共16题)
1.实验室配制100g10%的氯化钠溶液,有关实验操作不正确的是
A.用托盘天平称取10.0g氯化钠
B.用量筒量取90.0mL 的水
C.将称取的氯化钠倒入量筒中溶解
D.将配制的溶液装入试剂瓶中,贴上标签
2.往100 g 20%的食盐溶液中加入100 g水,则稀释前后
A.溶剂的质量不变 B.溶液的质量不变
C.溶质的质量不变 D.溶液中溶质的质量分数不变
3.将100g 5%的氢氧化钠溶液,分别进行下述操作,所得溶液中溶质的质量分数最大的是
A.蒸发掉20 g水,无晶体析出 B.加入20g 5%的氢氧化钠溶液
C.加入20 g固体氢氧化钠,使之完全溶解 D.加入20g水
4.配制100 g溶质质量分数为10%的硝酸钾溶液,不需要的仪器是
A.量筒 B.烧杯 C.酒精灯 D.玻璃棒
5.给10%的硫酸溶液通电(实质为电解水,硫酸不发生化学变化)以测定水的组成,下
面四组数据是实验后获得的,你认为其中最接近理论值的一组是:
氧气的质量(g) 氢气的质量(g) 硫酸的质量分数
A 64 8 10%
B 10 2 10%
C 16 2 11%
D 16 32 11%
A.A B.B C.C D.D
6.电解氢氧化钠稀溶液与电解水的原理均可表示为:2H2O2H2↑+O2↑。电解一定质量氢氧化钠稀溶液的过程中,下列说法正确的是
A.溶液氢氧化钠的质量分数减小 B.溶液中氢元素质量分数减少
C.溶液中钠元素质量变大 D.溶液中氢、氧元素质量比不变
7.下列关于“相等”的说法不正确的是
A.化学反应前后分子个数一定相等
B.原子中核外电子数与核内质子数一定相等
C.浓溶液在加水稀释前后溶质的质量一定相等
D.参加化学反应的各物质的质量总和与反应后生成的各物质的质量总和一定相等
8.下图是配制100 g溶质质量分数为5%的氯化钠溶液的操作过程。以下说法错误的是
A.该实验操作顺序为③②④⑤①
B.称量时如果发现指针偏向右边,应减少右盘中的砝码
C.配制该溶液需要称取5g氯化钠,量取95mL水
D.操作①中玻璃棒的作用是搅拌,加快溶解的速率
9.某同学配制100g质量分数为11%的葡萄糖溶液,下列操作会导致所配溶液浓度偏高的是
A.用托盘天平称葡萄糖时,砝码放在左盘 B.转移葡萄糖时,纸上有少量残留
C.用量筒量取水时,俯视液面 D.配好溶液装入试剂瓶时,有少量洒出
10.如图图象能正确反映其对应关系的是( )
A.常温下,稀释氢氧化钠溶液
B.浓硫酸露置空气中
C.向饱和石灰水中加入生石灰
D.电解水生成气体的质量关系
11.实验室要配制50g10%的氯化钠溶液,下列步骤中操作方法错误的是
A.计算:计算所需氯化钠的质量为5g,水的体积为45mL
B.称量:在托盘天平左盘加5g砝码,在右盘添加氯化钠至天平平衡,再将氯化钠倒入烧杯中
C.量取:用50mL量筒量取45mL水,倒入上述烧杯中
D.溶解:用玻璃棒搅拌,使氯化钠完全溶解
12.下列溶液中溶质的质量分数最大的是
A.10g溶质溶于100g水中
B.10g溶质配成100mL溶液,该溶液的密度是1.15g/cm3
C.100g25%的某溶液加水稀释到200g
D.100g10%的某溶液,又溶解了10g溶质
13.某学生只有下列仪器和用具:烧杯、试管、硬质玻璃管、圆底烧瓶、量筒、铁架台(带铁夹)、酒精灯、集气瓶、玻璃片、水槽、导气管、橡皮塞、橡皮管、玻璃棒、药匙、火柴。从缺少仪器 或用具的角度看,该学生不能进行的实验操作是
①制取氢气;②粗盐提纯;③用木炭还原氧化铜;④配制一定溶质质量分数的氯化钠溶液
A.① ② B.② ③ C.① ③ D.②④
14.下列四个图象,能正确反映其对应实验操作的是( )
A. 高温煅烧石灰石
B. 用等质量、等质量分数的过氧化氢溶液制取氧气
C.向一定体积的稀盐酸中逐滴加入氢氧化钠溶液
D.某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体
15.实验室有一瓶稀盐酸,欲测定其溶质的质量分数,取200g样品于烧杯中,先加入12.5g大理石粉末,充分反应后得固液混合物208.1g,再继续加入25g该种大理石粉末,充分反应后过滤,得滤液211.2g,则该瓶稀盐酸中溶质的质量分数为
A.14.6% B.3.65% C.7.3% D.10.95%
16.下列四个图象能正确反映其对应实验操作的是( )
A.用2份完全相同的双氧水制取氧气
B.向足量且相同的稀盐酸中分别加入质量、形状相同的镁片和铁片
C.向某温度下不饱和硝酸钾溶液中加入硝酸钾晶体(温度不变)
D.向一定质量FeCl2和CuCl2的混合溶液中逐渐加入足量锌粒
二、综合题(共6题)
17.北京冬奥会将于2022年2月4日开幕。北京冬奥会的理念是“绿色、低碳、可持续发展”。
(1)北京冬奥会的理念中的“低碳”指的是较低的_________
(2)为实现北京冬奥会“碳中和”目标,通过张北柔性直流电网工程,将张北地区的风能、太阳能等生产的绿电输入北京,赛事期间北京冬奥会所有场馆将实现100%绿电供应。北京冬奥会境内接力火炬将全部应用氢燃料。
①请写出火炬接力时,奥运圣火燃烧的化学方程式_________。
②北京冬奥会场馆使用绿电与使用燃煤发电相比,其优点是什么_________?(答一条即可)
(3)以玉米、薯类及秸秆等可再生资源为原材料生产的可降解餐具,将代替塑料制品为冬奥会提供相关服务。玉米、薯类不仅可用于做餐具,而且发酵可制得乙醇,写出乙醇燃烧的化学方程式_________。
(4)作为北京市区唯一新建的场馆国家速滑馆“冰丝带”,采用世界跨度最大的单层双向正交马鞍形索网屋面,用钢量仅为传统屋面的四分之一。炼钢的原材料是生铁。写出工业上用赤铁矿(主要成分是氧化铁)冶炼生铁的化学方程式_________。
(5)国家速滑馆、五棵松体育中心等冬奥场馆,选用二氧化碳跨临界制冷系统,冰面温差控制在0.5℃以内,碳排量接近于零。实验室可用大理石与稀盐酸反应制取CO2。
①选用的发生和收集装置依次是_________。你选择上述发生装置的理由是_________。
②向盛有12g大理石(杂质不参与反应)的反应容器中,加入100g稀盐酸,恰好完全反应后,反应容器内固体与溶液的总质量为107.6g,请计算稀盐酸的溶质质量分数_________。(忽略二氧化碳溶于水的质量)
18.请结合图示,回答下列问题:
①写出有标号的仪器名称:M_______,N_______。
②实验室制取O2、CO2均可用的发生装置是________(填字母),用此装置制取氧气的化学方程式为____________________。可用装置E收集O2的依据是____________。
③实验室用C装置制CO2的优点是_________。用图示D装置收集CO2应从____端通入(选填“a”或“b”)。
④实验室用25g石灰石与一定量稀盐酸制取CO2(杂质不参加反应)。加入稀盐酸的质量与反应得到气体的质量变化关系如图所示。计算:
Ⅰ.总共产生CO2的物质的量为______mol;
Ⅱ.所用稀盐酸溶质的质量分数为________(根据化学方程式列式计算)
19.在做实验时,欣欣需要用到200g溶质质量分数为15%的氯化钠溶液,但实验室只有50g溶质质量分数为30%的氯化钠溶液,于是她便自己动手并利用已有的溶液来配制所需的氯化钠溶液。
(1)在称量时,她需要把氯化钠固体放到天垫有纸片的______(选填“左侧”或“右侧”)托盘中,并且应当称量______g氯化钠固体。
(2)她把称量好的氯化钠和实验室中现有的氯化钠溶液全都转移到一个大烧杯中,并应向其中加入体积为______mL的水,边加水边搅拌。(水的密度为1.0g/mL)
(3)如表是氯化钠在不同温度下的溶解度,假如她想通过升高溶液的温度来得到氯化钠晶体,则你认为她的做法______(选填“可行”或“不可行”)。
温度/℃ 20 40 60 80
溶解度/g 36.0 36.6 37.3 38.4
20.钠及其化合物是中学化学学习和研究的重要内容.
(1)如图1是钠的原子结构示意图,钠在反应中失电子后形成离子的符号是_____.
(2)钠在氯气中燃烧生成氯化钠,化学方程式为_____.
(3)配制一瓶符合如图2所示的氯化钠溶液,需氯化钠_____g;小明同学配制的氯化钠溶液质量分数偏小了,请写出他操作中可能出现的错误(提示:1g以下用游码,至少答出两点)_____.
(4)如何测定一瓶苏打水的酸碱度(写出实验操作步骤)_____.
(5)小苏打受热分解生成碳酸钠、二氧化碳和水,化学方程式为_____.
(6)钛和钛合金性能优良,广泛用于航空、造船和化学工作中.工业上常用钠来制取钛,在高温时,钠与四氯化钛(TiCl4)反应生成氯化钠和钛.若用该方法制取2.4kg钛,理论上需要钠的质量是多少_____?
21.小明在实验室加热57g氯酸钾和二氧化锰的混合物一段时间后,剩余固体的质量为47.4g。小明继续加热剩余固体至完全反应,又收集到一些氧气。为了回收催化剂,进行了如图所示实验:
请回答下列问题:
(1)实验过程中发生反应的化学方程式为____________________________________;
(2)第一次加热后收集到的氧气质量为______________________________________;
(3)列出求解两次总共参加反应的氯酸钾质量X的比例式_____________________;
(4)小明两次加热过程中,消耗氯酸钾的质量比为____________________________;
(5)如将所得溶液制成溶质质量分数为10%的溶液,需加入水的质量是__________。
22.在一次实验操作考查时,教师制定了三个考签:①的制取:②配制50gl0%的溶液:③粗盐提纯。每个同学抽取一个考签进行实验。
I.甲同学抽签后来到实验室,发现本组实验桌上准备了下列仪器和药品:
图中仪器A的名称_______,仪器C的名称_______,仪器E的名称___________,甲同学抽到的考签是的制取,该实验的原理为_______(用化学方程式表示),二氧化锰的作用___________,可选用的发生装置组合有_______(填字母代号)。若用100g该双氧水溶液制取得到氧气16g,请求出该双氧水的溶质质量分数(列式计算)。_________
Ⅱ.乙同学抽到“配制50g10%的溶液”。通过计算,需称量______g,量取水需要选取的合适量筒是_______(填“”或“”或“”)。
Ⅲ.丙同学抽到的考签为粗盐提纯。
操作②的名称为______,该操作过程中玻璃棒的作用______,若提纯所得晶体的质量比实际值偏低,则可能的原因是______。
试卷第1页,共3页
参考答案:
1.C
【详解】
A.用托盘天平称取10.0g氯化钠是正确的叙述; B.用量筒量取90.0mL 的水是正确的叙述;C.将称取的氯化钠倒入量筒中溶解是错误的叙述,因为量筒不能做任何反应容器; D.将配制的溶液装入试剂瓶中,贴上标签 是正确的叙述,故答案选择C
2.C
【详解】
往100g20%的食盐溶液中加入100g水,稀释后,溶质的质量不变,溶剂的质量增加,溶液的质量等于溶质和溶剂质量之和,故溶液的质量增加,溶液中溶质的质量分数变小。
故选:C。
3.C
【详解】
A、100g5%的氢氧化钠溶液中有溶质100g×5%=5g,有溶剂100g-5g=95g。蒸发掉50g水后的溶质质量分数为。
B、加入20g 5%的氢氧化钠溶液因为溶质质量分数与原溶液相同,所以溶质质量分数不变。
C、加入20 g固体氢氧化钠,溶质质量分数变为。
D、加入20g水,溶质质量分数变小。
C得到的溶液中溶质质量分数最大,故选C。
4.C
【详解】
A、量筒,用于配制溶液时量取水的体积,故A需要;B、烧杯,用于溶解硝酸钾,故B需要;C、酒精灯,用于加热的仪器,而配制溶液的过程中不需要进行加热,故C不需要;D、玻璃棒在溶解时用于搅拌,加速溶解,故D需要。故选C。
5.C
【详解】
因为水中氢元素和氧元素的质量之比是1:8,所以得到的氢气和氧气的质量之比也是1:8.故选C.
6.B
【详解】
A、电解氢氧化钠稀溶液,水电解为氢气和氧气,溶液质量减少,氢氧化钠的质量分数增大,故A错误;B、水电解为氢气和氧气,溶液中氢元素质量减少,溶液中氢元素质量分数减少,故B正确;C、根据质量守恒定律,钠元素质量不变,故C错误;D、氢氧化钠中氢氧元素质量比1:16,水中氢氧元素质量比为1:8,因此水电解后溶液中氢、氧元素质量比改变,故D错误。故选B。
7.A
【详解】
A、化学反应前后分子个数不一定相等,如2H2+O22H2O,错误;
B、原子中核外电子数与核内质子数一定相等,整个原子不显电性,正确;
C、浓溶液在加水稀释前后溶质的质量一定相等,变化的是溶剂的质量,正确;
D、根据质量守恒定律,参加化学反应的各物质的质量总和与反应后生成的各物质的质量总和一定相等,正确;
故选A。
8.B
【详解】
A、配制一定溶质质量分数的氯化钠溶液的操作步骤为:计算(计算所需的氯化钠和水的质量)→称量(所需的氯化钠)→量取(所需的水)→溶解,故顺序为:③②④⑤①,不符合题意;
B、托盘天平相当于一个等臂杠杆,称量时如果发现指针偏向右边,说明氯化钠的质量不够,应向左边继续添加氯化钠,符合题意;
C、配制该溶液需要称取100g×5%=5g氯化钠,量取100g-5g=95g,也就是95mL水,不符合题意;
D、操作①中玻璃棒的作用是搅拌,加快溶解的速率,说法正确,不符合题意。
故选B。
9.C
【详解】
A、配制100g质量分数为11%的葡萄糖溶液,所需葡萄糖为:100g×11%=11g,需要用到游码,用托盘天平称量葡萄糖时,砝码放在左盘,左盘质量=右盘质量+游码质量,故葡萄糖质量=砝码质量-游码质量,会导致溶质质量偏小,配制溶液的浓度偏低,不符合题意;
B、转移葡萄糖时,纸上有少量残留,会导致溶质质量偏小,溶液浓度偏低,不符合题意;
C、用量筒量取水时,俯视液面,读取数字大于实际数值,会使量取水的体积偏小,溶液质量偏小,溶液浓度偏大,符合题意;
D、配好溶液装入试剂瓶时,有少量洒出,溶液具有均一性,不影响溶液的浓度,不符合题意。
故选C。
10.D
【详解】
A.氢氧化钠溶液加水稀释仍显碱性,pH>7,故错误;
B.浓硫酸具有吸水性,溶质的质量分数变小,但不会为零,故错误;
C.氧化钙和水反应生成氢氧化钙,所以一定温度下,向一定量的饱和石灰水中加入生石灰,溶剂质量减小,溶质质量也相应的减小,溶液质量减小,故错误;
D.电解水生成氢气与氧气的质量比为1:8,故正确。
故选D。
11.B
【详解】
A、根据配制要求,所需氯化钠的质量为50g×10%=5g,水的质量是50g-5g=45g,水的密度是1g/cm3,因此水的体积是45mL,选项A正确;
B、利用托盘天平称量氯化钠的质量时,应该是“左物右码”,选项B不正确;
C、为减少误差,用量程为50mL量筒量取45mL水,倒入上述烧杯中,选项C正确;
D、使用玻璃棒搅拌,加速氯化钠的溶解速度,选项D正确。
故选B。
12.D
【详解】
A、10g溶质溶于100g水中,溶质质量分数 ;
B、10g溶质配成100mL溶液,该溶液的密度是1.15g/cm3,溶质质量分数 ;
C、100g25%的某溶液加水稀释到200g,溶质质量分数;
D、100g10%的某溶液,又溶解了10g溶质,溶质质量分数 。
溶液中溶质的质量分数最大的是D。故选:D。
13.D
【详解】
①制取氢气需用试管、药匙、铁架台、带导管的橡皮塞、集气瓶、玻璃片,这些仪器都有,能完成制氢气;②粗盐提纯的步骤是溶解、过滤、蒸发,溶解中要用的烧杯、玻璃棒,药匙、过滤中还要用的漏斗、铁架台、玻璃棒、烧杯,蒸发中还要用到蒸发皿、酒精灯、玻璃棒,粗盐提纯需用到的仪器是:烧杯、玻璃棒、药匙、漏斗、蒸发皿、酒精灯、铁架台。提供的仪器中缺少漏斗、蒸发皿,不能完成粗盐提纯;③用木炭还原氧化铜时,要用到的仪器是:酒精灯、药匙、铁架台、试管、带导管的橡皮塞。这些仪器都具有,可以完成实验;④用固体物质配制一定质量分数溶液的步骤是计算、称量、溶解。称量中要用的托盘天平没有,不能完成实验。根据上述分析不能完成的实验是②④。故选D。
14.C
【详解】
A、石灰石的主要成分是碳酸钙,含有杂质,高温煅烧生成氧化钙和二氧化碳,完全反应后固体质量不可能为0,故A不能正确反映其对应实验操作;
B、用等质量、等质量分数的过氧化氢溶液制取氧气,使用催化剂能加快反应速率,但不影响生成氧气的质量,故B不能正确反映其对应实验操作;
C、稀盐酸显酸性,pH小于7;向一定体积的稀盐酸中逐滴加入氢氧化钠溶液,氢氧化钠与稀盐酸反应生成氯化钠和水,完全反应时,溶液显中性,pH等于7;继续加入氢氧化钠溶液,溶液显碱性,pH大于7;pH值的变化是从小于7逐渐的增大到大于7,故C能正确反映其对应实验操作;
D、某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体,不能继续溶解硝酸钾,溶液中溶质质量分数不变,故D不能正确反映其对应实验操作。
故选C。
15.C
【详解】
设200g稀盐酸样品中氯化氢的质量为
该瓶稀盐酸中溶质的质量分数=
答:该瓶稀盐酸中溶质的质量分数为7.3%。
16.C
【详解】
A、过氧化氢分解生成水和氧气时,利用催化剂时反应速率快,需要时间短,但是等质量的过氧化氢完全反应后得到的氧气质量相等,故不符合题意;
B、向足量且相同的稀盐酸中分别加入质量、形状相同的镁片和铁片时,镁和稀盐酸反应速率快,反应需要时间短,并且镁和稀盐酸反应生成的氢气比铁多,故不符合题意;
C、向某温度下不饱和硝酸钾溶液中加入硝酸钾晶体时,随着硝酸钾的加入,溶质质量分数增大,当达到饱和状态时,溶质质量分数不再变化,故符合题意;
D、锌和氯化亚铁反应生成氯化锌和铁,和氯化铜反应生成氯化锌和铜,反应的化学方程式为及其质量关系为:
由以上质量关系可知,向一定质量FeCl2和CuCl2的混合溶液中逐渐加入足量锌粒时,完全反应前应该是一条直线,不应该出现弯折,故不符合题意。
17.(1)二氧化碳排放
(2) 无污染
(3)
(4)
(5) BC 固体和液体反应,不需加热 解:生成二氧化碳的质量=(100g+12g)-107.6g=4.4g
设:稀盐酸的溶质质量为x。
答:稀盐酸的溶质质量分数为7.3%。
【解析】
(1)
所谓“低碳”,就是较低的二氧化碳排放。
(2)
氢燃料燃烧只生成水,化学方程式:。
使用绿电与使用燃煤发电相比,其优点是“低碳”、无污染、节约化石燃料等。
(3)
乙醇燃烧生成水和二氧化碳,化学方程式。
(4)
业上用赤铁矿(主要成分是氧化铁)冶炼生铁是氧化铁与一氧化碳在高温条件下反应生成铁和二氧化碳,化学方程式。
(5)
①稀盐酸是液体,大理石是固体,反应条件是常温,选择固体液体常温装置,二氧化碳能溶于水,密度比空气大,选择向上排空气法收集。
②见答案。
18. 试管 长颈漏斗 B 2H2O22H2O+O2↑ 难溶于水且不与水反应 能够随时控制反应的开始与停止 a 0.2 10%
【详解】
①仪器M为试管,N是长颈漏斗;
②实验室中制取二氧化碳常用大理石或石灰石和稀盐酸反应来制取,属于固液常温型发生装置,可选择B装置来制取,过氧化氢溶液制氧气也属于固液常温型,可选择B装置来制取,化学方程式为:2H2O22H2O+O2↑;由于氧气难溶于水也不与水反应,可以用排水取气法收集;
③该装置的多孔隔板可以放置石灰石,通过控制开关可以利用气压控制反应物的接触与分离,从而控制反应的发生和停止;由于二氧化碳的密度大于空气,用向下排空气法收集,CO2应从a端通入。
④根据图可知生成的二氧化碳的质量为8.8g,CO2的物质的量为=0.2mol;
解:设稀盐酸中HCl的质量为x,
得x=14.6g
则所用稀盐酸中溶质的质量分数为×100%=10%,
答:所用稀盐酸中溶质的质量分数为×100%=10%。
19. 左侧 15 135 不可行
【详解】
(1)药品应放在天平的左盘上,氯化钠的质量=200g×15%-50g×30%=15g;故填:左侧;15;
(2)水的质量为:200g-50g-15g=135g,水的体积为:135g÷1g/mL=135mL;故填:135;
(3)20℃时,氯化钠的溶解度为36.0g,此温度下的饱和溶液中,溶质的质量分数为: ≈26.5%,所以欣欣配置的溶液是不饱和溶液;氯化钠的溶解度随着温度的升高慢慢增大,所以不能用升温的方法来实现,可通过蒸发溶剂的方法来实现。故填:不可行。
20. Na+ 2Na+Cl22NaCl 4.5 称量时砝码和试剂放反了,量取水时仰视读数,溶解前用蒸馏水润洗了烧杯 用干燥的玻璃棒蘸取(或胶头滴管吸取)少量的待测溶液,并滴在放在干燥的玻璃皿或白瓷板上的干燥pH试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的Ph 2NaHCO3 Na2CO3+H2O+CO2↑ 4.6kg
【详解】
(1)钠元素的最外层有1个电子,容易失去电子,形成钠离子Na+;
(2)钠和氯气在点燃的条件下生成氯化钠,故答案为2Na+Cl22NaCl;
(3)氯化钠的质量为:500mL×1g/mL×0.9%=4.5g,小明同学配制的氯化钠溶液质量分数偏小了,可能是称量时砝码和试剂放反了,量取水时仰视读数,溶解前用蒸馏水润洗了烧杯;
(4)测定溶液酸碱度的方法:用干燥的玻璃棒蘸取(或胶头滴管吸取)少量的待测溶液,并滴在放在干燥的玻璃皿或白瓷板上的干燥pH试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的pH;
(5)碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,化学方程式为:
2NaHCO3Na2CO3+H2O+CO2↑;
(6)设理论上需要钠的质量是x,则
所以制取2.4kg钛,理论上需要钠的质量是4.6kg。
21. 2KClO32KCl + 3O2 ↑ 9.6g 1:1 98g
【详解】
(1)氯酸钾在二氧化锰的催化作用下受热生成氯化钾和氧气,化学方程式为: 2KClO32KCl + 3O2 ↑;
(2)生成氧气的质量就是固态混合物减少的质量,第一次加热后收集到的氧气质量为:57g-47.4g=9.6克;
(3)根据题意可知,反应生成的氯化钾的质量=200g×14.9%=29.8g;
设两次总共参加反应的氯酸钾质量X
X=49g
(4)设第一次分解的氯酸钾的质量为y。
y=24.5g;
小明两次加热过程中,消耗氯酸钾的质量比=24.5g:(49g-24.5g)=1:1;
(5)设需加入水的质量是z。
溶液稀释过程中,溶质的质量不变,则有:
200g×14.9%=(200g+z)×10% z=98g,即需加入水的质量是98g。
22. 锥形瓶 集气瓶 分液漏斗 催化作用 (或) 34% 5g 50mL 过滤 引流 蒸发时没有用玻璃棒搅拌导致晶体飞溅(其它原因合理即可)
【详解】
Ⅰ.甲同学抽到的考签应该是氧气的制取;应选用的仪器:A是锥形瓶、C是集气瓶、E是分液漏斗,该实验的原理为:过氧化氢在二氧化锰作催化剂的条件下生成水和氧气,化学方程式为:;可选用的发生装置组合有AG(或AEF)。
若用100g该双氧水溶液制取得到氧气16g,设该双氧水中溶质的质量为x。
解得x=34g,,
该双氧水的溶质质量分数为
故填:锥形瓶; 集气瓶 ; 分液漏斗;;催化作用; AG(或AEF);34%。
Ⅱ.需要氯化钠的质量为:50g×10%=5g,水的质量为45g,体积为45mL,故选择50mL量筒。故填:5;50mL.
Ⅲ.过滤可将不溶性杂质分离,操作②的名称为过滤,玻璃棒的作用是引流,提纯所得晶体的质量比实际值偏低,则可能的原因是:加入的水少氯化钠没有完全被溶解;蒸发时没有用玻璃棒搅拌导致晶体飞溅等。
故填:过滤;引流;蒸发时没有用玻璃棒搅拌导致晶体飞溅。
答案第1页,共2页
