科粤版九年级下册八章常见的酸、碱、盐章末综合练(word版有答案)
文档属性
| 名称 | 科粤版九年级下册八章常见的酸、碱、盐章末综合练(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 134.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-27 23:21:51 | ||
图片预览

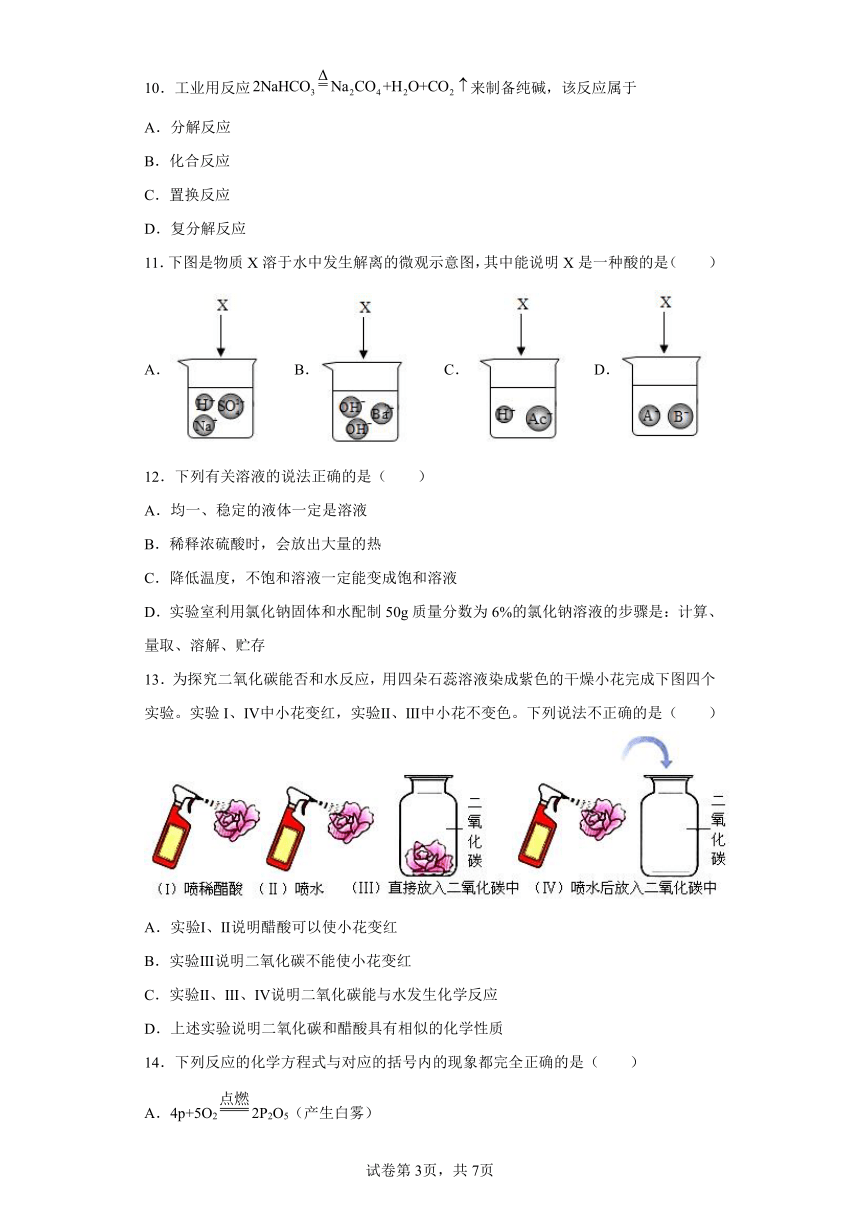

文档简介
科粤版九年级下册 八章 常见的酸、碱、盐 章末综合练
一、单选题
1.下列各组离子在水中能大量共存,并形成无色溶液的是
A.Ba2+、SO、NO
B.Fe2+、SO、OH-
C.Na+、NO、OH-
D.Ag+、NO、Cl-
2.下列有关生活中的化学说法正确的是( )
A.煤、石油、天然气等化石燃料是不可再生资源
B.室内发生火灾,立即打开门窗
C.生活中用过滤的方法降低水的硬度
D.农业上用氢氧化钠改良酸性土壤
3.下列对宏观事实的微观解释错误的是
选项 事 实 解 释
A 自然界的水循环 水分子的不断运动
B 气体容易压缩,液体、固体不易压缩 液体、固体中分子间无间隔
C 一氧化碳有毒,二氧化碳无毒 构成两者的分子不同
D 碳酸钠、碳酸钾都能与盐酸反应生成二氧化碳 两种盐中都含碳酸根离子
A.A B.B C.C D.D
4.下列有关实验现象描述正确的是( )
A.铁丝在空气中剧烈燃烧、火星四射,生成黑色固体
B.打开盛有浓盐酸的试剂瓶瓶塞,瓶口出现大量白烟
C.黄铜片和铜片互相刻划,黄铜片上留下明显的痕迹
D.铁锈在稀盐酸中浸泡一段时间后,铁锈消失,溶液变成黄色
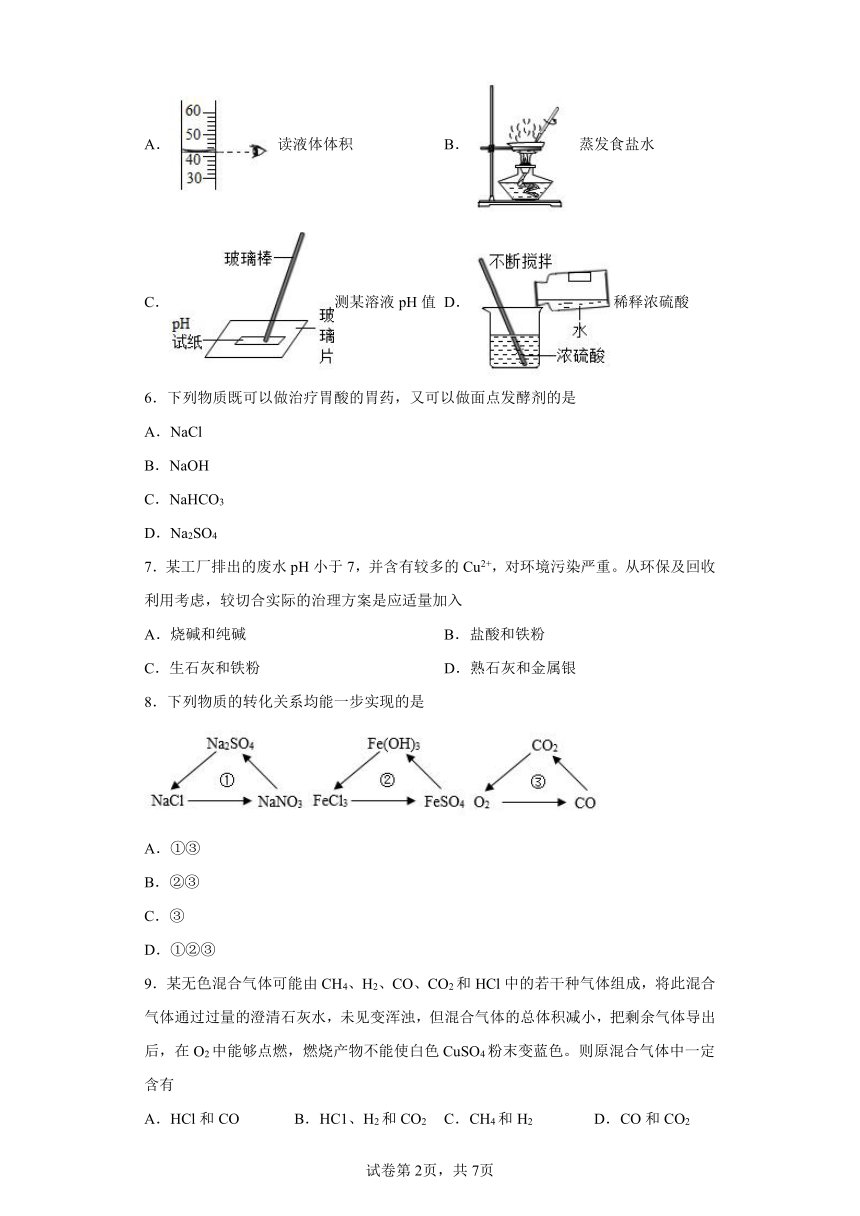
5.下列实验基本操作不正确的是
A. 读液体体积 B. 蒸发食盐水
C.测某溶液pH值 D.稀释浓硫酸
6.下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是
A.NaCl
B.NaOH
C.NaHCO3
D.Na2SO4
7.某工厂排出的废水pH小于7,并含有较多的Cu2+,对环境污染严重。从环保及回收利用考虑,较切合实际的治理方案是应适量加入
A.烧碱和纯碱 B.盐酸和铁粉
C.生石灰和铁粉 D.熟石灰和金属银
8.下列物质的转化关系均能一步实现的是
A.①③
B.②③
C.③
D.①②③
9.某无色混合气体可能由CH4、H2、CO、CO2和HCl中的若干种气体组成,将此混合气体通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使白色CuSO4粉末变蓝色。则原混合气体中一定含有
A.HCl和CO B.HC1、H2和CO2 C.CH4和H2 D.CO和CO2
10.工业用反应来制备纯碱,该反应属于
A.分解反应
B.化合反应
C.置换反应
D.复分解反应
11.下图是物质X溶于水中发生解离的微观示意图,其中能说明X是一种酸的是( )
A. B. C. D.
12.下列有关溶液的说法正确的是( )
A.均一、稳定的液体一定是溶液
B.稀释浓硫酸时,会放出大量的热
C.降低温度,不饱和溶液一定能变成饱和溶液
D.实验室利用氯化钠固体和水配制50g质量分数为6%的氯化钠溶液的步骤是:计算、量取、溶解、贮存
13.为探究二氧化碳能否和水反应,用四朵石蕊溶液染成紫色的干燥小花完成下图四个实验。实验I、Ⅳ中小花变红,实验Ⅱ、Ⅲ中小花不变色。下列说法不正确的是( )
A.实验Ⅰ、Ⅱ说明醋酸可以使小花变红
B.实验Ⅲ说明二氧化碳不能使小花变红
C.实验Ⅱ、Ⅲ、Ⅳ说明二氧化碳能与水发生化学反应
D.上述实验说明二氧化碳和醋酸具有相似的化学性质
14.下列反应的化学方程式与对应的括号内的现象都完全正确的是( )
A.4p+5O22P2O5(产生白雾)
B.2NaOH+CuCl2═Cu(OH)2↓+2NaCl(产生红褐色沉淀)
C.AgNO3+HCl═AgCl↓+HNO3(产生白色沉淀)
D.H2O2H2O+O2↑(冒气泡)
15.化肥碳酸铵、硫酸钾均为白色固体。分别取少量固体进行下列实验,不能将两者区别出来的是
A.与熟石灰粉末混合研磨 B.加入稀盐酸中
C.加入溶液中 D.加入溶液中
二、填空题
16.写出下列物质的化学式:
(1)天然气主要成分______;
(2)海洋中含量最多的物质______;
(3)发酵粉中含有的小苏打______;
(4)分析KClO3中氯酸根的构成和化合价,则氯酸钙的化学式为______。
17.食盐是重要的调味品,其主要成分的化学式是____________。蒸馒头时,既能除去面团中的酸又能使馒头变得松软,可加入小苏打,其化学式是____________。
18.燃烧与人类生产、生活有着密切的关系。
(1)下列成语的原意与燃烧不相关的是____(填标号)。
A 卧薪尝胆 B釜底抽薪
C 火上浇油 D 煽风点火
(2)古籍《天工开物》就有“煤饼烧石成灰”的记载。“烧石成灰”指高温条件下碳酸钙转化为生石灰。
①“煤饼烧石成灰”的过程中,能量转化的主要方式是_______。
②“石”转化为“灰”的反应属于___(填基本反应类型)。
③“灰”遇水成浆,该反应的化学方程式为_____。
(3)室内起火时,如果急于打开门窗,火反而会烧得更旺。原因是_____。
19.人教版下册58页习题3:在某些食品的包装袋内,有一个装有白色颗粒状的小纸袋,上面写着“干燥剂,主要成分为生石灰”。为什么生石灰能做干燥剂?___;如果将小纸袋拿出来放在空气中,经过一段时间后,会发现纸袋内的白色颗粒在一起成为块状。这是为什么?____;试写出有关反应的化学方程式____。
三、综合应用题
20.小明设计了图1所示的实验装置,用一氧化碳还原氧化铜的方法测量CuO样品的纯度,小明准确称取了10g干燥的样品进行实验。试回答:
反应前 反应后
装置A 50g 48.4g
(1)该装置的不足之处是_______。
(2)实验开始时,先要进行的操作是______(填序号)。
①通一氧化碳 ②加热
(3)实验过程中,A处观察到的现象是______,B处澄清石灰水变浑浊的方程式为______。
(4)请根据表,计算出CuO样品的纯度为_______。
(5)为分离A装置中反应排出的一氧化碳和二氧化碳,小明又设计了如图2所示的装置(铁架台、铁夹等固定装置已略去,a、b为活塞)。
①当关闭活塞b,打开活塞a时,可分离得到______。
②然后关闭活塞a,再打开活塞b,可分离得到另一种气体。
21.某化学兴趣小组为探究碱和盐的化学性质,进行了如图24所示实验(忽略空气中CO2对本实验的影响)。请你参与并完成相关内容。
(1)步骤一:关闭K,向下缓慢推动注射器活塞并轻轻振荡锥形瓶,使二氧化碳全部进入锥形瓶,并与m克溶质质量分数为10%的NaOH溶液恰好完全反应转化为碳酸钠,反应的化学方程式为______,轻轻振荡锥形瓶的目的是_____.
步骤二:打开K,向上缓慢拉动注射器活塞,观察到乙中溶液进入甲。
(2)上述实验过程中,甲中溶质总质量变化情况如图25所示,B点对应的溶质总质量为(用含m的代数式表示,可以不化简)_____克。BC段反应的化学方程式为______,BC段溶质总质量下降的原因是___.
(3)步骤一和步骤二结束后,将甲和乙中的物质全部转移到烧杯中,搅拌后过滤,得到白色沉淀和滤液。结合图25中C点的值确定滤液中溶质的成分为___,理由是____________.
22.2010年春我国西南大部分地区发生严重的旱灾,我们在抗旱救灾的同时,更应倡导保护水环境、珍惜水资源。请回答下列问题:
(1)不论是自来水还是纯净水,你认为保持水的化学性质的最小微粒是___________。下列选项中能确认水是由氢元素和氧元素组成的实验是_________(填序号)。
A.水的蒸馏 B.水的蒸发 C.水的电解 D.水的净化
(2)下图是我国部分地区人均水量图,从中可以看出河北是极度缺水的省。下列做法符合节约用水的是____________(填序号)。
A.使用节水龙头
B.用淘米水洗碗
C.用喷灌、滴灌方法给农作物浇水
D.使用不间断地边注水边冲淋、排水的用水量为165L/次的家用洗衣机
(3)实验室中有一杯含有MgCl2和CaCl2的硬水,下表是某兴趣小组设计软化硬水的实验方案,请你一起来完成下表。
可选用的药品有:Ca(OH)2溶液、NaOH溶液、Na2CO3溶液、肥皂水。
实验操作 现象 结论或化学方程式
①取少量硬水样品于试管中,向其中滴加Ca(OH)2溶液,直到不再产生沉淀 有白色沉淀产生 MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
②再向上述试管中滴加 ,直到不再产生沉淀 有白色沉淀产生 化学方程式:
③过滤 滤出沉淀 得到澄清滤液
④用两试管分别取等量的上述滤液和原硬水样品,分别滴加 ,振荡 盛有滤液的试管中 证明硬水已软化
____________ ____________ ____________ ____________
23.碱式氯化铝是某种高效净水剂的主要成分。实验室利用铝土矿(主要含Al2O3,还含少量Fe2O3及其他不溶杂质)制取碱式氯化铝的过程如下:
(1)溶解过程中,需要使用质量分数为15%的盐酸,则配制这种盐酸需要 ________ mL 30%的浓盐酸(密度约为1.15 g/cm3)和115 g蒸馏水。
(2)盐酸溶解铝土矿过程中,发生反应的化学方程式为: ____________________________________________ 。
(3)加少量铝粉的主要作用是除去浊液中的 ________ 。
(4)加CaCO3粉末的作用是调节pH至5。请写出用pH试纸测定溶液pH的操作:在白瓷板或玻璃片上放一小片pH试纸, ____________________________________________ ,得出被测液的pH。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.A
3.B
4.D
5.D
6.C
7.C
8.C
9.A
10.A
11.C
12.B
13.D
14.C
15.C
16. CH4 H2O NaHCO3 Ca(ClO3)2
17. NaCl NaHCO3
18. A 化学能→热能→化学能(或“化学能→热能、热能→化学能”) 分解反应 打开门窗,为可燃物提供更多氧气,使火势更猛(或其他合理答案)
19. 生石灰能与空气中的水发生化学反应,可以将水除去 氢氧化钙与空气中的二氧化碳反应生成碳酸钙 Ca(OH)2+CO2=CaCO3↓+H2O
20. 未进行尾气处理 ① 黑色固体逐渐变红 CO2+Ca(OH)2=CaCO3↓+H2O 80% CO
21. CO2+2NaOH=NaCO3+H2O 增大接触面使氢氧化钠溶液与二氧化碳充分反应 Na2CO3+Ba(OH)2=BaCO3↓+2NaOH 加入的氢氧化钡溶液与碳酸钠溶液反应生成沉淀,每171份质量的氢氧化钡,生成197份质量的碳酸钡沉淀,溶质质量减少26份 NaOH和Ba(OH)2 C点对应的溶液中溶质质量与A点相等,都为0.1m克,说明步骤一生成的碳酸钠和步骤二中进入的氢氧化钡恰好完全反应,此时溶液中的溶质只有氢氧化钠,将甲和乙混合后氢氧化钡有剩余,因此滤液中的溶质成分为氢氧化钠和氢氧化钡。
22. 水分子 C ABC Na2CO3溶液 CaCl2+Na2CO3═2NaCl+CaCO3↓ 等量的肥皂水 产生较多泡沫
23. 100 Al2O3+6HCl===2AlCl3+3H2O Fe2O3+6HCl===2FeCl3+3H2O 除去氯化铁 用玻璃棒将被测液滴到试纸上,立即把试纸显示的颜色与标准比色卡比较,读数
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列各组离子在水中能大量共存,并形成无色溶液的是
A.Ba2+、SO、NO
B.Fe2+、SO、OH-
C.Na+、NO、OH-
D.Ag+、NO、Cl-
2.下列有关生活中的化学说法正确的是( )
A.煤、石油、天然气等化石燃料是不可再生资源
B.室内发生火灾,立即打开门窗
C.生活中用过滤的方法降低水的硬度
D.农业上用氢氧化钠改良酸性土壤
3.下列对宏观事实的微观解释错误的是
选项 事 实 解 释
A 自然界的水循环 水分子的不断运动
B 气体容易压缩,液体、固体不易压缩 液体、固体中分子间无间隔
C 一氧化碳有毒,二氧化碳无毒 构成两者的分子不同
D 碳酸钠、碳酸钾都能与盐酸反应生成二氧化碳 两种盐中都含碳酸根离子
A.A B.B C.C D.D
4.下列有关实验现象描述正确的是( )
A.铁丝在空气中剧烈燃烧、火星四射,生成黑色固体
B.打开盛有浓盐酸的试剂瓶瓶塞,瓶口出现大量白烟
C.黄铜片和铜片互相刻划,黄铜片上留下明显的痕迹
D.铁锈在稀盐酸中浸泡一段时间后,铁锈消失,溶液变成黄色
5.下列实验基本操作不正确的是
A. 读液体体积 B. 蒸发食盐水
C.测某溶液pH值 D.稀释浓硫酸
6.下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是
A.NaCl
B.NaOH
C.NaHCO3
D.Na2SO4
7.某工厂排出的废水pH小于7,并含有较多的Cu2+,对环境污染严重。从环保及回收利用考虑,较切合实际的治理方案是应适量加入
A.烧碱和纯碱 B.盐酸和铁粉
C.生石灰和铁粉 D.熟石灰和金属银
8.下列物质的转化关系均能一步实现的是
A.①③
B.②③
C.③
D.①②③
9.某无色混合气体可能由CH4、H2、CO、CO2和HCl中的若干种气体组成,将此混合气体通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使白色CuSO4粉末变蓝色。则原混合气体中一定含有
A.HCl和CO B.HC1、H2和CO2 C.CH4和H2 D.CO和CO2
10.工业用反应来制备纯碱,该反应属于
A.分解反应
B.化合反应
C.置换反应
D.复分解反应
11.下图是物质X溶于水中发生解离的微观示意图,其中能说明X是一种酸的是( )
A. B. C. D.
12.下列有关溶液的说法正确的是( )
A.均一、稳定的液体一定是溶液
B.稀释浓硫酸时,会放出大量的热
C.降低温度,不饱和溶液一定能变成饱和溶液
D.实验室利用氯化钠固体和水配制50g质量分数为6%的氯化钠溶液的步骤是:计算、量取、溶解、贮存
13.为探究二氧化碳能否和水反应,用四朵石蕊溶液染成紫色的干燥小花完成下图四个实验。实验I、Ⅳ中小花变红,实验Ⅱ、Ⅲ中小花不变色。下列说法不正确的是( )
A.实验Ⅰ、Ⅱ说明醋酸可以使小花变红
B.实验Ⅲ说明二氧化碳不能使小花变红
C.实验Ⅱ、Ⅲ、Ⅳ说明二氧化碳能与水发生化学反应
D.上述实验说明二氧化碳和醋酸具有相似的化学性质
14.下列反应的化学方程式与对应的括号内的现象都完全正确的是( )
A.4p+5O22P2O5(产生白雾)
B.2NaOH+CuCl2═Cu(OH)2↓+2NaCl(产生红褐色沉淀)
C.AgNO3+HCl═AgCl↓+HNO3(产生白色沉淀)
D.H2O2H2O+O2↑(冒气泡)
15.化肥碳酸铵、硫酸钾均为白色固体。分别取少量固体进行下列实验,不能将两者区别出来的是
A.与熟石灰粉末混合研磨 B.加入稀盐酸中
C.加入溶液中 D.加入溶液中
二、填空题
16.写出下列物质的化学式:
(1)天然气主要成分______;
(2)海洋中含量最多的物质______;
(3)发酵粉中含有的小苏打______;
(4)分析KClO3中氯酸根的构成和化合价,则氯酸钙的化学式为______。
17.食盐是重要的调味品,其主要成分的化学式是____________。蒸馒头时,既能除去面团中的酸又能使馒头变得松软,可加入小苏打,其化学式是____________。
18.燃烧与人类生产、生活有着密切的关系。
(1)下列成语的原意与燃烧不相关的是____(填标号)。
A 卧薪尝胆 B釜底抽薪
C 火上浇油 D 煽风点火
(2)古籍《天工开物》就有“煤饼烧石成灰”的记载。“烧石成灰”指高温条件下碳酸钙转化为生石灰。
①“煤饼烧石成灰”的过程中,能量转化的主要方式是_______。
②“石”转化为“灰”的反应属于___(填基本反应类型)。
③“灰”遇水成浆,该反应的化学方程式为_____。
(3)室内起火时,如果急于打开门窗,火反而会烧得更旺。原因是_____。
19.人教版下册58页习题3:在某些食品的包装袋内,有一个装有白色颗粒状的小纸袋,上面写着“干燥剂,主要成分为生石灰”。为什么生石灰能做干燥剂?___;如果将小纸袋拿出来放在空气中,经过一段时间后,会发现纸袋内的白色颗粒在一起成为块状。这是为什么?____;试写出有关反应的化学方程式____。
三、综合应用题
20.小明设计了图1所示的实验装置,用一氧化碳还原氧化铜的方法测量CuO样品的纯度,小明准确称取了10g干燥的样品进行实验。试回答:
反应前 反应后
装置A 50g 48.4g
(1)该装置的不足之处是_______。
(2)实验开始时,先要进行的操作是______(填序号)。
①通一氧化碳 ②加热
(3)实验过程中,A处观察到的现象是______,B处澄清石灰水变浑浊的方程式为______。
(4)请根据表,计算出CuO样品的纯度为_______。
(5)为分离A装置中反应排出的一氧化碳和二氧化碳,小明又设计了如图2所示的装置(铁架台、铁夹等固定装置已略去,a、b为活塞)。
①当关闭活塞b,打开活塞a时,可分离得到______。
②然后关闭活塞a,再打开活塞b,可分离得到另一种气体。
21.某化学兴趣小组为探究碱和盐的化学性质,进行了如图24所示实验(忽略空气中CO2对本实验的影响)。请你参与并完成相关内容。
(1)步骤一:关闭K,向下缓慢推动注射器活塞并轻轻振荡锥形瓶,使二氧化碳全部进入锥形瓶,并与m克溶质质量分数为10%的NaOH溶液恰好完全反应转化为碳酸钠,反应的化学方程式为______,轻轻振荡锥形瓶的目的是_____.
步骤二:打开K,向上缓慢拉动注射器活塞,观察到乙中溶液进入甲。
(2)上述实验过程中,甲中溶质总质量变化情况如图25所示,B点对应的溶质总质量为(用含m的代数式表示,可以不化简)_____克。BC段反应的化学方程式为______,BC段溶质总质量下降的原因是___.
(3)步骤一和步骤二结束后,将甲和乙中的物质全部转移到烧杯中,搅拌后过滤,得到白色沉淀和滤液。结合图25中C点的值确定滤液中溶质的成分为___,理由是____________.
22.2010年春我国西南大部分地区发生严重的旱灾,我们在抗旱救灾的同时,更应倡导保护水环境、珍惜水资源。请回答下列问题:
(1)不论是自来水还是纯净水,你认为保持水的化学性质的最小微粒是___________。下列选项中能确认水是由氢元素和氧元素组成的实验是_________(填序号)。
A.水的蒸馏 B.水的蒸发 C.水的电解 D.水的净化
(2)下图是我国部分地区人均水量图,从中可以看出河北是极度缺水的省。下列做法符合节约用水的是____________(填序号)。
A.使用节水龙头
B.用淘米水洗碗
C.用喷灌、滴灌方法给农作物浇水
D.使用不间断地边注水边冲淋、排水的用水量为165L/次的家用洗衣机
(3)实验室中有一杯含有MgCl2和CaCl2的硬水,下表是某兴趣小组设计软化硬水的实验方案,请你一起来完成下表。
可选用的药品有:Ca(OH)2溶液、NaOH溶液、Na2CO3溶液、肥皂水。
实验操作 现象 结论或化学方程式
①取少量硬水样品于试管中,向其中滴加Ca(OH)2溶液,直到不再产生沉淀 有白色沉淀产生 MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
②再向上述试管中滴加 ,直到不再产生沉淀 有白色沉淀产生 化学方程式:
③过滤 滤出沉淀 得到澄清滤液
④用两试管分别取等量的上述滤液和原硬水样品,分别滴加 ,振荡 盛有滤液的试管中 证明硬水已软化
____________ ____________ ____________ ____________
23.碱式氯化铝是某种高效净水剂的主要成分。实验室利用铝土矿(主要含Al2O3,还含少量Fe2O3及其他不溶杂质)制取碱式氯化铝的过程如下:
(1)溶解过程中,需要使用质量分数为15%的盐酸,则配制这种盐酸需要 ________ mL 30%的浓盐酸(密度约为1.15 g/cm3)和115 g蒸馏水。
(2)盐酸溶解铝土矿过程中,发生反应的化学方程式为: ____________________________________________ 。
(3)加少量铝粉的主要作用是除去浊液中的 ________ 。
(4)加CaCO3粉末的作用是调节pH至5。请写出用pH试纸测定溶液pH的操作:在白瓷板或玻璃片上放一小片pH试纸, ____________________________________________ ,得出被测液的pH。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.A
3.B
4.D
5.D
6.C
7.C
8.C
9.A
10.A
11.C
12.B
13.D
14.C
15.C
16. CH4 H2O NaHCO3 Ca(ClO3)2
17. NaCl NaHCO3
18. A 化学能→热能→化学能(或“化学能→热能、热能→化学能”) 分解反应 打开门窗,为可燃物提供更多氧气,使火势更猛(或其他合理答案)
19. 生石灰能与空气中的水发生化学反应,可以将水除去 氢氧化钙与空气中的二氧化碳反应生成碳酸钙 Ca(OH)2+CO2=CaCO3↓+H2O
20. 未进行尾气处理 ① 黑色固体逐渐变红 CO2+Ca(OH)2=CaCO3↓+H2O 80% CO
21. CO2+2NaOH=NaCO3+H2O 增大接触面使氢氧化钠溶液与二氧化碳充分反应 Na2CO3+Ba(OH)2=BaCO3↓+2NaOH 加入的氢氧化钡溶液与碳酸钠溶液反应生成沉淀,每171份质量的氢氧化钡,生成197份质量的碳酸钡沉淀,溶质质量减少26份 NaOH和Ba(OH)2 C点对应的溶液中溶质质量与A点相等,都为0.1m克,说明步骤一生成的碳酸钠和步骤二中进入的氢氧化钡恰好完全反应,此时溶液中的溶质只有氢氧化钠,将甲和乙混合后氢氧化钡有剩余,因此滤液中的溶质成分为氢氧化钠和氢氧化钡。
22. 水分子 C ABC Na2CO3溶液 CaCl2+Na2CO3═2NaCl+CaCO3↓ 等量的肥皂水 产生较多泡沫
23. 100 Al2O3+6HCl===2AlCl3+3H2O Fe2O3+6HCl===2FeCl3+3H2O 除去氯化铁 用玻璃棒将被测液滴到试纸上,立即把试纸显示的颜色与标准比色卡比较,读数
答案第1页,共2页
答案第1页,共2页
