人教版化学九下册8.3金属资源的利用和保护同步练习(word版有答案)
文档属性
| 名称 | 人教版化学九下册8.3金属资源的利用和保护同步练习(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 364.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-28 10:09:23 | ||
图片预览


文档简介
人教版化学九下册 8.3 金属资源的利用和保护 同步练习
一、单选题
1.下列关于资源能源的叙述正确的是
A.地球上的总水储量很大,且淡水约占全球水储量的96.5%
B.空气是一种宝贵的资源,其中稀有气体的体积分数约为78%
C.防止金属的腐蚀是保护金属资源的唯一途径
D.人们正在利用和开发许多其他能源,如氢能、太阳能、生物质能等
2.坚持低碳生活、绿色发展,促进人与自然和谐共生,下列做法与这一理念不相符的是
A.限制燃放烟花 B.发展燃煤发电 C.分类处理垃圾 D.倡导公交出行
3.铁是年产量最高的金属,而且应用广泛,下列有关金属铁冶炼说法不正确的是( )
A.冶炼原料是铁矿石、焦炭、石灰石
B.炼铁中焦炭的作用是提供热量和还原剂
C.磁铁矿的成分是四氧化三铁
D.炼铁所得生铁含碳量是0.03%~2%
4.下列关于金属材料的说法中,不正确的是( )
A.常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜
B.铁在干燥的空气中容易生锈
C.硬铝(铝合金)的硬度大于纯铝
D.金属资源的回收利用既保护了环境,又节约了金属资源
5.2018年10月,南通被授予“国家森林城市”称号。为了使南通这座江风海韵森林城变得天更蓝、水更清、景更美,下列做法应该禁止的是( )
A.工业废水直接排入河流
B.加强对烟花爆竹燃放管理
C.生产生活垃圾分类放置
D.鼓励对旧金属回收再利用
6.下列关于资源、能源的说法正确的是
A.回收废旧金属,可节约金属资源,减少对环境的污染
B.可利用的淡水资源取之不尽用之不竭
C.发现家中天然气或者液化气泄漏时,应先开灯检查
D.煤、石油、天然气、沼气都是可再生的能源
7.炼铁高炉中发生了下列反应:①高温下一氧化碳将铁矿石还原为铁 ②高温煅烧石灰石 ③灼热的焦炭和二氧化碳反应 ④焦炭充分燃烧 其中属于化合反应的是
A.①和④ B.②和③ C.③和④ D.只有④
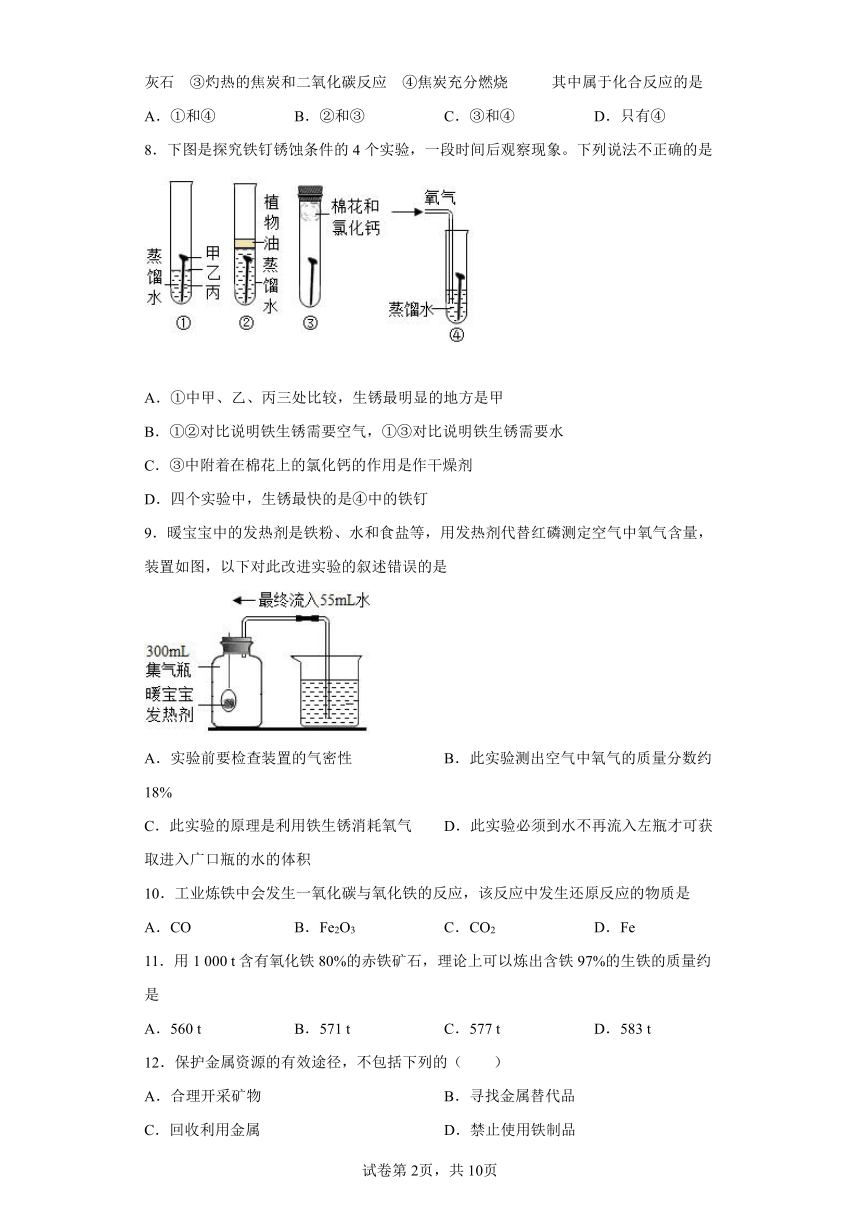
8.下图是探究铁钉锈蚀条件的4个实验,一段时间后观察现象。下列说法不正确的是
A.①中甲、乙、丙三处比较,生锈最明显的地方是甲
B.①②对比说明铁生锈需要空气,①③对比说明铁生锈需要水
C.③中附着在棉花上的氯化钙的作用是作干燥剂
D.四个实验中,生锈最快的是④中的铁钉
9.暖宝宝中的发热剂是铁粉、水和食盐等,用发热剂代替红磷测定空气中氧气含量,装置如图,以下对此改进实验的叙述错误的是
A.实验前要检查装置的气密性 B.此实验测出空气中氧气的质量分数约18%
C.此实验的原理是利用铁生锈消耗氧气 D.此实验必须到水不再流入左瓶才可获取进入广口瓶的水的体积
10.工业炼铁中会发生一氧化碳与氧化铁的反应,该反应中发生还原反应的物质是
A.CO B.Fe2O3 C.CO2 D.Fe
11.用1 000 t含有氧化铁80%的赤铁矿石,理论上可以炼出含铁97%的生铁的质量约是
A.560 t B.571 t C.577 t D.583 t
12.保护金属资源的有效途径,不包括下列的( )
A.合理开采矿物 B.寻找金属替代品
C.回收利用金属 D.禁止使用铁制品
13.我市即将正式跨入高铁时代。高铁钢轨制造使用的是含锰钢,轨道铺设时每段钢轨的长度达1~2千米,从而大幅减少轨道借口数量。下列说法错误的是
A.制造钢轨的材料是铁的合金
B.钢轨制造时加入锰是为了增大硬度、增强韧性
C.在钢轨接口处涂上油或扣上帽,可以防止接口处锈蚀
D.钢轨热胀冷缩、歪曲变形是化学变化
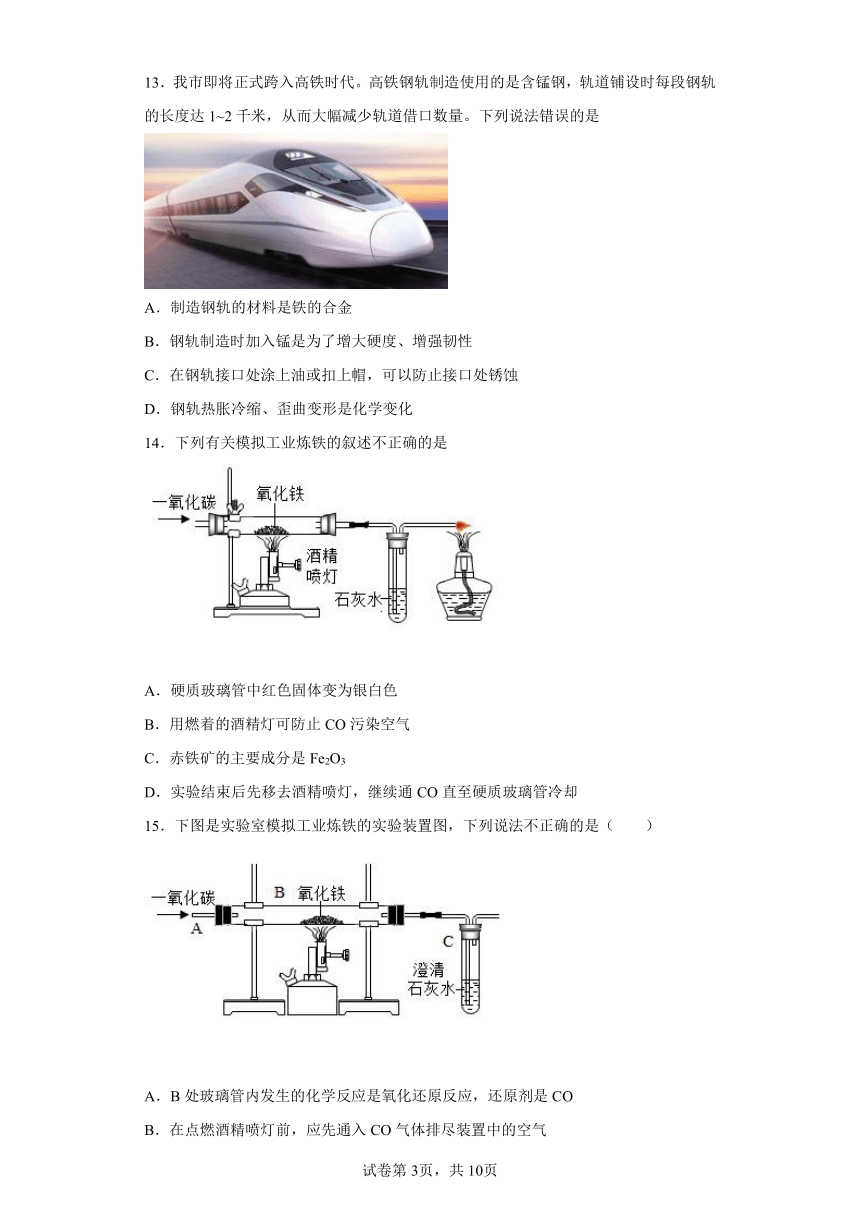
14.下列有关模拟工业炼铁的叙述不正确的是
A.硬质玻璃管中红色固体变为银白色
B.用燃着的酒精灯可防止CO污染空气
C.赤铁矿的主要成分是Fe2O3
D.实验结束后先移去酒精喷灯,继续通CO直至硬质玻璃管冷却
15.下图是实验室模拟工业炼铁的实验装置图,下列说法不正确的是( )
A.B处玻璃管内发生的化学反应是氧化还原反应,还原剂是CO
B.在点燃酒精喷灯前,应先通入CO气体排尽装置中的空气
C.该实验可以观察到B处固体从黑色逐渐变成红色
D.该模拟实验缺少尾气处理装置,会污染空气
16.今年我国将发射火星探测器。以下是关于火星的部分已知信息:
①其橘红色外表是因为地表被赤铁矿覆盖;
②火星上无液态水,但有大量冰;
③火星大气的成分为二氧化碳95.3%、氮气 2.7%、氩气 1.6%、氧气和水汽 0.4%。
下列说法正确的是
A.赤铁矿的主要成分是四氧化三铁
B.火星上的冰转化为液态水要放出热量
C.未来在火星上可用 CO 获取铁单质
D.蜡烛在火星大气中可以燃烧
二、综合应用题
17.金属材料是日常生活中应用广泛的材料,请回答下列与金属有关的问题。
(一)、金属材料及性质
(1)工业上从含有金属元素并有开采价值的矿石提炼金属,以下金属矿石中可用于 冶炼铝的是_______(填序号)。
(2)①金属材料包括纯金属以及它们的_______。
②铁制品锈蚀的主要条件是铁与_______和_______接触。
(3)已知Cr+FeSO4═Fe+CrSO4,则Fe、Cr、Hg三种金属的活动性由强到弱的顺序是_______。
(4)将一定量镁粉、锌粉的混合物加入到适量硝酸亚铁和硝酸银的混合溶液中,充分反应后,过滤,得到滤渣和滤液,下列说法正确的是_______(填序号)。
A 滤液中一定有硝酸镁,滤渣中一定有银
B 若滤液为无色,则滤渣中一定有锌
C 取少量滤液,加入氯化钠溶液,无明显现象,则滤渣中一定有铁
D 取少量滤渣,加入过量稀盐酸,产生气泡,则滤渣的组成有3种情况。
(二)制备氯化铜
氯化亚铜(CuCl2)广泛应用于冶金、电镀、医药等行业。已知CuCl难溶于水和乙醇,在潮湿空气中易变质。CuCl2的制备流程如下:
(1)“反应”中发生的化学变化是2CuCl2+Na2SO3=2CuCl2↓+2NaCl+SO3,产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为_______。
(2)“操作a”的名称是_______。本流程中可以循环利用的物质(水除外)是_______(写化学式)。
(3)可用“水洗”的原因是_______,“醇洗”的目的是_______。
(三)定量分析
铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等。
(1)写出赤铁矿石中的主要成分与一氧化碳反应的化学方程式_______。
(2)冶炼2900t含四氧化三铁80%的磁铁矿石,理论上能得到含杂质2%的生铁的质量是_______ t(结果精确到0.1)。
(3)含有锌粉6.5g、铁粉5.6g、铜粉3.2g、铝粉l。8g的混合物与一定质量的稀硫酸充分反应,反应停止后,有6g固体剩余。则生成氢气的质量为_______g。
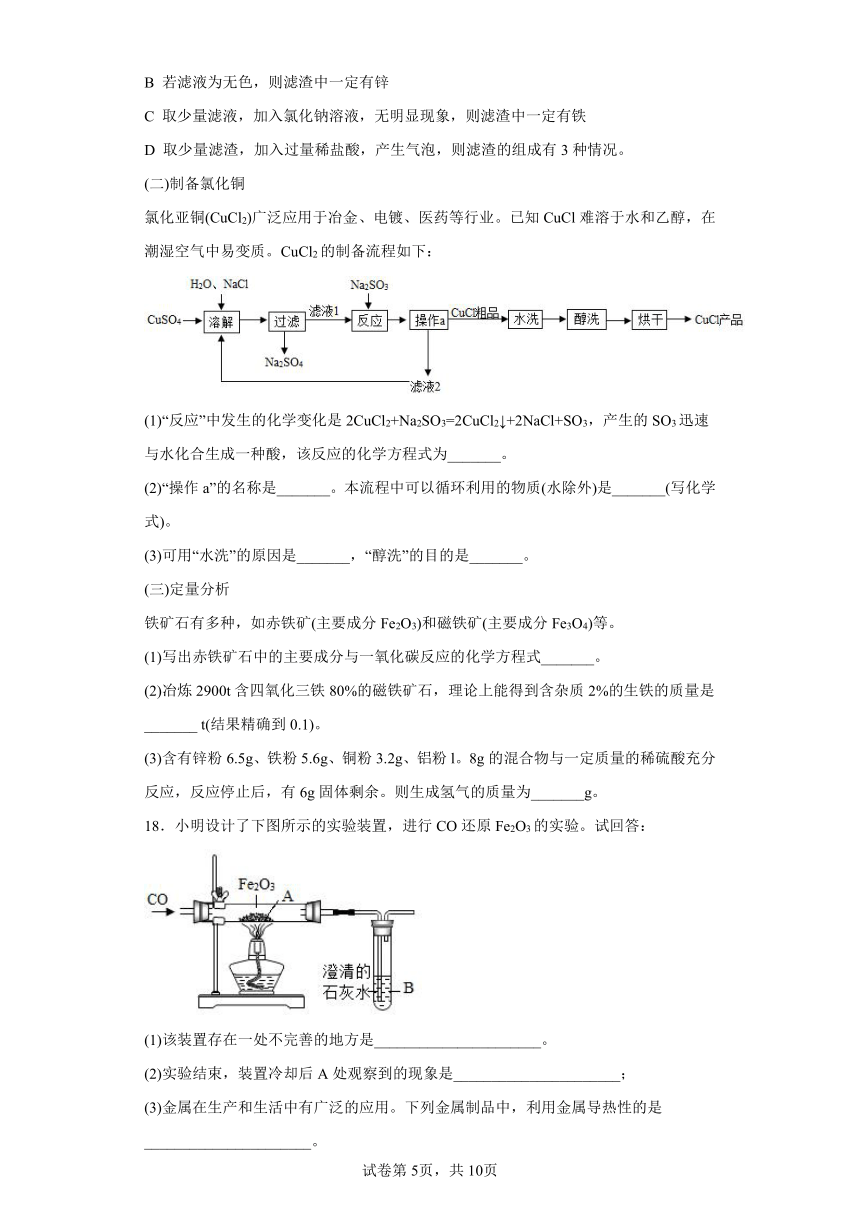
18.小明设计了下图所示的实验装置,进行CO还原Fe2O3的实验。试回答:
(1)该装置存在一处不完善的地方是______________________。
(2)实验结束,装置冷却后A处观察到的现象是______________________;
(3)金属在生产和生活中有广泛的应用。下列金属制品中,利用金属导热性的是______________________。
A.灯泡中钨丝 B.铝导线 C.铁锅
(4)工业上用含氧化铁480t的赤铁矿为原料炼铁,最多得到多少吨的纯铁?(根据化学方程式进行计算,写出完整的计算过程) _____________
19.化学兴趣小组同学参观了某钢铁公司。
I.大家对如图所示的炼铁和炼钢的工艺流程,有了全新的认识。
(1)用文字表示炼铁的原理_________。
(2)写出用赤铁矿石炼铁的化学方程式________。
(3)分析工艺流程,写出三脱装置中P发生反应的化学方程式___________。
(4)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中_______(填一种仪器的名称)的作用。
(5)在钢水铸件机中,高温钢加工成钢制零件时,充入氮气做保护气,主要因为氮气_________。
(6)在钢制成品表面“涂层”的目的是防止钢制成品中的铁与空气中的___发生化学反应而生锈。
Ⅱ.兴趣小组同学在化学实验室进行了有关铁的性质的一些基本实验。
(7)某同学用向上排空气法收集一瓶氧气做A实验,在引燃的火柴快燃尽时将细铁丝插入集气瓶中,实验现象为______,放热。
(8)试管B中装有硫酸铜溶液,发生的化学方程式为______,铁能和硫酸铜溶液反应的原因是_____。
(9)兴趣小组同学用13g锌与足量盐酸反应,理论上可生成氢气的质量是_______?(请利用化学方程式进行计算,并在答题纸上写出完整的计算过程)
(10)若兴趣小组改用13g镁铝合金与足量盐酸反应,则生成氢气的质量比用13g锌反应_____(填“小”"或“相等”或“大”)。
20.金属与人类的生产、生活密切相关,牢固掌握金属的知识非常重要。
(1)铜丝作导线是利用了其良好的______性。
(2)实验室模拟炼铁的产品是纯铁,工业炼铁的产品是生铁。
①生铁和钢性能不同的原因是______。
②图1A中的实验现象是______。
③从环保角度考虑,还需对以上装置进行改进,请简述改进措施______。
(3)铁制品容易锈蚀,是铁与______同时反应的结果。
(4)为了验证锌、铁、铜、银四种金属的活动性顺序,某同学进行如图2所示的实验。
①老师认为该同学不能达到实验目的,请说明理由______。
②请在原实验的基础上补充一个实验,以证明四种金属的活动性顺序______(写出所用试剂即可)。
(5)实验室用足量一氧化碳还原10g赤铁矿,充分反应后,测得生成二氧化碳的质量为6.6g,则该赤铁矿中氧化铁的质量分数是多少?
21.定性研究和定量研究是学习化学的重要手段。请根据实验要求回答问题:
实验一:图1是氢气还原氧化铜的实验装置
(1)该实验观察到的实验现象有______。实验结束时的正确操作及原因是______。
实验二:图2是用纯净的一氧化碳还原氧化铁的实验装置。
(2)根据实验要求,推测NaOH溶液的作用是______。
(3)实验装置B、C处发生反应的化学方程式为______、______。
(4)实验结束时应继续通入混合气体至装置冷却到室温,这样做的目的是______。但也有同学认为可以事先在装置中放置D中的止水夹(数量不限),实现停止加热时就可以停止通入混合气体。具体的操作是撤掉酒精喷灯,迅速______,将装置冷却至室温后再拆开整套装置。
实验三:进行定量实验
过氧化钙(CaO2)是一种重要的化工产品,可用来改善地表水质、治理赤潮。过氧化钙产品中常含有氧化钙杂质。某小组设计如下实验测定过氧化钙产品的纯度,实验装置如图3。
【资料在线】
①CaO2是一种白色固体,能与盐酸反应:
②CaO是一种白色固体,能与盐酸反应:
③MnO2与稀盐酸不反应。
【实验步骤】
①连接仪器并检查装置气密性。
②称取过氧化钙产品及MnO2共12g。
③缓慢通入N2一段时间后,加热铜网至红热。
④缓慢滴入过量稀盐酸,直至A中样品完全反应。
⑤缓慢通入N2一段时间后停止加热,待C中铜网冷却后,停止通入N2
⑥将锥形瓶中的剩余物过滤、洗涤、干燥,得到滤渣2g。
回答下列问题
(5)A中MnO2的作用是______,质量是______。
(6)实验前先缓慢通入一段时间的N2,作用是______。样品完全反应后,继续缓慢通入N2的目的是______。
(7)装置B的作用有:除去气体中的水蒸气、______。
(8)实验测得C装置中铜网增重1.8g,增重的质量是______的质量。由此可以计算出H2O2的质量为______g,产品中过氧化钙的质量分数为______。
22.用如图所示的实验装置制取气体并还原氧化铁。
已知草酸(H2C2O4)在浓硫酸存在时加热发生如下反应:
(1)A中盛放浓硫酸的仪器名称是______,检验A装置气密性的方法是______。C装置中浓硫酸是足量的,可以吸收完气体中的水分,做干燥剂用,B装置氢氧化钠也是足量的,试推测B装置的作用______。
(2)开始实验时应先点燃______(A或D)处酒精灯,过程中可观察到氧化铁样品颜色变化是______,该套装置的一个缺陷是______,E中发生的化学反应方程式为______。
(3)计算E中质量增加22g时,被还原的氧化铁的质量是多少克(保留一位小数)?
试卷第1页,共3页
试卷第2页,共2页
参考答案:
1.D
2.B
3.D
4.B
5.A
6.A
7.C
8.A
9.B
10.B
11.C
12.D
13.D
14.A
15.C
16.C
17. ③ 合金 氧气 水 Cr>Fe>Hg AD SO3+H2O═H2SO4 过滤 NaCl 能够除去可溶性杂质 可以除去水,防止在后续步骤中CuCl变质 1714.3 0.5
18.(1)缺少尾气的处理装置
(2)红棕色固体逐渐变成黑色
(3)C
(4)设:最多得到纯铁的质量为x
x=336t
答:最多得到336吨的纯铁。
19.(1)在高温下,利用炉内反应生成的CO把铁从铁矿石里还原出来
(2)3CO+ Fe2O32Fe +3CO2
(3)4P+5O22P2O5
(4)玻璃棒
(5)化学性质不活泼
(6)氧气和水蒸气或O2和H2O
(7)剧烈燃烧,火星四射,生成黑色固体
(8) Fe+CuSO4=Cu+FeSO4 在金属活动性顺序中,铁的活动性比铜强
(9)
解:设理论上可生成氢气的质量为x,
答:理论上可生成氢气的质量是0.4g;
(10)大
20.(1)导电
(2) 含碳量不同 红粉末逐渐变黑 在装置末端放一点燃的酒精灯
(3)O2和H2O
(4) 比较不出铁和铜的活动性强弱 铁丝,硫酸铜溶液
(5)解:设该赤铁矿中氧化铁的质量为.
则该赤铁矿中氧化铁的质量分数为:
答:该赤铁矿中氧化铁的质量分数是80%。
21.(1) 黑色固体逐渐变红,试管口有水滴 停止加热还要继续通入氢气, 直到试管冷却,为了防止灼热的铜又被空气氧化
(2)吸收混合气体中的二氧化碳
(3)
(4) 防止石灰水倒吸入玻璃管 在装置BC之间夹上止水夹
(5) 作过氧化氢的催化剂 2g
(6) 除去装置内的空气 使反应生成的氧气全部和铜反应
(7)便于观察、控制氧气流速
(8) O2##氧气 1.9 81%
22.(1) 分液漏斗 关闭分液漏斗活塞,导气管放入水中,微热烧瓶,看到导管口有气泡产生,证明A气密性良好 除去二氧化碳
(2) A 由红变黑 缺少尾气处理装置
(3)解:设被还原的氧化铁质量为x
由题意知E中增加的为CO2的质量
x=26 .7g
答;被还原的氧化铁的质量约为26 .7g。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列关于资源能源的叙述正确的是
A.地球上的总水储量很大,且淡水约占全球水储量的96.5%
B.空气是一种宝贵的资源,其中稀有气体的体积分数约为78%
C.防止金属的腐蚀是保护金属资源的唯一途径
D.人们正在利用和开发许多其他能源,如氢能、太阳能、生物质能等
2.坚持低碳生活、绿色发展,促进人与自然和谐共生,下列做法与这一理念不相符的是
A.限制燃放烟花 B.发展燃煤发电 C.分类处理垃圾 D.倡导公交出行
3.铁是年产量最高的金属,而且应用广泛,下列有关金属铁冶炼说法不正确的是( )
A.冶炼原料是铁矿石、焦炭、石灰石
B.炼铁中焦炭的作用是提供热量和还原剂
C.磁铁矿的成分是四氧化三铁
D.炼铁所得生铁含碳量是0.03%~2%
4.下列关于金属材料的说法中,不正确的是( )
A.常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜
B.铁在干燥的空气中容易生锈
C.硬铝(铝合金)的硬度大于纯铝
D.金属资源的回收利用既保护了环境,又节约了金属资源
5.2018年10月,南通被授予“国家森林城市”称号。为了使南通这座江风海韵森林城变得天更蓝、水更清、景更美,下列做法应该禁止的是( )
A.工业废水直接排入河流
B.加强对烟花爆竹燃放管理
C.生产生活垃圾分类放置
D.鼓励对旧金属回收再利用
6.下列关于资源、能源的说法正确的是
A.回收废旧金属,可节约金属资源,减少对环境的污染
B.可利用的淡水资源取之不尽用之不竭
C.发现家中天然气或者液化气泄漏时,应先开灯检查
D.煤、石油、天然气、沼气都是可再生的能源
7.炼铁高炉中发生了下列反应:①高温下一氧化碳将铁矿石还原为铁 ②高温煅烧石灰石 ③灼热的焦炭和二氧化碳反应 ④焦炭充分燃烧 其中属于化合反应的是
A.①和④ B.②和③ C.③和④ D.只有④
8.下图是探究铁钉锈蚀条件的4个实验,一段时间后观察现象。下列说法不正确的是
A.①中甲、乙、丙三处比较,生锈最明显的地方是甲
B.①②对比说明铁生锈需要空气,①③对比说明铁生锈需要水
C.③中附着在棉花上的氯化钙的作用是作干燥剂
D.四个实验中,生锈最快的是④中的铁钉
9.暖宝宝中的发热剂是铁粉、水和食盐等,用发热剂代替红磷测定空气中氧气含量,装置如图,以下对此改进实验的叙述错误的是
A.实验前要检查装置的气密性 B.此实验测出空气中氧气的质量分数约18%
C.此实验的原理是利用铁生锈消耗氧气 D.此实验必须到水不再流入左瓶才可获取进入广口瓶的水的体积
10.工业炼铁中会发生一氧化碳与氧化铁的反应,该反应中发生还原反应的物质是
A.CO B.Fe2O3 C.CO2 D.Fe
11.用1 000 t含有氧化铁80%的赤铁矿石,理论上可以炼出含铁97%的生铁的质量约是
A.560 t B.571 t C.577 t D.583 t
12.保护金属资源的有效途径,不包括下列的( )
A.合理开采矿物 B.寻找金属替代品
C.回收利用金属 D.禁止使用铁制品
13.我市即将正式跨入高铁时代。高铁钢轨制造使用的是含锰钢,轨道铺设时每段钢轨的长度达1~2千米,从而大幅减少轨道借口数量。下列说法错误的是
A.制造钢轨的材料是铁的合金
B.钢轨制造时加入锰是为了增大硬度、增强韧性
C.在钢轨接口处涂上油或扣上帽,可以防止接口处锈蚀
D.钢轨热胀冷缩、歪曲变形是化学变化
14.下列有关模拟工业炼铁的叙述不正确的是
A.硬质玻璃管中红色固体变为银白色
B.用燃着的酒精灯可防止CO污染空气
C.赤铁矿的主要成分是Fe2O3
D.实验结束后先移去酒精喷灯,继续通CO直至硬质玻璃管冷却
15.下图是实验室模拟工业炼铁的实验装置图,下列说法不正确的是( )
A.B处玻璃管内发生的化学反应是氧化还原反应,还原剂是CO
B.在点燃酒精喷灯前,应先通入CO气体排尽装置中的空气
C.该实验可以观察到B处固体从黑色逐渐变成红色
D.该模拟实验缺少尾气处理装置,会污染空气
16.今年我国将发射火星探测器。以下是关于火星的部分已知信息:
①其橘红色外表是因为地表被赤铁矿覆盖;
②火星上无液态水,但有大量冰;
③火星大气的成分为二氧化碳95.3%、氮气 2.7%、氩气 1.6%、氧气和水汽 0.4%。
下列说法正确的是
A.赤铁矿的主要成分是四氧化三铁
B.火星上的冰转化为液态水要放出热量
C.未来在火星上可用 CO 获取铁单质
D.蜡烛在火星大气中可以燃烧
二、综合应用题
17.金属材料是日常生活中应用广泛的材料,请回答下列与金属有关的问题。
(一)、金属材料及性质
(1)工业上从含有金属元素并有开采价值的矿石提炼金属,以下金属矿石中可用于 冶炼铝的是_______(填序号)。
(2)①金属材料包括纯金属以及它们的_______。
②铁制品锈蚀的主要条件是铁与_______和_______接触。
(3)已知Cr+FeSO4═Fe+CrSO4,则Fe、Cr、Hg三种金属的活动性由强到弱的顺序是_______。
(4)将一定量镁粉、锌粉的混合物加入到适量硝酸亚铁和硝酸银的混合溶液中,充分反应后,过滤,得到滤渣和滤液,下列说法正确的是_______(填序号)。
A 滤液中一定有硝酸镁,滤渣中一定有银
B 若滤液为无色,则滤渣中一定有锌
C 取少量滤液,加入氯化钠溶液,无明显现象,则滤渣中一定有铁
D 取少量滤渣,加入过量稀盐酸,产生气泡,则滤渣的组成有3种情况。
(二)制备氯化铜
氯化亚铜(CuCl2)广泛应用于冶金、电镀、医药等行业。已知CuCl难溶于水和乙醇,在潮湿空气中易变质。CuCl2的制备流程如下:
(1)“反应”中发生的化学变化是2CuCl2+Na2SO3=2CuCl2↓+2NaCl+SO3,产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为_______。
(2)“操作a”的名称是_______。本流程中可以循环利用的物质(水除外)是_______(写化学式)。
(3)可用“水洗”的原因是_______,“醇洗”的目的是_______。
(三)定量分析
铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等。
(1)写出赤铁矿石中的主要成分与一氧化碳反应的化学方程式_______。
(2)冶炼2900t含四氧化三铁80%的磁铁矿石,理论上能得到含杂质2%的生铁的质量是_______ t(结果精确到0.1)。
(3)含有锌粉6.5g、铁粉5.6g、铜粉3.2g、铝粉l。8g的混合物与一定质量的稀硫酸充分反应,反应停止后,有6g固体剩余。则生成氢气的质量为_______g。
18.小明设计了下图所示的实验装置,进行CO还原Fe2O3的实验。试回答:
(1)该装置存在一处不完善的地方是______________________。
(2)实验结束,装置冷却后A处观察到的现象是______________________;
(3)金属在生产和生活中有广泛的应用。下列金属制品中,利用金属导热性的是______________________。
A.灯泡中钨丝 B.铝导线 C.铁锅
(4)工业上用含氧化铁480t的赤铁矿为原料炼铁,最多得到多少吨的纯铁?(根据化学方程式进行计算,写出完整的计算过程) _____________
19.化学兴趣小组同学参观了某钢铁公司。
I.大家对如图所示的炼铁和炼钢的工艺流程,有了全新的认识。
(1)用文字表示炼铁的原理_________。
(2)写出用赤铁矿石炼铁的化学方程式________。
(3)分析工艺流程,写出三脱装置中P发生反应的化学方程式___________。
(4)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中_______(填一种仪器的名称)的作用。
(5)在钢水铸件机中,高温钢加工成钢制零件时,充入氮气做保护气,主要因为氮气_________。
(6)在钢制成品表面“涂层”的目的是防止钢制成品中的铁与空气中的___发生化学反应而生锈。
Ⅱ.兴趣小组同学在化学实验室进行了有关铁的性质的一些基本实验。
(7)某同学用向上排空气法收集一瓶氧气做A实验,在引燃的火柴快燃尽时将细铁丝插入集气瓶中,实验现象为______,放热。
(8)试管B中装有硫酸铜溶液,发生的化学方程式为______,铁能和硫酸铜溶液反应的原因是_____。
(9)兴趣小组同学用13g锌与足量盐酸反应,理论上可生成氢气的质量是_______?(请利用化学方程式进行计算,并在答题纸上写出完整的计算过程)
(10)若兴趣小组改用13g镁铝合金与足量盐酸反应,则生成氢气的质量比用13g锌反应_____(填“小”"或“相等”或“大”)。
20.金属与人类的生产、生活密切相关,牢固掌握金属的知识非常重要。
(1)铜丝作导线是利用了其良好的______性。
(2)实验室模拟炼铁的产品是纯铁,工业炼铁的产品是生铁。
①生铁和钢性能不同的原因是______。
②图1A中的实验现象是______。
③从环保角度考虑,还需对以上装置进行改进,请简述改进措施______。
(3)铁制品容易锈蚀,是铁与______同时反应的结果。
(4)为了验证锌、铁、铜、银四种金属的活动性顺序,某同学进行如图2所示的实验。
①老师认为该同学不能达到实验目的,请说明理由______。
②请在原实验的基础上补充一个实验,以证明四种金属的活动性顺序______(写出所用试剂即可)。
(5)实验室用足量一氧化碳还原10g赤铁矿,充分反应后,测得生成二氧化碳的质量为6.6g,则该赤铁矿中氧化铁的质量分数是多少?
21.定性研究和定量研究是学习化学的重要手段。请根据实验要求回答问题:
实验一:图1是氢气还原氧化铜的实验装置
(1)该实验观察到的实验现象有______。实验结束时的正确操作及原因是______。
实验二:图2是用纯净的一氧化碳还原氧化铁的实验装置。
(2)根据实验要求,推测NaOH溶液的作用是______。
(3)实验装置B、C处发生反应的化学方程式为______、______。
(4)实验结束时应继续通入混合气体至装置冷却到室温,这样做的目的是______。但也有同学认为可以事先在装置中放置D中的止水夹(数量不限),实现停止加热时就可以停止通入混合气体。具体的操作是撤掉酒精喷灯,迅速______,将装置冷却至室温后再拆开整套装置。
实验三:进行定量实验
过氧化钙(CaO2)是一种重要的化工产品,可用来改善地表水质、治理赤潮。过氧化钙产品中常含有氧化钙杂质。某小组设计如下实验测定过氧化钙产品的纯度,实验装置如图3。
【资料在线】
①CaO2是一种白色固体,能与盐酸反应:
②CaO是一种白色固体,能与盐酸反应:
③MnO2与稀盐酸不反应。
【实验步骤】
①连接仪器并检查装置气密性。
②称取过氧化钙产品及MnO2共12g。
③缓慢通入N2一段时间后,加热铜网至红热。
④缓慢滴入过量稀盐酸,直至A中样品完全反应。
⑤缓慢通入N2一段时间后停止加热,待C中铜网冷却后,停止通入N2
⑥将锥形瓶中的剩余物过滤、洗涤、干燥,得到滤渣2g。
回答下列问题
(5)A中MnO2的作用是______,质量是______。
(6)实验前先缓慢通入一段时间的N2,作用是______。样品完全反应后,继续缓慢通入N2的目的是______。
(7)装置B的作用有:除去气体中的水蒸气、______。
(8)实验测得C装置中铜网增重1.8g,增重的质量是______的质量。由此可以计算出H2O2的质量为______g,产品中过氧化钙的质量分数为______。
22.用如图所示的实验装置制取气体并还原氧化铁。
已知草酸(H2C2O4)在浓硫酸存在时加热发生如下反应:
(1)A中盛放浓硫酸的仪器名称是______,检验A装置气密性的方法是______。C装置中浓硫酸是足量的,可以吸收完气体中的水分,做干燥剂用,B装置氢氧化钠也是足量的,试推测B装置的作用______。
(2)开始实验时应先点燃______(A或D)处酒精灯,过程中可观察到氧化铁样品颜色变化是______,该套装置的一个缺陷是______,E中发生的化学反应方程式为______。
(3)计算E中质量增加22g时,被还原的氧化铁的质量是多少克(保留一位小数)?
试卷第1页,共3页
试卷第2页,共2页
参考答案:
1.D
2.B
3.D
4.B
5.A
6.A
7.C
8.A
9.B
10.B
11.C
12.D
13.D
14.A
15.C
16.C
17. ③ 合金 氧气 水 Cr>Fe>Hg AD SO3+H2O═H2SO4 过滤 NaCl 能够除去可溶性杂质 可以除去水,防止在后续步骤中CuCl变质 1714.3 0.5
18.(1)缺少尾气的处理装置
(2)红棕色固体逐渐变成黑色
(3)C
(4)设:最多得到纯铁的质量为x
x=336t
答:最多得到336吨的纯铁。
19.(1)在高温下,利用炉内反应生成的CO把铁从铁矿石里还原出来
(2)3CO+ Fe2O32Fe +3CO2
(3)4P+5O22P2O5
(4)玻璃棒
(5)化学性质不活泼
(6)氧气和水蒸气或O2和H2O
(7)剧烈燃烧,火星四射,生成黑色固体
(8) Fe+CuSO4=Cu+FeSO4 在金属活动性顺序中,铁的活动性比铜强
(9)
解:设理论上可生成氢气的质量为x,
答:理论上可生成氢气的质量是0.4g;
(10)大
20.(1)导电
(2) 含碳量不同 红粉末逐渐变黑 在装置末端放一点燃的酒精灯
(3)O2和H2O
(4) 比较不出铁和铜的活动性强弱 铁丝,硫酸铜溶液
(5)解:设该赤铁矿中氧化铁的质量为.
则该赤铁矿中氧化铁的质量分数为:
答:该赤铁矿中氧化铁的质量分数是80%。
21.(1) 黑色固体逐渐变红,试管口有水滴 停止加热还要继续通入氢气, 直到试管冷却,为了防止灼热的铜又被空气氧化
(2)吸收混合气体中的二氧化碳
(3)
(4) 防止石灰水倒吸入玻璃管 在装置BC之间夹上止水夹
(5) 作过氧化氢的催化剂 2g
(6) 除去装置内的空气 使反应生成的氧气全部和铜反应
(7)便于观察、控制氧气流速
(8) O2##氧气 1.9 81%
22.(1) 分液漏斗 关闭分液漏斗活塞,导气管放入水中,微热烧瓶,看到导管口有气泡产生,证明A气密性良好 除去二氧化碳
(2) A 由红变黑 缺少尾气处理装置
(3)解:设被还原的氧化铁质量为x
由题意知E中增加的为CO2的质量
x=26 .7g
答;被还原的氧化铁的质量约为26 .7g。
答案第1页,共2页
答案第1页,共2页
同课章节目录
