人教版化学九下9.3溶液的浓度一课一练(word版有答案)
文档属性
| 名称 | 人教版化学九下9.3溶液的浓度一课一练(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 207.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-28 12:15:18 | ||
图片预览



文档简介
人教版化学九下 9.3 溶液的浓度 一课一练
一、单选题
1.20℃时KCl的溶解度是34g。取65gKCl溶液放入甲烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( )
A.甲烧杯中是KCl的饱和溶液
B.乙和丙烧杯中KCl的质量分数相等
C.丁烧杯中KCl的质量分数为34%
D.若乙烧杯中溶液恰好饱和,则40℃时KCl的溶解度为40g
2.根据下表信息,相关说法正确的是( )
温度/℃ 溶解度/g
NaCl KCl NH4Cl KNO3
20 36.0 34.0 37.2 31.6
40 36.6 40.0 45.8 63.9
60 37.3 45.5 55.2 110
A.20℃时,NaCl 的溶液度为 36.0
B.40℃时,KCl 饱和溶液的溶质质量分数为 40%
C.40℃时,向 100g 水中加入 50gNH4Cl 充分溶解,溶液质量为 145.8g
D.60℃时降温到 20℃时,KNO3和 KCl 的饱和溶液析出晶体较多的是 KNO3
3.某温度下,甲、乙两个烧杯中各盛有100g相同浓度的氯化钾溶液,现将甲烧杯中的溶液蒸发掉35g水,析出5g晶体;乙烧杯中的溶液蒸发掉45g水,析出10g晶体.则原溶液的质量分数为 ( )
A.10% B.25% C.20% D.15%
4.将80g质量分数为35%的浓盐酸稀释成10%的稀盐酸需加水的质量为( )
A.80g B.100g C.200g D.280g
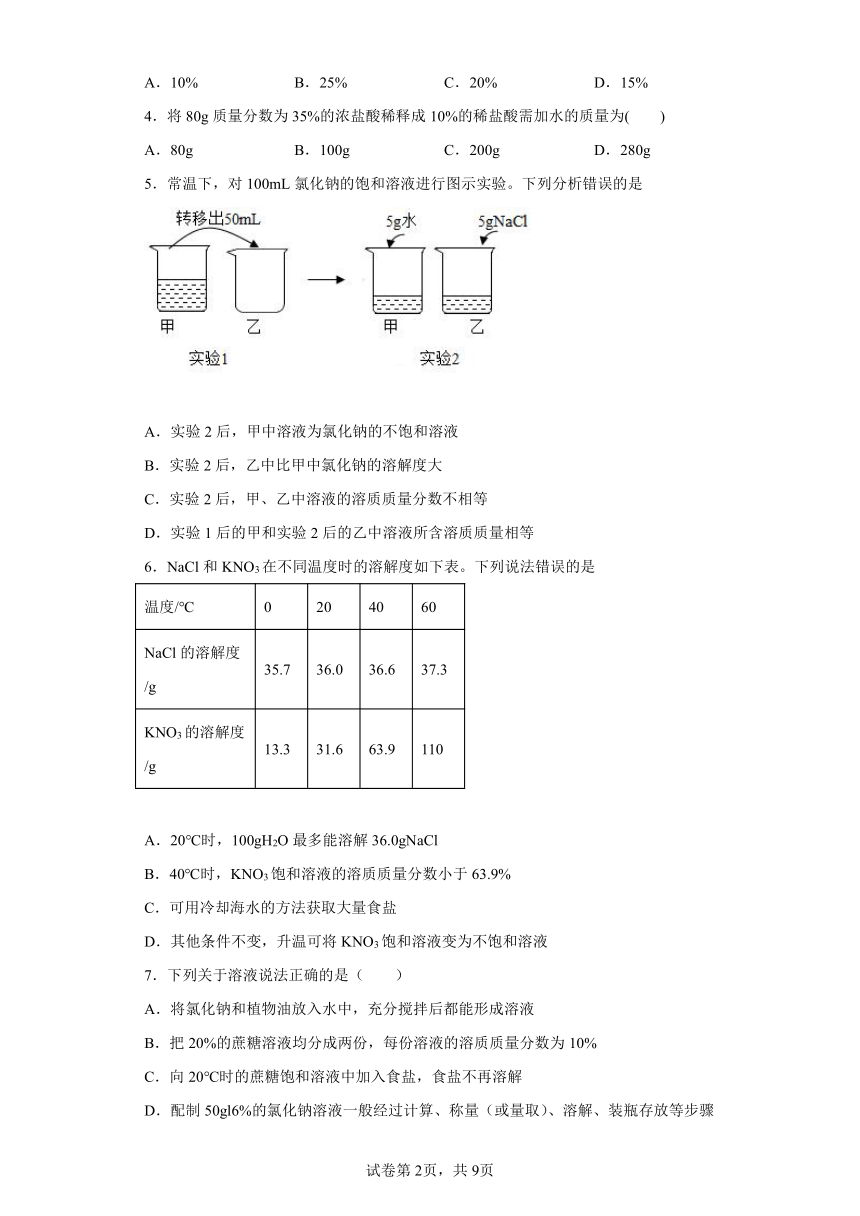
5.常温下,对100mL氯化钠的饱和溶液进行图示实验。下列分析错误的是
A.实验2后,甲中溶液为氯化钠的不饱和溶液
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲、乙中溶液的溶质质量分数不相等
D.实验1后的甲和实验2后的乙中溶液所含溶质质量相等
6.NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是
温度/℃ 0 20 40 60
NaCl的溶解度/g 35.7 36.0 36.6 37.3
KNO3的溶解度/g 13.3 31.6 63.9 110
A.20℃时,100gH2O最多能溶解36.0gNaCl
B.40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.可用冷却海水的方法获取大量食盐
D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
7.下列关于溶液说法正确的是( )
A.将氯化钠和植物油放入水中,充分搅拌后都能形成溶液
B.把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数为10%
C.向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解
D.配制50gl6%的氯化钠溶液一般经过计算、称量(或量取)、溶解、装瓶存放等步骤
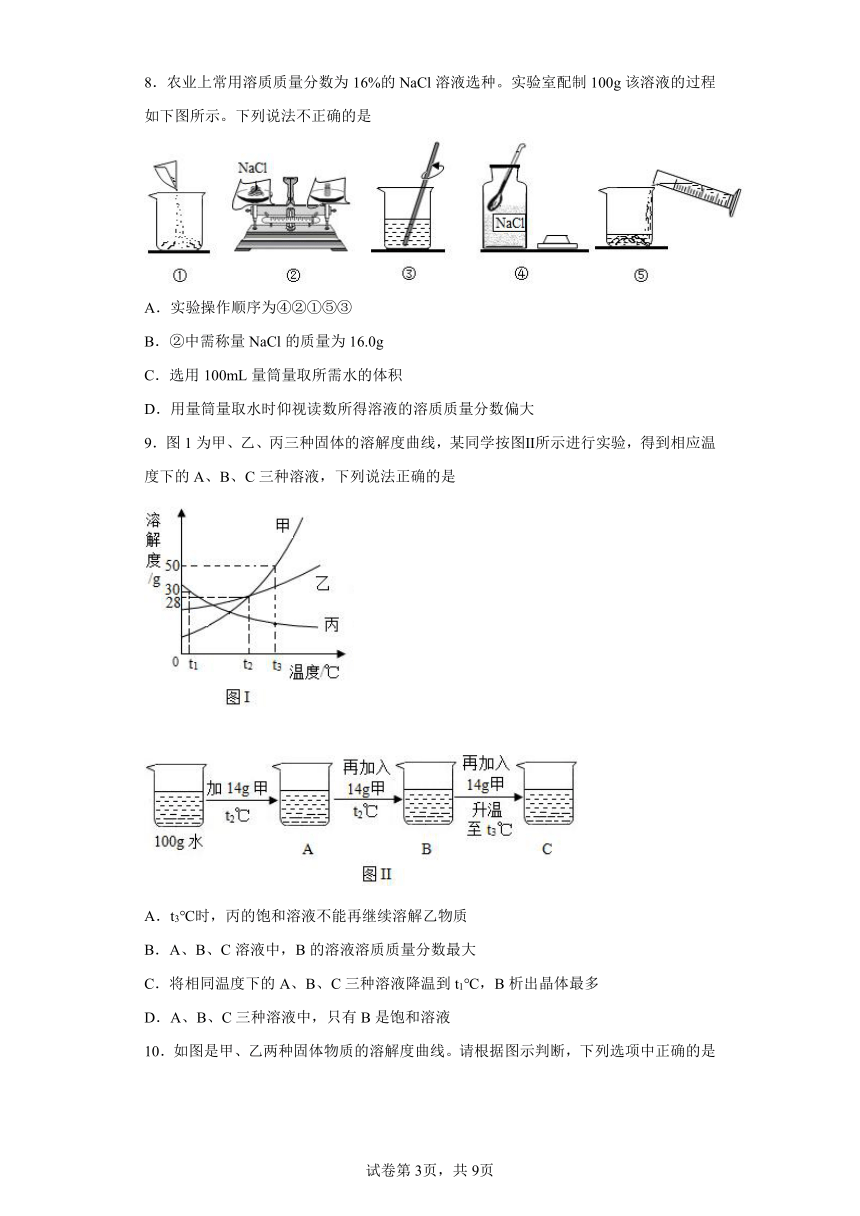
8.农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该溶液的过程如下图所示。下列说法不正确的是
A.实验操作顺序为④②①⑤③
B.②中需称量NaCl的质量为16.0g
C.选用100mL量筒量取所需水的体积
D.用量筒量取水时仰视读数所得溶液的溶质质量分数偏大
9.图1为甲、乙、丙三种固体的溶解度曲线,某同学按图Ⅱ所示进行实验,得到相应温度下的A、B、C三种溶液,下列说法正确的是
A.t3℃时,丙的饱和溶液不能再继续溶解乙物质
B.A、B、C溶液中,B的溶液溶质质量分数最大
C.将相同温度下的A、B、C三种溶液降温到t1℃,B析出晶体最多
D.A、B、C三种溶液中,只有B是饱和溶液
10.如图是甲、乙两种固体物质的溶解度曲线。请根据图示判断,下列选项中正确的是
A.t2℃时,溶质质量相等的甲、乙饱和溶液,溶液质量:甲 < 乙
B.当甲中含有少量乙物质时,可采用蒸发溶剂的方法提纯甲物质
C.tl℃时,甲、乙两种溶液的溶质质量分数相等
D.把甲物质的不饱和溶液变为饱和溶液,溶剂的质量一定变小
11.在20℃时,将40g氯化钠固体加入100g水中,充分搅拌后,有4g固体未溶解。下列说法正确的是
A.20℃时,氯化钠的溶解度为36g
B.该溶液不能继续溶解硝酸钾固体
C.所得氯化钠溶液的质量为140g
D.将该溶液倒出一半,则溶质的质量分数改变
12.某温度下,在100g质量分数为20%的KNO3不饱和溶液甲中加入10gKNO3固体,恰好得到饱和溶液乙。下列说法正确的是( )
A.该温度下,KNO3的溶解度为30g
B.乙溶液的质量分数为30%
C.降低温度,可以使甲溶液变成饱和溶液
D.升高温度,甲、乙两溶液的质量分数都增大
13.氢氧化钙的溶解度随温度升高而减小。要想把一瓶接近饱和的石灰水变成饱和,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水。
其中措施正确的是
A.①②④ B.①③④ C.①③⑤ D.①②⑤
14.小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
15.如图是甲、乙、两三种固体物质(均不含结晶水)的溶解度曲线。下列说法正确的是
A.甲和丙的溶解度相等
B.在t2℃时,将28g甲物质加入到50g水中,充分溶解后所得溶液的质 量为78g
C.将t2℃时,甲的饱和溶液降温到t1℃,有晶体析出
D.将t1℃时,甲、乙、丙三种物质的饱和溶液升温至t2℃(不考虑水的蒸发),所得溶液中溶质的质量分数由大到小的顺序是甲> Z>丙
16.用氯化钠固体配制溶质质量分数为5%的氯化钠溶液。下列仪器中必须用到的是( )
A.②④⑥⑦ B.①④⑤⑥ C.①③⑤⑦ D.①②④⑦
二、综合应用题
17.康康同学配制 50g 溶质质量分数为 3%的氯化钠溶液的过程如图所示:
(1)称量氯化钠时,发现托盘天平的指针偏向左盘,此时应 (填字母)。
A.增加适量砝码或移动游码 B.减少适量氯化钠固体 C.调节平衡螺母
(2)对配制的溶液进行检测时发现溶质质量分数偏小,可能的原因是什么?(答出 2 条)
18.现有FeCl3和CuCl2的混合溶液195.2g,向其中加入铁粉,反应的先后顺序为:2FeCl3+Fe=3FeCl2、CuCl2+Fe=FeCl2+Cu。加入铁粉质量与反应后溶液中剩余固体质量的关系如图所示。
(1)由FeCl3转变FeCl2的过程,铁元素的化合价是______价变到______价;
(2)m(剩余固体)>6.4g时,剩余固体的成分是______,向此剩余固体中加入盐酸,发生反应的化学方程式为______;
(3)求当加入11.2g铁粉时,反应后所得溶液中FeCl2的质量分数______。
19.I、实验室配制50g质量分数为6%的硝酸钾溶液,步骤如下:
(1)计算:配制50g质量分数为6%的硝酸钾溶液需硝酸钾______g;
称量:调节托盘天平,称取所需的硝酸钾,倒入小烧杯里;
(2)溶解:选用______(填“50 mL”或“100 mL”)量筒,量取所需水______mL,倒入装有硝酸钾的小烧杯,并用玻璃棒不断搅拌。
II、实验室用氯酸钾和二氧化锰的混合物制取氧气,某次实验中固体的质量变化如下:
(3)生成氧气的质量;
(4)求参加反应的氯酸钾的物质的质量。(均规范写出解题过程)
20.某实验小组探究了溶质的质量分数对H2O2分解速率的影响,实验装置如图 1 所示,用注射器加入不同浓度的H2O2溶液(见下表),实验中使用传感器装置测算生成O2的质量(圆底烧瓶内气压变化在安全范围),绘制氧气质量随时间变化的曲线,如图 2 所示。
实验编号 H2O2的质量分数(%) H2O2溶液的体积(mL) 对应曲线
Ⅰ 3.4 10.0 a
Ⅱ 2.4 10.0 b
(1)实验前需准备不同浓度的H2O2溶液,若要配制100.0g质量分数为 2.4 %的H2O2溶液,需质量分数为30%的H2O2溶液____________g。
(2)根据实验探究目的,从曲线a、b中,可得出的结论是________________。
(3)计算实验Ⅰ条件下H2O2完全分解所得氧气的质量,并写出具体计算过程(1.5~5.0% H2O2溶液的密度取值1.0g/mL)。_______________。
21.请结合图示实验装置,回答下列问题。
(1)仪器s名称是_________。
(2)实验室用装置A制取O2的化学方程式为_________。若用D装置收集O2,验满时需要进行的操作是_________。利用E装置收集O2,理由是_________。
(3)实验室制取H2时,若用装置C替代装置B,其优点是_________。
(4)过氧化氢溶液是一种常见的医用消毒剂,也可用于实验室制取氧气。请根据化学方程式进行计算,如果实验室要制取3.2g氧气,理论上需要溶质质量分数为5%的过氧化氢溶液的质量是多少?(在答题卡上写出完整计算过程)_________
22.铁是生活中常用的金属,请你根据学习回答下列问题。
(1)金属元素在自然界中分布很广,铁的矿物主要有赤铁矿、磁铁矿、黄铁矿等,生产生活中常用金属矿物冶炼金属,而一般情况下,不选择黄铁矿(FeS2)来炼铁,原因之一是______,原因二是生成的二氧化硫会污染空气。
(2)冬天使用的“取暖片”中,发热剂的主要成分有铁粉、活性炭、氯化钠、水等,发热剂需接触到空气才会发热,原因是铁要与______等物质共同作用才会“生锈”。
(3)第一种新型材料纳米级Fe粉在空气中易自燃,它能用作高效催化剂。实验室采用还原法制备纳米级Fe粉,其流程如图所示:
①完成上述制作工艺II中发生置换反应的化学方程式(氮气不参与反应):______。
②在制备纳米级Fe粉的工艺流程中,通入N2的目的是______。
(4)为了研究炼铁的主要反应原理,某化学兴趣小组的同学用一氧化碳还原氧化铁做实验。装置如图所示。请回答下列问题:
①组装好仪器后,检查气密性并在玻璃管中装入红色氧化铁粉末后的实验操作顺序为______。
a、通一氧化碳并点燃处理尾气的酒精灯
b、点燃给硬质玻璃管加热的酒精喷灯
c、检验一氧化碳的纯度
②实验中硬质玻璃管内可以观察到的现象为:______。
③某学校研究性学习小组为了测定某炼铁厂生产出来的生铁(铁碳合金, 其中含碳量2~ 4.3%)是否达到要求,取来了一些生铁样品,并取稀盐酸400g,平均分成4份,进行实验,结果如下:
实验 1 2 3 4
稀盐酸的质量/g 100 100 100 100
加入样品的质量/g 3 6 9 12
生成的H2质量/g 0.1 0.2 0.25 m
Ⅰ、上表中的m的数值为______。
Ⅱ、试计算这种生铁样品中碳的质量分数并判断是否达到要求______。
Ⅲ、试计算第2次实验后所得溶液的溶质质量分数。______(Ⅱ、Ⅲ写出计算过程,计算结果保留小数点后一位)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.B
4.C
5.B
6.C
7.D
8.D
9.D
10.A
11.A
12.C
13.D
14.D
15.C
16.B
17.(1)B
(2)量水时,仰视读数;称量固体时,砝码和固体放反了。
18.(1) +3 +2
(2) Fe、Cu Fe+2HCl═FeCl2+H2↑
(3)
解:设原混合溶液中氯化铁的质量为x。
,x=32.5g,铁和氯化铁恰好完全反应时,溶液中氯化亚铁的质量为:32.5g+5.6g=38.1g。
由图像可知,加入11.2g铁粉时,铁和氯化铁、氯化铜均恰好完全反应,剩余固体为反应置换出的铜,质量为6.4g,此时溶液的质量为:195.2g+11.2g-6.4g=200g。设铁与氯化铜反应生成氯化亚铁的质量为x。
,x=12.7g
反应后溶液中氯化亚铁的质量为:38.1g+12.7g=50.8g,则反应后所得溶液中FeCl2的质量分数为:=25.4%。
19.(1)3
(2) 50mL 47
(3)根据质量守恒,生成氧气质量为 15g+5g- 15.2g=4.8g
(4)设参加反应的氯酸钾质量为 x2KClO3MnO2__Δ2KCl+3O2↑24596x4.8g
x=12.25g
答: 生成氧气 4.8g,参加反应的氯酸钾质量为 12.25g。
20. 8 相同条件下,H2O2溶液中溶质的质量分数越高,其分解速率就越快 实验Ⅰ条件下所用过氧化氢溶液溶质H2O2的质量为10mL×1.0g/mL×3.4%=0.34g
解:设其完全分解所得氧气的质量为y
y=0.16g
答:实验Ⅰ条件下H2O2完全分解所得氧气的质量为0.16g。
21. 分液漏斗 将燃烧的木条置于a处,观察其是否燃烧的更旺 氧气不易溶于水且不与水反应 控制反应的发生与停止 解:设过氧化氢的质量为
解得
故需要质量分数为5%的过氧化氢溶液的溶质为:6.8g÷5%=136g。
答:需要质量分数为5%的过氧化氢溶液的溶质为136g。
22. 黄铁矿含铁量低 氧气、水 排尽空气,防止铁粉遇到氧气自燃(防止铁粉被氧化) cab 红色固体变为黑色 0.25 根据实验1,3g样品中加入100g稀盐酸,生成0.1g氢气,设生铁样品中铁的质量是x
解得x=2.8g;
碳元素的质量分数为:,所以不符合要求。 第2次实验中,6g样品中加入100g稀盐酸,生成0.2g氢气,由Ⅱ中可知3g样品含杂质为3g-2.8g=0.2g,则6g样品中含杂质0.4g;设溶液中氯化亚铁的质量是y
y=12.7g;
。
答:第二次实验后溶液中的溶质质量分数是12.0%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.20℃时KCl的溶解度是34g。取65gKCl溶液放入甲烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( )
A.甲烧杯中是KCl的饱和溶液
B.乙和丙烧杯中KCl的质量分数相等
C.丁烧杯中KCl的质量分数为34%
D.若乙烧杯中溶液恰好饱和,则40℃时KCl的溶解度为40g
2.根据下表信息,相关说法正确的是( )
温度/℃ 溶解度/g
NaCl KCl NH4Cl KNO3
20 36.0 34.0 37.2 31.6
40 36.6 40.0 45.8 63.9
60 37.3 45.5 55.2 110
A.20℃时,NaCl 的溶液度为 36.0
B.40℃时,KCl 饱和溶液的溶质质量分数为 40%
C.40℃时,向 100g 水中加入 50gNH4Cl 充分溶解,溶液质量为 145.8g
D.60℃时降温到 20℃时,KNO3和 KCl 的饱和溶液析出晶体较多的是 KNO3
3.某温度下,甲、乙两个烧杯中各盛有100g相同浓度的氯化钾溶液,现将甲烧杯中的溶液蒸发掉35g水,析出5g晶体;乙烧杯中的溶液蒸发掉45g水,析出10g晶体.则原溶液的质量分数为 ( )
A.10% B.25% C.20% D.15%
4.将80g质量分数为35%的浓盐酸稀释成10%的稀盐酸需加水的质量为( )
A.80g B.100g C.200g D.280g
5.常温下,对100mL氯化钠的饱和溶液进行图示实验。下列分析错误的是
A.实验2后,甲中溶液为氯化钠的不饱和溶液
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲、乙中溶液的溶质质量分数不相等
D.实验1后的甲和实验2后的乙中溶液所含溶质质量相等
6.NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是
温度/℃ 0 20 40 60
NaCl的溶解度/g 35.7 36.0 36.6 37.3
KNO3的溶解度/g 13.3 31.6 63.9 110
A.20℃时,100gH2O最多能溶解36.0gNaCl
B.40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.可用冷却海水的方法获取大量食盐
D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
7.下列关于溶液说法正确的是( )
A.将氯化钠和植物油放入水中,充分搅拌后都能形成溶液
B.把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数为10%
C.向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解
D.配制50gl6%的氯化钠溶液一般经过计算、称量(或量取)、溶解、装瓶存放等步骤
8.农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该溶液的过程如下图所示。下列说法不正确的是
A.实验操作顺序为④②①⑤③
B.②中需称量NaCl的质量为16.0g
C.选用100mL量筒量取所需水的体积
D.用量筒量取水时仰视读数所得溶液的溶质质量分数偏大
9.图1为甲、乙、丙三种固体的溶解度曲线,某同学按图Ⅱ所示进行实验,得到相应温度下的A、B、C三种溶液,下列说法正确的是
A.t3℃时,丙的饱和溶液不能再继续溶解乙物质
B.A、B、C溶液中,B的溶液溶质质量分数最大
C.将相同温度下的A、B、C三种溶液降温到t1℃,B析出晶体最多
D.A、B、C三种溶液中,只有B是饱和溶液
10.如图是甲、乙两种固体物质的溶解度曲线。请根据图示判断,下列选项中正确的是
A.t2℃时,溶质质量相等的甲、乙饱和溶液,溶液质量:甲 < 乙
B.当甲中含有少量乙物质时,可采用蒸发溶剂的方法提纯甲物质
C.tl℃时,甲、乙两种溶液的溶质质量分数相等
D.把甲物质的不饱和溶液变为饱和溶液,溶剂的质量一定变小
11.在20℃时,将40g氯化钠固体加入100g水中,充分搅拌后,有4g固体未溶解。下列说法正确的是
A.20℃时,氯化钠的溶解度为36g
B.该溶液不能继续溶解硝酸钾固体
C.所得氯化钠溶液的质量为140g
D.将该溶液倒出一半,则溶质的质量分数改变
12.某温度下,在100g质量分数为20%的KNO3不饱和溶液甲中加入10gKNO3固体,恰好得到饱和溶液乙。下列说法正确的是( )
A.该温度下,KNO3的溶解度为30g
B.乙溶液的质量分数为30%
C.降低温度,可以使甲溶液变成饱和溶液
D.升高温度,甲、乙两溶液的质量分数都增大
13.氢氧化钙的溶解度随温度升高而减小。要想把一瓶接近饱和的石灰水变成饱和,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水。
其中措施正确的是
A.①②④ B.①③④ C.①③⑤ D.①②⑤
14.小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
15.如图是甲、乙、两三种固体物质(均不含结晶水)的溶解度曲线。下列说法正确的是
A.甲和丙的溶解度相等
B.在t2℃时,将28g甲物质加入到50g水中,充分溶解后所得溶液的质 量为78g
C.将t2℃时,甲的饱和溶液降温到t1℃,有晶体析出
D.将t1℃时,甲、乙、丙三种物质的饱和溶液升温至t2℃(不考虑水的蒸发),所得溶液中溶质的质量分数由大到小的顺序是甲> Z>丙
16.用氯化钠固体配制溶质质量分数为5%的氯化钠溶液。下列仪器中必须用到的是( )
A.②④⑥⑦ B.①④⑤⑥ C.①③⑤⑦ D.①②④⑦
二、综合应用题
17.康康同学配制 50g 溶质质量分数为 3%的氯化钠溶液的过程如图所示:
(1)称量氯化钠时,发现托盘天平的指针偏向左盘,此时应 (填字母)。
A.增加适量砝码或移动游码 B.减少适量氯化钠固体 C.调节平衡螺母
(2)对配制的溶液进行检测时发现溶质质量分数偏小,可能的原因是什么?(答出 2 条)
18.现有FeCl3和CuCl2的混合溶液195.2g,向其中加入铁粉,反应的先后顺序为:2FeCl3+Fe=3FeCl2、CuCl2+Fe=FeCl2+Cu。加入铁粉质量与反应后溶液中剩余固体质量的关系如图所示。
(1)由FeCl3转变FeCl2的过程,铁元素的化合价是______价变到______价;
(2)m(剩余固体)>6.4g时,剩余固体的成分是______,向此剩余固体中加入盐酸,发生反应的化学方程式为______;
(3)求当加入11.2g铁粉时,反应后所得溶液中FeCl2的质量分数______。
19.I、实验室配制50g质量分数为6%的硝酸钾溶液,步骤如下:
(1)计算:配制50g质量分数为6%的硝酸钾溶液需硝酸钾______g;
称量:调节托盘天平,称取所需的硝酸钾,倒入小烧杯里;
(2)溶解:选用______(填“50 mL”或“100 mL”)量筒,量取所需水______mL,倒入装有硝酸钾的小烧杯,并用玻璃棒不断搅拌。
II、实验室用氯酸钾和二氧化锰的混合物制取氧气,某次实验中固体的质量变化如下:
(3)生成氧气的质量;
(4)求参加反应的氯酸钾的物质的质量。(均规范写出解题过程)
20.某实验小组探究了溶质的质量分数对H2O2分解速率的影响,实验装置如图 1 所示,用注射器加入不同浓度的H2O2溶液(见下表),实验中使用传感器装置测算生成O2的质量(圆底烧瓶内气压变化在安全范围),绘制氧气质量随时间变化的曲线,如图 2 所示。
实验编号 H2O2的质量分数(%) H2O2溶液的体积(mL) 对应曲线
Ⅰ 3.4 10.0 a
Ⅱ 2.4 10.0 b
(1)实验前需准备不同浓度的H2O2溶液,若要配制100.0g质量分数为 2.4 %的H2O2溶液,需质量分数为30%的H2O2溶液____________g。
(2)根据实验探究目的,从曲线a、b中,可得出的结论是________________。
(3)计算实验Ⅰ条件下H2O2完全分解所得氧气的质量,并写出具体计算过程(1.5~5.0% H2O2溶液的密度取值1.0g/mL)。_______________。
21.请结合图示实验装置,回答下列问题。
(1)仪器s名称是_________。
(2)实验室用装置A制取O2的化学方程式为_________。若用D装置收集O2,验满时需要进行的操作是_________。利用E装置收集O2,理由是_________。
(3)实验室制取H2时,若用装置C替代装置B,其优点是_________。
(4)过氧化氢溶液是一种常见的医用消毒剂,也可用于实验室制取氧气。请根据化学方程式进行计算,如果实验室要制取3.2g氧气,理论上需要溶质质量分数为5%的过氧化氢溶液的质量是多少?(在答题卡上写出完整计算过程)_________
22.铁是生活中常用的金属,请你根据学习回答下列问题。
(1)金属元素在自然界中分布很广,铁的矿物主要有赤铁矿、磁铁矿、黄铁矿等,生产生活中常用金属矿物冶炼金属,而一般情况下,不选择黄铁矿(FeS2)来炼铁,原因之一是______,原因二是生成的二氧化硫会污染空气。
(2)冬天使用的“取暖片”中,发热剂的主要成分有铁粉、活性炭、氯化钠、水等,发热剂需接触到空气才会发热,原因是铁要与______等物质共同作用才会“生锈”。
(3)第一种新型材料纳米级Fe粉在空气中易自燃,它能用作高效催化剂。实验室采用还原法制备纳米级Fe粉,其流程如图所示:
①完成上述制作工艺II中发生置换反应的化学方程式(氮气不参与反应):______。
②在制备纳米级Fe粉的工艺流程中,通入N2的目的是______。
(4)为了研究炼铁的主要反应原理,某化学兴趣小组的同学用一氧化碳还原氧化铁做实验。装置如图所示。请回答下列问题:
①组装好仪器后,检查气密性并在玻璃管中装入红色氧化铁粉末后的实验操作顺序为______。
a、通一氧化碳并点燃处理尾气的酒精灯
b、点燃给硬质玻璃管加热的酒精喷灯
c、检验一氧化碳的纯度
②实验中硬质玻璃管内可以观察到的现象为:______。
③某学校研究性学习小组为了测定某炼铁厂生产出来的生铁(铁碳合金, 其中含碳量2~ 4.3%)是否达到要求,取来了一些生铁样品,并取稀盐酸400g,平均分成4份,进行实验,结果如下:
实验 1 2 3 4
稀盐酸的质量/g 100 100 100 100
加入样品的质量/g 3 6 9 12
生成的H2质量/g 0.1 0.2 0.25 m
Ⅰ、上表中的m的数值为______。
Ⅱ、试计算这种生铁样品中碳的质量分数并判断是否达到要求______。
Ⅲ、试计算第2次实验后所得溶液的溶质质量分数。______(Ⅱ、Ⅲ写出计算过程,计算结果保留小数点后一位)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.B
4.C
5.B
6.C
7.D
8.D
9.D
10.A
11.A
12.C
13.D
14.D
15.C
16.B
17.(1)B
(2)量水时,仰视读数;称量固体时,砝码和固体放反了。
18.(1) +3 +2
(2) Fe、Cu Fe+2HCl═FeCl2+H2↑
(3)
解:设原混合溶液中氯化铁的质量为x。
,x=32.5g,铁和氯化铁恰好完全反应时,溶液中氯化亚铁的质量为:32.5g+5.6g=38.1g。
由图像可知,加入11.2g铁粉时,铁和氯化铁、氯化铜均恰好完全反应,剩余固体为反应置换出的铜,质量为6.4g,此时溶液的质量为:195.2g+11.2g-6.4g=200g。设铁与氯化铜反应生成氯化亚铁的质量为x。
,x=12.7g
反应后溶液中氯化亚铁的质量为:38.1g+12.7g=50.8g,则反应后所得溶液中FeCl2的质量分数为:=25.4%。
19.(1)3
(2) 50mL 47
(3)根据质量守恒,生成氧气质量为 15g+5g- 15.2g=4.8g
(4)设参加反应的氯酸钾质量为 x2KClO3MnO2__Δ2KCl+3O2↑24596x4.8g
x=12.25g
答: 生成氧气 4.8g,参加反应的氯酸钾质量为 12.25g。
20. 8 相同条件下,H2O2溶液中溶质的质量分数越高,其分解速率就越快 实验Ⅰ条件下所用过氧化氢溶液溶质H2O2的质量为10mL×1.0g/mL×3.4%=0.34g
解:设其完全分解所得氧气的质量为y
y=0.16g
答:实验Ⅰ条件下H2O2完全分解所得氧气的质量为0.16g。
21. 分液漏斗 将燃烧的木条置于a处,观察其是否燃烧的更旺 氧气不易溶于水且不与水反应 控制反应的发生与停止 解:设过氧化氢的质量为
解得
故需要质量分数为5%的过氧化氢溶液的溶质为:6.8g÷5%=136g。
答:需要质量分数为5%的过氧化氢溶液的溶质为136g。
22. 黄铁矿含铁量低 氧气、水 排尽空气,防止铁粉遇到氧气自燃(防止铁粉被氧化) cab 红色固体变为黑色 0.25 根据实验1,3g样品中加入100g稀盐酸,生成0.1g氢气,设生铁样品中铁的质量是x
解得x=2.8g;
碳元素的质量分数为:,所以不符合要求。 第2次实验中,6g样品中加入100g稀盐酸,生成0.2g氢气,由Ⅱ中可知3g样品含杂质为3g-2.8g=0.2g,则6g样品中含杂质0.4g;设溶液中氯化亚铁的质量是y
y=12.7g;
。
答:第二次实验后溶液中的溶质质量分数是12.0%。
答案第1页,共2页
答案第1页,共2页
