8.5化学肥料同步练习—2021~2022学年九年级化学科粤版下册(word版 含答案)
文档属性
| 名称 | 8.5化学肥料同步练习—2021~2022学年九年级化学科粤版下册(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 204.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-28 00:00:00 | ||
图片预览


文档简介
8.5 化学肥料
一、单选题
1.下列有关化肥或农药的叙述错误的是( )
A.硫酸铵属于复合肥料,所含的营养元素是氮和硫
B.氯化铵和磷矿粉从外观即可区分
C.农药施用后,会通过农作物、农产品等发生转移
D.化肥和农药施用不当,会对环境造成污染
2.氮肥能促进植物的枝叶繁茂,叶色浓绿。下列属于氮肥的是
A.KH2PO4 B.K2SO4 C.NH4NO3 D.Ca3(PO4)2
3.下列关于化肥的说法正确的是
A.过磷酸钙[Ca(H2PO4)2和CaSO4的混合物]属于氮肥
B.凡施用过化肥的蔬菜都会危害健康
C.硫酸钾与熟石灰混合、研磨,能闻到刺激性的气味
D.合理施用化肥能提高农作物的产量
4.下列肥料中含营养元素种类最少的是
A.KCl B.(NH4)2HPO4 C.NH4H2PO4 D.KNO3
5.农作物种植过程中可以施用下列化肥,其中属于复合肥的是
A.NH4NO3 B.KNO3 C.Ca(H2PO4)2 D.CO(NH2)2
6.如图是某菜农使用化肥包装袋上的部分说明,该化肥属于
A.氮肥
B.磷肥
C.钾肥
D.复合肥料
7.下列叙述正确的是( )
A.溶液是均一、稳定的含水混合物
B.合金中可以不含非金属元素
C.CO和CO2是元素组成不同的碳的氧化物
D.(NH4)2SO4属于由两种原子团构成的复合肥料
8.2013年“世界水日”的宣传主题是“水合作”。下列有关水的说法中不正确的是
A.水是一种氧化物
B.鉴别软水和硬水可以用肥皂水
C.农药、化肥的不合理施用,会造成水体污染
D.自然界中的水经过沉淀、过滤、吸附后即可得到纯水
9.某同学家中种植的植物比正常的植株矮小瘦弱,叶片发黄,你认为应该施加下列哪一种化肥
A.氯化钾 B.过磷酸钙 C.硫酸钾 D.尿素
10.小明家的甘蔗茎杆细弱,需要追施钾肥,应选择( )
A.KOH B.Ca3(PO4)2 C.K2CO3 D.CO(NH2)2
11.碳酸氢铵是白色固体,在生产生活中应用广泛。它稍微受热就能快速分解: 。下列有关叙述错误的是
A.碳酸氢铵要密封保存在阴凉干燥处
B.加热碳酸氢铵时,白色固体会逐渐消失
C.食品工业上常用碳酸氢铵作膨松剂
D.碳酸氢铵与草木灰混合施用能提高肥效
12.小美发现荔枝园旁边的水稻叶子发黄,并倒下了一片,你认为应该向稻田施用的复合肥是( )
A.CO(NH2)2 B.KCl C.Ca3(PO4)2 D.KNO3
13.农作物生长需要含较多氮、磷、钾元素的化肥,下列化肥属于含磷复合肥料的是
A.NH4NO3 B.Ca(H2PO4)2 C.(NH4)2HPO4 D.KNO3
14.下列说法正确的是
A.NaHCO3俗称苏打
B.CaCO3可用作补钙剂
C.Na2CO3俗称火碱
D.K2CO3属于复合肥
15.公园里部分植物的枝叶枯黄,茎也比较纤细。建议工作人员最好给这些植物施用的一种化肥是
A.NH4HCO3 B.KNO3 C.Ca(H2PO4)2 D.(NH4)3PO4
16.合理使用化肥,有利于农作物的生长和减少环境污染。下列有关化肥的说法不正确的是
A.为保证高产尽量多施用化肥
B.不能将氯化铵与碱性物质混合施用
C.KNO3是一种常用的复合肥料
D.提倡将农家肥与化肥综合使用
二、综合应用题
17.我国拥有地球上7%的耕地,但化肥使用量却占全球总量的35%,认识化肥,科学施肥至关重要.
(1)下列物质中,可用作磷肥的是_______________:
A.K2SO4 B.CO(NH2)2 C.KNO3 D.Ca(H2PO4)
(2)NH4Cl是常见的氮肥,不能与碱性物质混用,否则会因释放出________而损失肥效;
(3)过度使用化肥造成的后果有:①____________________;②水体富营养化等;
(4)“雷雨发庄稼”现象涉及的化学反应较为复杂,其中一个反应是NO3与H2O反应生成HNO2和NO,写出该反应的化学方程式:__________________________;该反应中.化合价发生改变的元素是________(填元素符号).
18.(1)下列关于酸、碱、盐的生产或应用中的说法合理的是_________。
A将氯化铵与草木灰混合施用
B用小苏打治疗胃酸过多
C烧碱既可以从内陆盐湖提取,又可用侯氏联合制碱法制取
D高温煅烧生石灰可以得到熟石灰
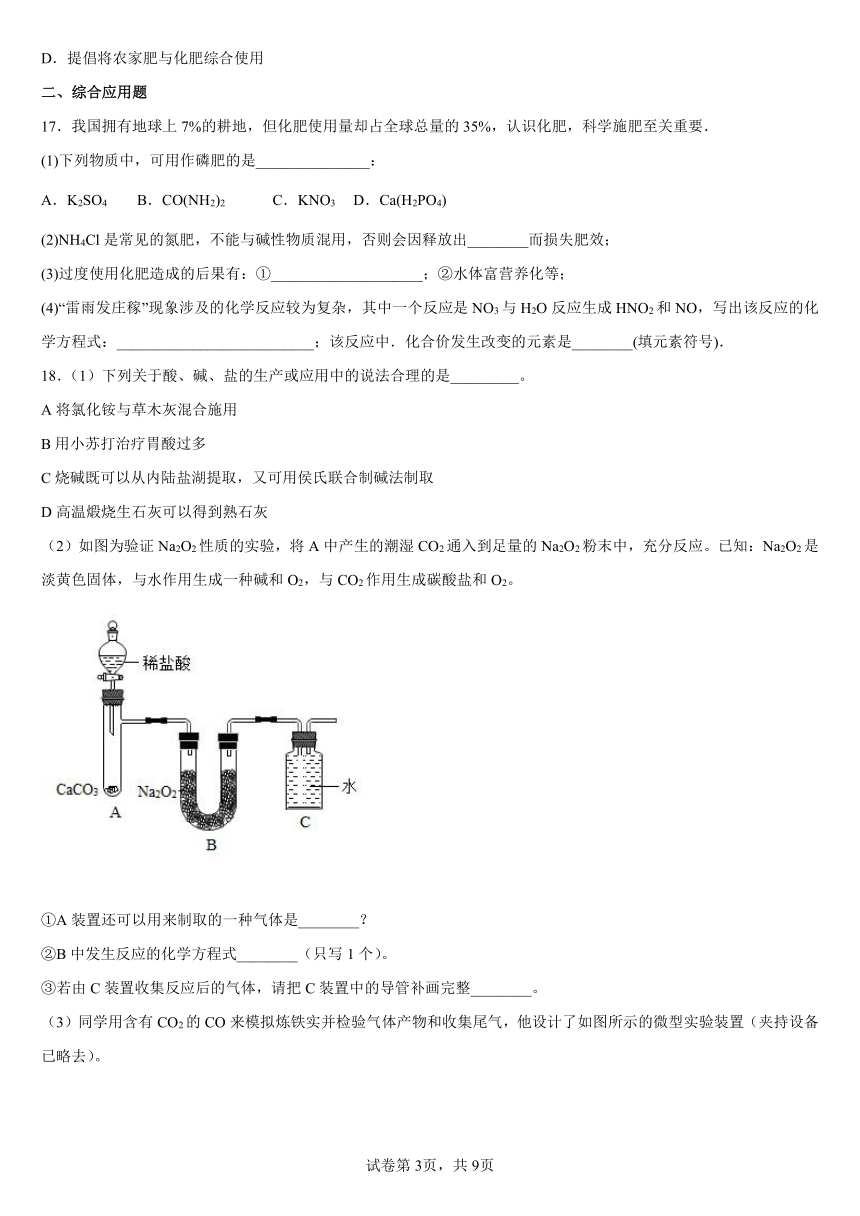
(2)如图为验证Na2O2性质的实验,将A中产生的潮湿CO2通入到足量的Na2O2粉末中,充分反应。已知:Na2O2是淡黄色固体,与水作用生成一种碱和O2,与CO2作用生成碳酸盐和O2。
①A装置还可以用来制取的一种气体是________?
②B中发生反应的化学方程式________(只写1个)。
③若由C装置收集反应后的气体,请把C装置中的导管补画完整________。
(3)同学用含有CO2的CO来模拟炼铁实并检验气体产物和收集尾气,他设计了如图所示的微型实验装置(夹持设备已略去)。
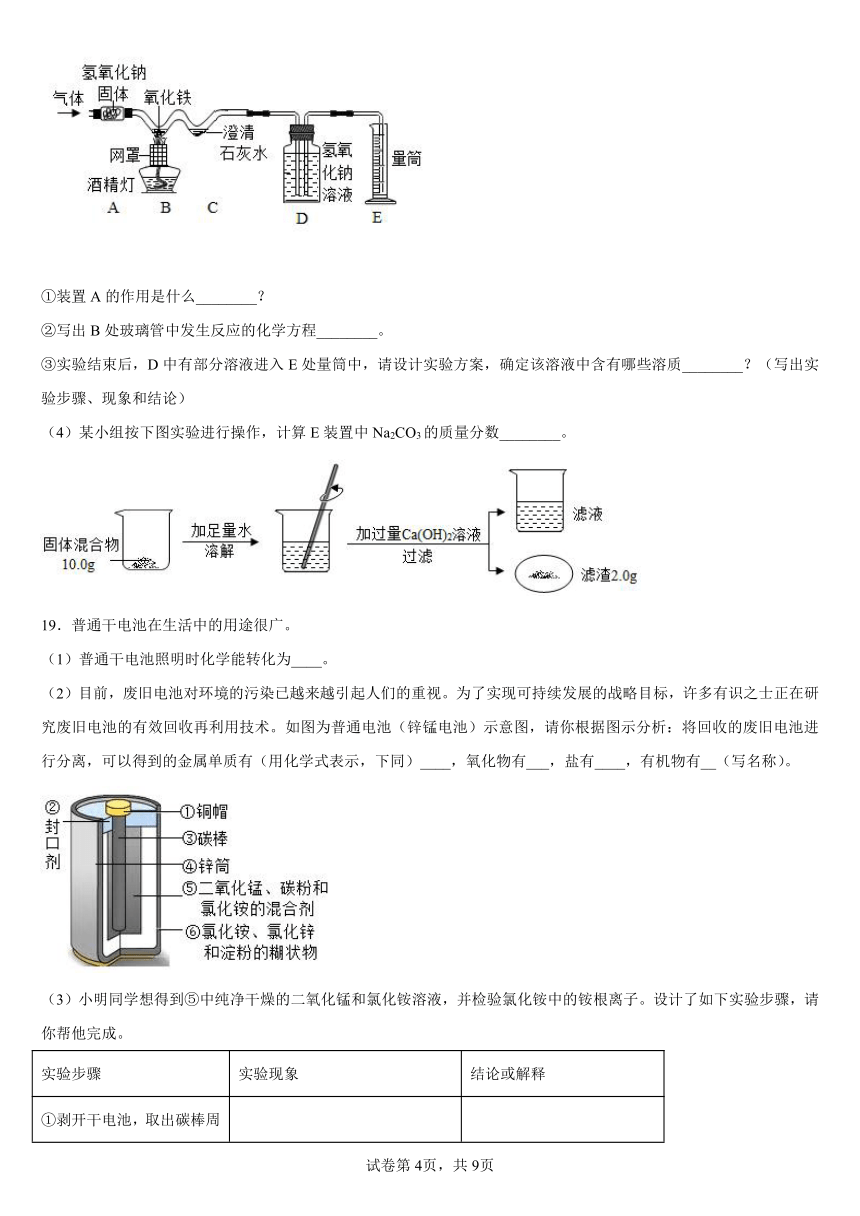
①装置A的作用是什么________?
②写出B处玻璃管中发生反应的化学方程________。
③实验结束后,D中有部分溶液进入E处量筒中,请设计实验方案,确定该溶液中含有哪些溶质________?(写出实验步骤、现象和结论)
(4)某小组按下图实验进行操作,计算E装置中Na2CO3的质量分数________。
19.普通干电池在生活中的用途很广。
(1)普通干电池照明时化学能转化为____。
(2)目前,废旧电池对环境的污染已越来越引起人们的重视。为了实现可持续发展的战略目标,许多有识之士正在研究废旧电池的有效回收再利用技术。如图为普通电池(锌锰电池)示意图,请你根据图示分析:将回收的废旧电池进行分离,可以得到的金属单质有(用化学式表示,下同)____,氧化物有___,盐有____,有机物有__(写名称)。
(3)小明同学想得到⑤中纯净干燥的二氧化锰和氯化铵溶液,并检验氯化铵中的铵根离子。设计了如下实验步骤,请你帮他完成。
实验步骤 实验现象 结论或解释
①剥开干电池,取出碳棒周围的黑色粉末
②溶解、___(填操作名称)、洗涤 得到黑色粉末和无色澄清液体 黑色粉末的成分为__。
③对黑色粉末进行__ 得到纯净的MnO2固体
④检验第②步中得到的无色澄清液体中是否含铵根离子的方法是:_____ _____ 化学方程式为:______
(4)对分离回收的铜帽净化处理,放入硝酸银溶液中,一段时间以后,可观察到的现象是__,反应的化学方程式是_____,其基本反应类型为___反应。
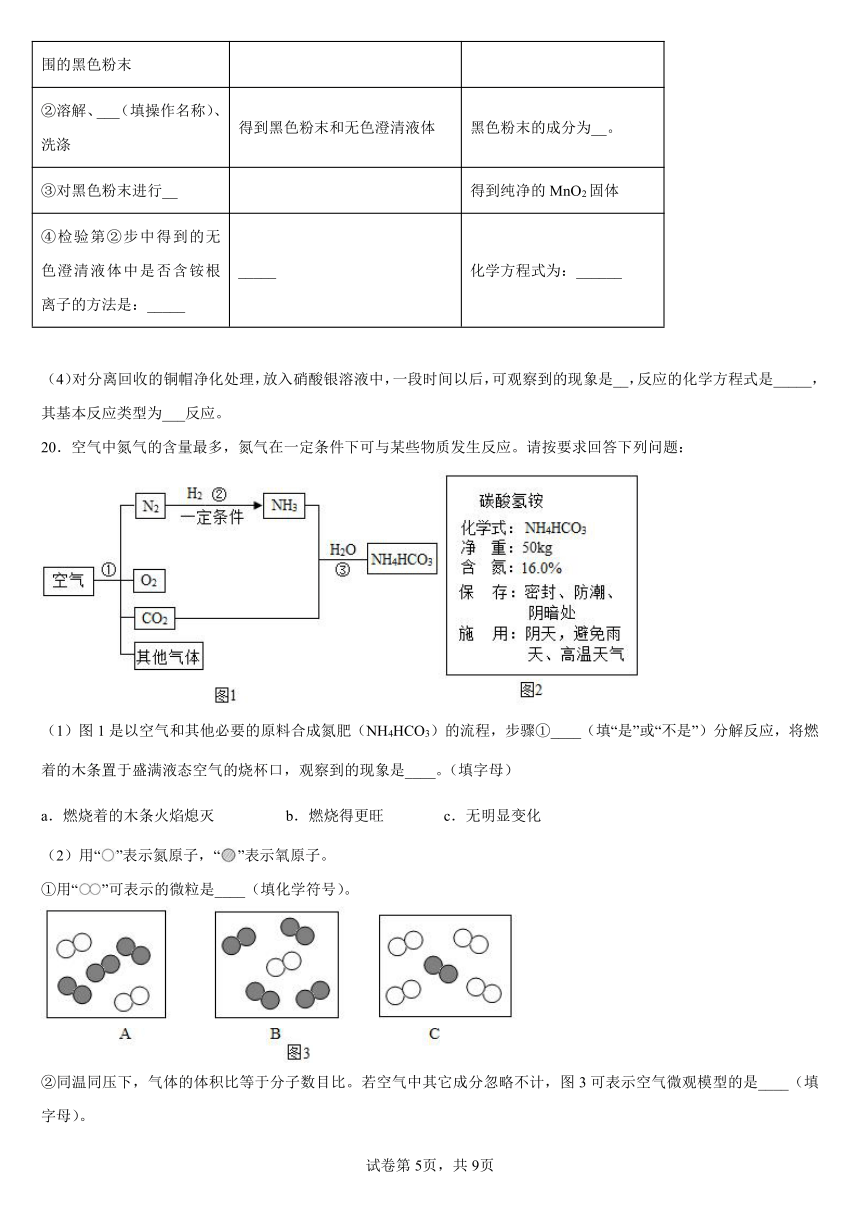
20.空气中氮气的含量最多,氮气在一定条件下可与某些物质发生反应。请按要求回答下列问题:
(1)图1是以空气和其他必要的原料合成氮肥(NH4HCO3)的流程,步骤①____(填“是”或“不是”)分解反应,将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是____。(填字母)
a.燃烧着的木条火焰熄灭 b.燃烧得更旺 c.无明显变化
(2)用“”表示氮原子,“”表示氧原子。
①用“”可表示的微粒是____(填化学符号)。
②同温同压下,气体的体积比等于分子数目比。若空气中其它成分忽略不计,图3可表示空气微观模型的是____(填字母)。
(3)图2是化肥NH4HCO3上的标签,从标签上看碳酸氢铵具有的化学性质是____(填字母)。
a.易溶于水 b.有挥发性 c.受热易分解
(4)这种化肥是纯净物吗?含氮量是否达到16%?
【资料】碱石灰能够吸收水和CO2,但是不吸收NH3,NH3极易溶于水。
【性质探究】某同学设计了如下的实验装置:
①用A装置给碳酸氢铵加热,装药品前,必须进行的一步操作是____。
②取适量碳酸氢铵加入试管,连接A、C、D装置,加热,D中的现象是无色酚酞变成____色,仪器E的作用是____。
③连接A、B装置,继续加热,观察到试管口的现象是_____,B中的现象是_____。
④碳酸氢铵在受热时发生的化学符号表达式是____。
【含量分析】
⑤结合标签中的信息,通过计算说明标签上的化肥是____(填“纯净物”或 “混合物”)。
⑥在A中加入20g 这种NH4HCO3化肥样品,加热至固体完全消失。得知:反应中产生NH3的质量为3.4g。(假设NH3中氮元素全部来自于碳酸氢铵,而且杂质中不含氮元素)计算此化肥中碳酸氢铵的质量分数是____。
21.酸、碱、盐在生产生活中应用广泛
(1)下列物质露置在空气中一段时间后,会因变质而使溶液质量减小的是____
A 食盐水
B 浓H2SO4
C 烧碱溶液
D 石灰水
(2)硫酸铵与熟石灰混合施用会降低肥效,有关反应方程式为____。
(3)某化学小组利用pH传感器,测得氢氧化钠溶液和稀硫酸反应过程中溶液pH随氢氧化钠溶液体积变化的关系如图所示。
①写出该过程中发生反应的化学方程式_____________。
②若改用溶质质量分数相同的氢氧化钙溶液进行该实验,pH曲线可能经过__(填“a”“b”或“c”)。
(4)为了探究NaOH样品中是否有在NaC1、Na2CO3杂质,某同学设计了如下实验方案:
①乙中有无色无味气体产生,证明样品中含有Na2CO3,该反应方程式为____________。
②滴加AgNO3溶液后丙中的现象是____________。
③该同学通过实验得出了NaOH样品中含有NaC1和Na2CO3,请分析他的结论是否正确并说明原因:____________。
(5)22.33gBaC12溶液与30g稀H2SO4刚好完全反应,过滤得到50g滤液,则滤液中溶质质量分数____。
22.K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。某研究性小组对K2SO4和Mn3O4的制备展开了系列研究。
(一)以硫酸工业的尾气SO2制备K2SO4的工艺流程如下:
⑴钾肥K2SO4对农作物生长的作用是___________。
A.促进植物茎、叶生长,使叶色浓绿;
B.增强植物的抗寒、抗旱能力
C.增强植物的抗病虫害、抗倒伏能力
⑵反应釜I中发生的反应包括:①碳酸钙高温分解的化学方程式为________;
②CaO + SO2==CaSO3③ 2CaSO3+O2==2CaSO4
⑶反应釜III:向反应II 所得(NH4)2SO4溶液中加入KCl溶液充分反应后,经蒸发浓缩、过滤 、洗涤、干燥等操作即可制得K2SO4产品。为提高K2SO4产品纯度,过滤时应控制反应液的温度范围为____________(填字母序号,如图为几种盐的溶解度曲线)。
A.0℃-10℃ B.20℃-30℃ C.60℃-65℃ D.80℃-90℃
⑷上述工艺流程中循环利用的物质是_______;证明产品K2SO4中不含杂质的实验方法是_______写出方法、现象)。
(二)实验室以SO2气体为原料制备少量高纯Mn3O4的操作步骤如下:
【步骤I】制备MnSO4溶液:在三颈烧瓶中(装置见图) 加入一定量MnO2和水,先通氮气,再通入SO2和N2混合气体,搅拌反应3小时。停止通SO2,继续反应片刻后过滤得MnSO4溶液。
[资料1]亚硫酸(H2SO3)在Mn2+催化作用下被O2氧化为硫酸,硫酸与MnO2在常温下不易发生反应。
⑸烧杯中石灰乳(有效成分为氢氧化钙)的作用为________。
⑹三颈烧瓶中生成MnSO4的反应化学方程式为____________。
⑺步骤I中,先通入氮气的目的是_________。为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有:及时搅拌反应液、_______(任写1条)。
【步骤II】制备MnSO4 H2O晶体:利用硫酸锰的溶解度在100℃以上随温度升高而急剧降低的原理,采用压力釜升温加压结晶法后过滤、洗涤、低温干燥得纯净的MnSO4 H2O晶体。
【步骤III】制备Mn3O4固体:准确称取101.4mg MnSO4 H2O,将MnSO4 H2O晶体在空气中高温煅烧,下图是用热重分析仪测定煅烧时温度与剩余固体质量变化曲线。
[资料2] MnSO4在空气中高温煅烧生成Mn3O4和三氧化硫,当温度超过1000℃时,Mn3O4又被氧气氧化为Mn2O3或MnO2
⑻该曲线中A段所表示物质的化学式为___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.C
3.D
4.A
5.B
6.D
7.B
8.D
9.D
10.C
11.D
12.D
13.C
14.B
15.B
16.A
17. D 氨气(或NH3) 土壤污染(或大气污染,土壤退化等) 3NO2+H2O=== 2HNO3+NO N
18. B H2 吸收二氧化碳气体 取少量溶液于试管中,滴加足量氯化钡(或氯化钙)溶液,静置,再向上层清液中滴加酚酞溶液,若无沉淀产生,溶液变红,说明溶质为氢氧化钠;若有白色沉淀产生,溶液变红,说明溶质为碳酸钠和氢氧化钠;若有白色沉淀产生,溶液不变红,说明溶质为碳酸钠 21.2%
19. 电能 Cu、Zn MnO2 NH4Cl、ZnCl2 淀粉 过滤 二氧化锰和炭粉 灼烧(或暴露在空气中加强热) 取样于试管中,加入氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口 产生强烈刺激性气味气体,湿润的红色石蕊试纸变蓝色 NH4Cl+NaOHNaCl+H2O+NH3↑ 铜表面有银白色固体析出,溶液由无色变为蓝色 Cu+2AgNO3=2Ag+Cu(NO3)2 置换
20. 不是 a N2 C c 检查装置的气密性 红 防倒吸 产生小水珠 石灰水变浑浊 NH4HCO3 NH3+ H2O+ CO2 混合物 79%
21. D a 有白色沉淀产生 不正确;因为加入稀盐酸引入C1-,无法证明NaCl的存在(合理即可) 1.46%
22. C CaCO3CaO+CO2↑ D CaCO3 取少量样品,加水配成溶液,先滴加足量Ba(NO3)2溶液,取上层清液滴加AgNO3溶液,若无沉淀生成,说明K2SO4中不含杂质。 吸收二氧化硫气体,防止空气污染 MnO2+SO2===MnSO4 排尽装置内的空气,防止SO2气体被氧化为硫酸,导致转化率降低。 微热提高温度 MnSO4
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列有关化肥或农药的叙述错误的是( )
A.硫酸铵属于复合肥料,所含的营养元素是氮和硫
B.氯化铵和磷矿粉从外观即可区分
C.农药施用后,会通过农作物、农产品等发生转移
D.化肥和农药施用不当,会对环境造成污染
2.氮肥能促进植物的枝叶繁茂,叶色浓绿。下列属于氮肥的是
A.KH2PO4 B.K2SO4 C.NH4NO3 D.Ca3(PO4)2
3.下列关于化肥的说法正确的是
A.过磷酸钙[Ca(H2PO4)2和CaSO4的混合物]属于氮肥
B.凡施用过化肥的蔬菜都会危害健康
C.硫酸钾与熟石灰混合、研磨,能闻到刺激性的气味
D.合理施用化肥能提高农作物的产量
4.下列肥料中含营养元素种类最少的是
A.KCl B.(NH4)2HPO4 C.NH4H2PO4 D.KNO3
5.农作物种植过程中可以施用下列化肥,其中属于复合肥的是
A.NH4NO3 B.KNO3 C.Ca(H2PO4)2 D.CO(NH2)2
6.如图是某菜农使用化肥包装袋上的部分说明,该化肥属于
A.氮肥
B.磷肥
C.钾肥
D.复合肥料
7.下列叙述正确的是( )
A.溶液是均一、稳定的含水混合物
B.合金中可以不含非金属元素
C.CO和CO2是元素组成不同的碳的氧化物
D.(NH4)2SO4属于由两种原子团构成的复合肥料
8.2013年“世界水日”的宣传主题是“水合作”。下列有关水的说法中不正确的是
A.水是一种氧化物
B.鉴别软水和硬水可以用肥皂水
C.农药、化肥的不合理施用,会造成水体污染
D.自然界中的水经过沉淀、过滤、吸附后即可得到纯水
9.某同学家中种植的植物比正常的植株矮小瘦弱,叶片发黄,你认为应该施加下列哪一种化肥
A.氯化钾 B.过磷酸钙 C.硫酸钾 D.尿素
10.小明家的甘蔗茎杆细弱,需要追施钾肥,应选择( )
A.KOH B.Ca3(PO4)2 C.K2CO3 D.CO(NH2)2
11.碳酸氢铵是白色固体,在生产生活中应用广泛。它稍微受热就能快速分解: 。下列有关叙述错误的是
A.碳酸氢铵要密封保存在阴凉干燥处
B.加热碳酸氢铵时,白色固体会逐渐消失
C.食品工业上常用碳酸氢铵作膨松剂
D.碳酸氢铵与草木灰混合施用能提高肥效
12.小美发现荔枝园旁边的水稻叶子发黄,并倒下了一片,你认为应该向稻田施用的复合肥是( )
A.CO(NH2)2 B.KCl C.Ca3(PO4)2 D.KNO3
13.农作物生长需要含较多氮、磷、钾元素的化肥,下列化肥属于含磷复合肥料的是
A.NH4NO3 B.Ca(H2PO4)2 C.(NH4)2HPO4 D.KNO3
14.下列说法正确的是
A.NaHCO3俗称苏打
B.CaCO3可用作补钙剂
C.Na2CO3俗称火碱
D.K2CO3属于复合肥
15.公园里部分植物的枝叶枯黄,茎也比较纤细。建议工作人员最好给这些植物施用的一种化肥是
A.NH4HCO3 B.KNO3 C.Ca(H2PO4)2 D.(NH4)3PO4
16.合理使用化肥,有利于农作物的生长和减少环境污染。下列有关化肥的说法不正确的是
A.为保证高产尽量多施用化肥
B.不能将氯化铵与碱性物质混合施用
C.KNO3是一种常用的复合肥料
D.提倡将农家肥与化肥综合使用
二、综合应用题
17.我国拥有地球上7%的耕地,但化肥使用量却占全球总量的35%,认识化肥,科学施肥至关重要.
(1)下列物质中,可用作磷肥的是_______________:
A.K2SO4 B.CO(NH2)2 C.KNO3 D.Ca(H2PO4)
(2)NH4Cl是常见的氮肥,不能与碱性物质混用,否则会因释放出________而损失肥效;
(3)过度使用化肥造成的后果有:①____________________;②水体富营养化等;
(4)“雷雨发庄稼”现象涉及的化学反应较为复杂,其中一个反应是NO3与H2O反应生成HNO2和NO,写出该反应的化学方程式:__________________________;该反应中.化合价发生改变的元素是________(填元素符号).
18.(1)下列关于酸、碱、盐的生产或应用中的说法合理的是_________。
A将氯化铵与草木灰混合施用
B用小苏打治疗胃酸过多
C烧碱既可以从内陆盐湖提取,又可用侯氏联合制碱法制取
D高温煅烧生石灰可以得到熟石灰
(2)如图为验证Na2O2性质的实验,将A中产生的潮湿CO2通入到足量的Na2O2粉末中,充分反应。已知:Na2O2是淡黄色固体,与水作用生成一种碱和O2,与CO2作用生成碳酸盐和O2。
①A装置还可以用来制取的一种气体是________?
②B中发生反应的化学方程式________(只写1个)。
③若由C装置收集反应后的气体,请把C装置中的导管补画完整________。
(3)同学用含有CO2的CO来模拟炼铁实并检验气体产物和收集尾气,他设计了如图所示的微型实验装置(夹持设备已略去)。
①装置A的作用是什么________?
②写出B处玻璃管中发生反应的化学方程________。
③实验结束后,D中有部分溶液进入E处量筒中,请设计实验方案,确定该溶液中含有哪些溶质________?(写出实验步骤、现象和结论)
(4)某小组按下图实验进行操作,计算E装置中Na2CO3的质量分数________。
19.普通干电池在生活中的用途很广。
(1)普通干电池照明时化学能转化为____。
(2)目前,废旧电池对环境的污染已越来越引起人们的重视。为了实现可持续发展的战略目标,许多有识之士正在研究废旧电池的有效回收再利用技术。如图为普通电池(锌锰电池)示意图,请你根据图示分析:将回收的废旧电池进行分离,可以得到的金属单质有(用化学式表示,下同)____,氧化物有___,盐有____,有机物有__(写名称)。
(3)小明同学想得到⑤中纯净干燥的二氧化锰和氯化铵溶液,并检验氯化铵中的铵根离子。设计了如下实验步骤,请你帮他完成。
实验步骤 实验现象 结论或解释
①剥开干电池,取出碳棒周围的黑色粉末
②溶解、___(填操作名称)、洗涤 得到黑色粉末和无色澄清液体 黑色粉末的成分为__。
③对黑色粉末进行__ 得到纯净的MnO2固体
④检验第②步中得到的无色澄清液体中是否含铵根离子的方法是:_____ _____ 化学方程式为:______
(4)对分离回收的铜帽净化处理,放入硝酸银溶液中,一段时间以后,可观察到的现象是__,反应的化学方程式是_____,其基本反应类型为___反应。
20.空气中氮气的含量最多,氮气在一定条件下可与某些物质发生反应。请按要求回答下列问题:
(1)图1是以空气和其他必要的原料合成氮肥(NH4HCO3)的流程,步骤①____(填“是”或“不是”)分解反应,将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是____。(填字母)
a.燃烧着的木条火焰熄灭 b.燃烧得更旺 c.无明显变化
(2)用“”表示氮原子,“”表示氧原子。
①用“”可表示的微粒是____(填化学符号)。
②同温同压下,气体的体积比等于分子数目比。若空气中其它成分忽略不计,图3可表示空气微观模型的是____(填字母)。
(3)图2是化肥NH4HCO3上的标签,从标签上看碳酸氢铵具有的化学性质是____(填字母)。
a.易溶于水 b.有挥发性 c.受热易分解
(4)这种化肥是纯净物吗?含氮量是否达到16%?
【资料】碱石灰能够吸收水和CO2,但是不吸收NH3,NH3极易溶于水。
【性质探究】某同学设计了如下的实验装置:
①用A装置给碳酸氢铵加热,装药品前,必须进行的一步操作是____。
②取适量碳酸氢铵加入试管,连接A、C、D装置,加热,D中的现象是无色酚酞变成____色,仪器E的作用是____。
③连接A、B装置,继续加热,观察到试管口的现象是_____,B中的现象是_____。
④碳酸氢铵在受热时发生的化学符号表达式是____。
【含量分析】
⑤结合标签中的信息,通过计算说明标签上的化肥是____(填“纯净物”或 “混合物”)。
⑥在A中加入20g 这种NH4HCO3化肥样品,加热至固体完全消失。得知:反应中产生NH3的质量为3.4g。(假设NH3中氮元素全部来自于碳酸氢铵,而且杂质中不含氮元素)计算此化肥中碳酸氢铵的质量分数是____。
21.酸、碱、盐在生产生活中应用广泛
(1)下列物质露置在空气中一段时间后,会因变质而使溶液质量减小的是____
A 食盐水
B 浓H2SO4
C 烧碱溶液
D 石灰水
(2)硫酸铵与熟石灰混合施用会降低肥效,有关反应方程式为____。
(3)某化学小组利用pH传感器,测得氢氧化钠溶液和稀硫酸反应过程中溶液pH随氢氧化钠溶液体积变化的关系如图所示。
①写出该过程中发生反应的化学方程式_____________。
②若改用溶质质量分数相同的氢氧化钙溶液进行该实验,pH曲线可能经过__(填“a”“b”或“c”)。
(4)为了探究NaOH样品中是否有在NaC1、Na2CO3杂质,某同学设计了如下实验方案:
①乙中有无色无味气体产生,证明样品中含有Na2CO3,该反应方程式为____________。
②滴加AgNO3溶液后丙中的现象是____________。
③该同学通过实验得出了NaOH样品中含有NaC1和Na2CO3,请分析他的结论是否正确并说明原因:____________。
(5)22.33gBaC12溶液与30g稀H2SO4刚好完全反应,过滤得到50g滤液,则滤液中溶质质量分数____。
22.K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。某研究性小组对K2SO4和Mn3O4的制备展开了系列研究。
(一)以硫酸工业的尾气SO2制备K2SO4的工艺流程如下:
⑴钾肥K2SO4对农作物生长的作用是___________。
A.促进植物茎、叶生长,使叶色浓绿;
B.增强植物的抗寒、抗旱能力
C.增强植物的抗病虫害、抗倒伏能力
⑵反应釜I中发生的反应包括:①碳酸钙高温分解的化学方程式为________;
②CaO + SO2==CaSO3③ 2CaSO3+O2==2CaSO4
⑶反应釜III:向反应II 所得(NH4)2SO4溶液中加入KCl溶液充分反应后,经蒸发浓缩、过滤 、洗涤、干燥等操作即可制得K2SO4产品。为提高K2SO4产品纯度,过滤时应控制反应液的温度范围为____________(填字母序号,如图为几种盐的溶解度曲线)。
A.0℃-10℃ B.20℃-30℃ C.60℃-65℃ D.80℃-90℃
⑷上述工艺流程中循环利用的物质是_______;证明产品K2SO4中不含杂质的实验方法是_______写出方法、现象)。
(二)实验室以SO2气体为原料制备少量高纯Mn3O4的操作步骤如下:
【步骤I】制备MnSO4溶液:在三颈烧瓶中(装置见图) 加入一定量MnO2和水,先通氮气,再通入SO2和N2混合气体,搅拌反应3小时。停止通SO2,继续反应片刻后过滤得MnSO4溶液。
[资料1]亚硫酸(H2SO3)在Mn2+催化作用下被O2氧化为硫酸,硫酸与MnO2在常温下不易发生反应。
⑸烧杯中石灰乳(有效成分为氢氧化钙)的作用为________。
⑹三颈烧瓶中生成MnSO4的反应化学方程式为____________。
⑺步骤I中,先通入氮气的目的是_________。为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有:及时搅拌反应液、_______(任写1条)。
【步骤II】制备MnSO4 H2O晶体:利用硫酸锰的溶解度在100℃以上随温度升高而急剧降低的原理,采用压力釜升温加压结晶法后过滤、洗涤、低温干燥得纯净的MnSO4 H2O晶体。
【步骤III】制备Mn3O4固体:准确称取101.4mg MnSO4 H2O,将MnSO4 H2O晶体在空气中高温煅烧,下图是用热重分析仪测定煅烧时温度与剩余固体质量变化曲线。
[资料2] MnSO4在空气中高温煅烧生成Mn3O4和三氧化硫,当温度超过1000℃时,Mn3O4又被氧气氧化为Mn2O3或MnO2
⑻该曲线中A段所表示物质的化学式为___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.C
3.D
4.A
5.B
6.D
7.B
8.D
9.D
10.C
11.D
12.D
13.C
14.B
15.B
16.A
17. D 氨气(或NH3) 土壤污染(或大气污染,土壤退化等) 3NO2+H2O=== 2HNO3+NO N
18. B H2 吸收二氧化碳气体 取少量溶液于试管中,滴加足量氯化钡(或氯化钙)溶液,静置,再向上层清液中滴加酚酞溶液,若无沉淀产生,溶液变红,说明溶质为氢氧化钠;若有白色沉淀产生,溶液变红,说明溶质为碳酸钠和氢氧化钠;若有白色沉淀产生,溶液不变红,说明溶质为碳酸钠 21.2%
19. 电能 Cu、Zn MnO2 NH4Cl、ZnCl2 淀粉 过滤 二氧化锰和炭粉 灼烧(或暴露在空气中加强热) 取样于试管中,加入氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口 产生强烈刺激性气味气体,湿润的红色石蕊试纸变蓝色 NH4Cl+NaOHNaCl+H2O+NH3↑ 铜表面有银白色固体析出,溶液由无色变为蓝色 Cu+2AgNO3=2Ag+Cu(NO3)2 置换
20. 不是 a N2 C c 检查装置的气密性 红 防倒吸 产生小水珠 石灰水变浑浊 NH4HCO3 NH3+ H2O+ CO2 混合物 79%
21. D a 有白色沉淀产生 不正确;因为加入稀盐酸引入C1-,无法证明NaCl的存在(合理即可) 1.46%
22. C CaCO3CaO+CO2↑ D CaCO3 取少量样品,加水配成溶液,先滴加足量Ba(NO3)2溶液,取上层清液滴加AgNO3溶液,若无沉淀生成,说明K2SO4中不含杂质。 吸收二氧化硫气体,防止空气污染 MnO2+SO2===MnSO4 排尽装置内的空气,防止SO2气体被氧化为硫酸,导致转化率降低。 微热提高温度 MnSO4
答案第1页,共2页
答案第1页,共2页
