专题8 金属和金属材料练习题-2021-2022学年九年级化学仁爱版下册(word版 含答案)
文档属性
| 名称 | 专题8 金属和金属材料练习题-2021-2022学年九年级化学仁爱版下册(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 193.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-28 15:09:56 | ||
图片预览


文档简介
专题8《金属和金属材料》练习题-2021-2022学年九年级化学仁爱版下册
一、单选题
1.有X、Y、Z三种金属,将X、Y分别浸入稀盐酸中,X溶解,Y不溶解,再将Y浸入Z的化合物溶液中,Y的表面有金属Z析出,则三种金属活动性由强到弱的顺序为
A.Z、Y、X
B.X、Y、Z
C.Y、X、Z
D.X、Z、Y
2.金属、金属材料的性质在很大程度上决定了它们的用途。下列说法中不正确的是
A.不锈钢抗腐蚀性好,常用于制造医疗器械
B.铁具有良好的导热性,可以用于制造炊具
C.铝合金轻而坚韧,可作为汽车、飞机和火箭的制作材料
D.钛合金的熔点低、密度大,常用作导弹和通讯设备的制作材料
3.下列有关金属资源的利用与防护解释不合理的是
A.在001A型国产航母金属外壳覆盖涂料,主要是为了美观
B.用“烤蓝”的方法处理钢铁表面,可减缓钢铁的腐蚀
C.用铝合金制造国产大飞机C919机壳,是利用铝合金强度大、质量轻、抗腐蚀
D.切菜后的菜刀用清水洗净擦干,可减缓菜刀生锈
4.下列关于合金的说法正确的是
A.合金不属于金属材料
B.合金的硬度一般比各成分金属大
C.合金属于金属单质
D.多数合金的熔点高于组成它的成分金属
5.物质的性质决定物质的用途,下列因果关系不成立的是
A.因为磷燃烧能产生白烟,所以可用于制烟幕弹
B.因为金属钨的熔点高,所以被用来制造灯泡中的灯丝
C.因为稀有气体的化学性质不活泼,所以无用途
D.因为酒精具有可燃性,所以可用作燃料
6.将一定质量的铁粉加至H2SO4、MgSO4和CuSO4的混和溶液中,充分反应后过滤,得到滤液M和滤渣N,下列有关说法中,不合理的是
A.滤液M中一定存在Fe2+
B.滤渣N的质量一定小于加入铁粉的质量
C.滤渣N中一定没有单质镁
D.滤液M中至少含有两种金属阳离子
7.下列各组物质间能发生化学反应的是
A.银和稀盐酸 B.铁和硫酸锌溶液
C.硝酸钾溶液和食盐水 D.硫酸和氯化钡溶液
8.将适量的铜粉和镁粉的混合物放入一定量的硝酸银溶液中,充分反应后过滤,得到固体物质和无色滤液,则关于滤出的固体和无色滤液的下列判断正确的是
A.滤出的固体中一定含有银和铜,一定不含镁
B.滤出的固体中一定含有银,可能含有铜和镁
C.滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜
D.滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜
9.学习金属单元后,我们知道Zn、Fe、Cu三种金属的活动性顺序为:Zn>Fe>Cu。为验证这一结论,下面实验设计合理的是
A.将Zn、Cu两金属片分别放入稀盐酸中
B.将Fe、Cu两金属片分别放入稀盐酸中
C.将Zn、Fe两金属片分别放入CuCl2溶液中
D.将Zn、Cu两金属片分别放入FeCl2溶液中
10.下列实验操作能达到实验目的的是
选项 实验目的 实验操作
A 分离KCl和MnO2的固体混合物 加足量的水溶解,过滤
B 鉴别NaNO3和NH4HCO3两种氮肥 取样,闻气味
C 除去CO中的CO2 将混合气体通过红热的铜网
D 探究铁钉生锈的条件 将两根铁钉分别密封在盛有干燥空气和盛满水的试管中一周并观察现象
A.A B.B C.C D.D
二、简答题
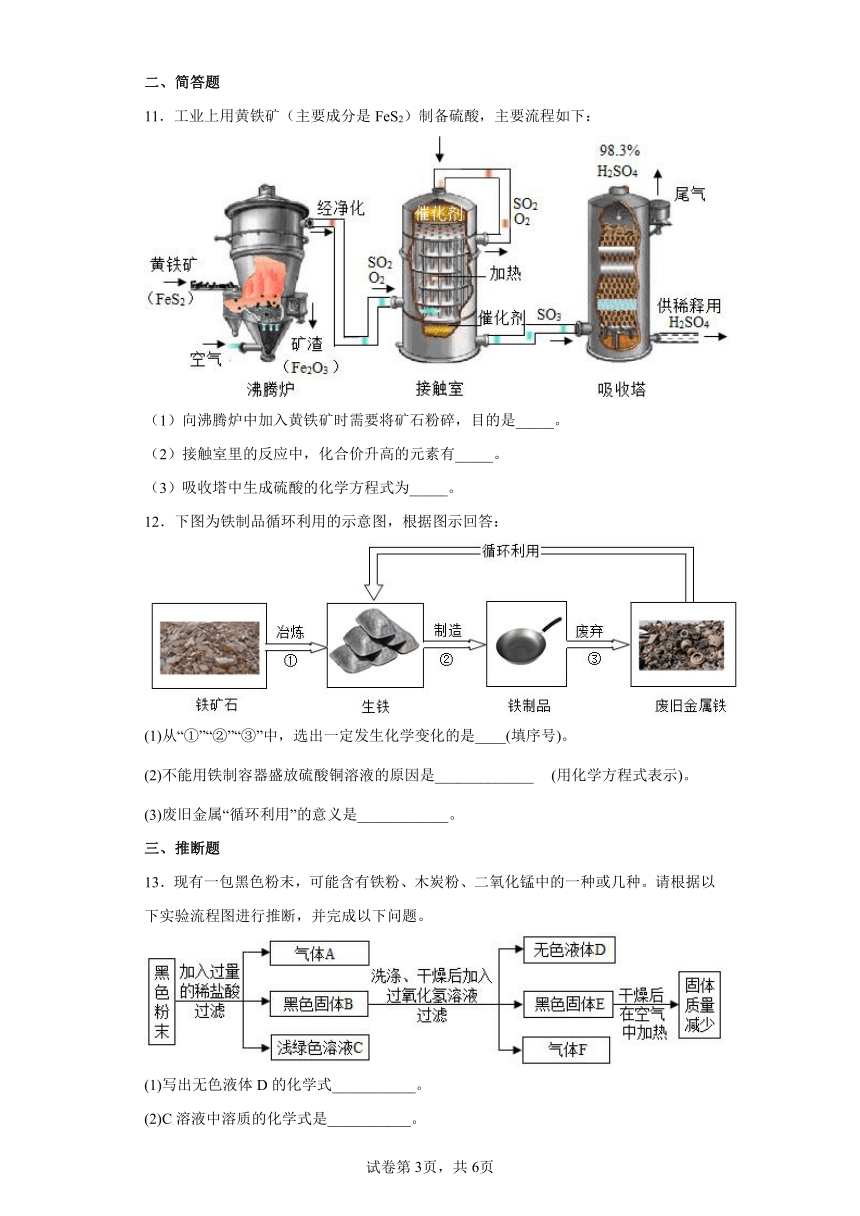
11.工业上用黄铁矿(主要成分是FeS2)制备硫酸,主要流程如下:
(1)向沸腾炉中加入黄铁矿时需要将矿石粉碎,目的是_____。
(2)接触室里的反应中,化合价升高的元素有_____。
(3)吸收塔中生成硫酸的化学方程式为_____。
12.下图为铁制品循环利用的示意图,根据图示回答:
(1)从“①”“②”“③”中,选出一定发生化学变化的是____(填序号)。
(2)不能用铁制容器盛放硫酸铜溶液的原因是_____________ (用化学方程式表示)。
(3)废旧金属“循环利用”的意义是____________。
三、推断题
13.现有一包黑色粉末,可能含有铁粉、木炭粉、二氧化锰中的一种或几种。请根据以下实验流程图进行推断,并完成以下问题。
(1)写出无色液体D的化学式___________。
(2)C溶液中溶质的化学式是___________。
(3)气体F是__________,它的检验方法是___________。
(4)这包黑色粉末的成分是__________。
14.A是地壳中含量最多的金属元素,A能和空气中的B反应生成一层致密的薄膜C,把A单质放在稀硫酸当中产生气体D,A单质与氯化铜溶液反应生成红色金属E.
(1)写出B单质的化学式_____________;E的化学符号____________.
(2)写出有关化学方程式
A→C:___________________;
A→D_____________________;
A→E:___________________.
四、实验题
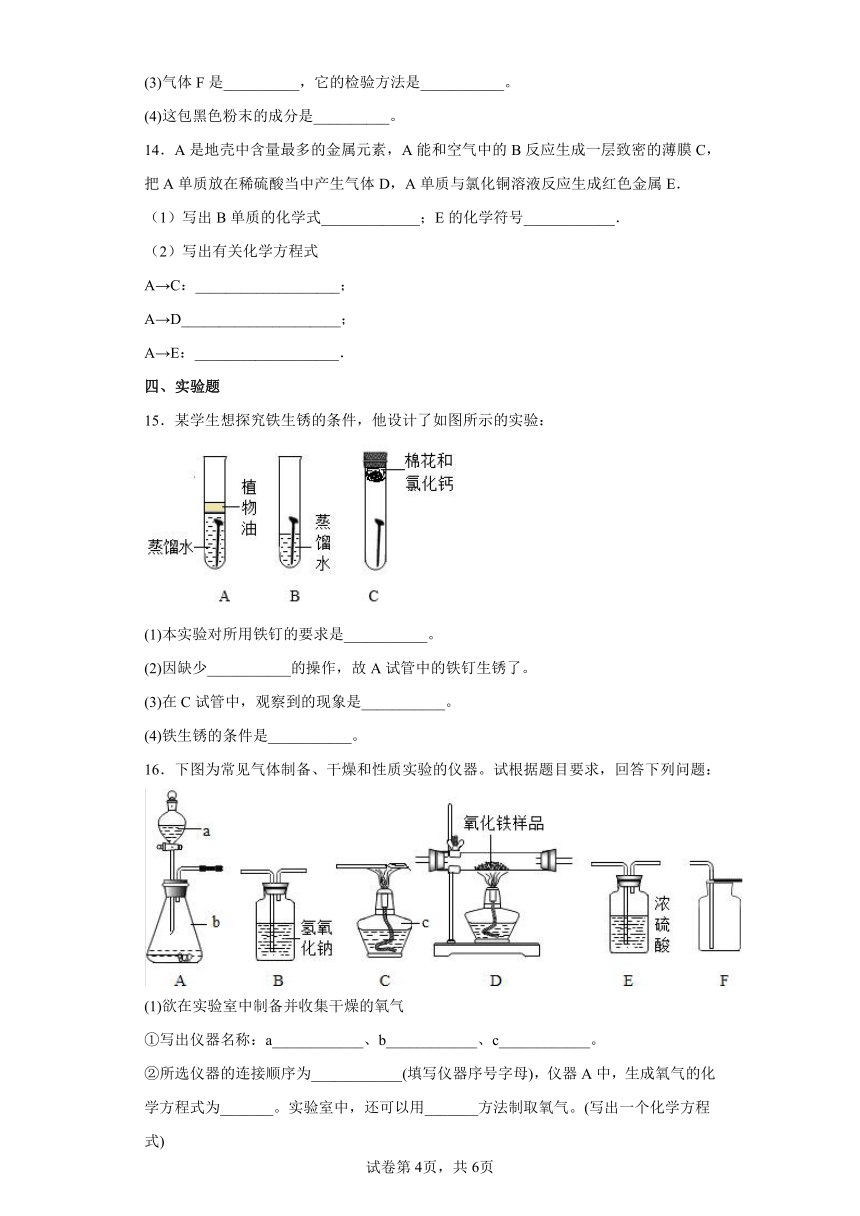
15.某学生想探究铁生锈的条件,他设计了如图所示的实验:
(1)本实验对所用铁钉的要求是___________。
(2)因缺少___________的操作,故A试管中的铁钉生锈了。
(3)在C试管中,观察到的现象是___________。
(4)铁生锈的条件是___________。
16.下图为常见气体制备、干燥和性质实验的仪器。试根据题目要求,回答下列问题:
(1)欲在实验室中制备并收集干燥的氧气
①写出仪器名称:a____________、b____________、c____________。
②所选仪器的连接顺序为____________(填写仪器序号字母),仪器A中,生成氧气的化学方程式为_______。实验室中,还可以用_______方法制取氧气。(写出一个化学方程式)
(2)欲用一氧化碳气体测定某不纯氧化铁样品的纯度(杂质不反应),所选仪器的连接顺序为一氧化碳→D→B→C。
①仪器D中发生反应的化学方程式为_______,仪器D大玻璃管内的反应现象为____________。
②仪器C的作用是________,发生反应的化学方程式为_______。
五、计算题
17.生铁和钢是两种不同的铁合金,生铁含碳量为2%~4.3%,钢含碳量为0.03%~2%,化学兴趣小组的同学为确定该铁合金是生铁还是钢,他们取11.5g铁合金样品放到锥形瓶中,将100g稀盐酸分成5等份,分5次加入锥形瓶,每次待充分反应后记录实验数据。实验数据整理如下表所示:
次数 加盐酸前 第1次 第2次 第3次 第4次 第5次
加入稀盐酸质量(g) 0 20 20 20 20 20
锥形瓶内物质的总质量(g) 11.5 31.4 m 71.2 91.1 111.1
【査阅资料】碳及其他杂质不与稀盐酸反应。
请回答下列问题:
(1)实验数据表中m的值为______。
(2)请通过计算确定该铁合金是生铁还是钢(写出计算过程,计算结果保留到0.1%)。
18.废旧金属的回收利用既能保护环境,又能节约资源和能源。某冶金厂回收了一批废黄铜屑,需测定其中铜元素的质量分数。现称取150.0g样品,加入足量稀硫酸,充分反应后得无色溶液,产生氢气的质量及剩余固体的质量与消耗稀硫酸的质量关系分别如图所示。(设该批次黄铜屑只含铜、锌和少量黄铜锈。黄铜锈与稀硫酸反应生成CuSO4、ZnSO4、CO2和H2O),请回答下列问题:
(1)完全反应时,样品消耗稀硫酸的质量为______g;
(2)样品中铜元素的质量分数为______%(计算结果精确到0.1%,下同);
(3)计算稀硫酸中溶质的质量分数(写出计算过程)。
19.工业上用赤铁矿石(主要成分是氧化铁)与一氧化碳在高温条件下冶炼生铁。现有800t含氧化铁80%的赤铁矿石。求:
(1)该赤铁矿石中氧化铁的质量。
(2)该赤铁矿石能冶炼出含杂质4%的生铁的质量。(计算结果精确到0.1)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.D
3.A
4.B
5.C
6.B
7.D
8.B
9.D
10.B
11. 增大矿石与空气的接触面积,使反应更充分 S H2O + SO3=H2SO4
12. ① Fe+CuSO4===FeSO4+Cu 节约金属资源,树立可持续发展的观念(或保护金属资源或节约能源或减少对环境的污染等)
13.(1)H2O
(2)FeCl2、HCl
(3) 氧气##O2 将带火星的木条伸入到试管内,若木条复燃,证明气体是氧气
(4)铁粉、二氧化锰、木炭粉
14. O2 Cu 4Al+3O2═2Al2O3 2Al+3H2SO4═Al2(SO4)3+3H2↑ 2Al+3CuCl2=2AlCl3+3Cu
15.(1)洁净光亮
(2)蒸馏水煮沸
(3)铁钉没有生锈
(4)与氧气和水接触
16.(1) 分液漏斗 锥形瓶 酒精灯 AEF
(2) 红色固体变为黑色 点燃未反应的CO ,防止污染空气
17.(1)51.3
(2)设该合金中铁的质量为x,
合金中碳的质量为:11.5g-11.2g=0.3g,合金中碳的质量分数为:
合金中碳的质量分数介于2%~4.3%之间,该铁合金属于生铁。
18.(1)267.0
(2)60.0%
(3)解:设稀硫酸中溶质的质量分数为x
x=30.0%
答:稀硫酸中溶质的质量分数为30.0%
19.(1)640t
(2)设可炼出生铁的质量为x,含杂质4%的生铁则含铁量=1﹣4%=96%。
解得:x≈466.7t
答:该赤铁矿石能冶炼出含杂质4%的生铁的质量是466.7t。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.有X、Y、Z三种金属,将X、Y分别浸入稀盐酸中,X溶解,Y不溶解,再将Y浸入Z的化合物溶液中,Y的表面有金属Z析出,则三种金属活动性由强到弱的顺序为
A.Z、Y、X
B.X、Y、Z
C.Y、X、Z
D.X、Z、Y
2.金属、金属材料的性质在很大程度上决定了它们的用途。下列说法中不正确的是
A.不锈钢抗腐蚀性好,常用于制造医疗器械
B.铁具有良好的导热性,可以用于制造炊具
C.铝合金轻而坚韧,可作为汽车、飞机和火箭的制作材料
D.钛合金的熔点低、密度大,常用作导弹和通讯设备的制作材料
3.下列有关金属资源的利用与防护解释不合理的是
A.在001A型国产航母金属外壳覆盖涂料,主要是为了美观
B.用“烤蓝”的方法处理钢铁表面,可减缓钢铁的腐蚀
C.用铝合金制造国产大飞机C919机壳,是利用铝合金强度大、质量轻、抗腐蚀
D.切菜后的菜刀用清水洗净擦干,可减缓菜刀生锈
4.下列关于合金的说法正确的是
A.合金不属于金属材料
B.合金的硬度一般比各成分金属大
C.合金属于金属单质
D.多数合金的熔点高于组成它的成分金属
5.物质的性质决定物质的用途,下列因果关系不成立的是
A.因为磷燃烧能产生白烟,所以可用于制烟幕弹
B.因为金属钨的熔点高,所以被用来制造灯泡中的灯丝
C.因为稀有气体的化学性质不活泼,所以无用途
D.因为酒精具有可燃性,所以可用作燃料
6.将一定质量的铁粉加至H2SO4、MgSO4和CuSO4的混和溶液中,充分反应后过滤,得到滤液M和滤渣N,下列有关说法中,不合理的是
A.滤液M中一定存在Fe2+
B.滤渣N的质量一定小于加入铁粉的质量
C.滤渣N中一定没有单质镁
D.滤液M中至少含有两种金属阳离子
7.下列各组物质间能发生化学反应的是
A.银和稀盐酸 B.铁和硫酸锌溶液
C.硝酸钾溶液和食盐水 D.硫酸和氯化钡溶液
8.将适量的铜粉和镁粉的混合物放入一定量的硝酸银溶液中,充分反应后过滤,得到固体物质和无色滤液,则关于滤出的固体和无色滤液的下列判断正确的是
A.滤出的固体中一定含有银和铜,一定不含镁
B.滤出的固体中一定含有银,可能含有铜和镁
C.滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜
D.滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜
9.学习金属单元后,我们知道Zn、Fe、Cu三种金属的活动性顺序为:Zn>Fe>Cu。为验证这一结论,下面实验设计合理的是
A.将Zn、Cu两金属片分别放入稀盐酸中
B.将Fe、Cu两金属片分别放入稀盐酸中
C.将Zn、Fe两金属片分别放入CuCl2溶液中
D.将Zn、Cu两金属片分别放入FeCl2溶液中
10.下列实验操作能达到实验目的的是
选项 实验目的 实验操作
A 分离KCl和MnO2的固体混合物 加足量的水溶解,过滤
B 鉴别NaNO3和NH4HCO3两种氮肥 取样,闻气味
C 除去CO中的CO2 将混合气体通过红热的铜网
D 探究铁钉生锈的条件 将两根铁钉分别密封在盛有干燥空气和盛满水的试管中一周并观察现象
A.A B.B C.C D.D
二、简答题
11.工业上用黄铁矿(主要成分是FeS2)制备硫酸,主要流程如下:
(1)向沸腾炉中加入黄铁矿时需要将矿石粉碎,目的是_____。
(2)接触室里的反应中,化合价升高的元素有_____。
(3)吸收塔中生成硫酸的化学方程式为_____。
12.下图为铁制品循环利用的示意图,根据图示回答:
(1)从“①”“②”“③”中,选出一定发生化学变化的是____(填序号)。
(2)不能用铁制容器盛放硫酸铜溶液的原因是_____________ (用化学方程式表示)。
(3)废旧金属“循环利用”的意义是____________。
三、推断题
13.现有一包黑色粉末,可能含有铁粉、木炭粉、二氧化锰中的一种或几种。请根据以下实验流程图进行推断,并完成以下问题。
(1)写出无色液体D的化学式___________。
(2)C溶液中溶质的化学式是___________。
(3)气体F是__________,它的检验方法是___________。
(4)这包黑色粉末的成分是__________。
14.A是地壳中含量最多的金属元素,A能和空气中的B反应生成一层致密的薄膜C,把A单质放在稀硫酸当中产生气体D,A单质与氯化铜溶液反应生成红色金属E.
(1)写出B单质的化学式_____________;E的化学符号____________.
(2)写出有关化学方程式
A→C:___________________;
A→D_____________________;
A→E:___________________.
四、实验题
15.某学生想探究铁生锈的条件,他设计了如图所示的实验:
(1)本实验对所用铁钉的要求是___________。
(2)因缺少___________的操作,故A试管中的铁钉生锈了。
(3)在C试管中,观察到的现象是___________。
(4)铁生锈的条件是___________。
16.下图为常见气体制备、干燥和性质实验的仪器。试根据题目要求,回答下列问题:
(1)欲在实验室中制备并收集干燥的氧气
①写出仪器名称:a____________、b____________、c____________。
②所选仪器的连接顺序为____________(填写仪器序号字母),仪器A中,生成氧气的化学方程式为_______。实验室中,还可以用_______方法制取氧气。(写出一个化学方程式)
(2)欲用一氧化碳气体测定某不纯氧化铁样品的纯度(杂质不反应),所选仪器的连接顺序为一氧化碳→D→B→C。
①仪器D中发生反应的化学方程式为_______,仪器D大玻璃管内的反应现象为____________。
②仪器C的作用是________,发生反应的化学方程式为_______。
五、计算题
17.生铁和钢是两种不同的铁合金,生铁含碳量为2%~4.3%,钢含碳量为0.03%~2%,化学兴趣小组的同学为确定该铁合金是生铁还是钢,他们取11.5g铁合金样品放到锥形瓶中,将100g稀盐酸分成5等份,分5次加入锥形瓶,每次待充分反应后记录实验数据。实验数据整理如下表所示:
次数 加盐酸前 第1次 第2次 第3次 第4次 第5次
加入稀盐酸质量(g) 0 20 20 20 20 20
锥形瓶内物质的总质量(g) 11.5 31.4 m 71.2 91.1 111.1
【査阅资料】碳及其他杂质不与稀盐酸反应。
请回答下列问题:
(1)实验数据表中m的值为______。
(2)请通过计算确定该铁合金是生铁还是钢(写出计算过程,计算结果保留到0.1%)。
18.废旧金属的回收利用既能保护环境,又能节约资源和能源。某冶金厂回收了一批废黄铜屑,需测定其中铜元素的质量分数。现称取150.0g样品,加入足量稀硫酸,充分反应后得无色溶液,产生氢气的质量及剩余固体的质量与消耗稀硫酸的质量关系分别如图所示。(设该批次黄铜屑只含铜、锌和少量黄铜锈。黄铜锈与稀硫酸反应生成CuSO4、ZnSO4、CO2和H2O),请回答下列问题:
(1)完全反应时,样品消耗稀硫酸的质量为______g;
(2)样品中铜元素的质量分数为______%(计算结果精确到0.1%,下同);
(3)计算稀硫酸中溶质的质量分数(写出计算过程)。
19.工业上用赤铁矿石(主要成分是氧化铁)与一氧化碳在高温条件下冶炼生铁。现有800t含氧化铁80%的赤铁矿石。求:
(1)该赤铁矿石中氧化铁的质量。
(2)该赤铁矿石能冶炼出含杂质4%的生铁的质量。(计算结果精确到0.1)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.D
3.A
4.B
5.C
6.B
7.D
8.B
9.D
10.B
11. 增大矿石与空气的接触面积,使反应更充分 S H2O + SO3=H2SO4
12. ① Fe+CuSO4===FeSO4+Cu 节约金属资源,树立可持续发展的观念(或保护金属资源或节约能源或减少对环境的污染等)
13.(1)H2O
(2)FeCl2、HCl
(3) 氧气##O2 将带火星的木条伸入到试管内,若木条复燃,证明气体是氧气
(4)铁粉、二氧化锰、木炭粉
14. O2 Cu 4Al+3O2═2Al2O3 2Al+3H2SO4═Al2(SO4)3+3H2↑ 2Al+3CuCl2=2AlCl3+3Cu
15.(1)洁净光亮
(2)蒸馏水煮沸
(3)铁钉没有生锈
(4)与氧气和水接触
16.(1) 分液漏斗 锥形瓶 酒精灯 AEF
(2) 红色固体变为黑色 点燃未反应的CO ,防止污染空气
17.(1)51.3
(2)设该合金中铁的质量为x,
合金中碳的质量为:11.5g-11.2g=0.3g,合金中碳的质量分数为:
合金中碳的质量分数介于2%~4.3%之间,该铁合金属于生铁。
18.(1)267.0
(2)60.0%
(3)解:设稀硫酸中溶质的质量分数为x
x=30.0%
答:稀硫酸中溶质的质量分数为30.0%
19.(1)640t
(2)设可炼出生铁的质量为x,含杂质4%的生铁则含铁量=1﹣4%=96%。
解得:x≈466.7t
答:该赤铁矿石能冶炼出含杂质4%的生铁的质量是466.7t。
答案第1页,共2页
答案第1页,共2页
