第9章溶液同步练习 —2021~2022学年九年级化学京改版(2013)下册(word版 含解析)
文档属性
| 名称 | 第9章溶液同步练习 —2021~2022学年九年级化学京改版(2013)下册(word版 含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 216.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-28 00:00:00 | ||
图片预览



文档简介
第9章溶液
一、选择题(共16题)
1.下列现象不属于乳化现象在生活中的应用的是( )
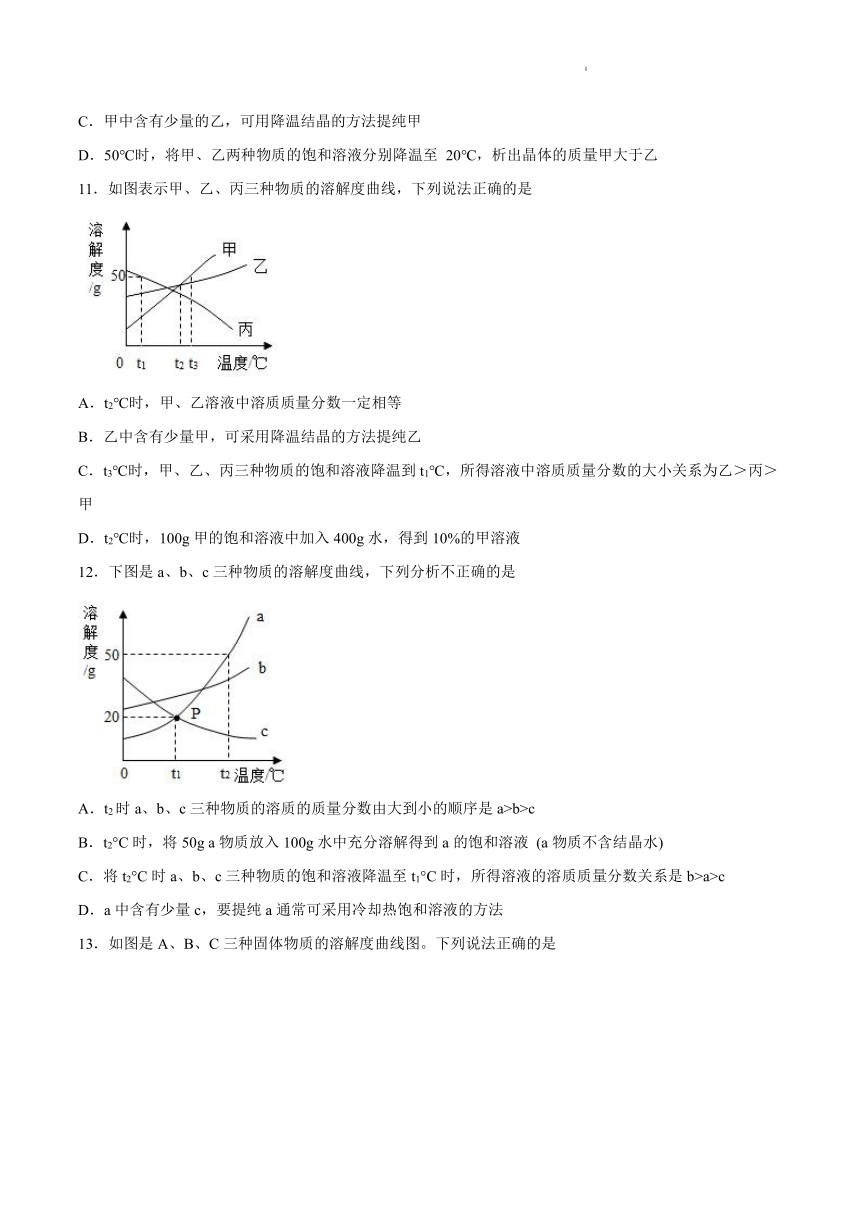
A.用洗洁精洗去碗盆上沾染的油污
B.用洗衣粉清洗就餐时不小心沾染的油污
C.用酒精洗去衣服上沾染的圆珠笔油
D.各种日常洗涤剂、化妆品的配制
2.下列有关溶液的叙述中,不正确的是
A.外界条件不改变,溶质不会从溶液中分离出来
B.溶质可以是固体、液体或气体
C.将固体氢氧化钠溶于水中,溶液的温度升高
D.汽油和洗洁精去除油污都是利用了乳化作用
3.下列饮品中可以看作溶液的是( )
A.长沙某网红店的珍珠奶茶
B.某品牌的“果粒橙”
C.矿泉水
D.带有果肉的椰汁
4.下列物质分别加入到足量的水中,充分混合后能得到无色溶液的是
A.氯化铁 B.硝酸钠 C.泥土 D.豆油
5.用汽油或加了洗涤剂的水都能除去衣服上的油污,两者去油污的原理分别是
A.乳化、乳化 B.溶解、乳化 C.乳化、溶解 D.溶解、溶解
6.如图是A、B、C为三种物质的溶解度曲线,下列说法错误的是:
A.可用降温结晶法从A、C的固体混合物中提纯A
B.t2℃时三种饱和溶液降温至t1℃,溶质质量分数:B>A=C
C.若A、B、C中有一种是易溶气体溶解度曲线,那一定是C
D.用同一种方法能将A、B、C的饱和溶液均变为不饱和溶液
7.溶液是一种均一稳定的混合物。下列说法中,不正确的是
A.溶液中各微观粒子之间存在着相互作用且都在不断运动
B.一种物质的饱和溶液还可以溶解其它物质
C.洗涤剂去油污主要利用了乳化作用
D.溶质质量分数为 10%的氯化钠溶液中,溶质与溶剂质量比为 1:10
8.配制100g溶质质量分数为10%的氯化钠溶液,不需要的仪器是( )
A.托盘天平 B.玻璃棒 C.酒精灯 D.量筒
9.下列各组物质的分离、鉴别方法中,不正确的是( )
选项 物质 鉴别方法
A 分离食盐和沙粒 溶解、过滤、蒸发
B 鉴别氢氧化钠固体和硝酸铵固体 加水溶解后,测溶液温度变化
C 鉴别蒸馏水和过氧化氢溶液 加入二氧化锰后,看气泡
D 鉴别硬水和软水 过滤
A.A B.B C.C D.D
10.如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )
A.20℃时,100g 甲溶液中含甲物质的质量小于 25g
B.20℃时,等质量甲、乙饱和溶液中含溶质的质量相等
C.甲中含有少量的乙,可用降温结晶的方法提纯甲
D.50℃时,将甲、乙两种物质的饱和溶液分别降温至 20℃,析出晶体的质量甲大于乙
11.如图表示甲、乙、丙三种物质的溶解度曲线,下列说法正确的是
A.t2℃时,甲、乙溶液中溶质质量分数一定相等
B.乙中含有少量甲,可采用降温结晶的方法提纯乙
C.t3℃时,甲、乙、丙三种物质的饱和溶液降温到t1℃,所得溶液中溶质质量分数的大小关系为乙>丙>甲
D.t2℃时,100g甲的饱和溶液中加入400g水,得到10%的甲溶液
12.下图是a、b、c三种物质的溶解度曲线,下列分析不正确的是
A.t2时a、b、c三种物质的溶质的质量分数由大到小的顺序是a>b>c
B.t2°C时,将50g a物质放入100g水中充分溶解得到a的饱和溶液 (a物质不含结晶水)
C.将t2°C时a、b、c三种物质的饱和溶液降温至t1°C时,所得溶液的溶质质量分数关系是b>a>c
D.a中含有少量c,要提纯a通常可采用冷却热饱和溶液的方法
13.如图是A、B、C三种固体物质的溶解度曲线图。下列说法正确的是
A.t1℃时B物质的溶液溶质质量分数最大
B.t3℃时不可能得到相同浓度的三种物质的溶液
C.t3℃时A的饱和溶液的溶质质量分数是80%
D.分别将t3℃时的三种物质的饱和溶液降温到t2℃时,只有C的溶液溶质质量分数不变
14.生活中的下列现象不能说明气体溶解度随温度升高而减小的是
A.打开啤酒瓶盖有大量泡沫逸出 B.烧开水时沸腾前有气泡逸出
C.喝下汽水感到有气味冲到鼻腔 D.夏季黄昏池塘里的鱼常浮出水面
15.如图是A、B两种物质饱和溶液中溶质质量分数(注:不是溶解度)随温度变化的曲线,现分别向50gA和80gB固体中各加水150g,加热溶解,同时蒸掉50g水,冷却至T1℃,此时
A.二者均有晶体析出 B.只有A析出
C.只有B析出 D.二者均没有晶体析出
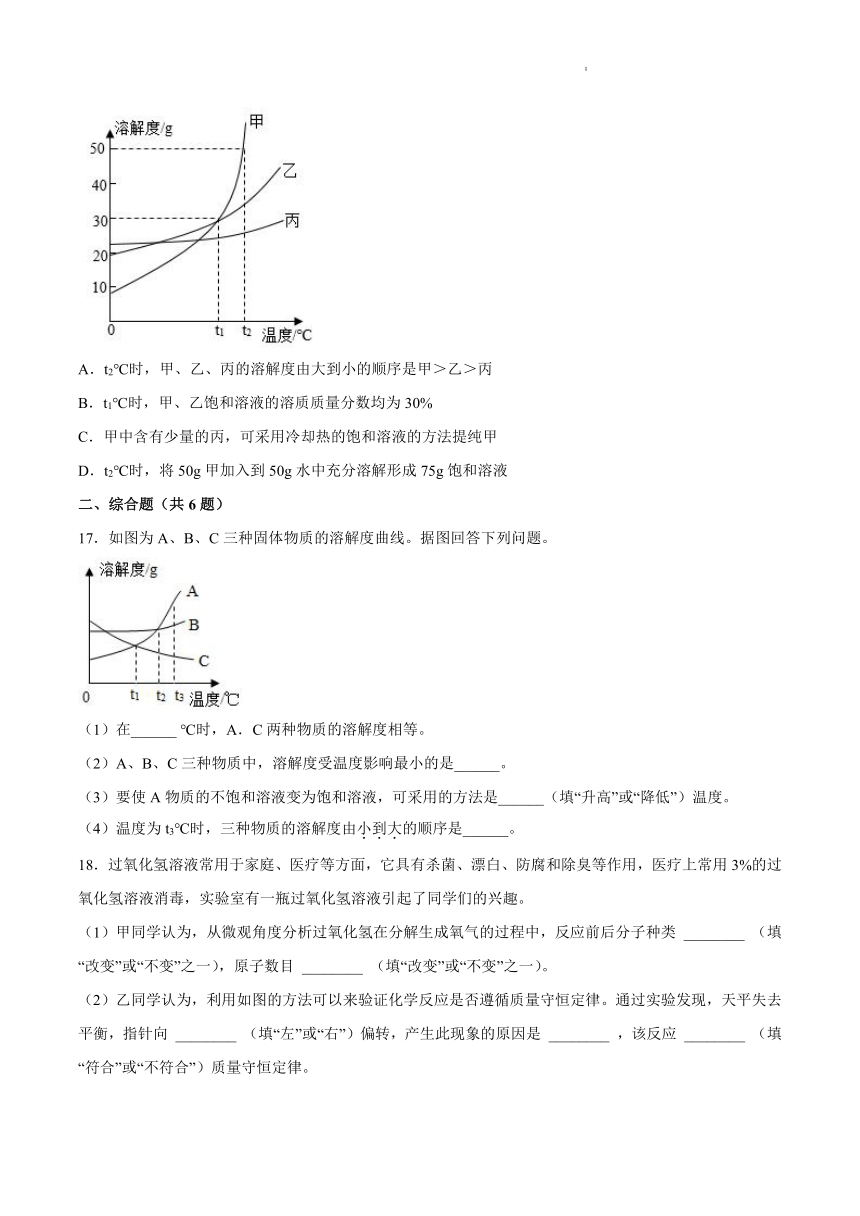
16.如图为甲、乙、丙三种固体的溶解度曲线,下列说法错误的是
A.t2℃时,甲、乙、丙的溶解度由大到小的顺序是甲>乙>丙
B.t1℃时,甲、乙饱和溶液的溶质质量分数均为30%
C.甲中含有少量的丙,可采用冷却热的饱和溶液的方法提纯甲
D.t2℃时,将50g甲加入到50g水中充分溶解形成75g饱和溶液
二、综合题(共6题)
17.如图为A、B、C三种固体物质的溶解度曲线。据图回答下列问题。
(1)在______ ℃时,A.C两种物质的溶解度相等。
(2)A、B、C三种物质中,溶解度受温度影响最小的是______。
(3)要使A物质的不饱和溶液变为饱和溶液,可采用的方法是______(填“升高”或“降低”)温度。
(4)温度为t3℃时,三种物质的溶解度由小到大的顺序是______。
18.过氧化氢溶液常用于家庭、医疗等方面,它具有杀菌、漂白、防腐和除臭等作用,医疗上常用3%的过氧化氢溶液消毒,实验室有一瓶过氧化氢溶液引起了同学们的兴趣。
(1)甲同学认为,从微观角度分析过氧化氢在分解生成氧气的过程中,反应前后分子种类 ________ (填“改变”或“不变”之一),原子数目 ________ (填“改变”或“不变”之一)。
(2)乙同学认为,利用如图的方法可以来验证化学反应是否遵循质量守恒定律。通过实验发现,天平失去平衡,指针向 ________ (填“左”或“右”)偏转,产生此现象的原因是 ________ ,该反应 ________ (填“符合”或“不符合”)质量守恒定律。
(3)丙同学认为,可以通过加水稀释的方法让溶液变稀。若要配制500g溶质质量分数为3%的过氧化氢溶液,需溶质质量分数为30%的过氧化氢溶液的质量是 ______ ?加水的质量是 ______ ?(列式计算)
19.水、溶液与人类的生产生活关系紧密。
(1)水净化时先加入絮凝剂,沉降过滤后,通过活性炭。活性炭的作用是______。
(2)发生火灾时,消防员利用高压水枪灭火的主要原理是______。
(3)漂白粉可用于自来水的杀菌消毒,其有效成分是次氯酸钙【化学式为】。次氯酸钙可发生如下反应:,则 X 的化学式______。
(4)公共场所常用“84 消毒液”(NaClO 溶液)进行环境杀菌.NaClO 中Cl 元素的化合价是______。
(5)将硬水通过如图所示的阳离子交换柱后可变成软水(图中阴离子未画出),交换后的水仍然呈电中性。
①一个 Ca2+可以交换出 ______ 个Na+。
②阳离子交换柱长时间使用后,Na+变少,失去软化硬水的功能而失效。利用生活中常见物质检验阳离子交换柱已失效的方法是______。
(6)20℃时打开汽水瓶盖时,有大量气泡冒出。汽水瓶盖打开前后,CO2 的溶解度变化如图中的 a 点变化到______(选填“b”、“c”、“d”或“e”)点。
(7)甲、乙、丙三种不含结晶水的固体物质在水中的溶解度曲线如图所示,请回答下列问题。
①t1℃时,甲的饱和溶液中溶质与溶液的质量比为______。
②t2℃时,将甲、乙、丙三种物质的饱和溶液分别降温至 t1℃时,所得溶液中溶质质量分数的由大到小关系为______。
(8)某化学兴趣小组设计出下列粗盐提纯的实验方案,回答下列问题:。
①本实验中精盐的产率是________(计算结果取小数点后一位)。
②若精盐的产率偏低,则可能的原因是______(填字母序号)。
A过滤时滤纸有破损
B蒸发时有固体溅出
C溶解含有泥沙的粗盐时,加入的水量过多
D转移精盐时,蒸发皿中有残留的固体
20.人类的生产、生活离不开水和溶液。
(1)自来水厂净水过程中使用了活性炭,这是因为活性炭具有_________作用。
(2)现有软水和硬水样品各一瓶,请设计实验对它们进行区分,并完成实验报告。
实验步骤 实验现象及结论
____ ____
(3)下表是氯化钠、硝酸钾在不同温度时的溶解度。
温度/℃ 0 10 20 30 40 50 60 70 80
溶解度/g 氯化钠 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4
硝酸钾 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169
下列说法正确的是_________(填字母)。
a.氯化钠的溶解度大于硝酸钾的溶解度
b.20℃时,将30g氯化钠加入50 g水中,充分搅拌,所得溶液中溶质的质量分数为37.5%
c.分别将80℃时硝酸钾的饱和溶液和氯化钠的饱和溶液降温至30℃,析出硝酸钾晶体的质量比析出氯化钠晶体的质量大
d.从含有少量氯化钠的硝酸钾的饱和溶液中得到较多的硝酸钾晶体,通常可采用冷却热饱和溶液的方法
(4)下图是一定溶质质量分数的氯化钠溶液的配制流程。
①实验步骤依次为:_________、称量、量取、溶解。用量筒量取所需的水时,若采用仰视的方法读数,配制的氯化钠溶液中溶质的质量分数会_________(填“偏大”或“偏小”)。
②将20g质量分数为6%的氯化钠溶液与30g质量分数为4%的氯化钠溶液充分混合,所得溶液中溶质的质量分数为_________。
(5)在0℃时,氮气的溶解度为0.024。这句话的含义是_________。
21.实验室用大理石和稀盐酸制取CO2,并用向上排空气法收集,可供选择的仪器如下。
(1)仪器A的名称是______;
(2)组装整套装置时,可选用上图中的A、B、H、I、J、L、P和______;
(3)利用组装完毕后的装置制取CO2气体时,验满的操作是______;
(4)若要制取4.4gCO2,理论上至少需要50g质量分数为______的稀盐酸。
22.CO2的捕集与资源化利用是目前化学研究的热点。
Ⅰ.二氧化碳的捕集
加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度______(填“增大”“不变”或“减小”)。捕集CO2后的溶液可以使紫色石蕊试液变红,原因是______(用化学方程式表示)。
Ⅱ.二氧化碳的资源化利用
(1)对CO2气体加压、降温,可获得干冰,从微观角度分析,该过程主要改变的是______。
(2)科学家利用新型催化剂,将二氧化碳转化为甲醇(CH4O),反应的微观示意图为:
生成甲醇时参加反应的CO2与H2的质量比______ 。
(3)以二氧化碳为原料,制取炭黑的太阳能工艺如图所示。
①写出图中反应2的化学方程式:______。
②该工艺中Fe3O4的作用是______。
(4)一种新型“人造树叶”可在光照条件下将二氧化碳转化为乙醇(C2H6O),反应的化学方程式为 。研究显示,每升“人造树叶”每天能从空气中吸收968g二氧化碳。计算2L“人造树叶”工作一天得到的乙醇,可以配制溶质质量分数为70%的乙醇溶液多少克?(写出计算过程,结果保留一位小数)______。
试卷第1页,共3页
参考答案:
1.C
【详解】
A、洗洁精中有乳化剂,它有乳化作用,能把油污变成无数细小的油滴,用洗洁精洗去碗盆上沾染的油污是利用乳化现象,故A不符合题意;
B、洗衣粉中有乳化剂,它有乳化作用,能把油污变成无数细小的油滴,用洗衣粉清洗就餐时不小心沾染的油污是利用乳化现象,故B不符合题意;
C、酒精是有机溶剂,能溶解衣服上沾染的圆珠笔油,不是利用乳化现象,是利用溶解现象,故B符合题意;
D、洗涤剂、化妆品一般是乳状,是利用乳化现象配制,故D不符合是题意。故选C。
2.D
【详解】
A、溶液具有稳定性,外界条件不改变,溶质不会从溶液中分离出来;正确。
B、溶质可以是固体、液体或气体;正确。
C、固体氢氧化钠溶于水中,会放出大量的热,溶液的温度升高;正确。
D、油污加入含有洗洁精的水中,洗洁精具有乳化作用,能将大的油滴分散成细小的油滴随水冲走,形成的是稳定的乳浊液,而汽油是溶解油污;错误。
故选:D。
3.C
【详解】
A、奶茶是溶液,但是含有珍珠就不是溶液了,故A不符合题意;
B、果粒橙里边含有果肉,形成的不是均一的混合物,故B不符合题意;
C、矿泉水里边含有多种盐,是均一稳定的混合物,故C符合题意;
D、带果肉的椰汁成分不均一,不是溶液,故D不符合题意;
故选C。
4.B
【详解】
A.氯化铁溶于水,形成均一、稳定的混合物,能形成黄色溶液,故选项A不正确;
B.硝酸钠溶于水,形成均一、稳定的混合物,能形成无色溶液,故选项B正确;
C.泥土不溶于水,不能和水形成均一、稳定的混合物,即不能够形成无色溶液,故选项C不正确;
D.豆油不溶于水,不能和水形成均一、稳定的混合物,即不能够形成无色溶液,故选项D不正确。
故选B。
5.B
【详解】
汽油可以溶解油污,原理是溶解。洗涤剂可以去除油污是可以将油污分散成小液滴,原理是乳化。故选B。
6.B
【详解】
A、因为A的溶解度受温度的影响变化比较大,可用降温结晶法从A、C的固体混合物中提纯A,正确但不符合题意。
B、t2℃时三种饱和溶液降温至t1℃,AB溶解度减小,溶质结晶析出,还是饱和溶液,降温之后B溶解度大于A溶解度,故饱和溶液溶质质量分数B大于A,C降温之后溶解度变大,变为不饱和溶液,溶质质量分数等于降温之前溶质质量分数,降温之前C溶解度小于降温之后A溶解度,故溶质质量分数B>A>C,故B错,符合题意。
C、气体溶解度随温度升高而减小,若A、B、C中有一种是易溶气体溶解度曲线,那一定是C,C正确,不符合题意。
D、用同一种方法能将A、B、C的饱和溶液均变为不饱和溶液正确,如加入溶剂,正确,但不符合题意。
故选:B。
7.D
【详解】
A、分子在不断运动。溶液中各微观粒子之间存在着相互作用且都在不断运动,正确。
B、一种物质的饱和溶液不一定是其他物质的饱和溶液,还可以溶解其它物质,正确。
C、洗涤剂去油污是将油污乳化成小液滴除去,主要利用了乳化作用。正确。
D、溶质质量分数为 10%的氯化钠溶液中,溶质与溶剂质量比为10:(100-10)=1:9,错误。
故选D。
8.C
【详解】
A、托盘天平用于配置溶液时称取固体氯化钠,故A需要;
B、玻璃棒用于溶解氯化钠时搅拌,加速氯化钠溶解,故B需要;
C、酒精灯,用于加热的玻璃仪器,而配置溶液的过程中不需要加热,故C不需要;
D、量筒用于配置溶液时量取水的体积,故D需要;
答案:C。
9.D
【详解】
A、分离食盐和沙粒,溶解后形成食盐水和泥沙的混合物、过滤的食盐水、蒸发得到食盐固体,正确;
B、鉴别氢氧化钠固体和硝酸铵固体 加水溶解后,氢氧化钠溶液温度升高,硝酸铵溶液温度降低,可以鉴别;
C、鉴别蒸馏水和过氧化氢溶液 加入二氧化锰后,过氧化氢因分解生成氧气而产生气泡,蒸馏水无明显现象,可以鉴别;
D、鉴别硬水和软水,应加入肥皂水,搅拌后泡沫多浮渣少的为软水,反之为硬水,它们都是液体,过滤不可以鉴别。
故选D。
10.D
【详解】
A、20℃时,100克水中最多溶解25克甲,100g 甲溶液中含甲物质的质量小于 25g,说法正确,不符合题意;
B、20℃时,甲乙溶解度相等,等质量甲、乙饱和溶液中含溶质的质量相等,说法正确,不符合题意;
C、甲的溶解度受温度影响大,甲中含有少量的乙,可用降温结晶的方法提纯甲,说法正确,不符合题意;
D、50℃时,将甲、乙两种物质的饱和溶液分别降温至 20℃,析出晶体的质量甲不一定大于乙,不知道溶液质量是否相等,说法错误,符合题意。
故选D。
11.C
【详解】
A、t2℃时,甲、乙的溶解度相等,该温度下,甲、乙饱和溶液的溶质质量分数相等,但是溶液状态未知,无法比较,不符合题意;
B、由图可知,甲、乙的溶解度均随温度的升高而增加,甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,当乙中含有少量甲,可采用蒸发结晶的方法提纯乙,不符合题意;
C、t3℃时,甲、乙、丙三种物质的饱和溶液降温到t1℃,降温后,甲、乙的溶解度减小,还是饱和溶液,丙的溶解度增加,变为不饱和溶液,降温后,丙的溶质质量分数不变,t1℃时,乙的溶解度大于t3℃时,丙的溶解度大于t1℃时,甲的溶解度,故t1℃时,乙的饱和溶液的溶质质量分数大于t3℃时,丙的饱和溶液的溶质质量分数大于t1℃时,甲的饱和溶液的溶质质量分数,故所得溶液中溶质质量分数的大小关系为乙>丙>甲,符合题意;
D、t2℃时,甲的溶解度小于50g,故100g甲的饱和溶液中溶质质量小于50g,加入400g水,无法得到10%的甲溶液,不符合题意。
故选C。
12.A
【详解】
A、t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>c,由于没有确定溶液的状态(是否饱和),所以不能确定溶液中溶质质量分数的大小,故A错误;
B、t2℃时,a的溶解度是50g,即100g水中溶解50g的a达到饱和状态,所以将50g a物质放入100g水中充分溶解得到a的饱和溶液,故B正确;
C、将t2℃时a、b、c三种物质的饱和溶液降温到t1℃时,a、b的溶解度减小,c的溶解度随温度的降低而增大,a、b有晶体析出,质量分数变小,溶液仍为饱和溶液,c没有晶体析出,质量分数不变,一定温度下饱和溶液的溶质分数=,溶解度越大,质量分数越大,t1℃时b的溶解度大于a的溶解度大于t2℃时c的溶解度,所以t1℃时三种物质的溶质质量分数由大到小的顺序是b>a>c。,故C 正确;
D、a、b的溶解度都随温度的降低而减小,a的溶解度受温度影响较大,b的溶解度受温度影响较小,a中含有少量c,要提纯a通常可采用冷却热饱和溶液的方法,故D正确。故选A。
13.D
【详解】
A、t1℃时,B物质的溶液溶质质量分数不一定最大,因为没有指明是饱和溶液,故选项错误;
B、t3℃时三者溶解度不相同,若A、B是不饱和溶液,可以与C相同,可能得到相同浓度的三种物质的溶液,故选项错误;
C、t3℃时A的溶解度为80g,饱和溶液的溶质质量分数=×100%≈44.4%,故选项错误;
D、A、B物质的溶解度随温度的降低而降低,C物质的溶解度随温度的降低而增大,分别将t3℃时的三种物质的饱和溶液降温到t2℃时,A、B物质析出晶体,溶解度变小,只有C溶质质量不变,溶剂质量不变,C溶液溶质质量分数不变,故选项正确。故选D。
14.B
【详解】
分析:对于气体来说溶解度影响因素主要有两方面,一是温度;二是压强,利用这些知识分析各选项提供的信息进行判断选择即可.
解答:解:A、烧开水使水的温度升高,气体的溶解度变小,气泡会溢出,故此选项错误.
B、揭开啤酒瓶盖,瓶内气压变小,则会有有大量气泡逸出,是压强对气体的影响,故此选项正确.
C、喝下汽水,气体的温度升高,二氧化碳溶解度变小,是温度对它的影响,故此选项错误.
D、夏季黄昏,气温较高,水中的氧气溶解量变小,与会出现浮头现象,故此选项错误.
故选B
15.C
【详解】
T1℃A、B两种物质饱和溶液的溶质质量分数均为40%,设T1℃A、B两种物质溶解度均为x,则:×100%=40%,x≈66.7g,即该温度下100g水中最多溶解A、B66.7g;A、分别向50克A和80克B固体中各加水150克,加热溶解,同时蒸发掉50克水,冷却至T1℃,即在100g水中,50克A能全部溶解,有B物质析出,故选项说法错误;B、分别向50克A和80克B固体中各加水150克,加热溶解,同时蒸发掉50克水,冷却至T1℃,即在100g水中,50克A能全部溶解,有B物质析出,故选项说法错误;C、分别向50克A和80克B固体中各加水150克,加热溶解,同时蒸发掉50克水,冷却至T1℃,即在100g水中,50克A能全部溶解,有B物质析出,故选项说法正确;D、T1℃,A、B两种物质的溶解度相等,由于D选项未指明温度,无法比较它们的溶解度大小,故选项说法错误。故选C。
16.B
【详解】
A、由溶解度曲线可知:t2℃时,甲、乙、丙的溶解度由大到小的顺序是甲>乙>丙,说法正确;
B、t1℃时,甲、乙固体物质的溶解度为30g,甲、乙饱和溶液的溶质质量分数=,说法错误;
C、固体物质甲的溶解度随温度升高而增大,且增大幅度较大,固体物质乙的溶解度随温度升高而增大,增大幅度较小,甲中含有少量的丙,可采用冷却热的饱和溶液的方法提纯甲,说法正确;
D、t2℃时,固体物质甲的溶解度为50g,即t2℃时,100g水中最多溶解50g固体甲物质,t2℃时,将50g甲加入到50g水中充分溶解,此时溶质是25g,溶剂是50g,形成75g溶液,说法正确;
答案:B。
17. t1 B 降低 C【详解】
(1)由溶解曲线图可知:在t1时,A、C两种物质的溶解度曲线相交于一点故在此温度下它们溶解度相等,故填:t1;
(2)根据溶解度曲线图可知A、B、C三种物质中,溶解度受温度影响最小的是B,它的曲线变化最平缓。故填:B;
(3)A物质的溶解度随着温度的升高而升高,故要使A物质的不饱和溶液变为饱和溶液,可采用的方法是:降低温度。故填:降低;
(4)又溶解度曲线可知温度为t3℃时,三种物质的溶解度由小到大的顺序是C18. 改变 不变 右 双氧水反应生成了氧气,氧气逸散到空气中,使得左盘中质量减小,所以天平往右偏转 符合 50g 450g
【详解】
(1)根据质量守恒定律的微观实质可知:化学反应前后,分子种类发生改变,原子种类和数目不变,故填写:改变;不变;
(2)化学反应都遵循质量守恒定律,该反应因为在敞口容器中发生,过氧化氢溶液与二氧化锰混合产生的氧气逸散到空气中,使得左盘中质量减小,指针向右偏转,故填写:右;双氧水反应生成了氧气,氧气逸散到空气中,使得左盘中质量减小,所以天平往右偏转;符合;
(3)若要用30%的过氧化氢溶液配制3%的过氧化氢溶液,需加水稀释,稀释过程中溶质质量不变
解:设需溶质质量分数为30%的过氧化氢溶液的质量是x
500gⅹ3%=30%x
x=50g
加水的质量是:500g-50g=450g
答:若要配制500g溶质质量分数为3%的过氧化氢溶液,需溶质质量分数为30%的过氧化氢溶液的质量是50g,加水的质量是450g
故填写:50g;450g。
19. 吸附(吸附作用) 吸收热量,使可燃物燃烧的温度降到着火点以下 CO2 +1 2 取少量通过阳离子交换柱的水于试管中。向其中加入适量肥皂水,振荡,若 观察到泡沫较少且有较多浮渣产生。说明阳离子交换柱已失效 或少量通过阳离子交换柱的水于试管中。向其中加入碳酸钠溶液,白色沉淀产生,说明 阳离子交换柱已失效 c 1:6 乙 甲 丙 66.7% BD
【详解】
(1)活性炭的作用是吸附(吸附作用);
(2)消防员利用高压水枪灭火的主要原理是吸收热量,使可燃物燃烧的温度降到着火点以下(根据燃烧三要素进行分析);
(3)根据质量守恒定律反应前后原子的种类数目不发生变化,反应后原子的种类数目为Ca:1;C:1;O:5;H:2;Cl:2;反应前(不包括X)原子的种类数目为Ca:1;O:3;H:2;Cl:2;因此X中年原子的种类数目为C:1;O:2,因此X的化学式为CO2;
(4)设NaClO 中Cl 元素的化合价是x,其中钠元素的化合价为+1价,氧元素的化合价为-2价,有(+1)+x+(-2)=0;x=+1;
(5)①一个钙离子含有两个正电荷,交换后的水仍然呈电中性,因此一个钙离子可以交换出2个钠离子。
②利用生活中常见物质检验阳离子交换柱已失效的方法是:取少量通过阳离子交换柱的水于试管中。向其中加入适量肥皂水,振荡,若 观察到泡沫较少且有较多浮渣产生。说明阳离子交换柱已失效 或少量通过阳离子交换柱的水于试管中。向其中加入碳酸钠溶液,白色沉淀产生,说明阳离子交换柱已失效。
(6)溶液的温度未变,因此还是20 ℃,打开汽水盖时,二氧化碳逸出,汽水的压强变小,因此为c点。
(7)①t1℃时,甲的溶解度为20g,即100g水中最多溶解20g甲,因此甲的饱和溶液中溶质与溶液的质量比为20g:(20g+100g)=1:6;
②温度下降甲、乙的溶解度下降,有晶体析出,但是甲、乙均为饱和溶液;温度下降丙的溶解度上升,变为不饱和溶液,因为t1℃时乙的溶解度>甲的溶解度>t2℃时丙的溶解度。因此所得溶液中溶质质量分数的由大到小关系为乙 甲 丙。
(8)①本实验中精盐的产率是;
②A、过滤时滤纸有破损,造成有一部分不溶性的泥沙等进入滤液,会导致所得精盐质量偏大,产率偏高,故选项错误;
B、蒸发时有固体溅出,会造成原混合物中的食盐没有全部转到精盐中,导致所得精盐质量偏小,产率偏低,故选项正确;
C、溶解含有泥沙的粗盐时,加入的水量过多,不会对精盐的产率产生影响,故选项错误;
D、转移精盐时,蒸发皿中有残留的固体即在蒸发皿中的固体转移过程中,精盐有丢失,导致所得精盐质量偏小,产率偏低,故选项正确。
故选BD。
20. 吸附 取等量的水样于两支试管中,分别向其中滴加等量的肥皂水,振荡 产生较多泡沫的是软水,产生较少泡沫且有浮渣的是硬水 D 计算 偏小 4.8% 氮气的压强为101kPa和温度为0℃时,1体积水里最多能溶解0.024体积的氮气
【详解】
(1)自来水厂净水过程中使用了活性炭,这是因为活性炭具有吸附作用,可以吸附水中的色素和异味;
(2)常用肥皂水来鉴别硬水和软水,肥皂水在硬水中易起浮渣,在软水中泡沫较多,故实验步骤:取等量的水样于两支试管中,分别向其中滴加等量的肥皂水,振荡;实验现象及结论:产生较多泡沫的是软水,产生较少泡沫且有浮渣的是硬水;
(3)A、溶解度比较,应指明温度,否则无法比较,不符合题意;
B、20℃时,氯化钠的溶解度为36g,该温度下,100g水中最多溶解36g氯化钠,故将30g氯化钠加入50g水中,充分搅拌,所得溶液中溶质的质量分数为:,不符合题意;
C、由表可知,硝酸钾的溶解度受温度的影响较大,氯化钠的溶解度受温度的影响较小,分别将80℃时等质量的硝酸钾的饱和溶液和氯化钠的饱和溶液降温至30℃,析出硝酸钾晶体的质量比析出氯化钠晶体的质量大,饱和溶液的质量未知的情况下,无法比较,不符合题意;
D、硝酸钾的溶解度受温度的影响较大,氯化钠的溶解度受温度的影响较小,从含有少量氯化钠的硝酸钾的饱和溶液中得到较多的硝酸钾晶体,通常可采用冷却热饱和溶液的方法,符合题意。故选D。
(4)①实验步骤依次为:计算、称量、量取、溶解;
用量筒量取所需的水时,若采用仰视的方法读数,读取数值小于实际数值,使量取水的质量偏大,溶液质量偏大,配制的氯化钠溶液中溶质的质量分数会偏小;
②将20g质量分数为6%的氯化钠溶液与30g质量分数为4%的氯化钠溶液充分混合,所得溶液中溶质的质量分数为:;
(5)在0℃时,氮气的溶解度为0.024。这句话的含义是:氮气的压强为101kPa和温度为0℃时,1体积水里最多能溶解0.024体积的氮气。
21.(1)锥形瓶
(2)C
(3)燃着的木条放在集气瓶口
(4)设生成4.4g二氧化碳需要HCl的质量为x。
x=7.3g。
盐酸的质量分数为:。
答:盐酸的质量分数为14.6%。
【分析】
(1)
仪器A的名称是锥形瓶;
(2)
实验室用大理石和稀盐酸制取CO2,反应条件不需要加热,反应物的状态是固体和液体,不需要酒精灯;并用向上排空气法收集;组装整套装置时,可选用图中的A、B、H、I、J、L、P和C;
(3)
因为二氧化碳的密度比空气大,不燃烧也不支持燃烧,所以利用组装完毕后的装置制取CO2气体时 ,验满的操作是:把燃着的木条放在集气瓶口,若木条熄灭则集满;
(4)
详见答案。
22. 增大 CO2+H2O=H2CO3 分子间间隔 22:3 6FeO+CO22Fe3O4+C 催化作用
解:设2L人造树叶工作一天得到的乙醇的质量为x
m(溶液)=1012g÷70%=1445.7g
答:制得溶质质量分数为70%的乙醇溶液的质量1445.7g
【详解】
Ⅰ压强越大,气体溶解度越大,加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度增大,捕集CO2后的溶液可以使紫色石蕊试液变红,原因是二氧化碳和水生成了碳酸,化学方程式:CO2+H2O=H2CO3,故填:增大;CO2+H2O=H2CO3。
Ⅱ(1)对CO2气体加压、降温,分子间隔变小,可获得干冰,从微观角度分析,该过程主要改变的是分子间间隔,故填:分子间间隔。
(2)由微观示意图可知,二氧化碳和氢气生成甲醇和水,化学方程式CO2+3H2CH3OH+H2O, 生成甲醇时参加反应的CO2与H2的质量比44:(2×3)=22:3,故填:22:3。
(3)①图中反应2氧化亚铁和二氧化碳生成四氧化三铁和碳,化学方程式6FeO+CO22Fe3O4+C,故填:6FeO+CO22Fe3O4+C。
②该工艺中Fe3O4改变了反应速度,质量和化学性质没变,是催化剂起到催化作用,故填:催化作用。答案第1页,共2页
一、选择题(共16题)
1.下列现象不属于乳化现象在生活中的应用的是( )
A.用洗洁精洗去碗盆上沾染的油污
B.用洗衣粉清洗就餐时不小心沾染的油污
C.用酒精洗去衣服上沾染的圆珠笔油
D.各种日常洗涤剂、化妆品的配制
2.下列有关溶液的叙述中,不正确的是
A.外界条件不改变,溶质不会从溶液中分离出来
B.溶质可以是固体、液体或气体
C.将固体氢氧化钠溶于水中,溶液的温度升高
D.汽油和洗洁精去除油污都是利用了乳化作用
3.下列饮品中可以看作溶液的是( )
A.长沙某网红店的珍珠奶茶
B.某品牌的“果粒橙”
C.矿泉水
D.带有果肉的椰汁
4.下列物质分别加入到足量的水中,充分混合后能得到无色溶液的是
A.氯化铁 B.硝酸钠 C.泥土 D.豆油
5.用汽油或加了洗涤剂的水都能除去衣服上的油污,两者去油污的原理分别是
A.乳化、乳化 B.溶解、乳化 C.乳化、溶解 D.溶解、溶解
6.如图是A、B、C为三种物质的溶解度曲线,下列说法错误的是:
A.可用降温结晶法从A、C的固体混合物中提纯A
B.t2℃时三种饱和溶液降温至t1℃,溶质质量分数:B>A=C
C.若A、B、C中有一种是易溶气体溶解度曲线,那一定是C
D.用同一种方法能将A、B、C的饱和溶液均变为不饱和溶液
7.溶液是一种均一稳定的混合物。下列说法中,不正确的是
A.溶液中各微观粒子之间存在着相互作用且都在不断运动
B.一种物质的饱和溶液还可以溶解其它物质
C.洗涤剂去油污主要利用了乳化作用
D.溶质质量分数为 10%的氯化钠溶液中,溶质与溶剂质量比为 1:10
8.配制100g溶质质量分数为10%的氯化钠溶液,不需要的仪器是( )
A.托盘天平 B.玻璃棒 C.酒精灯 D.量筒
9.下列各组物质的分离、鉴别方法中,不正确的是( )
选项 物质 鉴别方法
A 分离食盐和沙粒 溶解、过滤、蒸发
B 鉴别氢氧化钠固体和硝酸铵固体 加水溶解后,测溶液温度变化
C 鉴别蒸馏水和过氧化氢溶液 加入二氧化锰后,看气泡
D 鉴别硬水和软水 过滤
A.A B.B C.C D.D
10.如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )
A.20℃时,100g 甲溶液中含甲物质的质量小于 25g
B.20℃时,等质量甲、乙饱和溶液中含溶质的质量相等
C.甲中含有少量的乙,可用降温结晶的方法提纯甲
D.50℃时,将甲、乙两种物质的饱和溶液分别降温至 20℃,析出晶体的质量甲大于乙
11.如图表示甲、乙、丙三种物质的溶解度曲线,下列说法正确的是
A.t2℃时,甲、乙溶液中溶质质量分数一定相等
B.乙中含有少量甲,可采用降温结晶的方法提纯乙
C.t3℃时,甲、乙、丙三种物质的饱和溶液降温到t1℃,所得溶液中溶质质量分数的大小关系为乙>丙>甲
D.t2℃时,100g甲的饱和溶液中加入400g水,得到10%的甲溶液
12.下图是a、b、c三种物质的溶解度曲线,下列分析不正确的是
A.t2时a、b、c三种物质的溶质的质量分数由大到小的顺序是a>b>c
B.t2°C时,将50g a物质放入100g水中充分溶解得到a的饱和溶液 (a物质不含结晶水)
C.将t2°C时a、b、c三种物质的饱和溶液降温至t1°C时,所得溶液的溶质质量分数关系是b>a>c
D.a中含有少量c,要提纯a通常可采用冷却热饱和溶液的方法
13.如图是A、B、C三种固体物质的溶解度曲线图。下列说法正确的是
A.t1℃时B物质的溶液溶质质量分数最大
B.t3℃时不可能得到相同浓度的三种物质的溶液
C.t3℃时A的饱和溶液的溶质质量分数是80%
D.分别将t3℃时的三种物质的饱和溶液降温到t2℃时,只有C的溶液溶质质量分数不变
14.生活中的下列现象不能说明气体溶解度随温度升高而减小的是
A.打开啤酒瓶盖有大量泡沫逸出 B.烧开水时沸腾前有气泡逸出
C.喝下汽水感到有气味冲到鼻腔 D.夏季黄昏池塘里的鱼常浮出水面
15.如图是A、B两种物质饱和溶液中溶质质量分数(注:不是溶解度)随温度变化的曲线,现分别向50gA和80gB固体中各加水150g,加热溶解,同时蒸掉50g水,冷却至T1℃,此时
A.二者均有晶体析出 B.只有A析出
C.只有B析出 D.二者均没有晶体析出
16.如图为甲、乙、丙三种固体的溶解度曲线,下列说法错误的是
A.t2℃时,甲、乙、丙的溶解度由大到小的顺序是甲>乙>丙
B.t1℃时,甲、乙饱和溶液的溶质质量分数均为30%
C.甲中含有少量的丙,可采用冷却热的饱和溶液的方法提纯甲
D.t2℃时,将50g甲加入到50g水中充分溶解形成75g饱和溶液
二、综合题(共6题)
17.如图为A、B、C三种固体物质的溶解度曲线。据图回答下列问题。
(1)在______ ℃时,A.C两种物质的溶解度相等。
(2)A、B、C三种物质中,溶解度受温度影响最小的是______。
(3)要使A物质的不饱和溶液变为饱和溶液,可采用的方法是______(填“升高”或“降低”)温度。
(4)温度为t3℃时,三种物质的溶解度由小到大的顺序是______。
18.过氧化氢溶液常用于家庭、医疗等方面,它具有杀菌、漂白、防腐和除臭等作用,医疗上常用3%的过氧化氢溶液消毒,实验室有一瓶过氧化氢溶液引起了同学们的兴趣。
(1)甲同学认为,从微观角度分析过氧化氢在分解生成氧气的过程中,反应前后分子种类 ________ (填“改变”或“不变”之一),原子数目 ________ (填“改变”或“不变”之一)。
(2)乙同学认为,利用如图的方法可以来验证化学反应是否遵循质量守恒定律。通过实验发现,天平失去平衡,指针向 ________ (填“左”或“右”)偏转,产生此现象的原因是 ________ ,该反应 ________ (填“符合”或“不符合”)质量守恒定律。
(3)丙同学认为,可以通过加水稀释的方法让溶液变稀。若要配制500g溶质质量分数为3%的过氧化氢溶液,需溶质质量分数为30%的过氧化氢溶液的质量是 ______ ?加水的质量是 ______ ?(列式计算)
19.水、溶液与人类的生产生活关系紧密。
(1)水净化时先加入絮凝剂,沉降过滤后,通过活性炭。活性炭的作用是______。
(2)发生火灾时,消防员利用高压水枪灭火的主要原理是______。
(3)漂白粉可用于自来水的杀菌消毒,其有效成分是次氯酸钙【化学式为】。次氯酸钙可发生如下反应:,则 X 的化学式______。
(4)公共场所常用“84 消毒液”(NaClO 溶液)进行环境杀菌.NaClO 中Cl 元素的化合价是______。
(5)将硬水通过如图所示的阳离子交换柱后可变成软水(图中阴离子未画出),交换后的水仍然呈电中性。
①一个 Ca2+可以交换出 ______ 个Na+。
②阳离子交换柱长时间使用后,Na+变少,失去软化硬水的功能而失效。利用生活中常见物质检验阳离子交换柱已失效的方法是______。
(6)20℃时打开汽水瓶盖时,有大量气泡冒出。汽水瓶盖打开前后,CO2 的溶解度变化如图中的 a 点变化到______(选填“b”、“c”、“d”或“e”)点。
(7)甲、乙、丙三种不含结晶水的固体物质在水中的溶解度曲线如图所示,请回答下列问题。
①t1℃时,甲的饱和溶液中溶质与溶液的质量比为______。
②t2℃时,将甲、乙、丙三种物质的饱和溶液分别降温至 t1℃时,所得溶液中溶质质量分数的由大到小关系为______。
(8)某化学兴趣小组设计出下列粗盐提纯的实验方案,回答下列问题:。
①本实验中精盐的产率是________(计算结果取小数点后一位)。
②若精盐的产率偏低,则可能的原因是______(填字母序号)。
A过滤时滤纸有破损
B蒸发时有固体溅出
C溶解含有泥沙的粗盐时,加入的水量过多
D转移精盐时,蒸发皿中有残留的固体
20.人类的生产、生活离不开水和溶液。
(1)自来水厂净水过程中使用了活性炭,这是因为活性炭具有_________作用。
(2)现有软水和硬水样品各一瓶,请设计实验对它们进行区分,并完成实验报告。
实验步骤 实验现象及结论
____ ____
(3)下表是氯化钠、硝酸钾在不同温度时的溶解度。
温度/℃ 0 10 20 30 40 50 60 70 80
溶解度/g 氯化钠 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4
硝酸钾 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169
下列说法正确的是_________(填字母)。
a.氯化钠的溶解度大于硝酸钾的溶解度
b.20℃时,将30g氯化钠加入50 g水中,充分搅拌,所得溶液中溶质的质量分数为37.5%
c.分别将80℃时硝酸钾的饱和溶液和氯化钠的饱和溶液降温至30℃,析出硝酸钾晶体的质量比析出氯化钠晶体的质量大
d.从含有少量氯化钠的硝酸钾的饱和溶液中得到较多的硝酸钾晶体,通常可采用冷却热饱和溶液的方法
(4)下图是一定溶质质量分数的氯化钠溶液的配制流程。
①实验步骤依次为:_________、称量、量取、溶解。用量筒量取所需的水时,若采用仰视的方法读数,配制的氯化钠溶液中溶质的质量分数会_________(填“偏大”或“偏小”)。
②将20g质量分数为6%的氯化钠溶液与30g质量分数为4%的氯化钠溶液充分混合,所得溶液中溶质的质量分数为_________。
(5)在0℃时,氮气的溶解度为0.024。这句话的含义是_________。
21.实验室用大理石和稀盐酸制取CO2,并用向上排空气法收集,可供选择的仪器如下。
(1)仪器A的名称是______;
(2)组装整套装置时,可选用上图中的A、B、H、I、J、L、P和______;
(3)利用组装完毕后的装置制取CO2气体时,验满的操作是______;
(4)若要制取4.4gCO2,理论上至少需要50g质量分数为______的稀盐酸。
22.CO2的捕集与资源化利用是目前化学研究的热点。
Ⅰ.二氧化碳的捕集
加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度______(填“增大”“不变”或“减小”)。捕集CO2后的溶液可以使紫色石蕊试液变红,原因是______(用化学方程式表示)。
Ⅱ.二氧化碳的资源化利用
(1)对CO2气体加压、降温,可获得干冰,从微观角度分析,该过程主要改变的是______。
(2)科学家利用新型催化剂,将二氧化碳转化为甲醇(CH4O),反应的微观示意图为:
生成甲醇时参加反应的CO2与H2的质量比______ 。
(3)以二氧化碳为原料,制取炭黑的太阳能工艺如图所示。
①写出图中反应2的化学方程式:______。
②该工艺中Fe3O4的作用是______。
(4)一种新型“人造树叶”可在光照条件下将二氧化碳转化为乙醇(C2H6O),反应的化学方程式为 。研究显示,每升“人造树叶”每天能从空气中吸收968g二氧化碳。计算2L“人造树叶”工作一天得到的乙醇,可以配制溶质质量分数为70%的乙醇溶液多少克?(写出计算过程,结果保留一位小数)______。
试卷第1页,共3页
参考答案:
1.C
【详解】
A、洗洁精中有乳化剂,它有乳化作用,能把油污变成无数细小的油滴,用洗洁精洗去碗盆上沾染的油污是利用乳化现象,故A不符合题意;
B、洗衣粉中有乳化剂,它有乳化作用,能把油污变成无数细小的油滴,用洗衣粉清洗就餐时不小心沾染的油污是利用乳化现象,故B不符合题意;
C、酒精是有机溶剂,能溶解衣服上沾染的圆珠笔油,不是利用乳化现象,是利用溶解现象,故B符合题意;
D、洗涤剂、化妆品一般是乳状,是利用乳化现象配制,故D不符合是题意。故选C。
2.D
【详解】
A、溶液具有稳定性,外界条件不改变,溶质不会从溶液中分离出来;正确。
B、溶质可以是固体、液体或气体;正确。
C、固体氢氧化钠溶于水中,会放出大量的热,溶液的温度升高;正确。
D、油污加入含有洗洁精的水中,洗洁精具有乳化作用,能将大的油滴分散成细小的油滴随水冲走,形成的是稳定的乳浊液,而汽油是溶解油污;错误。
故选:D。
3.C
【详解】
A、奶茶是溶液,但是含有珍珠就不是溶液了,故A不符合题意;
B、果粒橙里边含有果肉,形成的不是均一的混合物,故B不符合题意;
C、矿泉水里边含有多种盐,是均一稳定的混合物,故C符合题意;
D、带果肉的椰汁成分不均一,不是溶液,故D不符合题意;
故选C。
4.B
【详解】
A.氯化铁溶于水,形成均一、稳定的混合物,能形成黄色溶液,故选项A不正确;
B.硝酸钠溶于水,形成均一、稳定的混合物,能形成无色溶液,故选项B正确;
C.泥土不溶于水,不能和水形成均一、稳定的混合物,即不能够形成无色溶液,故选项C不正确;
D.豆油不溶于水,不能和水形成均一、稳定的混合物,即不能够形成无色溶液,故选项D不正确。
故选B。
5.B
【详解】
汽油可以溶解油污,原理是溶解。洗涤剂可以去除油污是可以将油污分散成小液滴,原理是乳化。故选B。
6.B
【详解】
A、因为A的溶解度受温度的影响变化比较大,可用降温结晶法从A、C的固体混合物中提纯A,正确但不符合题意。
B、t2℃时三种饱和溶液降温至t1℃,AB溶解度减小,溶质结晶析出,还是饱和溶液,降温之后B溶解度大于A溶解度,故饱和溶液溶质质量分数B大于A,C降温之后溶解度变大,变为不饱和溶液,溶质质量分数等于降温之前溶质质量分数,降温之前C溶解度小于降温之后A溶解度,故溶质质量分数B>A>C,故B错,符合题意。
C、气体溶解度随温度升高而减小,若A、B、C中有一种是易溶气体溶解度曲线,那一定是C,C正确,不符合题意。
D、用同一种方法能将A、B、C的饱和溶液均变为不饱和溶液正确,如加入溶剂,正确,但不符合题意。
故选:B。
7.D
【详解】
A、分子在不断运动。溶液中各微观粒子之间存在着相互作用且都在不断运动,正确。
B、一种物质的饱和溶液不一定是其他物质的饱和溶液,还可以溶解其它物质,正确。
C、洗涤剂去油污是将油污乳化成小液滴除去,主要利用了乳化作用。正确。
D、溶质质量分数为 10%的氯化钠溶液中,溶质与溶剂质量比为10:(100-10)=1:9,错误。
故选D。
8.C
【详解】
A、托盘天平用于配置溶液时称取固体氯化钠,故A需要;
B、玻璃棒用于溶解氯化钠时搅拌,加速氯化钠溶解,故B需要;
C、酒精灯,用于加热的玻璃仪器,而配置溶液的过程中不需要加热,故C不需要;
D、量筒用于配置溶液时量取水的体积,故D需要;
答案:C。
9.D
【详解】
A、分离食盐和沙粒,溶解后形成食盐水和泥沙的混合物、过滤的食盐水、蒸发得到食盐固体,正确;
B、鉴别氢氧化钠固体和硝酸铵固体 加水溶解后,氢氧化钠溶液温度升高,硝酸铵溶液温度降低,可以鉴别;
C、鉴别蒸馏水和过氧化氢溶液 加入二氧化锰后,过氧化氢因分解生成氧气而产生气泡,蒸馏水无明显现象,可以鉴别;
D、鉴别硬水和软水,应加入肥皂水,搅拌后泡沫多浮渣少的为软水,反之为硬水,它们都是液体,过滤不可以鉴别。
故选D。
10.D
【详解】
A、20℃时,100克水中最多溶解25克甲,100g 甲溶液中含甲物质的质量小于 25g,说法正确,不符合题意;
B、20℃时,甲乙溶解度相等,等质量甲、乙饱和溶液中含溶质的质量相等,说法正确,不符合题意;
C、甲的溶解度受温度影响大,甲中含有少量的乙,可用降温结晶的方法提纯甲,说法正确,不符合题意;
D、50℃时,将甲、乙两种物质的饱和溶液分别降温至 20℃,析出晶体的质量甲不一定大于乙,不知道溶液质量是否相等,说法错误,符合题意。
故选D。
11.C
【详解】
A、t2℃时,甲、乙的溶解度相等,该温度下,甲、乙饱和溶液的溶质质量分数相等,但是溶液状态未知,无法比较,不符合题意;
B、由图可知,甲、乙的溶解度均随温度的升高而增加,甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,当乙中含有少量甲,可采用蒸发结晶的方法提纯乙,不符合题意;
C、t3℃时,甲、乙、丙三种物质的饱和溶液降温到t1℃,降温后,甲、乙的溶解度减小,还是饱和溶液,丙的溶解度增加,变为不饱和溶液,降温后,丙的溶质质量分数不变,t1℃时,乙的溶解度大于t3℃时,丙的溶解度大于t1℃时,甲的溶解度,故t1℃时,乙的饱和溶液的溶质质量分数大于t3℃时,丙的饱和溶液的溶质质量分数大于t1℃时,甲的饱和溶液的溶质质量分数,故所得溶液中溶质质量分数的大小关系为乙>丙>甲,符合题意;
D、t2℃时,甲的溶解度小于50g,故100g甲的饱和溶液中溶质质量小于50g,加入400g水,无法得到10%的甲溶液,不符合题意。
故选C。
12.A
【详解】
A、t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>c,由于没有确定溶液的状态(是否饱和),所以不能确定溶液中溶质质量分数的大小,故A错误;
B、t2℃时,a的溶解度是50g,即100g水中溶解50g的a达到饱和状态,所以将50g a物质放入100g水中充分溶解得到a的饱和溶液,故B正确;
C、将t2℃时a、b、c三种物质的饱和溶液降温到t1℃时,a、b的溶解度减小,c的溶解度随温度的降低而增大,a、b有晶体析出,质量分数变小,溶液仍为饱和溶液,c没有晶体析出,质量分数不变,一定温度下饱和溶液的溶质分数=,溶解度越大,质量分数越大,t1℃时b的溶解度大于a的溶解度大于t2℃时c的溶解度,所以t1℃时三种物质的溶质质量分数由大到小的顺序是b>a>c。,故C 正确;
D、a、b的溶解度都随温度的降低而减小,a的溶解度受温度影响较大,b的溶解度受温度影响较小,a中含有少量c,要提纯a通常可采用冷却热饱和溶液的方法,故D正确。故选A。
13.D
【详解】
A、t1℃时,B物质的溶液溶质质量分数不一定最大,因为没有指明是饱和溶液,故选项错误;
B、t3℃时三者溶解度不相同,若A、B是不饱和溶液,可以与C相同,可能得到相同浓度的三种物质的溶液,故选项错误;
C、t3℃时A的溶解度为80g,饱和溶液的溶质质量分数=×100%≈44.4%,故选项错误;
D、A、B物质的溶解度随温度的降低而降低,C物质的溶解度随温度的降低而增大,分别将t3℃时的三种物质的饱和溶液降温到t2℃时,A、B物质析出晶体,溶解度变小,只有C溶质质量不变,溶剂质量不变,C溶液溶质质量分数不变,故选项正确。故选D。
14.B
【详解】
分析:对于气体来说溶解度影响因素主要有两方面,一是温度;二是压强,利用这些知识分析各选项提供的信息进行判断选择即可.
解答:解:A、烧开水使水的温度升高,气体的溶解度变小,气泡会溢出,故此选项错误.
B、揭开啤酒瓶盖,瓶内气压变小,则会有有大量气泡逸出,是压强对气体的影响,故此选项正确.
C、喝下汽水,气体的温度升高,二氧化碳溶解度变小,是温度对它的影响,故此选项错误.
D、夏季黄昏,气温较高,水中的氧气溶解量变小,与会出现浮头现象,故此选项错误.
故选B
15.C
【详解】
T1℃A、B两种物质饱和溶液的溶质质量分数均为40%,设T1℃A、B两种物质溶解度均为x,则:×100%=40%,x≈66.7g,即该温度下100g水中最多溶解A、B66.7g;A、分别向50克A和80克B固体中各加水150克,加热溶解,同时蒸发掉50克水,冷却至T1℃,即在100g水中,50克A能全部溶解,有B物质析出,故选项说法错误;B、分别向50克A和80克B固体中各加水150克,加热溶解,同时蒸发掉50克水,冷却至T1℃,即在100g水中,50克A能全部溶解,有B物质析出,故选项说法错误;C、分别向50克A和80克B固体中各加水150克,加热溶解,同时蒸发掉50克水,冷却至T1℃,即在100g水中,50克A能全部溶解,有B物质析出,故选项说法正确;D、T1℃,A、B两种物质的溶解度相等,由于D选项未指明温度,无法比较它们的溶解度大小,故选项说法错误。故选C。
16.B
【详解】
A、由溶解度曲线可知:t2℃时,甲、乙、丙的溶解度由大到小的顺序是甲>乙>丙,说法正确;
B、t1℃时,甲、乙固体物质的溶解度为30g,甲、乙饱和溶液的溶质质量分数=,说法错误;
C、固体物质甲的溶解度随温度升高而增大,且增大幅度较大,固体物质乙的溶解度随温度升高而增大,增大幅度较小,甲中含有少量的丙,可采用冷却热的饱和溶液的方法提纯甲,说法正确;
D、t2℃时,固体物质甲的溶解度为50g,即t2℃时,100g水中最多溶解50g固体甲物质,t2℃时,将50g甲加入到50g水中充分溶解,此时溶质是25g,溶剂是50g,形成75g溶液,说法正确;
答案:B。
17. t1 B 降低 C
(1)由溶解曲线图可知:在t1时,A、C两种物质的溶解度曲线相交于一点故在此温度下它们溶解度相等,故填:t1;
(2)根据溶解度曲线图可知A、B、C三种物质中,溶解度受温度影响最小的是B,它的曲线变化最平缓。故填:B;
(3)A物质的溶解度随着温度的升高而升高,故要使A物质的不饱和溶液变为饱和溶液,可采用的方法是:降低温度。故填:降低;
(4)又溶解度曲线可知温度为t3℃时,三种物质的溶解度由小到大的顺序是C
【详解】
(1)根据质量守恒定律的微观实质可知:化学反应前后,分子种类发生改变,原子种类和数目不变,故填写:改变;不变;
(2)化学反应都遵循质量守恒定律,该反应因为在敞口容器中发生,过氧化氢溶液与二氧化锰混合产生的氧气逸散到空气中,使得左盘中质量减小,指针向右偏转,故填写:右;双氧水反应生成了氧气,氧气逸散到空气中,使得左盘中质量减小,所以天平往右偏转;符合;
(3)若要用30%的过氧化氢溶液配制3%的过氧化氢溶液,需加水稀释,稀释过程中溶质质量不变
解:设需溶质质量分数为30%的过氧化氢溶液的质量是x
500gⅹ3%=30%x
x=50g
加水的质量是:500g-50g=450g
答:若要配制500g溶质质量分数为3%的过氧化氢溶液,需溶质质量分数为30%的过氧化氢溶液的质量是50g,加水的质量是450g
故填写:50g;450g。
19. 吸附(吸附作用) 吸收热量,使可燃物燃烧的温度降到着火点以下 CO2 +1 2 取少量通过阳离子交换柱的水于试管中。向其中加入适量肥皂水,振荡,若 观察到泡沫较少且有较多浮渣产生。说明阳离子交换柱已失效 或少量通过阳离子交换柱的水于试管中。向其中加入碳酸钠溶液,白色沉淀产生,说明 阳离子交换柱已失效 c 1:6 乙 甲 丙 66.7% BD
【详解】
(1)活性炭的作用是吸附(吸附作用);
(2)消防员利用高压水枪灭火的主要原理是吸收热量,使可燃物燃烧的温度降到着火点以下(根据燃烧三要素进行分析);
(3)根据质量守恒定律反应前后原子的种类数目不发生变化,反应后原子的种类数目为Ca:1;C:1;O:5;H:2;Cl:2;反应前(不包括X)原子的种类数目为Ca:1;O:3;H:2;Cl:2;因此X中年原子的种类数目为C:1;O:2,因此X的化学式为CO2;
(4)设NaClO 中Cl 元素的化合价是x,其中钠元素的化合价为+1价,氧元素的化合价为-2价,有(+1)+x+(-2)=0;x=+1;
(5)①一个钙离子含有两个正电荷,交换后的水仍然呈电中性,因此一个钙离子可以交换出2个钠离子。
②利用生活中常见物质检验阳离子交换柱已失效的方法是:取少量通过阳离子交换柱的水于试管中。向其中加入适量肥皂水,振荡,若 观察到泡沫较少且有较多浮渣产生。说明阳离子交换柱已失效 或少量通过阳离子交换柱的水于试管中。向其中加入碳酸钠溶液,白色沉淀产生,说明阳离子交换柱已失效。
(6)溶液的温度未变,因此还是20 ℃,打开汽水盖时,二氧化碳逸出,汽水的压强变小,因此为c点。
(7)①t1℃时,甲的溶解度为20g,即100g水中最多溶解20g甲,因此甲的饱和溶液中溶质与溶液的质量比为20g:(20g+100g)=1:6;
②温度下降甲、乙的溶解度下降,有晶体析出,但是甲、乙均为饱和溶液;温度下降丙的溶解度上升,变为不饱和溶液,因为t1℃时乙的溶解度>甲的溶解度>t2℃时丙的溶解度。因此所得溶液中溶质质量分数的由大到小关系为乙 甲 丙。
(8)①本实验中精盐的产率是;
②A、过滤时滤纸有破损,造成有一部分不溶性的泥沙等进入滤液,会导致所得精盐质量偏大,产率偏高,故选项错误;
B、蒸发时有固体溅出,会造成原混合物中的食盐没有全部转到精盐中,导致所得精盐质量偏小,产率偏低,故选项正确;
C、溶解含有泥沙的粗盐时,加入的水量过多,不会对精盐的产率产生影响,故选项错误;
D、转移精盐时,蒸发皿中有残留的固体即在蒸发皿中的固体转移过程中,精盐有丢失,导致所得精盐质量偏小,产率偏低,故选项正确。
故选BD。
20. 吸附 取等量的水样于两支试管中,分别向其中滴加等量的肥皂水,振荡 产生较多泡沫的是软水,产生较少泡沫且有浮渣的是硬水 D 计算 偏小 4.8% 氮气的压强为101kPa和温度为0℃时,1体积水里最多能溶解0.024体积的氮气
【详解】
(1)自来水厂净水过程中使用了活性炭,这是因为活性炭具有吸附作用,可以吸附水中的色素和异味;
(2)常用肥皂水来鉴别硬水和软水,肥皂水在硬水中易起浮渣,在软水中泡沫较多,故实验步骤:取等量的水样于两支试管中,分别向其中滴加等量的肥皂水,振荡;实验现象及结论:产生较多泡沫的是软水,产生较少泡沫且有浮渣的是硬水;
(3)A、溶解度比较,应指明温度,否则无法比较,不符合题意;
B、20℃时,氯化钠的溶解度为36g,该温度下,100g水中最多溶解36g氯化钠,故将30g氯化钠加入50g水中,充分搅拌,所得溶液中溶质的质量分数为:,不符合题意;
C、由表可知,硝酸钾的溶解度受温度的影响较大,氯化钠的溶解度受温度的影响较小,分别将80℃时等质量的硝酸钾的饱和溶液和氯化钠的饱和溶液降温至30℃,析出硝酸钾晶体的质量比析出氯化钠晶体的质量大,饱和溶液的质量未知的情况下,无法比较,不符合题意;
D、硝酸钾的溶解度受温度的影响较大,氯化钠的溶解度受温度的影响较小,从含有少量氯化钠的硝酸钾的饱和溶液中得到较多的硝酸钾晶体,通常可采用冷却热饱和溶液的方法,符合题意。故选D。
(4)①实验步骤依次为:计算、称量、量取、溶解;
用量筒量取所需的水时,若采用仰视的方法读数,读取数值小于实际数值,使量取水的质量偏大,溶液质量偏大,配制的氯化钠溶液中溶质的质量分数会偏小;
②将20g质量分数为6%的氯化钠溶液与30g质量分数为4%的氯化钠溶液充分混合,所得溶液中溶质的质量分数为:;
(5)在0℃时,氮气的溶解度为0.024。这句话的含义是:氮气的压强为101kPa和温度为0℃时,1体积水里最多能溶解0.024体积的氮气。
21.(1)锥形瓶
(2)C
(3)燃着的木条放在集气瓶口
(4)设生成4.4g二氧化碳需要HCl的质量为x。
x=7.3g。
盐酸的质量分数为:。
答:盐酸的质量分数为14.6%。
【分析】
(1)
仪器A的名称是锥形瓶;
(2)
实验室用大理石和稀盐酸制取CO2,反应条件不需要加热,反应物的状态是固体和液体,不需要酒精灯;并用向上排空气法收集;组装整套装置时,可选用图中的A、B、H、I、J、L、P和C;
(3)
因为二氧化碳的密度比空气大,不燃烧也不支持燃烧,所以利用组装完毕后的装置制取CO2气体时 ,验满的操作是:把燃着的木条放在集气瓶口,若木条熄灭则集满;
(4)
详见答案。
22. 增大 CO2+H2O=H2CO3 分子间间隔 22:3 6FeO+CO22Fe3O4+C 催化作用
解:设2L人造树叶工作一天得到的乙醇的质量为x
m(溶液)=1012g÷70%=1445.7g
答:制得溶质质量分数为70%的乙醇溶液的质量1445.7g
【详解】
Ⅰ压强越大,气体溶解度越大,加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度增大,捕集CO2后的溶液可以使紫色石蕊试液变红,原因是二氧化碳和水生成了碳酸,化学方程式:CO2+H2O=H2CO3,故填:增大;CO2+H2O=H2CO3。
Ⅱ(1)对CO2气体加压、降温,分子间隔变小,可获得干冰,从微观角度分析,该过程主要改变的是分子间间隔,故填:分子间间隔。
(2)由微观示意图可知,二氧化碳和氢气生成甲醇和水,化学方程式CO2+3H2CH3OH+H2O, 生成甲醇时参加反应的CO2与H2的质量比44:(2×3)=22:3,故填:22:3。
(3)①图中反应2氧化亚铁和二氧化碳生成四氧化三铁和碳,化学方程式6FeO+CO22Fe3O4+C,故填:6FeO+CO22Fe3O4+C。
②该工艺中Fe3O4改变了反应速度,质量和化学性质没变,是催化剂起到催化作用,故填:催化作用。答案第1页,共2页
