6.4珍惜和保护金属资源同步练习 -2021-2022学年九年级化学科粤版(2012)下册(word版有答案)
文档属性
| 名称 | 6.4珍惜和保护金属资源同步练习 -2021-2022学年九年级化学科粤版(2012)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 347.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-28 16:25:08 | ||
图片预览



文档简介
科粤版九年级化学下册 6.4 珍惜和保护金属资源 同步练习
一、单选题
1.铁是目前世界上使用量最大的金属,下列关于铁的说法正确的是
A.铁部分锈蚀后没有回收价值
B.铁是地壳中含量最丰富的金属元素
C.铁生锈后,产生的铁锈能阻止铁继续被锈蚀
D.铁生锈是铁与空气中的氧气、水蒸气等发生化学反应的过程
2.下列措施中,不能防止金属制品锈蚀的是( )
A.在表面刷漆 B.在表面涂油 C.在表面镀铬 D.用湿布擦拭
3.如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )
①一段时间后,铁丝会由下向上出现锈蚀现象
②一段时间后,水面处铁丝锈蚀严重
③一段时间后,塑料瓶会变膨胀,因为铁生锈要放热
④一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关
A.①② B.②④ C.②③ D.③④
4.菜刀在生活中有重要应用。下列情况中,菜刀腐蚀由快到慢的是:①切青菜后用清水冲洗;②切湿咸菜后未清洗; ③切肥猪肉后放置。
A.①③② B.③①② C.③②① D.②①③
5.如图是探究铁器锈蚀条件的装置。调节L端与R端的液面高度使之相同,塞紧橡皮塞,一周后观察。下列说法错误的是
A.a管中在靠近水面上方且近水面处铁钉上有明显的锈迹
B.L端液面低于R端
C.a管中铁钉明显生锈,b管中铁钉几乎不生锈
D.若将a管中的水改为海水则铁钉生锈更严重
6.世界每年因锈蚀而损失的金属数量巨大,防止金属锈蚀以成为科学研究中的重大问题。下列有关金属锈蚀与保护措施中不正确的是
A.铁锈蚀的实质是铁与空气中的氧气、水蒸气等发生了化学变化
B.同样的铁制品在海南比在兰州更易锈蚀
C.在铁表面刷油漆可以防止铁锈蚀
D.铝的抗锈蚀性能比铁强,生活中可用钢丝球洗刷铝锅
7.下列措施不能在一定程度上防止金属生锈的是
A.在金属表面涂油或刷漆 B.在金属表面镀上一层耐腐蚀的铬
C.制成耐腐蚀的合金 D.用砂纸擦去铝制品表面的氧化膜
8.下列有关金属铁的说法合理的是
A.生铁是纯净物
B.将铁片放入氯化铜溶液中,反应后溶液质量增大
C.在铁制暖气片上刷铝粉可防止铁生锈
D.一氧化碳在高温条件下还原氧化铁发生的是置换反应
9.分别向a、b两支试管中加入形状和大小完全相同的铁片,再向a中加入植物油,均塞上橡皮塞,U型玻璃管内为红墨水(开始时两端液面水平),如下图所示,放置一段时间后,以下说法错误的是( )
A.植物油用于隔绝氧气和水 B.b试管中的铁片被腐蚀
C.U型玻璃管两端的液面变为右低左高 D.U型玻璃管两端的液面变为左低右高
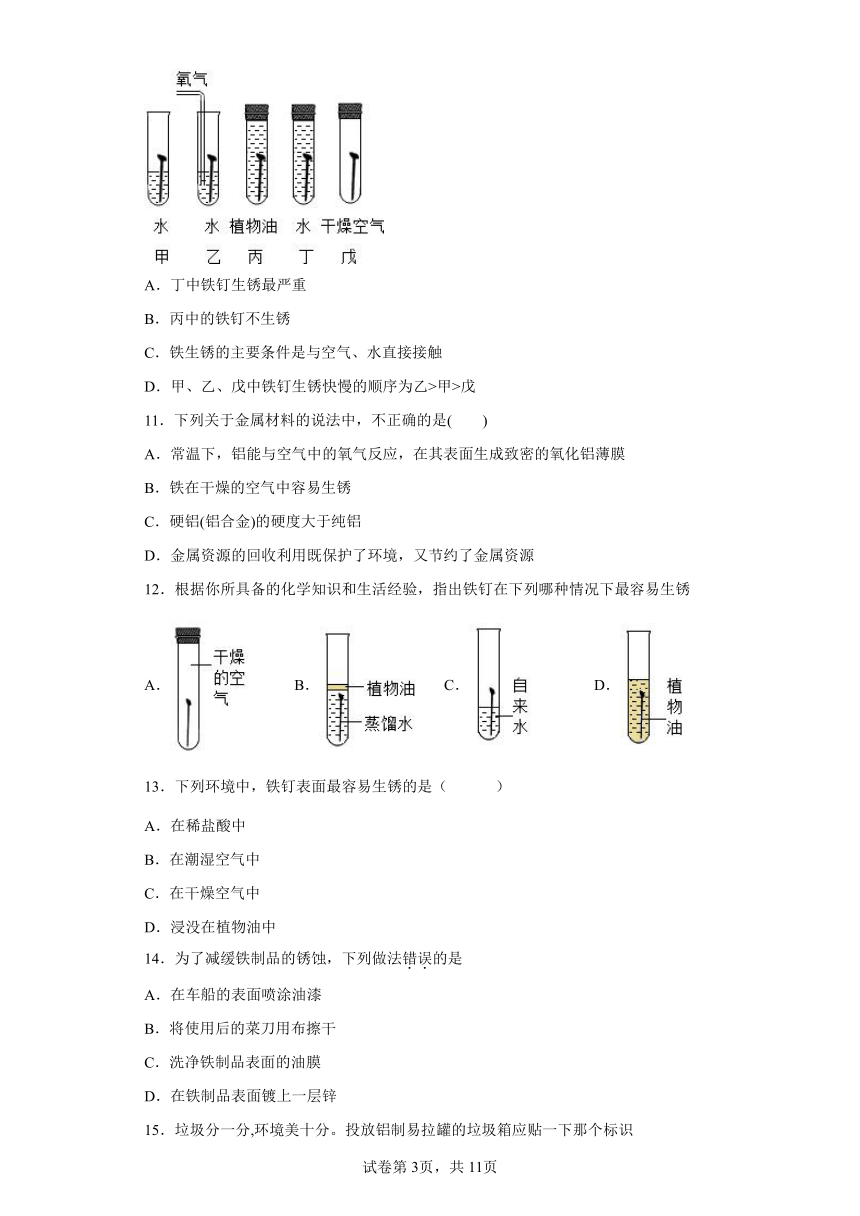
10.如图是探究铁制品锈蚀的条件时做的五个实验(铁钉在不同环境中),实验一段时间后,得出的结论错误的是( )
A.丁中铁钉生锈最严重
B.丙中的铁钉不生锈
C.铁生锈的主要条件是与空气、水直接接触
D.甲、乙、戊中铁钉生锈快慢的顺序为乙>甲>戊
11.下列关于金属材料的说法中,不正确的是( )
A.常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜
B.铁在干燥的空气中容易生锈
C.硬铝(铝合金)的硬度大于纯铝
D.金属资源的回收利用既保护了环境,又节约了金属资源
12.根据你所具备的化学知识和生活经验,指出铁钉在下列哪种情况下最容易生锈
A. B. C. D.
13.下列环境中,铁钉表面最容易生锈的是( )
A.在稀盐酸中
B.在潮湿空气中
C.在干燥空气中
D.浸没在植物油中
14.为了减缓铁制品的锈蚀,下列做法错误的是
A.在车船的表面喷涂油漆
B.将使用后的菜刀用布擦干
C.洗净铁制品表面的油膜
D.在铁制品表面镀上一层锌
15.垃圾分一分,环境美十分。投放铝制易拉罐的垃圾箱应贴一下那个标识
A.可回收物 B.厨余垃圾
C.有害垃圾 D.其他垃圾
16.细心的同学会注意到在面盆、痰盂等铁制品表面有烧制搪瓷,其目的是( )
A.增大硬度防止撞坏 B.增大厚度防止磨损
C.防止铁生锈且美观 D.美观和杀菌消毒作用
二、综合应用题
17.我国城市高铁和地铁的开通运行,给天们的生活带来了很多便利。高铁和地铁的建设广泛使用了金属材料。
(1)地铁建没中使用了钢轨,钢轨长时间使用后会生锈,写出用稀盐酸除去铁锈的化学方程式__________。写出防止铁制品锈蚀的一种常用方法___________。
(2)防止金属锈蚀是保护金属资源的有效途径之一。下列情况铁最不容易生锈的是__________(填序号)。
①部分浸没在海水中少许 ②在潮湿空气中 ③浸没在植物油中
(3)我国的高铁技术在当今世界上遥遥领先,其中铁轨用锰钢而不使用纯铁的原因是__________,已知锰的金属活动性介于镁和锌之间,下列试剂能够验证铁和锰的金属活动性强弱的是__________。
A铁、锰、硫酸锌溶液
B铁、锰、硫酸镁溶液
C铜、硫酸亚铁溶液、硫酸锰溶液
18.化学是一门以实验为基础的科学,实验是科学探究的重要手段。
(1)控制变量法是实验探究的重要方法。根据下图所示实验回答问题:
①甲图实验中,使紫色干花(用石蕊溶液浸泡过)变红的物质是______。(填化学式)
②乙图实验中用煮沸过蒸馏水的目的是______,实验①③对比说明铁生锈需要的条件是______。
(2)如图是我们学过的几个重要实验,分析实验,回答问题:
①图甲实验为测定空气中氧气体积分数的实验,在瓶内加少量水并将水面上方空间分为5等份,接下来的实验步骤依次为______(填字母),最后打开弹簧夹。
A.冷却到室温 B.弹簧夹夹紧橡皮管 C.点燃燃烧匙内的红磷后,立即伸入瓶中
②图乙为自制简易净水器,如果要检验净化后的水是软水还是硬水,生活中常用的试剂是______。
③图丙实验中能够说明物质燃烧需要达到可燃物着火点的现象是______。
(3)小莉想测定Cu-Zn合金和Cu-Ag合金中铜的质量分数,实验室只提供了一瓶未标明溶质质量分数的稀盐酸和必要的仪器。
①你认为她能测出铜的质量分数的合金是______合金。
②小莉取该合金的粉末32.5g,与足量该盐酸充分反应后,经测定产生了0.4g气体,请你帮助她计算出该合金中铜的质量分数______。
19.化学兴趣小组同学参观了某钢铁公司。
I.大家对矿石选取、冶炼和炼钢的工艺流程(如图)、生铁和钢的区别等,有了全新的认识。
(1)钢铁是使用最多的金属材料。生铁和钢是含碳量不同的两种铁合金,其中生铁的含碳量______(填“大于”或“小于”)钢的含碳量。
(2)分析工艺流程,写出三脱装置中P发生反应的化学方程式__________。
(3)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中___________的作用(填一种仪器的名称)。
(4)在钢制成品表面“涂层”的目的是:防止钢制成品中的铁与空气中的________发生化学反应而生锈。
II.兴趣小组同学在化学实验室进行了有关铁的性质的一些基本实验。
(5)某同学收集一瓶氧气做A实验,在引燃的火柴快燃尽时将细铁丝插入集气瓶中,观察到剧烈燃烧、火星四射的现象,写出发生反应的化学方程式_________。
(6)若B中液体为硫酸铜溶液,观察到的现象是_________。
(7)钢铁的使用是人类文明和进步的重要标志。某钢铁公司用500t含氧化铁64%的赤铁矿石进行炼铁,计算这些矿石理论上能炼得铁多少吨________?(请利用化学方程式进行计算,并在答题纸上写出完整的计算过程)
20.金属材料是日常生活中应用广泛的材料,请回答下列与金属有关的问题。
(一)、金属材料及性质
(1)工业上从含有金属元素并有开采价值的矿石提炼金属,以下金属矿石中可用于 冶炼铝的是_______(填序号)。
(2)①金属材料包括纯金属以及它们的_______。
②铁制品锈蚀的主要条件是铁与_______和_______接触。
(3)已知Cr+FeSO4═Fe+CrSO4,则Fe、Cr、Hg三种金属的活动性由强到弱的顺序是_______。
(4)将一定量镁粉、锌粉的混合物加入到适量硝酸亚铁和硝酸银的混合溶液中,充分反应后,过滤,得到滤渣和滤液,下列说法正确的是_______(填序号)。
A 滤液中一定有硝酸镁,滤渣中一定有银
B 若滤液为无色,则滤渣中一定有锌
C 取少量滤液,加入氯化钠溶液,无明显现象,则滤渣中一定有铁
D 取少量滤渣,加入过量稀盐酸,产生气泡,则滤渣的组成有3种情况。
(二)制备氯化铜
氯化亚铜(CuCl2)广泛应用于冶金、电镀、医药等行业。已知CuCl难溶于水和乙醇,在潮湿空气中易变质。CuCl2的制备流程如下:
(1)“反应”中发生的化学变化是2CuCl2+Na2SO3=2CuCl2↓+2NaCl+SO3,产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为_______。
(2)“操作a”的名称是_______。本流程中可以循环利用的物质(水除外)是_______(写化学式)。
(3)可用“水洗”的原因是_______,“醇洗”的目的是_______。
(三)定量分析
铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等。
(1)写出赤铁矿石中的主要成分与一氧化碳反应的化学方程式_______。
(2)冶炼2900t含四氧化三铁80%的磁铁矿石,理论上能得到含杂质2%的生铁的质量是_______ t(结果精确到0.1)。
(3)含有锌粉6.5g、铁粉5.6g、铜粉3.2g、铝粉l。8g的混合物与一定质量的稀硫酸充分反应,反应停止后,有6g固体剩余。则生成氢气的质量为_______g。
21.人类文明的发展和社会的进步与材料密切相关。请根据相关信息回答下列问题:
(1)解码智慧冬奥:
①2022年北京冬奥会,碲化镉发电玻璃成为绿色和科技办奥交汇的创新点。如图是碲的原子结构示意图,有关信息正确的是______。
A.碲是金属元素 B.碲的核电荷数为52
C.相对原子质量为127.6g D.蹄元素位于第六周期
②氢能“黑科技”将亮相北京冬奥会。冬奥会“飞扬”火炬科技亮点之一是采用氢气作为燃料,其优点是什么______(答出一点);写出氢气燃烧的化学方程式______。
③冬奥会国家速滑馆“冰丝带”采用面向未来的单层双向正交马鞍形索网结构,减少屋顶所用钢材2800吨。金属资源储量有限,钢铁生锈是世界面临的难题。铁生锈的主要条件是什么______。
(2)近年来,我国高铁建设飞速发展,建造高铁需要大量的钢铁。图为模拟炼铁的装置,写出a中发生反应的化学方程式______;描述b处反应的现象______。
(3)2021年12月8日,我国首座大型二氧化碳循环发电机组投入运行。实验室若用500g含碳酸钙80%的石灰石与足量的稀盐酸反应,可制得二氧化碳多少g?
22.钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
Ⅰ.铁的冶炼
工业炼铁的原理是高温下用CO作还原剂,将铁从其氧化物中还原出来。请回答下列问题:
(1)写出以赤铁矿为原料,高炉炼铁的化学方程式:_____________;
(2)高炉炼铁中,焦炭的作用除了可以提供热量外,还能________(用化学方程式表示)。
Ⅱ.实验探究炼铁原理:
用如图装置完成CO还原Fe2O3的实验。缓慢通入一定量CO,点燃酒精喷灯,继续通入CO。一段时间后,当粉末全部变为黑色时,停止通入CO,熄灭酒精喷灯。
(1)实验开始先缓慢通入一定量的CO,再点燃酒精喷灯的目的是____;
(2)气球的作用是______。
Ⅲ.铁的锈蚀与防护
创新意识与科学探究是我们应该逐步形成的必备品格和关键能力。化学兴趣小组对“铁的生锈”进行了如下创新探究。
一、探究铁粉型“暖宝宝”反应原理与铁的生锈本质是否一致(夹持仪器已略去)。
【资料信息】
①“暖宝宝”的主要成分:铁粉、水、活性炭、蛭石、吸水性树酯、食盐。
②蛭石是当今世界首屈一指的超级保温材料。
③吸水性树脂是一种新型高分子材料,能吸收自身重量几百到几千倍的水分,吸水、保水能力均很强,并可反复释水、吸水。
【实验准备】按如图连接装置,设计采集频率、采集时间,将拆除包装的暖宝宝倒入三颈烧瓶中,密封装置,点击电脑屏幕上的“开始采集”按钮,观察电脑屏幕上的曲线变化。
【实验结果】见下图
【实验思考】
(1)分析图象可知:____曲线与探究一不相符,原因可能与“暖宝宝”原材料中的______有关。
(2)铁钉生锈需较长时间,而“暖宝宝”能快速反应的原因可能是______
a.铁粉与其他物质的接触面积大加快了铁粉的锈蚀速率
b.蛭石的保温作用加快了铁粉的生锈速率
c.“暖宝宝”中氧气含量更高
由此可见,“暖宝宝”的反应原理与铁的生锈本质是一致的。
Ⅳ.测定废铁屑中单质铁的质量,并制取硫酸亚铁晶体(FeSO4 7H2O)。
某兴趣小组设计实验测定废铁屑中单质铁的质量,并制取硫酸亚铁晶体(FeSO4 7H2O)。废铁屑的主要成分是铁,同时还有少量氧化铁和碳。实验过程如下图所示。
(1)在反应器中,除了Fe与H2SO4发生反应,还发生的反应有____(写出化学反应方程式)和Fe2(SO4)3+Fe=3FeSO4。
(2)滤液M中肯定含有的溶质的化学式是_______。
(3)在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和______。
(4)滤液M经过操作B可得硫酸亚铁晶体(FeSO4 7H2O)。
已知硫酸亚铁的溶解度和析出晶体的组成如下表:
温度/℃ 0 10 30 40 50 60 64 70 80 90
溶解度/g 15.6 20.5 33.0 40.4 48.8 55.0 55.3 50.6 43.7
析出晶体 FeSO4 7H2O FeSO4 4H2O FeSO4 H2O
根据上表,硫酸亚铁晶体(FeSO4 7H2O)冷却结晶温度最高不超过____℃。
(5)甲同学根据产生氢气的质量计算出废铁屑中单质铁的质量为_____g,乙同学认为不合理,原因是______
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.D
3.B
4.D
5.B
6.D
7.D
8.C
9.C
10.A
11.B
12.C
13.B
14.C
15.A
16.C
17. 刷漆(涂油等合理即可) ③ 锰钢比纯铁的硬度大(合理即可) A
18.(1) H2CO3 排出溶解在水中少量的氧气 需要与水接触
(2) BCA 肥皂水 空气中白磷燃烧、红磷不燃烧
(3) Cu-Zn 60%
19.(1)大于
(2)
(3)玻璃棒
(4)氧气和水
(5)
(6)铁钉表面有红色固体析出,溶液由蓝色变为浅绿色
(7)解:设这些矿石理论上能炼得铁的质量为x
x=224t
答:这些矿石理论上能炼得铁的质量为224t
20. ③ 合金 氧气 水 Cr>Fe>Hg AD SO3+H2O═H2SO4 过滤 NaCl 能够除去可溶性杂质 可以除去水,防止在后续步骤中CuCl变质 1714.3 0.5
21.(1) B 燃烧产物是水,无污染 铁与O2、H2O等同时接触
(2) 澄清石灰水变浑浊
(3)176g
解:设:可制得二氧化碳的质量为x,
答:可制得二氧化碳176g。
22. 排出装置内的空气 收集尾气 时间—湿度曲线 吸水性树脂 ab H2SO4、FeSO4 漏斗 64 5.6g 铁还和硫酸铁反应,所以废铁屑中的铁单质质量应大于5.6g;
答案第1页,共2页
答案第1页,共2页
一、单选题
1.铁是目前世界上使用量最大的金属,下列关于铁的说法正确的是
A.铁部分锈蚀后没有回收价值
B.铁是地壳中含量最丰富的金属元素
C.铁生锈后,产生的铁锈能阻止铁继续被锈蚀
D.铁生锈是铁与空气中的氧气、水蒸气等发生化学反应的过程
2.下列措施中,不能防止金属制品锈蚀的是( )
A.在表面刷漆 B.在表面涂油 C.在表面镀铬 D.用湿布擦拭
3.如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )
①一段时间后,铁丝会由下向上出现锈蚀现象
②一段时间后,水面处铁丝锈蚀严重
③一段时间后,塑料瓶会变膨胀,因为铁生锈要放热
④一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关
A.①② B.②④ C.②③ D.③④
4.菜刀在生活中有重要应用。下列情况中,菜刀腐蚀由快到慢的是:①切青菜后用清水冲洗;②切湿咸菜后未清洗; ③切肥猪肉后放置。
A.①③② B.③①② C.③②① D.②①③
5.如图是探究铁器锈蚀条件的装置。调节L端与R端的液面高度使之相同,塞紧橡皮塞,一周后观察。下列说法错误的是
A.a管中在靠近水面上方且近水面处铁钉上有明显的锈迹
B.L端液面低于R端
C.a管中铁钉明显生锈,b管中铁钉几乎不生锈
D.若将a管中的水改为海水则铁钉生锈更严重
6.世界每年因锈蚀而损失的金属数量巨大,防止金属锈蚀以成为科学研究中的重大问题。下列有关金属锈蚀与保护措施中不正确的是
A.铁锈蚀的实质是铁与空气中的氧气、水蒸气等发生了化学变化
B.同样的铁制品在海南比在兰州更易锈蚀
C.在铁表面刷油漆可以防止铁锈蚀
D.铝的抗锈蚀性能比铁强,生活中可用钢丝球洗刷铝锅
7.下列措施不能在一定程度上防止金属生锈的是
A.在金属表面涂油或刷漆 B.在金属表面镀上一层耐腐蚀的铬
C.制成耐腐蚀的合金 D.用砂纸擦去铝制品表面的氧化膜
8.下列有关金属铁的说法合理的是
A.生铁是纯净物
B.将铁片放入氯化铜溶液中,反应后溶液质量增大
C.在铁制暖气片上刷铝粉可防止铁生锈
D.一氧化碳在高温条件下还原氧化铁发生的是置换反应
9.分别向a、b两支试管中加入形状和大小完全相同的铁片,再向a中加入植物油,均塞上橡皮塞,U型玻璃管内为红墨水(开始时两端液面水平),如下图所示,放置一段时间后,以下说法错误的是( )
A.植物油用于隔绝氧气和水 B.b试管中的铁片被腐蚀
C.U型玻璃管两端的液面变为右低左高 D.U型玻璃管两端的液面变为左低右高
10.如图是探究铁制品锈蚀的条件时做的五个实验(铁钉在不同环境中),实验一段时间后,得出的结论错误的是( )
A.丁中铁钉生锈最严重
B.丙中的铁钉不生锈
C.铁生锈的主要条件是与空气、水直接接触
D.甲、乙、戊中铁钉生锈快慢的顺序为乙>甲>戊
11.下列关于金属材料的说法中,不正确的是( )
A.常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜
B.铁在干燥的空气中容易生锈
C.硬铝(铝合金)的硬度大于纯铝
D.金属资源的回收利用既保护了环境,又节约了金属资源
12.根据你所具备的化学知识和生活经验,指出铁钉在下列哪种情况下最容易生锈
A. B. C. D.
13.下列环境中,铁钉表面最容易生锈的是( )
A.在稀盐酸中
B.在潮湿空气中
C.在干燥空气中
D.浸没在植物油中
14.为了减缓铁制品的锈蚀,下列做法错误的是
A.在车船的表面喷涂油漆
B.将使用后的菜刀用布擦干
C.洗净铁制品表面的油膜
D.在铁制品表面镀上一层锌
15.垃圾分一分,环境美十分。投放铝制易拉罐的垃圾箱应贴一下那个标识
A.可回收物 B.厨余垃圾
C.有害垃圾 D.其他垃圾
16.细心的同学会注意到在面盆、痰盂等铁制品表面有烧制搪瓷,其目的是( )
A.增大硬度防止撞坏 B.增大厚度防止磨损
C.防止铁生锈且美观 D.美观和杀菌消毒作用
二、综合应用题
17.我国城市高铁和地铁的开通运行,给天们的生活带来了很多便利。高铁和地铁的建设广泛使用了金属材料。
(1)地铁建没中使用了钢轨,钢轨长时间使用后会生锈,写出用稀盐酸除去铁锈的化学方程式__________。写出防止铁制品锈蚀的一种常用方法___________。
(2)防止金属锈蚀是保护金属资源的有效途径之一。下列情况铁最不容易生锈的是__________(填序号)。
①部分浸没在海水中少许 ②在潮湿空气中 ③浸没在植物油中
(3)我国的高铁技术在当今世界上遥遥领先,其中铁轨用锰钢而不使用纯铁的原因是__________,已知锰的金属活动性介于镁和锌之间,下列试剂能够验证铁和锰的金属活动性强弱的是__________。
A铁、锰、硫酸锌溶液
B铁、锰、硫酸镁溶液
C铜、硫酸亚铁溶液、硫酸锰溶液
18.化学是一门以实验为基础的科学,实验是科学探究的重要手段。
(1)控制变量法是实验探究的重要方法。根据下图所示实验回答问题:
①甲图实验中,使紫色干花(用石蕊溶液浸泡过)变红的物质是______。(填化学式)
②乙图实验中用煮沸过蒸馏水的目的是______,实验①③对比说明铁生锈需要的条件是______。
(2)如图是我们学过的几个重要实验,分析实验,回答问题:
①图甲实验为测定空气中氧气体积分数的实验,在瓶内加少量水并将水面上方空间分为5等份,接下来的实验步骤依次为______(填字母),最后打开弹簧夹。
A.冷却到室温 B.弹簧夹夹紧橡皮管 C.点燃燃烧匙内的红磷后,立即伸入瓶中
②图乙为自制简易净水器,如果要检验净化后的水是软水还是硬水,生活中常用的试剂是______。
③图丙实验中能够说明物质燃烧需要达到可燃物着火点的现象是______。
(3)小莉想测定Cu-Zn合金和Cu-Ag合金中铜的质量分数,实验室只提供了一瓶未标明溶质质量分数的稀盐酸和必要的仪器。
①你认为她能测出铜的质量分数的合金是______合金。
②小莉取该合金的粉末32.5g,与足量该盐酸充分反应后,经测定产生了0.4g气体,请你帮助她计算出该合金中铜的质量分数______。
19.化学兴趣小组同学参观了某钢铁公司。
I.大家对矿石选取、冶炼和炼钢的工艺流程(如图)、生铁和钢的区别等,有了全新的认识。
(1)钢铁是使用最多的金属材料。生铁和钢是含碳量不同的两种铁合金,其中生铁的含碳量______(填“大于”或“小于”)钢的含碳量。
(2)分析工艺流程,写出三脱装置中P发生反应的化学方程式__________。
(3)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中___________的作用(填一种仪器的名称)。
(4)在钢制成品表面“涂层”的目的是:防止钢制成品中的铁与空气中的________发生化学反应而生锈。
II.兴趣小组同学在化学实验室进行了有关铁的性质的一些基本实验。
(5)某同学收集一瓶氧气做A实验,在引燃的火柴快燃尽时将细铁丝插入集气瓶中,观察到剧烈燃烧、火星四射的现象,写出发生反应的化学方程式_________。
(6)若B中液体为硫酸铜溶液,观察到的现象是_________。
(7)钢铁的使用是人类文明和进步的重要标志。某钢铁公司用500t含氧化铁64%的赤铁矿石进行炼铁,计算这些矿石理论上能炼得铁多少吨________?(请利用化学方程式进行计算,并在答题纸上写出完整的计算过程)
20.金属材料是日常生活中应用广泛的材料,请回答下列与金属有关的问题。
(一)、金属材料及性质
(1)工业上从含有金属元素并有开采价值的矿石提炼金属,以下金属矿石中可用于 冶炼铝的是_______(填序号)。
(2)①金属材料包括纯金属以及它们的_______。
②铁制品锈蚀的主要条件是铁与_______和_______接触。
(3)已知Cr+FeSO4═Fe+CrSO4,则Fe、Cr、Hg三种金属的活动性由强到弱的顺序是_______。
(4)将一定量镁粉、锌粉的混合物加入到适量硝酸亚铁和硝酸银的混合溶液中,充分反应后,过滤,得到滤渣和滤液,下列说法正确的是_______(填序号)。
A 滤液中一定有硝酸镁,滤渣中一定有银
B 若滤液为无色,则滤渣中一定有锌
C 取少量滤液,加入氯化钠溶液,无明显现象,则滤渣中一定有铁
D 取少量滤渣,加入过量稀盐酸,产生气泡,则滤渣的组成有3种情况。
(二)制备氯化铜
氯化亚铜(CuCl2)广泛应用于冶金、电镀、医药等行业。已知CuCl难溶于水和乙醇,在潮湿空气中易变质。CuCl2的制备流程如下:
(1)“反应”中发生的化学变化是2CuCl2+Na2SO3=2CuCl2↓+2NaCl+SO3,产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为_______。
(2)“操作a”的名称是_______。本流程中可以循环利用的物质(水除外)是_______(写化学式)。
(3)可用“水洗”的原因是_______,“醇洗”的目的是_______。
(三)定量分析
铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等。
(1)写出赤铁矿石中的主要成分与一氧化碳反应的化学方程式_______。
(2)冶炼2900t含四氧化三铁80%的磁铁矿石,理论上能得到含杂质2%的生铁的质量是_______ t(结果精确到0.1)。
(3)含有锌粉6.5g、铁粉5.6g、铜粉3.2g、铝粉l。8g的混合物与一定质量的稀硫酸充分反应,反应停止后,有6g固体剩余。则生成氢气的质量为_______g。
21.人类文明的发展和社会的进步与材料密切相关。请根据相关信息回答下列问题:
(1)解码智慧冬奥:
①2022年北京冬奥会,碲化镉发电玻璃成为绿色和科技办奥交汇的创新点。如图是碲的原子结构示意图,有关信息正确的是______。
A.碲是金属元素 B.碲的核电荷数为52
C.相对原子质量为127.6g D.蹄元素位于第六周期
②氢能“黑科技”将亮相北京冬奥会。冬奥会“飞扬”火炬科技亮点之一是采用氢气作为燃料,其优点是什么______(答出一点);写出氢气燃烧的化学方程式______。
③冬奥会国家速滑馆“冰丝带”采用面向未来的单层双向正交马鞍形索网结构,减少屋顶所用钢材2800吨。金属资源储量有限,钢铁生锈是世界面临的难题。铁生锈的主要条件是什么______。
(2)近年来,我国高铁建设飞速发展,建造高铁需要大量的钢铁。图为模拟炼铁的装置,写出a中发生反应的化学方程式______;描述b处反应的现象______。
(3)2021年12月8日,我国首座大型二氧化碳循环发电机组投入运行。实验室若用500g含碳酸钙80%的石灰石与足量的稀盐酸反应,可制得二氧化碳多少g?
22.钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
Ⅰ.铁的冶炼
工业炼铁的原理是高温下用CO作还原剂,将铁从其氧化物中还原出来。请回答下列问题:
(1)写出以赤铁矿为原料,高炉炼铁的化学方程式:_____________;
(2)高炉炼铁中,焦炭的作用除了可以提供热量外,还能________(用化学方程式表示)。
Ⅱ.实验探究炼铁原理:
用如图装置完成CO还原Fe2O3的实验。缓慢通入一定量CO,点燃酒精喷灯,继续通入CO。一段时间后,当粉末全部变为黑色时,停止通入CO,熄灭酒精喷灯。
(1)实验开始先缓慢通入一定量的CO,再点燃酒精喷灯的目的是____;
(2)气球的作用是______。
Ⅲ.铁的锈蚀与防护
创新意识与科学探究是我们应该逐步形成的必备品格和关键能力。化学兴趣小组对“铁的生锈”进行了如下创新探究。
一、探究铁粉型“暖宝宝”反应原理与铁的生锈本质是否一致(夹持仪器已略去)。
【资料信息】
①“暖宝宝”的主要成分:铁粉、水、活性炭、蛭石、吸水性树酯、食盐。
②蛭石是当今世界首屈一指的超级保温材料。
③吸水性树脂是一种新型高分子材料,能吸收自身重量几百到几千倍的水分,吸水、保水能力均很强,并可反复释水、吸水。
【实验准备】按如图连接装置,设计采集频率、采集时间,将拆除包装的暖宝宝倒入三颈烧瓶中,密封装置,点击电脑屏幕上的“开始采集”按钮,观察电脑屏幕上的曲线变化。
【实验结果】见下图
【实验思考】
(1)分析图象可知:____曲线与探究一不相符,原因可能与“暖宝宝”原材料中的______有关。
(2)铁钉生锈需较长时间,而“暖宝宝”能快速反应的原因可能是______
a.铁粉与其他物质的接触面积大加快了铁粉的锈蚀速率
b.蛭石的保温作用加快了铁粉的生锈速率
c.“暖宝宝”中氧气含量更高
由此可见,“暖宝宝”的反应原理与铁的生锈本质是一致的。
Ⅳ.测定废铁屑中单质铁的质量,并制取硫酸亚铁晶体(FeSO4 7H2O)。
某兴趣小组设计实验测定废铁屑中单质铁的质量,并制取硫酸亚铁晶体(FeSO4 7H2O)。废铁屑的主要成分是铁,同时还有少量氧化铁和碳。实验过程如下图所示。
(1)在反应器中,除了Fe与H2SO4发生反应,还发生的反应有____(写出化学反应方程式)和Fe2(SO4)3+Fe=3FeSO4。
(2)滤液M中肯定含有的溶质的化学式是_______。
(3)在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和______。
(4)滤液M经过操作B可得硫酸亚铁晶体(FeSO4 7H2O)。
已知硫酸亚铁的溶解度和析出晶体的组成如下表:
温度/℃ 0 10 30 40 50 60 64 70 80 90
溶解度/g 15.6 20.5 33.0 40.4 48.8 55.0 55.3 50.6 43.7
析出晶体 FeSO4 7H2O FeSO4 4H2O FeSO4 H2O
根据上表,硫酸亚铁晶体(FeSO4 7H2O)冷却结晶温度最高不超过____℃。
(5)甲同学根据产生氢气的质量计算出废铁屑中单质铁的质量为_____g,乙同学认为不合理,原因是______
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.D
3.B
4.D
5.B
6.D
7.D
8.C
9.C
10.A
11.B
12.C
13.B
14.C
15.A
16.C
17. 刷漆(涂油等合理即可) ③ 锰钢比纯铁的硬度大(合理即可) A
18.(1) H2CO3 排出溶解在水中少量的氧气 需要与水接触
(2) BCA 肥皂水 空气中白磷燃烧、红磷不燃烧
(3) Cu-Zn 60%
19.(1)大于
(2)
(3)玻璃棒
(4)氧气和水
(5)
(6)铁钉表面有红色固体析出,溶液由蓝色变为浅绿色
(7)解:设这些矿石理论上能炼得铁的质量为x
x=224t
答:这些矿石理论上能炼得铁的质量为224t
20. ③ 合金 氧气 水 Cr>Fe>Hg AD SO3+H2O═H2SO4 过滤 NaCl 能够除去可溶性杂质 可以除去水,防止在后续步骤中CuCl变质 1714.3 0.5
21.(1) B 燃烧产物是水,无污染 铁与O2、H2O等同时接触
(2) 澄清石灰水变浑浊
(3)176g
解:设:可制得二氧化碳的质量为x,
答:可制得二氧化碳176g。
22. 排出装置内的空气 收集尾气 时间—湿度曲线 吸水性树脂 ab H2SO4、FeSO4 漏斗 64 5.6g 铁还和硫酸铁反应,所以废铁屑中的铁单质质量应大于5.6g;
答案第1页,共2页
答案第1页,共2页
