8.3金属资源的利用和保护同步练习-2021-2022学年九年级化学人教版下册(word版有答案)
文档属性
| 名称 | 8.3金属资源的利用和保护同步练习-2021-2022学年九年级化学人教版下册(word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 265.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-28 00:00:00 | ||
图片预览



文档简介
人教版化学九下册 8.3 金属资源的利用和保护 同步练习
一、单选题
1.某同学的下列生活行为不符合环保理念的是( )
A.骑自行车上学 B.将废弃易拉罐丢入“可回收垃圾”桶
C.用洗菜的水冲厕所 D.夏季使用空调时,将温度调至最低
2.炼铁高炉中发生了下列反应:①高温下一氧化碳将铁矿石还原为铁 ②高温煅烧石灰石 ③灼热的焦炭和二氧化碳反应 ④焦炭充分燃烧 其中属于化合反应的是
A.①和④ B.②和③ C.③和④ D.只有④
3.已知:3CO + Fe2O3 2Fe + 3CO2,向装有20gFe2O3的硬质玻璃管中通入CO,加热反应一段时间后,测得玻璃 管中剩余固体质量为15.2g,则下列说法正确的是( )
A.该反应中,CO是氧化剂
B.反应生成Fe的质量为15.2g
C.反应生成CO2的质量为16.5g
D.参加反应的Fe2O3占原总质量的80%
4.下列有关金属材料的说法错误的是
A.在潮湿的空气中铁易生锈
B.金属的回收利用是保护金属资源的有效途径之一
C.铝和金都有很好的抗腐蚀性,是因为二者的化学性质都很稳定
D.高炉炼铁的原理是在高温条件下,用一氧化碳把铁从铁矿石里还原出来
5.如图为一氧化碳还原氧化铁实验。下列说法中正确的是( )
A.开始时应先预热玻璃管,后通入一氧化碳
B.实验中玻璃管里粉末由黑色逐渐变成红棕色
C.参加反应的氧化铁和一氧化碳质量比为40:7
D.将尾气点燃或收集,可防止一氧化碳污染空气
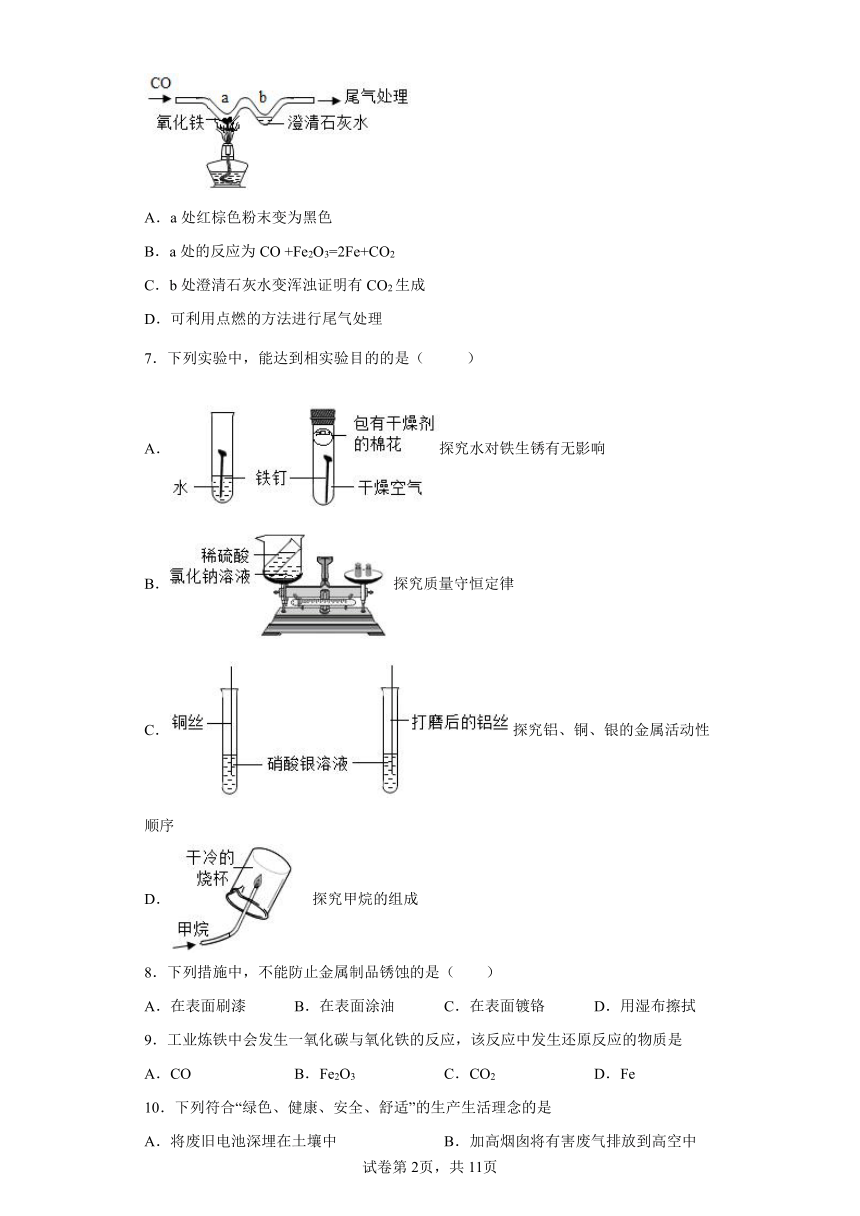
6.用“W”型玻璃管进行微型实验,如下图所示。下列说法不正确的是
A.a处红棕色粉末变为黑色
B.a处的反应为CO +Fe2O3=2Fe+CO2
C.b处澄清石灰水变浑浊证明有CO2生成
D.可利用点燃的方法进行尾气处理
7.下列实验中,能达到相实验目的的是( )
A.探究水对铁生锈有无影响
B.探究质量守恒定律
C.探究铝、铜、银的金属活动性顺序
D.探究甲烷的组成
8.下列措施中,不能防止金属制品锈蚀的是( )
A.在表面刷漆 B.在表面涂油 C.在表面镀铬 D.用湿布擦拭
9.工业炼铁中会发生一氧化碳与氧化铁的反应,该反应中发生还原反应的物质是
A.CO B.Fe2O3 C.CO2 D.Fe
10.下列符合“绿色、健康、安全、舒适”的生产生活理念的是
A.将废旧电池深埋在土壤中 B.加高烟囱将有害废气排放到高空中
C.大量使用一次性的木筷和餐盒 D.废弃口罩投入专用垃圾箱回收处理
11.用一氧化碳还原氧化铁的实验中,Fe2O3转化为铁的具体过程是: 。已知铁的氧化物除Fe2O3外,其余均为黑色。下列说法正确的是
A.装置中漏斗的作用是防止倒吸
B.通过实验现象可以判断氧化铁是否完全转化为铁
C.该实验中所有的化学反应里,氧元素的化合价均未改变
D.当硬质玻璃管内固体中铁元素的质量分数为74%时,固体成分是Fe3O4和FeO
12.如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )
①一段时间后,铁丝会由下向上出现锈蚀现象
②一段时间后,水面处铁丝锈蚀严重
③一段时间后,塑料瓶会变膨胀,因为铁生锈要放热
④一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关
A.①② B.②④ C.②③ D.③④
13.据探测卫星发回的数据分析,火星大气中95%是二氧化碳,其余为少量的氮气.氢气,还找到了有液态水存在的证据。根据以上信息,某同学作出如下推断:①火星大气是混合物②火星大气与地球大气成分相似③火星上钢铁不容易生锈 ④火星环境适宜人类生存⑤火星上温室效应显著。你认为正确的是
A.①③⑤ B.②③⑤ C.②③④ D.①④⑤
14.下列有关金属及合金的说法错误的是( )
A.常温下所有的金属都是固体
B.铁制品在潮湿的空气中易生锈
C.生铁和不锈钢都是金属材料
D.铝片表面易生成致密的氧化膜
15.通过对比实验可探究铁生锈的条件。下列实验设计与探究条件的对应关系正确的是
A.甲和乙:水
B.乙和丙:空气
C.甲和丙:空气
D.甲和丁:水
16.保护金属资源的有效途径,不包括下列的( )
A.合理开采矿物 B.寻找金属替代品
C.回收利用金属 D.禁止使用铁制品
二、综合应用题
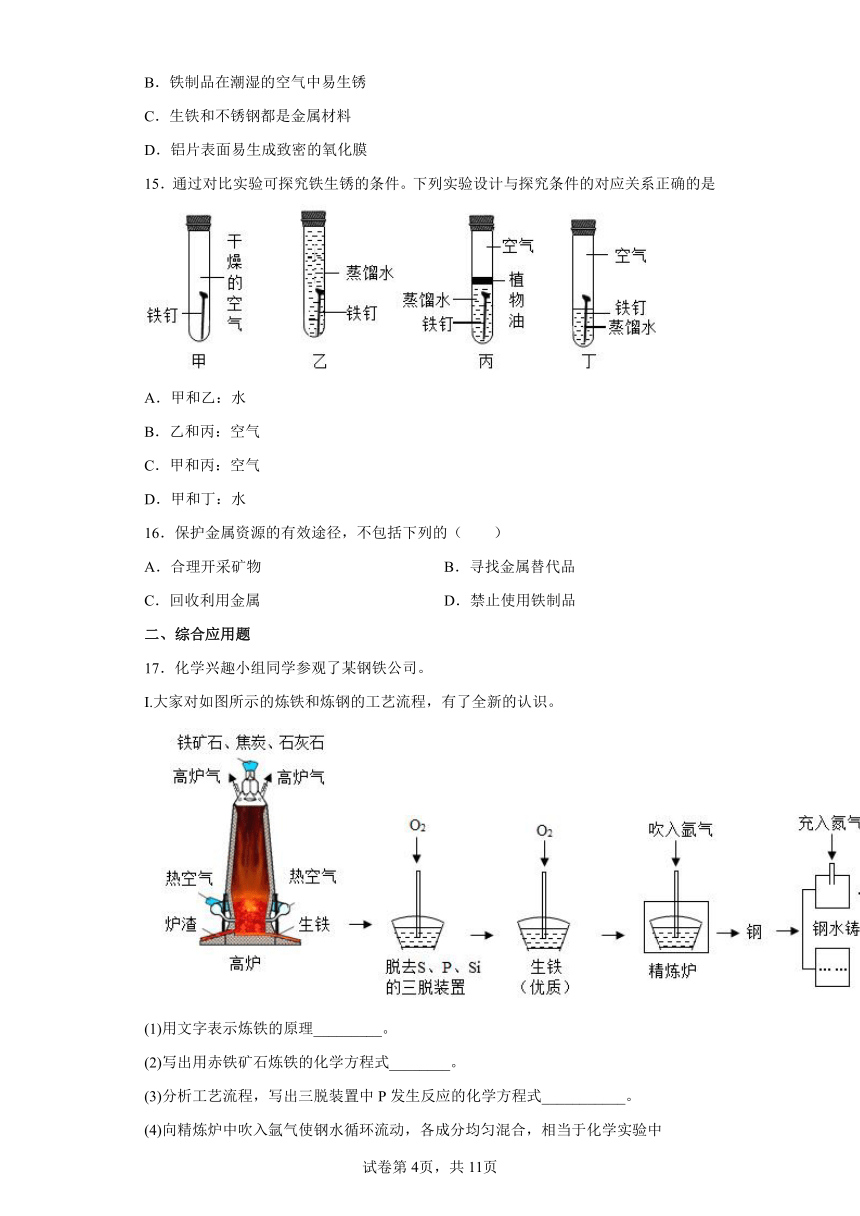
17.化学兴趣小组同学参观了某钢铁公司。
I.大家对如图所示的炼铁和炼钢的工艺流程,有了全新的认识。
(1)用文字表示炼铁的原理_________。
(2)写出用赤铁矿石炼铁的化学方程式________。
(3)分析工艺流程,写出三脱装置中P发生反应的化学方程式___________。
(4)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中_______(填一种仪器的名称)的作用。
(5)在钢水铸件机中,高温钢加工成钢制零件时,充入氮气做保护气,主要因为氮气_________。
(6)在钢制成品表面“涂层”的目的是防止钢制成品中的铁与空气中的___发生化学反应而生锈。
Ⅱ.兴趣小组同学在化学实验室进行了有关铁的性质的一些基本实验。
(7)某同学用向上排空气法收集一瓶氧气做A实验,在引燃的火柴快燃尽时将细铁丝插入集气瓶中,实验现象为______,放热。
(8)试管B中装有硫酸铜溶液,发生的化学方程式为______,铁能和硫酸铜溶液反应的原因是_____。
(9)兴趣小组同学用13g锌与足量盐酸反应,理论上可生成氢气的质量是_______?(请利用化学方程式进行计算,并在答题纸上写出完整的计算过程)
(10)若兴趣小组改用13g镁铝合金与足量盐酸反应,则生成氢气的质量比用13g锌反应_____(填“小”"或“相等”或“大”)。
18.如图所示为实验室常用的实验装置,回答问题:
(1)实验室用锌和稀硫酸制取氢气,应选用的制取装置一套为______(填序号,下同),该反应的化学方程式为______。
(2)实验室常用稀盐酸和石灰石反应制CO2,应选用的制取装置一套为______,该反应的化学方程式为______。
(3)此外,也可用加热碳酸氢钠(NaHCO3)固体(产物为碳酸钠、二氧化碳、水)来制取CO2,该反应的化学方程式为______,若用此法来制取CO2,应选用的发生装置为______。
(4)若用如图装置采用排水法收集H2,请简述操作步骤。
(5)某赤铁矿石中含Fe2O3为80%,用2000吨这种矿石可冶炼出含杂质为4%的生铁多少吨?(精确到0.1)
19.铜及其化合物在生产、生活中都有广泛的应用。
一、铜的性质及其应用
兔首和鼠首均为青铜器(铜、锡合金),表面呈绿色,这是铜器长期暴露在空气中生成了铜锈(铜锈俗称铜绿)。铜绿化学式是Cu2(OH)2CO3,它受热会分解生成三种氧化物。青铜器属于无机材料
(1)铜绿分解的化学方程式为_____。
(2)为了弄清铜生成铜绿的条件,某化学实验小组借鉴课本“铁钉锈蚀条件的探究”实验,设计了“铜片锈蚀条件的探究”实验,实验如下图所示(所用铜片洁净、光亮,试管内的“”为铜片)。
实验较长时间后,发现_____(填试管编号)试管中铜片最先生锈。小组讨论后发现实验还不够完善,要得出正确的结论,还要补充一个实验。你认为要补充的一个实验是:Cu和______(写出试管中需要的物质)。可以省略不做的实验是试管_____(填试管编号)。
二、铜的制备研究
铜可采用如下方法制备:
方法一:火法炼铜:Cu2S+O22Cu+SO2
方法二:湿法炼铜:CuSO4+Fe=FeSO4+Cu
上述两种方法中,你认为哪种方法更好_____,原因是_____(写出1条原因即可)。辉铜矿的主要成分为Cu2S,常用于火法炼铜。若生成过程中铜元素的转化率为90%,生产64tCu需要含Cu2S 80%的辉铜矿_____t(取整数)。
(3)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,6Na2CO3+3Fe2(SO4)3+6H2O=2NaFe3(OH)6(SO4)2+6CO2↑+5_____。
(4)加入Na2CO3沉淀时,反应液pH对产品中的SO42- 含量以及反应液中Cu2+沉淀效率的影响如下图所示,第二次沉淀时溶液pH最好控制在_______。
(5)所制得的碱式碳酸铜的组成可表示为:xCuCO3·yCu(OH)2·zH2O。某研究小组设计如上图实验装置测定其中CuCO3的质量分数(不考虑植物油中溶解CO2产生的影响)。
实验步骤如下:①连接装置并 ;②准确称量样品的质量1.2g;③装药品,调节量气装置两边液面相平,读取量气管刻度为10mL;④向锥形瓶内加入50mL(足量)的稀硫酸,充分反应;⑤冷却到室温;⑥再次调节量气装置两边液面相平,读取量气管刻度为172ml。
Ⅰ.请将上述实验步骤补充完整_______;
Ⅱ.装置B的作用是_______,少量植物油的作用是_______,C中的试剂是_______(填字母序号);
a 碱石灰 b 浓硫酸 c 无水硫酸铜
Ⅲ.步骤⑥中调节液面相平的操作是将水准管_______(填“缓慢上移”或“缓慢下移”)。
Ⅳ.若标准状况下,每44g二氧化碳的体积为22.4L。根据实验数据计算产品中CuCO3的质量分数(写出计算过程)_______。(保留到0.1%)
V.若其他操作均正确,仅因下列因素可使测定结果偏小的是_______(填字母序号);
A 步骤③中平视刻度,步骤⑥中仰视读数 B 硫酸的用量不足
C 量气管中未加植物油 D 步骤⑥中没有调节量气装置两边液面相平,直接读数
(6)碱式碳酸铜【xCuCO3·yCu(OH)2·zH2O】的热分解研究。小组同学用热分析仪对固体进行热分解,获得相关数据,绘成的固体质量与分解温度的关系如下图。
(已知Cu(OH)2的分解温度小于CuCO3的分解温度。)
Ⅰ.通过计算可得x:y:z=_______;
Ⅱ.若将16.0g剩余固体继续加热到更高的温度,发现固体质量减少了1.6g后质量不再改变,写出此过程中可能发生反应的化学方程式:_______。
20.金属是生产、生活中重要的材料,回答下列问题。
(1)金、银在自然界有单质形式存在,说明它们的化学性质都______。
(2)钛和钛合金是21世纪的重要的金属材料,钛合金制品放在海水中数年取出后仍光亮如新,是因为其______(填序号)非常好。
A.可塑性 B.机械性能 C.抗腐蚀性能
(3)如下图,利用W形管完成一氧化碳还原氧化铁实验。已知一氧化碳还原氧化铁的反应是分步进行:
; ;
①A处为CO气体的发生装置。写出甲酸(HCOOH)在浓硫酸催化作用下用水制取CO的化学方程式:______。
②实验中,B处酒精灯火焰外围加装防风罩的原因是______。
③为得到纯铁,当红棕色粉末全部变黑时,不能立刻停止加热,应再加热一段时间,原因是______。
④熄灭酒精灯后。立即用磁铁将产生的的黑色粉末吸引并转移到W形管A处凹槽中,与剩余酸液反应。当观察到______证明有Fe生成。
(4)现有某铁样品5.6g,含有的杂质为镁、锌、铜中的两种或三种。向其中逐渐加入溶质质量分数为9.8%的稀硫酸,产生氢气质量与加入稀硫酸质量的关系如下图所示。则下列结论正确的是( )
a.恰好完全反应时,一定没有固体剩余
b.x的值为0.2
c.铁样品中可能含有镁
d.M点对应的溶液中只含有2种或3种溶质
21.某兴趣小组对物质的性质和成分进行相关探究。
(1)常见金属活动性顺序如下,“▲”处填写的相应元素符号为: ________ 、 __________ 。
某同学用硫酸铜溶液把“把铁刀变成铜刀”,其反应的化学方程式 ______________________ ,该反应所属的基本类型为 __________ ;反应过程硫酸铜溶液逐渐由蓝色变为为 ______ 色。
(2)某兴趣小组同学将一定量氧化铜与足量的炭粉混合,利用图所示装置进行实验并对生成气体的成分进行探究。(资料:氢氧化钠溶液可以吸收二氧化碳气体)
【提出问题】生成的气体中是否含有一氧化碳?
【实验与讨论】
①打开K,缓缓通入干燥的氮气一段时间。
②关闭K,加热至一定温度使之反应,用气囊收集气体样品。
③用足量的氢氧化钠溶液除去气体样品中的二氧化碳,并将剩余气体收集在集气瓶中,下列图所示装置中为合理的是 _______________ (填标号)。
【实验求证】
将除尽二氧化碳后的气体样品干燥,仍然用图甲所示的装置进行实验,A中的固体为氧化铜,B中液体为澄清石灰水,若A中出现 _____________ 现象,B中出现 ______________ 现象,可说明气体样品中含有一氧化碳,B中的化学反应方程式为 ____________________ 。
【实验反思】
炭粉还原氧化铜的实验中,若生成的气体中含有一氧化碳,则反应时消耗碳、氧元素的质量比 ______ (填“大于”、“等于”或“小于”)3:8。
22.金属在生产和生活中具有广泛的应用.
(1)地壳中含量最高的金属元素是________(写元素符号,下同);人体中含量最高的金属元素是________.
(2)铁制品容易锈蚀,用稀盐酸除铁锈的化学方程式为________.
(3)铁矿石冶炼成铁是一个复杂的过程.把铁矿石、焦炭和石灰石一起加入高炉,在高温下,利用其中反应生成的______把铁从铁矿石中还原出来.
(4)炼钢过程中,检验员提取5g钢样,在足量的氧气中充分燃烧,将生成的气体用足量的澄清石灰水充分吸收,得到0.25g白色沉淀.求:
①该钢样燃烧时生成二氧化碳的质量________;
②该钢样中碳的质量分数________.(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.D
4.C
5.D
6.B
7.A
8.D
9.B
10.D
11.D
12.B
13.A
14.A
15.D
16.D
17.(1)在高温下,利用炉内反应生成的CO把铁从铁矿石里还原出来
(2)3CO+ Fe2O32Fe +3CO2
(3)4P+5O22P2O5
(4)玻璃棒
(5)化学性质不活泼
(6)氧气和水蒸气或O2和H2O
(7)剧烈燃烧,火星四射,生成黑色固体
(8) Fe+CuSO4=Cu+FeSO4 在金属活动性顺序中,铁的活动性比铜强
(9)
解:设理论上可生成氢气的质量为x,
答:理论上可生成氢气的质量是0.4g;
(10)大
18.(1) BD##BE##BD或BE Zn+H2SO4=ZnSO4+H2↑
(2) BC##CB CaCO3+2HCl=CaCl2+H2O+CO2↑
(3) 2NaHCO3Na2CO3+CO2↑+H2O A
(4)先在装置中装满水,再将氢气从a导管口通入
(5)解:氧化铁的质量为2000t×80%=1600t;
设生成铁的质量为x
x=1120t
所以生铁的质量为1120t÷(1-4%)=1166.7t
答:可冶炼出含杂质为4%的生铁的质量为1166.7t。
19. D CO2和O2 ABC 方法二 能耗低 111 8.5 连接装置后补充检查装置气密性 除去二氧化碳中的水 防止二氧化碳溶于水 c 缓慢下移 0.62g÷1.2g×100%≈51.7% BCD 1:1:1
20.(1)稳定、不活泼
(2)C
(3)
提高酒精灯火焰的温度到600℃以上; 黑色固体中可能还混有Fe3O4、FeO; 固体溶解,溶液中有气泡生成;
(4)bd
21. Mg Ag Fe+CuSO4=Cu+FeSO4 置换反应 浅绿色 C 黑色固体变红色 液体变浑浊 CO2+Ca(OH)2═CaCO3↓+H2O 大于
22. Al Ca Fe2O3+6HCl=2FeCl3+3H2O CO 设生成二氧化碳的质量为x
CO2+Ca(OH)2=CaCO3↓+H2O
44 100
x 0.25g
x=0.11g 0.11g二氧化碳中碳元素的质量=0.11g××100%=0.03g
钢样中含碳质量分数=×100%=0.6%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.某同学的下列生活行为不符合环保理念的是( )
A.骑自行车上学 B.将废弃易拉罐丢入“可回收垃圾”桶
C.用洗菜的水冲厕所 D.夏季使用空调时,将温度调至最低
2.炼铁高炉中发生了下列反应:①高温下一氧化碳将铁矿石还原为铁 ②高温煅烧石灰石 ③灼热的焦炭和二氧化碳反应 ④焦炭充分燃烧 其中属于化合反应的是
A.①和④ B.②和③ C.③和④ D.只有④
3.已知:3CO + Fe2O3 2Fe + 3CO2,向装有20gFe2O3的硬质玻璃管中通入CO,加热反应一段时间后,测得玻璃 管中剩余固体质量为15.2g,则下列说法正确的是( )
A.该反应中,CO是氧化剂
B.反应生成Fe的质量为15.2g
C.反应生成CO2的质量为16.5g
D.参加反应的Fe2O3占原总质量的80%
4.下列有关金属材料的说法错误的是
A.在潮湿的空气中铁易生锈
B.金属的回收利用是保护金属资源的有效途径之一
C.铝和金都有很好的抗腐蚀性,是因为二者的化学性质都很稳定
D.高炉炼铁的原理是在高温条件下,用一氧化碳把铁从铁矿石里还原出来
5.如图为一氧化碳还原氧化铁实验。下列说法中正确的是( )
A.开始时应先预热玻璃管,后通入一氧化碳
B.实验中玻璃管里粉末由黑色逐渐变成红棕色
C.参加反应的氧化铁和一氧化碳质量比为40:7
D.将尾气点燃或收集,可防止一氧化碳污染空气
6.用“W”型玻璃管进行微型实验,如下图所示。下列说法不正确的是
A.a处红棕色粉末变为黑色
B.a处的反应为CO +Fe2O3=2Fe+CO2
C.b处澄清石灰水变浑浊证明有CO2生成
D.可利用点燃的方法进行尾气处理
7.下列实验中,能达到相实验目的的是( )
A.探究水对铁生锈有无影响
B.探究质量守恒定律
C.探究铝、铜、银的金属活动性顺序
D.探究甲烷的组成
8.下列措施中,不能防止金属制品锈蚀的是( )
A.在表面刷漆 B.在表面涂油 C.在表面镀铬 D.用湿布擦拭
9.工业炼铁中会发生一氧化碳与氧化铁的反应,该反应中发生还原反应的物质是
A.CO B.Fe2O3 C.CO2 D.Fe
10.下列符合“绿色、健康、安全、舒适”的生产生活理念的是
A.将废旧电池深埋在土壤中 B.加高烟囱将有害废气排放到高空中
C.大量使用一次性的木筷和餐盒 D.废弃口罩投入专用垃圾箱回收处理
11.用一氧化碳还原氧化铁的实验中,Fe2O3转化为铁的具体过程是: 。已知铁的氧化物除Fe2O3外,其余均为黑色。下列说法正确的是
A.装置中漏斗的作用是防止倒吸
B.通过实验现象可以判断氧化铁是否完全转化为铁
C.该实验中所有的化学反应里,氧元素的化合价均未改变
D.当硬质玻璃管内固体中铁元素的质量分数为74%时,固体成分是Fe3O4和FeO
12.如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )
①一段时间后,铁丝会由下向上出现锈蚀现象
②一段时间后,水面处铁丝锈蚀严重
③一段时间后,塑料瓶会变膨胀,因为铁生锈要放热
④一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关
A.①② B.②④ C.②③ D.③④
13.据探测卫星发回的数据分析,火星大气中95%是二氧化碳,其余为少量的氮气.氢气,还找到了有液态水存在的证据。根据以上信息,某同学作出如下推断:①火星大气是混合物②火星大气与地球大气成分相似③火星上钢铁不容易生锈 ④火星环境适宜人类生存⑤火星上温室效应显著。你认为正确的是
A.①③⑤ B.②③⑤ C.②③④ D.①④⑤
14.下列有关金属及合金的说法错误的是( )
A.常温下所有的金属都是固体
B.铁制品在潮湿的空气中易生锈
C.生铁和不锈钢都是金属材料
D.铝片表面易生成致密的氧化膜
15.通过对比实验可探究铁生锈的条件。下列实验设计与探究条件的对应关系正确的是
A.甲和乙:水
B.乙和丙:空气
C.甲和丙:空气
D.甲和丁:水
16.保护金属资源的有效途径,不包括下列的( )
A.合理开采矿物 B.寻找金属替代品
C.回收利用金属 D.禁止使用铁制品
二、综合应用题
17.化学兴趣小组同学参观了某钢铁公司。
I.大家对如图所示的炼铁和炼钢的工艺流程,有了全新的认识。
(1)用文字表示炼铁的原理_________。
(2)写出用赤铁矿石炼铁的化学方程式________。
(3)分析工艺流程,写出三脱装置中P发生反应的化学方程式___________。
(4)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中_______(填一种仪器的名称)的作用。
(5)在钢水铸件机中,高温钢加工成钢制零件时,充入氮气做保护气,主要因为氮气_________。
(6)在钢制成品表面“涂层”的目的是防止钢制成品中的铁与空气中的___发生化学反应而生锈。
Ⅱ.兴趣小组同学在化学实验室进行了有关铁的性质的一些基本实验。
(7)某同学用向上排空气法收集一瓶氧气做A实验,在引燃的火柴快燃尽时将细铁丝插入集气瓶中,实验现象为______,放热。
(8)试管B中装有硫酸铜溶液,发生的化学方程式为______,铁能和硫酸铜溶液反应的原因是_____。
(9)兴趣小组同学用13g锌与足量盐酸反应,理论上可生成氢气的质量是_______?(请利用化学方程式进行计算,并在答题纸上写出完整的计算过程)
(10)若兴趣小组改用13g镁铝合金与足量盐酸反应,则生成氢气的质量比用13g锌反应_____(填“小”"或“相等”或“大”)。
18.如图所示为实验室常用的实验装置,回答问题:
(1)实验室用锌和稀硫酸制取氢气,应选用的制取装置一套为______(填序号,下同),该反应的化学方程式为______。
(2)实验室常用稀盐酸和石灰石反应制CO2,应选用的制取装置一套为______,该反应的化学方程式为______。
(3)此外,也可用加热碳酸氢钠(NaHCO3)固体(产物为碳酸钠、二氧化碳、水)来制取CO2,该反应的化学方程式为______,若用此法来制取CO2,应选用的发生装置为______。
(4)若用如图装置采用排水法收集H2,请简述操作步骤。
(5)某赤铁矿石中含Fe2O3为80%,用2000吨这种矿石可冶炼出含杂质为4%的生铁多少吨?(精确到0.1)
19.铜及其化合物在生产、生活中都有广泛的应用。
一、铜的性质及其应用
兔首和鼠首均为青铜器(铜、锡合金),表面呈绿色,这是铜器长期暴露在空气中生成了铜锈(铜锈俗称铜绿)。铜绿化学式是Cu2(OH)2CO3,它受热会分解生成三种氧化物。青铜器属于无机材料
(1)铜绿分解的化学方程式为_____。
(2)为了弄清铜生成铜绿的条件,某化学实验小组借鉴课本“铁钉锈蚀条件的探究”实验,设计了“铜片锈蚀条件的探究”实验,实验如下图所示(所用铜片洁净、光亮,试管内的“”为铜片)。
实验较长时间后,发现_____(填试管编号)试管中铜片最先生锈。小组讨论后发现实验还不够完善,要得出正确的结论,还要补充一个实验。你认为要补充的一个实验是:Cu和______(写出试管中需要的物质)。可以省略不做的实验是试管_____(填试管编号)。
二、铜的制备研究
铜可采用如下方法制备:
方法一:火法炼铜:Cu2S+O22Cu+SO2
方法二:湿法炼铜:CuSO4+Fe=FeSO4+Cu
上述两种方法中,你认为哪种方法更好_____,原因是_____(写出1条原因即可)。辉铜矿的主要成分为Cu2S,常用于火法炼铜。若生成过程中铜元素的转化率为90%,生产64tCu需要含Cu2S 80%的辉铜矿_____t(取整数)。
(3)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,6Na2CO3+3Fe2(SO4)3+6H2O=2NaFe3(OH)6(SO4)2+6CO2↑+5_____。
(4)加入Na2CO3沉淀时,反应液pH对产品中的SO42- 含量以及反应液中Cu2+沉淀效率的影响如下图所示,第二次沉淀时溶液pH最好控制在_______。
(5)所制得的碱式碳酸铜的组成可表示为:xCuCO3·yCu(OH)2·zH2O。某研究小组设计如上图实验装置测定其中CuCO3的质量分数(不考虑植物油中溶解CO2产生的影响)。
实验步骤如下:①连接装置并 ;②准确称量样品的质量1.2g;③装药品,调节量气装置两边液面相平,读取量气管刻度为10mL;④向锥形瓶内加入50mL(足量)的稀硫酸,充分反应;⑤冷却到室温;⑥再次调节量气装置两边液面相平,读取量气管刻度为172ml。
Ⅰ.请将上述实验步骤补充完整_______;
Ⅱ.装置B的作用是_______,少量植物油的作用是_______,C中的试剂是_______(填字母序号);
a 碱石灰 b 浓硫酸 c 无水硫酸铜
Ⅲ.步骤⑥中调节液面相平的操作是将水准管_______(填“缓慢上移”或“缓慢下移”)。
Ⅳ.若标准状况下,每44g二氧化碳的体积为22.4L。根据实验数据计算产品中CuCO3的质量分数(写出计算过程)_______。(保留到0.1%)
V.若其他操作均正确,仅因下列因素可使测定结果偏小的是_______(填字母序号);
A 步骤③中平视刻度,步骤⑥中仰视读数 B 硫酸的用量不足
C 量气管中未加植物油 D 步骤⑥中没有调节量气装置两边液面相平,直接读数
(6)碱式碳酸铜【xCuCO3·yCu(OH)2·zH2O】的热分解研究。小组同学用热分析仪对固体进行热分解,获得相关数据,绘成的固体质量与分解温度的关系如下图。
(已知Cu(OH)2的分解温度小于CuCO3的分解温度。)
Ⅰ.通过计算可得x:y:z=_______;
Ⅱ.若将16.0g剩余固体继续加热到更高的温度,发现固体质量减少了1.6g后质量不再改变,写出此过程中可能发生反应的化学方程式:_______。
20.金属是生产、生活中重要的材料,回答下列问题。
(1)金、银在自然界有单质形式存在,说明它们的化学性质都______。
(2)钛和钛合金是21世纪的重要的金属材料,钛合金制品放在海水中数年取出后仍光亮如新,是因为其______(填序号)非常好。
A.可塑性 B.机械性能 C.抗腐蚀性能
(3)如下图,利用W形管完成一氧化碳还原氧化铁实验。已知一氧化碳还原氧化铁的反应是分步进行:
; ;
①A处为CO气体的发生装置。写出甲酸(HCOOH)在浓硫酸催化作用下用水制取CO的化学方程式:______。
②实验中,B处酒精灯火焰外围加装防风罩的原因是______。
③为得到纯铁,当红棕色粉末全部变黑时,不能立刻停止加热,应再加热一段时间,原因是______。
④熄灭酒精灯后。立即用磁铁将产生的的黑色粉末吸引并转移到W形管A处凹槽中,与剩余酸液反应。当观察到______证明有Fe生成。
(4)现有某铁样品5.6g,含有的杂质为镁、锌、铜中的两种或三种。向其中逐渐加入溶质质量分数为9.8%的稀硫酸,产生氢气质量与加入稀硫酸质量的关系如下图所示。则下列结论正确的是( )
a.恰好完全反应时,一定没有固体剩余
b.x的值为0.2
c.铁样品中可能含有镁
d.M点对应的溶液中只含有2种或3种溶质
21.某兴趣小组对物质的性质和成分进行相关探究。
(1)常见金属活动性顺序如下,“▲”处填写的相应元素符号为: ________ 、 __________ 。
某同学用硫酸铜溶液把“把铁刀变成铜刀”,其反应的化学方程式 ______________________ ,该反应所属的基本类型为 __________ ;反应过程硫酸铜溶液逐渐由蓝色变为为 ______ 色。
(2)某兴趣小组同学将一定量氧化铜与足量的炭粉混合,利用图所示装置进行实验并对生成气体的成分进行探究。(资料:氢氧化钠溶液可以吸收二氧化碳气体)
【提出问题】生成的气体中是否含有一氧化碳?
【实验与讨论】
①打开K,缓缓通入干燥的氮气一段时间。
②关闭K,加热至一定温度使之反应,用气囊收集气体样品。
③用足量的氢氧化钠溶液除去气体样品中的二氧化碳,并将剩余气体收集在集气瓶中,下列图所示装置中为合理的是 _______________ (填标号)。
【实验求证】
将除尽二氧化碳后的气体样品干燥,仍然用图甲所示的装置进行实验,A中的固体为氧化铜,B中液体为澄清石灰水,若A中出现 _____________ 现象,B中出现 ______________ 现象,可说明气体样品中含有一氧化碳,B中的化学反应方程式为 ____________________ 。
【实验反思】
炭粉还原氧化铜的实验中,若生成的气体中含有一氧化碳,则反应时消耗碳、氧元素的质量比 ______ (填“大于”、“等于”或“小于”)3:8。
22.金属在生产和生活中具有广泛的应用.
(1)地壳中含量最高的金属元素是________(写元素符号,下同);人体中含量最高的金属元素是________.
(2)铁制品容易锈蚀,用稀盐酸除铁锈的化学方程式为________.
(3)铁矿石冶炼成铁是一个复杂的过程.把铁矿石、焦炭和石灰石一起加入高炉,在高温下,利用其中反应生成的______把铁从铁矿石中还原出来.
(4)炼钢过程中,检验员提取5g钢样,在足量的氧气中充分燃烧,将生成的气体用足量的澄清石灰水充分吸收,得到0.25g白色沉淀.求:
①该钢样燃烧时生成二氧化碳的质量________;
②该钢样中碳的质量分数________.(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.D
4.C
5.D
6.B
7.A
8.D
9.B
10.D
11.D
12.B
13.A
14.A
15.D
16.D
17.(1)在高温下,利用炉内反应生成的CO把铁从铁矿石里还原出来
(2)3CO+ Fe2O32Fe +3CO2
(3)4P+5O22P2O5
(4)玻璃棒
(5)化学性质不活泼
(6)氧气和水蒸气或O2和H2O
(7)剧烈燃烧,火星四射,生成黑色固体
(8) Fe+CuSO4=Cu+FeSO4 在金属活动性顺序中,铁的活动性比铜强
(9)
解:设理论上可生成氢气的质量为x,
答:理论上可生成氢气的质量是0.4g;
(10)大
18.(1) BD##BE##BD或BE Zn+H2SO4=ZnSO4+H2↑
(2) BC##CB CaCO3+2HCl=CaCl2+H2O+CO2↑
(3) 2NaHCO3Na2CO3+CO2↑+H2O A
(4)先在装置中装满水,再将氢气从a导管口通入
(5)解:氧化铁的质量为2000t×80%=1600t;
设生成铁的质量为x
x=1120t
所以生铁的质量为1120t÷(1-4%)=1166.7t
答:可冶炼出含杂质为4%的生铁的质量为1166.7t。
19. D CO2和O2 ABC 方法二 能耗低 111 8.5 连接装置后补充检查装置气密性 除去二氧化碳中的水 防止二氧化碳溶于水 c 缓慢下移 0.62g÷1.2g×100%≈51.7% BCD 1:1:1
20.(1)稳定、不活泼
(2)C
(3)
提高酒精灯火焰的温度到600℃以上; 黑色固体中可能还混有Fe3O4、FeO; 固体溶解,溶液中有气泡生成;
(4)bd
21. Mg Ag Fe+CuSO4=Cu+FeSO4 置换反应 浅绿色 C 黑色固体变红色 液体变浑浊 CO2+Ca(OH)2═CaCO3↓+H2O 大于
22. Al Ca Fe2O3+6HCl=2FeCl3+3H2O CO 设生成二氧化碳的质量为x
CO2+Ca(OH)2=CaCO3↓+H2O
44 100
x 0.25g
x=0.11g 0.11g二氧化碳中碳元素的质量=0.11g××100%=0.03g
钢样中含碳质量分数=×100%=0.6%
答案第1页,共2页
答案第1页,共2页
同课章节目录
