12.2化学元素与人体健康同步练习-2021-2022学年九年级化学人教版下册(word版有答案)
文档属性
| 名称 | 12.2化学元素与人体健康同步练习-2021-2022学年九年级化学人教版下册(word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 201.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-28 00:00:00 | ||
图片预览



文档简介
人教版化学九下册 12.2 化学元素与人体健康 同步练习
一、单选题
1.以人为本,关注健康,是人类永恒的主题。下列叙述正确的是
①使用酸性的洗发液可以更好地去除头发上的油脂,使头发更健康
②在蚊虫叮咬处,涂抹氢氧化钠溶液,以减轻痛痒
③人体健康时,胃液的pH一般在0.9~1.5范围内
④在冬天,我们教室内因含有较多的二氧化碳,要适当开窗通风
⑤长期饮用蒸馏水对人体健康有益
A.全部 B.只有①②⑤ C.只有③④ D.只有③④⑤
2.健康的生活离不开化学,下列说法正确的是
A.油脂是重要的营养物质,可大量摄入油脂
B.为保持肉制品鲜美,在香肠中加过量的亚硝酸钠
C.为预防甲状腺肿大,应在食盐中添加大量的碘元素
D.人误食重金属盐中毒后,服用鸡蛋清可减轻毒性
3.我市天柱山野生猕猴桃含有丰富的维生素、酶、钾、铁、锌等,营养价值很高。下列有关说法正确的是
A.钾、锌都属于人体微量元素
B.猕猴桃中不含无机盐
C.维生素在人体内不能合成
D.多食猕猴桃可预防甲状腺肿大
4.下列有关油脂的叙述正确的是
A.各种油脂都是由碳、氢、氧三种元素组成的
B.葡萄糖不能转化为人体内的脂肪
C.汽油、煤油、菜籽油、花牛油都属于油脂
D.洗发剂洗去头发上的油脂不属于乳化现象
5.化学与生活息息相关,下列做法不科学的是( )
A.甲醛大量用于海鲜的防腐 B.明矾、活性炭用于净水
C.将易拉罐投入可回收垃圾箱 D.青少年常喝牛奶补充钙元素
6.恩施玉露是中国传统名茶,富含锌、硒,有增强食欲和防癌等功效。茶叶中主要成分是茶氨酸(C7H14O3N2)。茶树适宜在pH为5-6的土壤中生长。下列说法错误的是
A.茶氨酸的相对分子质量是174g B.茶树不宜在碱性土壤中生长
C.茶氨酸由碳、氢、氧、氮四种元素组成 D.茶叶中的锌、硒属于微量元素
7.“吃出营养、吃出健康”是人们普遍的饮食追求,下列说法不正确的是
A.人体缺乏维生素A会引起夜盲症
B.食用甲醛浸泡的食物会危害人体健康
C.不吃霉变或超过保质期的食物
D.微量元素对人体十分重要,必须大量服用
8.微量元素是指在人体总含量不到万分之一,而质量总和不到人体质量的千分之一的二十多种元素,这些元素对人体正常代谢和健康起着重要作用。下列元素中肯定不是人体中微量元素的是
A.I B.F C.H D.Fe
9.医生发现某同学体内缺少维生素C,该同学饮食中需适量增加的食物是( )
A.面食 B.植物油 C.牛肉 D.蔬菜、水果
10.下列说法中正确的是( )
A.氟元素(F)是人体必需的微量元素,缺氟会引起贫血
B.缺碘会引起甲状腺肿大,所以日常生活中要适量补碘
C.维生素可以起到维持身体健康的重要作用,缺乏维生素D会引起夜盲症
D.米饭在人体内经酶的催化作用,与水发生一系列反应,最终转化为氨基酸
11.人体摄入过量的铝会对脑、肾等器官造成损害,世界卫生组织将铝确定为食品污染物。但现实生活中,却“铝禁不止”。下列关于铝的应用不科学的是
A.使用含铝膨松剂制作油条
B.使铁锅代替铝制炊具
C.用纸盒代替铝制易拉罐盛装饮料
D.用氢氧化镁代替氢氧化铝中和过多胃酸
12.鱼肉含有丰富的营养成分,是人们餐桌上常见的一道美食。每100g鱼肉中含有的部分营养成分如图,其中表述错误的是( )
A.鱼肉中富含蛋白质 B.多食鱼肉可预防夜盲症
C.鱼肉营养丰富,可代替主食 D.青少年多食鱼肉,可促进骨骼发育
13.人体中含量最高的金属元素是( )
A.O
B.Fe
C.Ca
D.Na
14.青少年处于身体成长的关键时段,饮食应丰富全面。下列说法正确的是
A.缺铁会引起贫血
B.缺钙会引起发育不良
C.缺碘会引起骨质疏松
D.缺锌会引起甲状腺肿大
15.下列生活中的做法正确的是
A.霉变大米经高温蒸煮后食用
B.甲醛溶液浸泡海鲜防腐
C.明矾用于水的杀菌消毒
D.焙制面包时加入适量小苏打
16.碘元素被称为“智力元素”,是人体必需的微量元素之一,人体缺碘会引起甲状腺肿大,幼儿缺碘会造成思维迟钝,影响生长发育。因此,人们常通过摄入海产品或食用加碘盐来补充碘元素,以保证人体健康。利用海带提取碘单质(I2)的工艺流程如图所示,下列说法错误的是( )
A.操作①中,所需要的玻璃仪器有3种
B.由于淀粉有遇碘(I2)变蓝的特性,因此可以利用淀粉检验加入H2O2溶液后所得的“溶液一”中是否有单质碘生成
C.在上述过程中碘元素的化合价没有发生变化
D.在蒸馏操作中,蒸馏烧瓶内加入沸石的目的是为了防止液体的暴沸
二、综合应用题
17.南通有漫长的海岸线,海洋蕴藏着丰富的资源。请按要求填空。
(1)海洋为我们提供了营养丰富的食材。海带富含的______元素可以预防甲状腺肿大。
(2)今年5月我国在海域可燃冰开采技术领域取得重大突破。可燃冰主要含有甲烷水合物,还含少量CO2等气体,可燃冰属于______(选填“纯净物”或“混合物”)。若甲烷大量泄露到大气中,会导致使全球气候变暖。
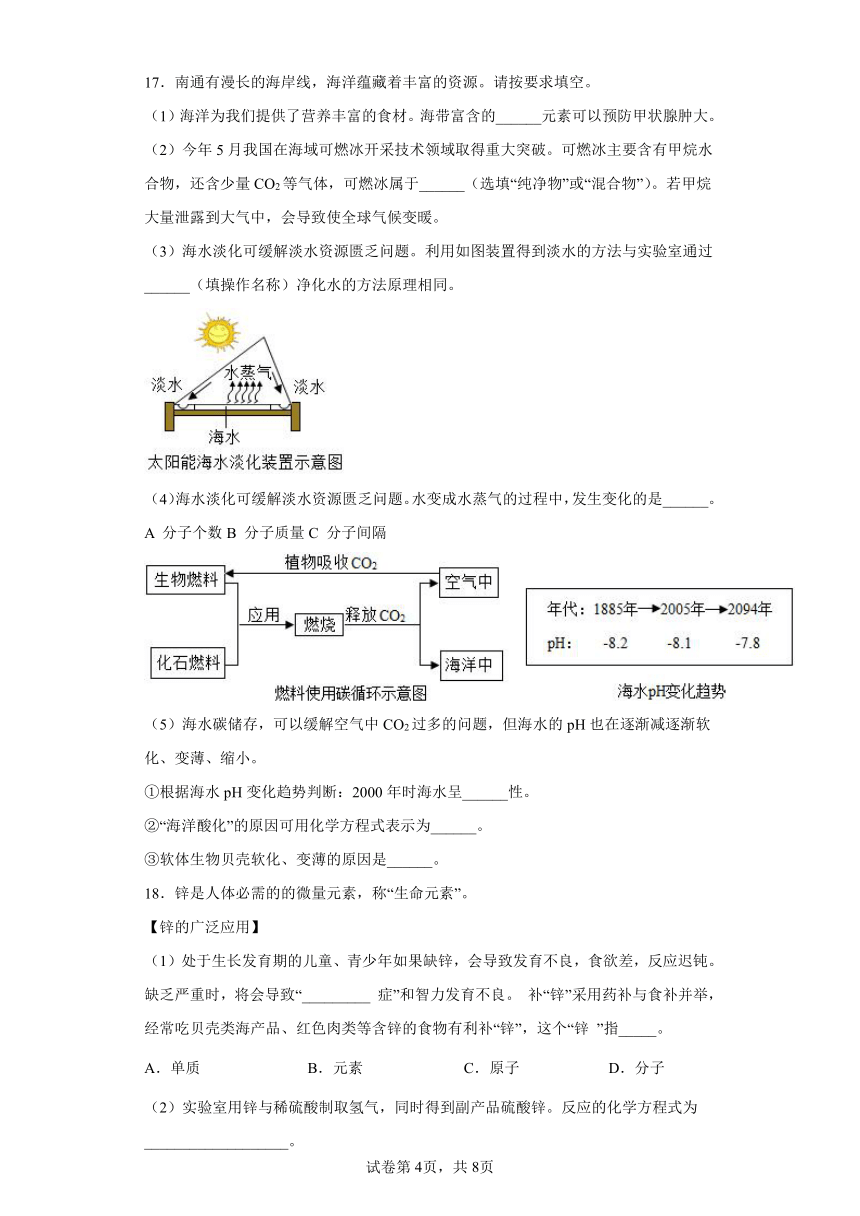
(3)海水淡化可缓解淡水资源匮乏问题。利用如图装置得到淡水的方法与实验室通过______(填操作名称)净化水的方法原理相同。
(4)海水淡化可缓解淡水资源匮乏问题。水变成水蒸气的过程中,发生变化的是______。
A 分子个数B 分子质量C 分子间隔
(5)海水碳储存,可以缓解空气中CO2过多的问题,但海水的pH也在逐渐减逐渐软化、变薄、缩小。
①根据海水pH变化趋势判断:2000年时海水呈______性。
②“海洋酸化”的原因可用化学方程式表示为______。
③软体生物贝壳软化、变薄的原因是______。
18.锌是人体必需的的微量元素,称“生命元素”。
【锌的广泛应用】
(1)处于生长发育期的儿童、青少年如果缺锌,会导致发育不良,食欲差,反应迟钝。缺乏严重时,将会导致“_________ 症”和智力发育不良。 补“锌”采用药补与食补并举,经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”,这个“锌 ”指_____。
A.单质 B.元素 C.原子 D.分子
(2)实验室用锌与稀硫酸制取氢气,同时得到副产品硫酸锌。反应的化学方程式为___________________。
【制备七水硫酸锌】
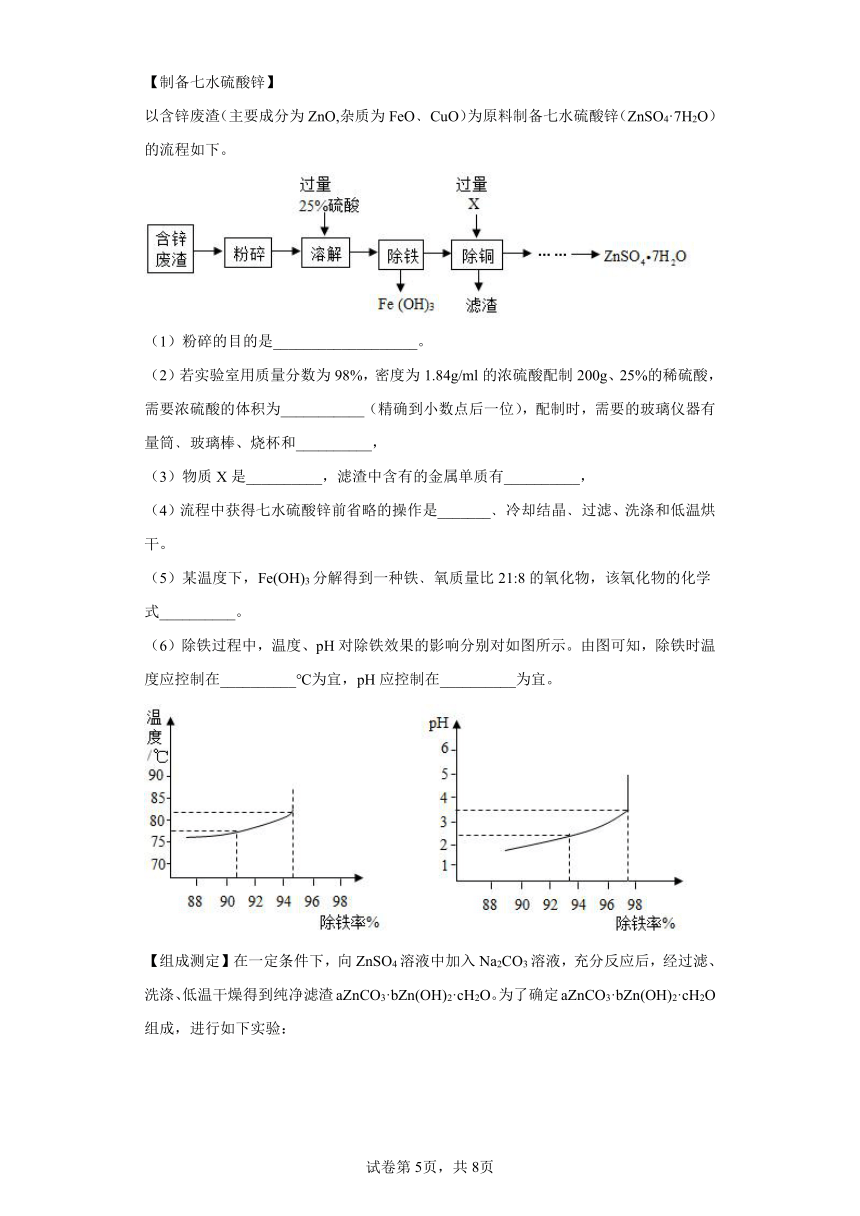
以含锌废渣(主要成分为ZnO,杂质为FeO﹑CuO)为原料制备七水硫酸锌(ZnSO4·7H2O)的流程如下。
(1)粉碎的目的是___________________。
(2)若实验室用质量分数为98%,密度为1.84g/ml的浓硫酸配制200g、25%的稀硫酸,需要浓硫酸的体积为___________(精确到小数点后一位),配制时,需要的玻璃仪器有量筒﹑玻璃棒、烧杯和__________,
(3)物质X是__________,滤渣中含有的金属单质有__________,
(4)流程中获得七水硫酸锌前省略的操作是_______﹑冷却结晶﹑过滤、洗涤和低温烘干。
(5)某温度下,Fe(OH)3分解得到一种铁﹑氧质量比21:8的氧化物,该氧化物的化学式__________。
(6)除铁过程中,温度、pH对除铁效果的影响分别对如图所示。由图可知,除铁时温度应控制在__________℃为宜,pH应控制在__________为宜。
【组成测定】在一定条件下,向ZnSO4溶液中加入Na2CO3溶液,充分反应后,经过滤、洗涤、低温干燥得到纯净滤渣aZnCO3·bZn(OH)2·cH2O。为了确定aZnCO3·bZn(OH)2·cH2O组成,进行如下实验:
【查阅资料】(假设每步反应、吸收均完全。碱石灰为氢氧化钠和生石灰的混合物。)
aZnCO3·bZn(OH)2·cH2O受热分解生成ZnO、H2O、CO2三种产物,
其中ZnCO3 ZnO+CO2↑;Zn(OH)2ZnO+H2O。
现称取35.9 g aZnCO3·bZn(OH)2·cH2O在B装置中进行煅烧,将完全煅烧过程中产生的气体依次通过装置C和装置D,它们分别增重7.2 g和4.4 g。
【实验分析及数据处理】
(1)装置A的作用是_______________。
(2)若没有E装置,测得二氧化碳的质量____________(填“偏大”、“偏小”或“无影响”)。
(3)根据上述数据,化学式a ZnCO3·b Zn(OH)2· c H2O中的a:b:c =_____________ 。
【反思与拓展】
滤渣成分因温度等不同导致a、b、c会有差异,假设B化学式为ZnCO3·2Zn(OH)2·H2O,向该B中加入稀硫酸,反应的化学方程式为:_____________。
19.金属及金属材料在生产、生活中用途广泛。请回答:
(1)______(填元素符号)是人体中含量最高的金属元素。
(2)合金有着优良的性能,在金属中加热______某些金属或非金属,就可以制得具有金属特征的合金。
(3)钢铁锈蚀主要是铁与空气中的氧气和______(填化学式)发生化学反应,生成铁锈,为防止钢铁锈蚀可采取的措施是______(写出一条措施)。
(4)某炼铁厂要治炼1000t含杂质3%的生铁,需要含Fe2O3 80%的赤铁矿石的质量是______(计算结果精确至0.1)。
20.钙是维持人体正常功能所必需的元素。
(1)人体缺钙有可能导致_____ (选填序号)。
a、骨质疏松症b、贫血症c、佝偻病d、发育停滞、智力低下
(2)某钙片的主要成分是碳酸钙,兴趣小组同学想通过实验测定该钙片中碳酸钙的质量分数。(钙片中的其他成分不溶于水,且不与稀盐酸反应)
①取该钙片 10 克,研磨成粉末,置于大烧杯内,并在小烧杯中盛放足量稀盐酸,将两个烧杯放在电子天平上,记录天平读数。
②将稀盐酸倒入钙片粉末中,若观察到_____ 的现象,证明反应已经结束。
实验记录如下,试计算该品牌钙片中碳酸钙的质量分数_____ 。
实验进程 起始(/g) 最终(/g)
电子天平读数 173.20 171.00
21.如图是某口服液标签的部分内容。
××口服液 有效成分:硫酸亚铁(FeSO4) ……
(1)该口服液能为人体提供的一种微量元素是________,人体缺乏该元素会引发的病症是________。
(2)硫酸亚铁的相对分子质量是________,硫酸亚铁中铁、硫、氧三种元素的质量比是________。
22.以化合价为纵坐标、物质类别为横坐标所绘制的图象叫二维价类图,价类图可有效帮助我们建立物质之间的联系,高效进行化学学习。下图所示为碳的价类图
(1)常见的碳单质有金刚石、石墨和C60等,其中常用作电池电极的是_______(填“金刚石”或“石墨”)。它们的化学性质相似,都具有可燃性,写出C60在空气中完全燃烧的化学方程式_______,从热效应的角度分析,该反应___热量(填“吸收”或“释放”)。
(2)由图可知,M物质是氧化物,其保持M物质化学性质的最小微粒是______(填名称),实验室常用_____(填试剂的名称)检验M物质,实验室制备M物质的化学方程式是______。
(3)将CO2通入紫色石蕊试液,溶液变为_______色,该实验说明_______。
(4)碳酸钙由Ca2+和______(填符号)构成,碳酸钙中氧元素的质量分数为_______。石灰石是生产建筑材料生石灰的原料,该生产的原理(用化学方程式表示)________。
(5)钙_______(填“是”或“不是”)人体所需的微量元素,儿童缺钙易得______(填字母)。
a侏儒症 b佝偻病 c贫血病 d白内障
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.C
4.A
5.A
6.A
7.D
8.C
9.D
10.B
11.A
12.C
13.C
14.A
15.D
16.C
17. 碘 混合物 蒸馏 C 碱 CO2+H2O═H2CO3 碳酸钙能和显酸性的物质反应
18. 侏儒 B Zn+H2SO4==ZnSO4+H2↑ 增大接触面积,使反应更快更充分 22.7ml 胶头滴管 Zn Zn、Cu 蒸发浓缩 Fe3O4 83±1 3.5±0.1 除去空气中的CO2 和H2O 偏大 1∶2∶2 ZnCO3·2Zn(OH)2·H2O + 3H2SO4 = 3ZnSO4 + 6H2O + CO2↑
19.(1)Ca
(2)熔合
(3) H2O 喷漆(合理即可)
(4)1732.1t
20.(1)ac
(2)②无气泡生成。
根据质量守恒定律可得,生成二氧化碳的质量为173.2g-171g=2.2g
设该品牌钙片中碳酸钙的质量为x,
x=5g
该品牌钙片中碳酸钙的质量分数为
答:该品牌钙片中碳酸钙的质量分数为50%。
21.(1)铁 ;贫血
(2)152;7∶4∶8
22. 石墨 C60+60O260CO2 释放 二氧化碳分子 澄清石灰水 2HCl+CaCO3=CaCl2+CO2↑+H2O 红 CO2能和水反应 40% CaCO3CaO+CO2↑ 不是 b
答案第1页,共2页
答案第1页,共2页
一、单选题
1.以人为本,关注健康,是人类永恒的主题。下列叙述正确的是
①使用酸性的洗发液可以更好地去除头发上的油脂,使头发更健康
②在蚊虫叮咬处,涂抹氢氧化钠溶液,以减轻痛痒
③人体健康时,胃液的pH一般在0.9~1.5范围内
④在冬天,我们教室内因含有较多的二氧化碳,要适当开窗通风
⑤长期饮用蒸馏水对人体健康有益
A.全部 B.只有①②⑤ C.只有③④ D.只有③④⑤
2.健康的生活离不开化学,下列说法正确的是
A.油脂是重要的营养物质,可大量摄入油脂
B.为保持肉制品鲜美,在香肠中加过量的亚硝酸钠
C.为预防甲状腺肿大,应在食盐中添加大量的碘元素
D.人误食重金属盐中毒后,服用鸡蛋清可减轻毒性
3.我市天柱山野生猕猴桃含有丰富的维生素、酶、钾、铁、锌等,营养价值很高。下列有关说法正确的是
A.钾、锌都属于人体微量元素
B.猕猴桃中不含无机盐
C.维生素在人体内不能合成
D.多食猕猴桃可预防甲状腺肿大
4.下列有关油脂的叙述正确的是
A.各种油脂都是由碳、氢、氧三种元素组成的
B.葡萄糖不能转化为人体内的脂肪
C.汽油、煤油、菜籽油、花牛油都属于油脂
D.洗发剂洗去头发上的油脂不属于乳化现象
5.化学与生活息息相关,下列做法不科学的是( )
A.甲醛大量用于海鲜的防腐 B.明矾、活性炭用于净水
C.将易拉罐投入可回收垃圾箱 D.青少年常喝牛奶补充钙元素
6.恩施玉露是中国传统名茶,富含锌、硒,有增强食欲和防癌等功效。茶叶中主要成分是茶氨酸(C7H14O3N2)。茶树适宜在pH为5-6的土壤中生长。下列说法错误的是
A.茶氨酸的相对分子质量是174g B.茶树不宜在碱性土壤中生长
C.茶氨酸由碳、氢、氧、氮四种元素组成 D.茶叶中的锌、硒属于微量元素
7.“吃出营养、吃出健康”是人们普遍的饮食追求,下列说法不正确的是
A.人体缺乏维生素A会引起夜盲症
B.食用甲醛浸泡的食物会危害人体健康
C.不吃霉变或超过保质期的食物
D.微量元素对人体十分重要,必须大量服用
8.微量元素是指在人体总含量不到万分之一,而质量总和不到人体质量的千分之一的二十多种元素,这些元素对人体正常代谢和健康起着重要作用。下列元素中肯定不是人体中微量元素的是
A.I B.F C.H D.Fe
9.医生发现某同学体内缺少维生素C,该同学饮食中需适量增加的食物是( )
A.面食 B.植物油 C.牛肉 D.蔬菜、水果
10.下列说法中正确的是( )
A.氟元素(F)是人体必需的微量元素,缺氟会引起贫血
B.缺碘会引起甲状腺肿大,所以日常生活中要适量补碘
C.维生素可以起到维持身体健康的重要作用,缺乏维生素D会引起夜盲症
D.米饭在人体内经酶的催化作用,与水发生一系列反应,最终转化为氨基酸
11.人体摄入过量的铝会对脑、肾等器官造成损害,世界卫生组织将铝确定为食品污染物。但现实生活中,却“铝禁不止”。下列关于铝的应用不科学的是
A.使用含铝膨松剂制作油条
B.使铁锅代替铝制炊具
C.用纸盒代替铝制易拉罐盛装饮料
D.用氢氧化镁代替氢氧化铝中和过多胃酸
12.鱼肉含有丰富的营养成分,是人们餐桌上常见的一道美食。每100g鱼肉中含有的部分营养成分如图,其中表述错误的是( )
A.鱼肉中富含蛋白质 B.多食鱼肉可预防夜盲症
C.鱼肉营养丰富,可代替主食 D.青少年多食鱼肉,可促进骨骼发育
13.人体中含量最高的金属元素是( )
A.O
B.Fe
C.Ca
D.Na
14.青少年处于身体成长的关键时段,饮食应丰富全面。下列说法正确的是
A.缺铁会引起贫血
B.缺钙会引起发育不良
C.缺碘会引起骨质疏松
D.缺锌会引起甲状腺肿大
15.下列生活中的做法正确的是
A.霉变大米经高温蒸煮后食用
B.甲醛溶液浸泡海鲜防腐
C.明矾用于水的杀菌消毒
D.焙制面包时加入适量小苏打
16.碘元素被称为“智力元素”,是人体必需的微量元素之一,人体缺碘会引起甲状腺肿大,幼儿缺碘会造成思维迟钝,影响生长发育。因此,人们常通过摄入海产品或食用加碘盐来补充碘元素,以保证人体健康。利用海带提取碘单质(I2)的工艺流程如图所示,下列说法错误的是( )
A.操作①中,所需要的玻璃仪器有3种
B.由于淀粉有遇碘(I2)变蓝的特性,因此可以利用淀粉检验加入H2O2溶液后所得的“溶液一”中是否有单质碘生成
C.在上述过程中碘元素的化合价没有发生变化
D.在蒸馏操作中,蒸馏烧瓶内加入沸石的目的是为了防止液体的暴沸
二、综合应用题
17.南通有漫长的海岸线,海洋蕴藏着丰富的资源。请按要求填空。
(1)海洋为我们提供了营养丰富的食材。海带富含的______元素可以预防甲状腺肿大。
(2)今年5月我国在海域可燃冰开采技术领域取得重大突破。可燃冰主要含有甲烷水合物,还含少量CO2等气体,可燃冰属于______(选填“纯净物”或“混合物”)。若甲烷大量泄露到大气中,会导致使全球气候变暖。
(3)海水淡化可缓解淡水资源匮乏问题。利用如图装置得到淡水的方法与实验室通过______(填操作名称)净化水的方法原理相同。
(4)海水淡化可缓解淡水资源匮乏问题。水变成水蒸气的过程中,发生变化的是______。
A 分子个数B 分子质量C 分子间隔
(5)海水碳储存,可以缓解空气中CO2过多的问题,但海水的pH也在逐渐减逐渐软化、变薄、缩小。
①根据海水pH变化趋势判断:2000年时海水呈______性。
②“海洋酸化”的原因可用化学方程式表示为______。
③软体生物贝壳软化、变薄的原因是______。
18.锌是人体必需的的微量元素,称“生命元素”。
【锌的广泛应用】
(1)处于生长发育期的儿童、青少年如果缺锌,会导致发育不良,食欲差,反应迟钝。缺乏严重时,将会导致“_________ 症”和智力发育不良。 补“锌”采用药补与食补并举,经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”,这个“锌 ”指_____。
A.单质 B.元素 C.原子 D.分子
(2)实验室用锌与稀硫酸制取氢气,同时得到副产品硫酸锌。反应的化学方程式为___________________。
【制备七水硫酸锌】
以含锌废渣(主要成分为ZnO,杂质为FeO﹑CuO)为原料制备七水硫酸锌(ZnSO4·7H2O)的流程如下。
(1)粉碎的目的是___________________。
(2)若实验室用质量分数为98%,密度为1.84g/ml的浓硫酸配制200g、25%的稀硫酸,需要浓硫酸的体积为___________(精确到小数点后一位),配制时,需要的玻璃仪器有量筒﹑玻璃棒、烧杯和__________,
(3)物质X是__________,滤渣中含有的金属单质有__________,
(4)流程中获得七水硫酸锌前省略的操作是_______﹑冷却结晶﹑过滤、洗涤和低温烘干。
(5)某温度下,Fe(OH)3分解得到一种铁﹑氧质量比21:8的氧化物,该氧化物的化学式__________。
(6)除铁过程中,温度、pH对除铁效果的影响分别对如图所示。由图可知,除铁时温度应控制在__________℃为宜,pH应控制在__________为宜。
【组成测定】在一定条件下,向ZnSO4溶液中加入Na2CO3溶液,充分反应后,经过滤、洗涤、低温干燥得到纯净滤渣aZnCO3·bZn(OH)2·cH2O。为了确定aZnCO3·bZn(OH)2·cH2O组成,进行如下实验:
【查阅资料】(假设每步反应、吸收均完全。碱石灰为氢氧化钠和生石灰的混合物。)
aZnCO3·bZn(OH)2·cH2O受热分解生成ZnO、H2O、CO2三种产物,
其中ZnCO3 ZnO+CO2↑;Zn(OH)2ZnO+H2O。
现称取35.9 g aZnCO3·bZn(OH)2·cH2O在B装置中进行煅烧,将完全煅烧过程中产生的气体依次通过装置C和装置D,它们分别增重7.2 g和4.4 g。
【实验分析及数据处理】
(1)装置A的作用是_______________。
(2)若没有E装置,测得二氧化碳的质量____________(填“偏大”、“偏小”或“无影响”)。
(3)根据上述数据,化学式a ZnCO3·b Zn(OH)2· c H2O中的a:b:c =_____________ 。
【反思与拓展】
滤渣成分因温度等不同导致a、b、c会有差异,假设B化学式为ZnCO3·2Zn(OH)2·H2O,向该B中加入稀硫酸,反应的化学方程式为:_____________。
19.金属及金属材料在生产、生活中用途广泛。请回答:
(1)______(填元素符号)是人体中含量最高的金属元素。
(2)合金有着优良的性能,在金属中加热______某些金属或非金属,就可以制得具有金属特征的合金。
(3)钢铁锈蚀主要是铁与空气中的氧气和______(填化学式)发生化学反应,生成铁锈,为防止钢铁锈蚀可采取的措施是______(写出一条措施)。
(4)某炼铁厂要治炼1000t含杂质3%的生铁,需要含Fe2O3 80%的赤铁矿石的质量是______(计算结果精确至0.1)。
20.钙是维持人体正常功能所必需的元素。
(1)人体缺钙有可能导致_____ (选填序号)。
a、骨质疏松症b、贫血症c、佝偻病d、发育停滞、智力低下
(2)某钙片的主要成分是碳酸钙,兴趣小组同学想通过实验测定该钙片中碳酸钙的质量分数。(钙片中的其他成分不溶于水,且不与稀盐酸反应)
①取该钙片 10 克,研磨成粉末,置于大烧杯内,并在小烧杯中盛放足量稀盐酸,将两个烧杯放在电子天平上,记录天平读数。
②将稀盐酸倒入钙片粉末中,若观察到_____ 的现象,证明反应已经结束。
实验记录如下,试计算该品牌钙片中碳酸钙的质量分数_____ 。
实验进程 起始(/g) 最终(/g)
电子天平读数 173.20 171.00
21.如图是某口服液标签的部分内容。
××口服液 有效成分:硫酸亚铁(FeSO4) ……
(1)该口服液能为人体提供的一种微量元素是________,人体缺乏该元素会引发的病症是________。
(2)硫酸亚铁的相对分子质量是________,硫酸亚铁中铁、硫、氧三种元素的质量比是________。
22.以化合价为纵坐标、物质类别为横坐标所绘制的图象叫二维价类图,价类图可有效帮助我们建立物质之间的联系,高效进行化学学习。下图所示为碳的价类图
(1)常见的碳单质有金刚石、石墨和C60等,其中常用作电池电极的是_______(填“金刚石”或“石墨”)。它们的化学性质相似,都具有可燃性,写出C60在空气中完全燃烧的化学方程式_______,从热效应的角度分析,该反应___热量(填“吸收”或“释放”)。
(2)由图可知,M物质是氧化物,其保持M物质化学性质的最小微粒是______(填名称),实验室常用_____(填试剂的名称)检验M物质,实验室制备M物质的化学方程式是______。
(3)将CO2通入紫色石蕊试液,溶液变为_______色,该实验说明_______。
(4)碳酸钙由Ca2+和______(填符号)构成,碳酸钙中氧元素的质量分数为_______。石灰石是生产建筑材料生石灰的原料,该生产的原理(用化学方程式表示)________。
(5)钙_______(填“是”或“不是”)人体所需的微量元素,儿童缺钙易得______(填字母)。
a侏儒症 b佝偻病 c贫血病 d白内障
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.C
4.A
5.A
6.A
7.D
8.C
9.D
10.B
11.A
12.C
13.C
14.A
15.D
16.C
17. 碘 混合物 蒸馏 C 碱 CO2+H2O═H2CO3 碳酸钙能和显酸性的物质反应
18. 侏儒 B Zn+H2SO4==ZnSO4+H2↑ 增大接触面积,使反应更快更充分 22.7ml 胶头滴管 Zn Zn、Cu 蒸发浓缩 Fe3O4 83±1 3.5±0.1 除去空气中的CO2 和H2O 偏大 1∶2∶2 ZnCO3·2Zn(OH)2·H2O + 3H2SO4 = 3ZnSO4 + 6H2O + CO2↑
19.(1)Ca
(2)熔合
(3) H2O 喷漆(合理即可)
(4)1732.1t
20.(1)ac
(2)②无气泡生成。
根据质量守恒定律可得,生成二氧化碳的质量为173.2g-171g=2.2g
设该品牌钙片中碳酸钙的质量为x,
x=5g
该品牌钙片中碳酸钙的质量分数为
答:该品牌钙片中碳酸钙的质量分数为50%。
21.(1)铁 ;贫血
(2)152;7∶4∶8
22. 石墨 C60+60O260CO2 释放 二氧化碳分子 澄清石灰水 2HCl+CaCO3=CaCl2+CO2↑+H2O 红 CO2能和水反应 40% CaCO3CaO+CO2↑ 不是 b
答案第1页,共2页
答案第1页,共2页
同课章节目录
