6.2金属的化学性质同步练习—2021-2022学年九年级化学科粤版(2012)下册(word版 含解析)
文档属性
| 名称 | 6.2金属的化学性质同步练习—2021-2022学年九年级化学科粤版(2012)下册(word版 含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 108.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-28 22:14:41 | ||
图片预览




文档简介
科粤版九年级化学下册 6.2 金属的化学性质 同步练习
一、单选题
1.现有X、Y、Z三种金属,如果把X、Y和Z分别放入稀硫酸中,X和Z溶解并产生气体,Y无变化;如果把X放入Z的盐溶液中,过一会儿,在X的表面有Z析出。根据以上实验事实,判断X、Y和Z的金属活动性顺序( )
A.X>Y>Z B.Y>Z>X C.X>Z>Y D.Z>X>Y
2.取镁、铝两种金属的混合物12.6g,加入到一定量的稀硫酸中恰好完全反应,反应后溶液质量增加了11.4g。将反应后的溶液蒸发结晶、干燥,所得固体质量为
A.24.0g B.36.6g C.70.2g D.82.4g
3.下列与金属相关的说法正确的是
A.生铁和钢性能完全相同
B.炼铁过程只发生物理变化
C.常温下所有金属均为固态
D.铁在潮湿的空气中易生锈
4.现有某铁样品5.6g,含有的杂质为镁、锌、铜中的两种或三种。向其中逐渐加入溶质质量分数为9.8%的稀硫酸,产生氢气质量与加入稀硫酸质量的关系如下图所示。则下列结论正确的个数是
①恰好完全反应时,一定没有固体剩余
②x的值为0.2
③铁样品中可能含有镁
④M点对应的溶液中含有2种或3种溶质
A.1个
B.2个
C.3个
D.4个
5.下列物质不能由金属单质和盐酸直接反应生成的是( )
A.FeCl2 B.ZnCl2 C.CuCl2 D.AlCl3
6.将下列各组中的物质放入烧杯中,加入适量水搅拌,待充分反应后过滤,在滤纸上留下两种金属的是( )
A.Zn、NaCl、CuCl2(过量)
B.Fe(过量)、Cu(NO3)2、AgNO3
C.Fe(过量)、KNO3、CuSO4
D.Cu (过量)、FeCl2、HCl
7.有X、Y、Z三种金属,把Y投入X(NO3)2溶液中,Y表面有X析出,溶液质量增大:把X投入Z(NO3)2溶液中,得到X(NO3)2,溶液质量减小。下列判断错误的是( )
A.X、Y、Z可能依次是:Cu、Fe、Ag
B.元素的相对原子质量可能是:Z>Y>X
C.金属活动性顺序是:Y>X>Z
D.X、Y、Z可能依次是:Fe、Zn、Hg
8.相同质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如图所示.下列有关叙述正确的是
A.金属活动性:N>M B.生成H2的质量相等
C.相对原子质量:N>M D.消耗盐酸的质量相等
9.为验证Mg、Cu、Sn的金属活动性顺序,不可选用的一组物质是
A.MgCl2溶液、Cu、Sn
B.Mg、Cu、SnCl2溶液
C.Mg、Sn、Cu、盐酸
D.MgCl2溶液、Sn、CuCl2溶液
10.铝是一种应用越来越广泛的金属。下列有关铝的描述正确的是
A.铝是地壳中含量最高的元素
B.单质铝的化合价常表现为+3价
C.铁比铝容易生锈,故铁的化学性质比铝活泼
D.镁和铝的金属活动性可通过等浓度的稀盐酸来判断
11.将适量的铜粉和镁粉的混合物放入一定量的硝酸银溶液中,充分反应后过滤,得到固体物质和无色滤液,则关于滤出的固体和无色滤液的下列判断正确的是
A.滤出的固体中一定含有银和铜,一定不含镁
B.滤出的固体中一定含有银,可能含有铜和镁
C.滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜
D.滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜
12.下列金属中,金属活动性最强的是
A.铁 B.铝 C.铜 D.银
13.等质量、等浓度的稀硫酸分别与足量的镁、锌两种金属反应,下列图像能正确表示产生氢气质量与反应时间之间关系的是( )
A. B.
C. D.
14.有甲、乙、丙、丁四种金属,只有丙在自然界能以单质形态存在。含甲化合物的水溶液不能用乙制的容器盛放。将甲和丁分别放入硝酸铜溶液中,在甲表面有铜析出,而丁没有变化。这四种金属活动性顺序由弱到强的是
A.丙<丁<甲<乙 B.乙<甲<丁<丙 C.丁<甲<乙<丙 D.丙< 乙<甲<丁
15.收藏家收藏清末的铝器,至今保存完好,该艺术品不易锈损的主要原因是
A.铝不易发生化学反应 B.铝的氧化物易发生还原反应
C.铝不易氧化 D.铝易氧化,但铝表面的氧化铝具有保护内部的作用
16.下列各组物质不能验证Fe、Mg、Cu三种金属活动性强弱的是( )
①Mg、Cu、FeSO4溶液
②MgSO4溶液、Fe、Cu
③Cu、MgSO4溶液、FeSO4溶液
④Fe、MgSO4溶液、Cu(NO3)2溶液
A.只有①③
B.只有②③
C.只有①②④
D.只有②③④
二、综合应用题
17.材料是人类赖以生存和发展的重要物质,铜是目前使用最广泛的金属之一.
(一)铜材料的有关知识
(1)人类使用金属先后经历了“青铜”、“铁器”时代,直到近代才开始大量使用铝材料.这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是_____.
(2)纯铜又称紫铜,常见铜合金有黄铜、青铜等种类.家用电缆常用紫铜,以聚氯乙烯塑料或TPU橡胶包裹.
①我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理____.
②鉴别黄铜和黄金,以下方法不可行的是_____(选填序号).
A 观察颜色 B 加稀盐酸 C 在空气中灼烧
(二)铜及其化合物的实验1.硫酸铜是制备其他含铜化合物的重要原料,以下是制取硫酸铜的常见方法.
(1)方案1:向稀硫酸中加入铜粉,再用导管通入空气并加热,铜粉逐渐减少,溶液由无色变为蓝色.
①反应中溶液的稀硫酸的质量逐渐____(填“增大”或“减小”).
②该反应的化学方程式______.
(2)方案2:将铜片加入浓硫酸中,加热,产生刺激性气味,溶液逐渐变成蓝色.将产生的气体通入酸性高锰酸钾溶液中,溶液褪色,说明该气体是_____.
(3)从环保角度进行比较,你认为方案_____(填“1”或“2”)更合理.
2.在一定量硫酸铜溶液中加入碳酸钠溶液,过滤、洗涤、低温干燥得到碱式碳酸铜固体,其组成为:xCuCO3·yCu(OH)2·zH2O.
(三)碱式碳酸铜的热分解实验
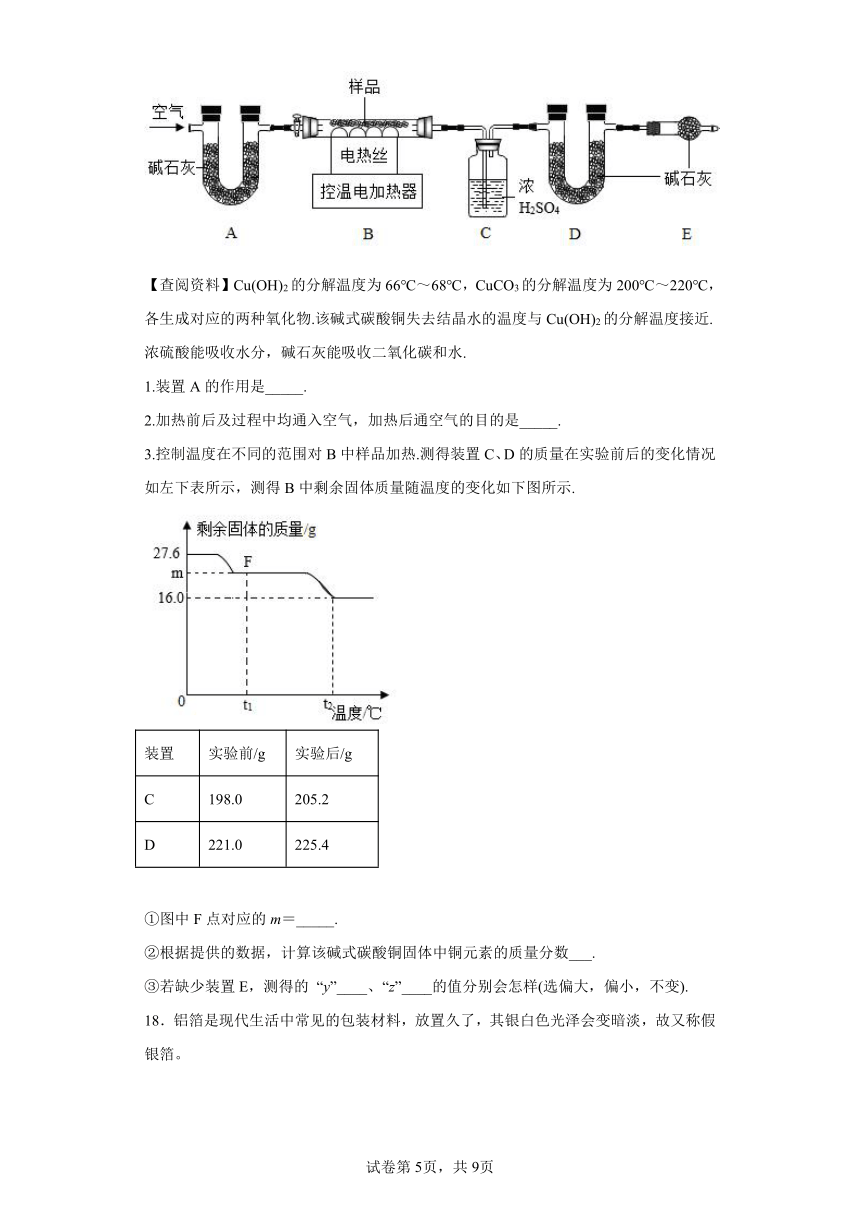
兴趣小组称取此固体27.6g,在科研人员的指导下用下图装置进行热分解实验.
【查阅资料】Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃,各生成对应的两种氧化物.该碱式碳酸铜失去结晶水的温度与Cu(OH)2的分解温度接近.浓硫酸能吸收水分,碱石灰能吸收二氧化碳和水.
1.装置A的作用是_____.
2.加热前后及过程中均通入空气,加热后通空气的目的是_____.
3.控制温度在不同的范围对B中样品加热.测得装置C、D的质量在实验前后的变化情况如左下表所示,测得B中剩余固体质量随温度的变化如下图所示.
装置 实验前/g 实验后/g
C 198.0 205.2
D 221.0 225.4
①图中F点对应的m=_____.
②根据提供的数据,计算该碱式碳酸铜固体中铜元素的质量分数___.
③若缺少装置E,测得的 “y”____、“z”____的值分别会怎样(选偏大,偏小,不变).
18.铝箔是现代生活中常见的包装材料,放置久了,其银白色光泽会变暗淡,故又称假银箔。
(1)小柯用放置很久的铝箔与稀盐酸反应,产生氢气质量和反应时间关系如图所示。在0~t1时间段内,铝箔表面看不到明显的气泡,原因是铝表面的致密保护膜阻止铝与稀盐酸反应;在t2~t3时间段产生气泡的速度逐渐放缓,直到反应停止时,铝箔还有大量剩余。t2~t3时间段产生气泡速度放缓的原因是 __________________________________________ ;t3时间后氢气质量不再增加的原因是 ____________________________________ 。
(2)为进一步测量铝箔中单质铝的质量分数,小柯取1.9g铝箔样品与50.0g稀盐酸充分反应,铝箔完全溶解后剩余溶液的总质量为51.7g。计算样品中单质铝的质量分数是 ______ 。(保留1位小数)
19.我国探月工程“嫦娥五号”探测器首次从月球带回约1731g月壤,国家航天局同步发布了《月球样品管理办法》。根据所学知识回答下列问题:
(1)“嫦娥五号”探测器的关键部件采用铝合金而不采用纯铝,原因是________。
(2)月球制氧机利用月球土壤制备出氧气,用于未来人类移民。月球制氧机可使用太阳能电池板,将丰富的太阳光能转换成______能,月壤中一定含有____(填“氧气”或“氧元素”)。
(3)月壤样品中发现核聚变发电的理想原料氦﹣3,其原子核中质子数为2、中子数为1,氦原子中的核电荷数为____,氦与其它物质____(填“容易”或“不易”)发生化学反应。
(4)月球表面富含钛铁矿,钛因其硬度大、熔点高、常温下耐酸碱、耐腐蚀等优良的性能,被誉为“未来金属”。工业上以钛铁矿为(主要成分为钛酸亚铁FeTiO3)为原料生产钛,其主要工艺流程如下图所示。
①写出镁在高温下与TiCl4反应生成钛和氯化镁的化学方程式_________,此反应说明金属钛的活动性比镁_________(填“强”或“弱”)。
②上述生产过程中得到的金属钛中混有少量金属杂质,可加入____ 除去(填试剂名称)。
20.铜在生产、生活中用途广泛。请回答下面关于铜的有关问题。
Ⅰ、图甲是铜(Cu)和A、B、C、D其它四物质间的关系(“—”表示物质间能发生反应,“→”表示物质在一定条件下能转化)。A、B、C是单质,D是氧化物,且A和B是金属,C和D是无色气体,。
(1)Cu、A、B三种金属的活动性由强到弱排列顺序是_____,①②③反应的基本类型都是_____。
(2)⑤的化学方程式是_____,反应⑥中表现D具有_____性。
Ⅱ、从含 Cu、Zn的废旧电池铜帽中回收铜并制取硫酸锌溶液的过程如图乙所示(反应条件已略去)。已知2Cu+2H2SO4+O2=2CuSO4+2H2O。
(1)操作②的名称是_____,固体C所含的物质是_____(填化学式)。
(2)②发生反应的化学方程式是_____。
(3)③中加入适量稀H2SO4的作用是_____。
21.回答问题
(1)修建火神山、雷神山两座医院时用到了大量铝合金材料,铝合金密度小、硬度大、耐腐蚀。铝制品耐腐蚀的原因是______________(用化学方程式表示)。
(2)铝合金中主要含铝、铜、镁三种金属,为验证这三种金属的活动性顺序,某同学设计了以下3个实验:
实验甲中铝丝表面会出现的现象是__________,实验甲能得出的结论是_________的金属活动性更强,另一位同学认为实验乙、丙中均无明显现象,对完整的结论没有作用,都可以省去。你的看法是__________(填序号)。
A.乙、丙都可以省去 B.乙、丙都不能省去
C.丙可以省去,乙不能省 D.乙可以省去,丙不能省
(3)黄铜是以Zn为主要添加元素的铜合金。黄铜渣中含有Zn、ZnO、Cu、CuO,其余为杂质。某工厂处理黄铜渣主要流程如下(杂质不溶于水、不参加反应):
已知:
①溶液A中的阳离子有__________(填离子符号)。
②固体B是___________(填“纯净物”或“混合物”)。
③在整个流程中生成硫酸锌的化学方程式有_________个。
22.某实验小组为了研究反应物的接触面积对反应速率的影响。实验装置如“题21-1图”所示,他们用等质量不同形状的金属锌(所用金属锌均不含任何杂质)和稀盐酸反应(见下表),实验中使用传感器装置测算生成氢气的体积,绘制氢气体积随时间变化的曲线如图所示。
实验编号 药品
I 6.5g锌块、7.3%的稀盐酸150g
II 6.5g锌粒、7.3%的稀盐酸150g
III 6.5g锌粉、7.3%的稀盐酸150g
(1)如图的曲线___________(填“甲”、“乙”或“丙”)代表的是实验III,从曲线甲、乙、丙得出探究结论是:_______________。
(2)实验前需要配制7.3%的稀盐酸150g,需要质量分数为36.5%的浓盐酸__________g。
(3)请计算以上任意一组实验中生成氢气的质量___________(写出具体计算过程)。
(4)分析上表数据,请在图中画出在6.5g锌中加入0~150g稀盐酸过程中,产生氢气质量对应的变化曲线图,并标注必要的数值。___________
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.D
4.A
5.C
6.C
7.A
8.C
9.A
10.D
11.B
12.B
13.B
14.A
15.D
16.B
17. Al Fe Cu Fe+CuSO4=FeSO4+Cu A 减小 2Cu +O2+2H2SO4=2CuSO4+2H2O SO2 1 除去空气中的二氧化碳和水 将B中残留的气体赶到CD装置 20.4g 46.4% 偏小 偏大
18. 稀盐酸的浓度在反应中逐渐降低 稀盐酸已全部反应完 94.7%。
19. 铝合金的硬度等机械强度要大 电 氧元素 2 不易 2Mg+TiCl4Ti+2MgCl2 弱 稀盐酸或稀硫酸
20. A﹥B﹥Cu 置换反应
可燃性(或还原性) 过滤 Zn、Cu
除去铜、锌混合物中的锌,转化为ZnSO4
21.(1)
(2) 铝丝表面有红色物质析出 Al C
(3) Zn2+、Cu2+ 混合物 3
22. 甲 在其他条件相同时,固体颗粒越小,反应速率越快; 30 0.2g
答案第1页,共2页
答案第1页,共2页
一、单选题
1.现有X、Y、Z三种金属,如果把X、Y和Z分别放入稀硫酸中,X和Z溶解并产生气体,Y无变化;如果把X放入Z的盐溶液中,过一会儿,在X的表面有Z析出。根据以上实验事实,判断X、Y和Z的金属活动性顺序( )
A.X>Y>Z B.Y>Z>X C.X>Z>Y D.Z>X>Y
2.取镁、铝两种金属的混合物12.6g,加入到一定量的稀硫酸中恰好完全反应,反应后溶液质量增加了11.4g。将反应后的溶液蒸发结晶、干燥,所得固体质量为
A.24.0g B.36.6g C.70.2g D.82.4g
3.下列与金属相关的说法正确的是
A.生铁和钢性能完全相同
B.炼铁过程只发生物理变化
C.常温下所有金属均为固态
D.铁在潮湿的空气中易生锈
4.现有某铁样品5.6g,含有的杂质为镁、锌、铜中的两种或三种。向其中逐渐加入溶质质量分数为9.8%的稀硫酸,产生氢气质量与加入稀硫酸质量的关系如下图所示。则下列结论正确的个数是
①恰好完全反应时,一定没有固体剩余
②x的值为0.2
③铁样品中可能含有镁
④M点对应的溶液中含有2种或3种溶质
A.1个
B.2个
C.3个
D.4个
5.下列物质不能由金属单质和盐酸直接反应生成的是( )
A.FeCl2 B.ZnCl2 C.CuCl2 D.AlCl3
6.将下列各组中的物质放入烧杯中,加入适量水搅拌,待充分反应后过滤,在滤纸上留下两种金属的是( )
A.Zn、NaCl、CuCl2(过量)
B.Fe(过量)、Cu(NO3)2、AgNO3
C.Fe(过量)、KNO3、CuSO4
D.Cu (过量)、FeCl2、HCl
7.有X、Y、Z三种金属,把Y投入X(NO3)2溶液中,Y表面有X析出,溶液质量增大:把X投入Z(NO3)2溶液中,得到X(NO3)2,溶液质量减小。下列判断错误的是( )
A.X、Y、Z可能依次是:Cu、Fe、Ag
B.元素的相对原子质量可能是:Z>Y>X
C.金属活动性顺序是:Y>X>Z
D.X、Y、Z可能依次是:Fe、Zn、Hg
8.相同质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如图所示.下列有关叙述正确的是
A.金属活动性:N>M B.生成H2的质量相等
C.相对原子质量:N>M D.消耗盐酸的质量相等
9.为验证Mg、Cu、Sn的金属活动性顺序,不可选用的一组物质是
A.MgCl2溶液、Cu、Sn
B.Mg、Cu、SnCl2溶液
C.Mg、Sn、Cu、盐酸
D.MgCl2溶液、Sn、CuCl2溶液
10.铝是一种应用越来越广泛的金属。下列有关铝的描述正确的是
A.铝是地壳中含量最高的元素
B.单质铝的化合价常表现为+3价
C.铁比铝容易生锈,故铁的化学性质比铝活泼
D.镁和铝的金属活动性可通过等浓度的稀盐酸来判断
11.将适量的铜粉和镁粉的混合物放入一定量的硝酸银溶液中,充分反应后过滤,得到固体物质和无色滤液,则关于滤出的固体和无色滤液的下列判断正确的是
A.滤出的固体中一定含有银和铜,一定不含镁
B.滤出的固体中一定含有银,可能含有铜和镁
C.滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜
D.滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜
12.下列金属中,金属活动性最强的是
A.铁 B.铝 C.铜 D.银
13.等质量、等浓度的稀硫酸分别与足量的镁、锌两种金属反应,下列图像能正确表示产生氢气质量与反应时间之间关系的是( )
A. B.
C. D.
14.有甲、乙、丙、丁四种金属,只有丙在自然界能以单质形态存在。含甲化合物的水溶液不能用乙制的容器盛放。将甲和丁分别放入硝酸铜溶液中,在甲表面有铜析出,而丁没有变化。这四种金属活动性顺序由弱到强的是
A.丙<丁<甲<乙 B.乙<甲<丁<丙 C.丁<甲<乙<丙 D.丙< 乙<甲<丁
15.收藏家收藏清末的铝器,至今保存完好,该艺术品不易锈损的主要原因是
A.铝不易发生化学反应 B.铝的氧化物易发生还原反应
C.铝不易氧化 D.铝易氧化,但铝表面的氧化铝具有保护内部的作用
16.下列各组物质不能验证Fe、Mg、Cu三种金属活动性强弱的是( )
①Mg、Cu、FeSO4溶液
②MgSO4溶液、Fe、Cu
③Cu、MgSO4溶液、FeSO4溶液
④Fe、MgSO4溶液、Cu(NO3)2溶液
A.只有①③
B.只有②③
C.只有①②④
D.只有②③④
二、综合应用题
17.材料是人类赖以生存和发展的重要物质,铜是目前使用最广泛的金属之一.
(一)铜材料的有关知识
(1)人类使用金属先后经历了“青铜”、“铁器”时代,直到近代才开始大量使用铝材料.这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是_____.
(2)纯铜又称紫铜,常见铜合金有黄铜、青铜等种类.家用电缆常用紫铜,以聚氯乙烯塑料或TPU橡胶包裹.
①我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理____.
②鉴别黄铜和黄金,以下方法不可行的是_____(选填序号).
A 观察颜色 B 加稀盐酸 C 在空气中灼烧
(二)铜及其化合物的实验1.硫酸铜是制备其他含铜化合物的重要原料,以下是制取硫酸铜的常见方法.
(1)方案1:向稀硫酸中加入铜粉,再用导管通入空气并加热,铜粉逐渐减少,溶液由无色变为蓝色.
①反应中溶液的稀硫酸的质量逐渐____(填“增大”或“减小”).
②该反应的化学方程式______.
(2)方案2:将铜片加入浓硫酸中,加热,产生刺激性气味,溶液逐渐变成蓝色.将产生的气体通入酸性高锰酸钾溶液中,溶液褪色,说明该气体是_____.
(3)从环保角度进行比较,你认为方案_____(填“1”或“2”)更合理.
2.在一定量硫酸铜溶液中加入碳酸钠溶液,过滤、洗涤、低温干燥得到碱式碳酸铜固体,其组成为:xCuCO3·yCu(OH)2·zH2O.
(三)碱式碳酸铜的热分解实验
兴趣小组称取此固体27.6g,在科研人员的指导下用下图装置进行热分解实验.
【查阅资料】Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃,各生成对应的两种氧化物.该碱式碳酸铜失去结晶水的温度与Cu(OH)2的分解温度接近.浓硫酸能吸收水分,碱石灰能吸收二氧化碳和水.
1.装置A的作用是_____.
2.加热前后及过程中均通入空气,加热后通空气的目的是_____.
3.控制温度在不同的范围对B中样品加热.测得装置C、D的质量在实验前后的变化情况如左下表所示,测得B中剩余固体质量随温度的变化如下图所示.
装置 实验前/g 实验后/g
C 198.0 205.2
D 221.0 225.4
①图中F点对应的m=_____.
②根据提供的数据,计算该碱式碳酸铜固体中铜元素的质量分数___.
③若缺少装置E,测得的 “y”____、“z”____的值分别会怎样(选偏大,偏小,不变).
18.铝箔是现代生活中常见的包装材料,放置久了,其银白色光泽会变暗淡,故又称假银箔。
(1)小柯用放置很久的铝箔与稀盐酸反应,产生氢气质量和反应时间关系如图所示。在0~t1时间段内,铝箔表面看不到明显的气泡,原因是铝表面的致密保护膜阻止铝与稀盐酸反应;在t2~t3时间段产生气泡的速度逐渐放缓,直到反应停止时,铝箔还有大量剩余。t2~t3时间段产生气泡速度放缓的原因是 __________________________________________ ;t3时间后氢气质量不再增加的原因是 ____________________________________ 。
(2)为进一步测量铝箔中单质铝的质量分数,小柯取1.9g铝箔样品与50.0g稀盐酸充分反应,铝箔完全溶解后剩余溶液的总质量为51.7g。计算样品中单质铝的质量分数是 ______ 。(保留1位小数)
19.我国探月工程“嫦娥五号”探测器首次从月球带回约1731g月壤,国家航天局同步发布了《月球样品管理办法》。根据所学知识回答下列问题:
(1)“嫦娥五号”探测器的关键部件采用铝合金而不采用纯铝,原因是________。
(2)月球制氧机利用月球土壤制备出氧气,用于未来人类移民。月球制氧机可使用太阳能电池板,将丰富的太阳光能转换成______能,月壤中一定含有____(填“氧气”或“氧元素”)。
(3)月壤样品中发现核聚变发电的理想原料氦﹣3,其原子核中质子数为2、中子数为1,氦原子中的核电荷数为____,氦与其它物质____(填“容易”或“不易”)发生化学反应。
(4)月球表面富含钛铁矿,钛因其硬度大、熔点高、常温下耐酸碱、耐腐蚀等优良的性能,被誉为“未来金属”。工业上以钛铁矿为(主要成分为钛酸亚铁FeTiO3)为原料生产钛,其主要工艺流程如下图所示。
①写出镁在高温下与TiCl4反应生成钛和氯化镁的化学方程式_________,此反应说明金属钛的活动性比镁_________(填“强”或“弱”)。
②上述生产过程中得到的金属钛中混有少量金属杂质,可加入____ 除去(填试剂名称)。
20.铜在生产、生活中用途广泛。请回答下面关于铜的有关问题。
Ⅰ、图甲是铜(Cu)和A、B、C、D其它四物质间的关系(“—”表示物质间能发生反应,“→”表示物质在一定条件下能转化)。A、B、C是单质,D是氧化物,且A和B是金属,C和D是无色气体,。
(1)Cu、A、B三种金属的活动性由强到弱排列顺序是_____,①②③反应的基本类型都是_____。
(2)⑤的化学方程式是_____,反应⑥中表现D具有_____性。
Ⅱ、从含 Cu、Zn的废旧电池铜帽中回收铜并制取硫酸锌溶液的过程如图乙所示(反应条件已略去)。已知2Cu+2H2SO4+O2=2CuSO4+2H2O。
(1)操作②的名称是_____,固体C所含的物质是_____(填化学式)。
(2)②发生反应的化学方程式是_____。
(3)③中加入适量稀H2SO4的作用是_____。
21.回答问题
(1)修建火神山、雷神山两座医院时用到了大量铝合金材料,铝合金密度小、硬度大、耐腐蚀。铝制品耐腐蚀的原因是______________(用化学方程式表示)。
(2)铝合金中主要含铝、铜、镁三种金属,为验证这三种金属的活动性顺序,某同学设计了以下3个实验:
实验甲中铝丝表面会出现的现象是__________,实验甲能得出的结论是_________的金属活动性更强,另一位同学认为实验乙、丙中均无明显现象,对完整的结论没有作用,都可以省去。你的看法是__________(填序号)。
A.乙、丙都可以省去 B.乙、丙都不能省去
C.丙可以省去,乙不能省 D.乙可以省去,丙不能省
(3)黄铜是以Zn为主要添加元素的铜合金。黄铜渣中含有Zn、ZnO、Cu、CuO,其余为杂质。某工厂处理黄铜渣主要流程如下(杂质不溶于水、不参加反应):
已知:
①溶液A中的阳离子有__________(填离子符号)。
②固体B是___________(填“纯净物”或“混合物”)。
③在整个流程中生成硫酸锌的化学方程式有_________个。
22.某实验小组为了研究反应物的接触面积对反应速率的影响。实验装置如“题21-1图”所示,他们用等质量不同形状的金属锌(所用金属锌均不含任何杂质)和稀盐酸反应(见下表),实验中使用传感器装置测算生成氢气的体积,绘制氢气体积随时间变化的曲线如图所示。
实验编号 药品
I 6.5g锌块、7.3%的稀盐酸150g
II 6.5g锌粒、7.3%的稀盐酸150g
III 6.5g锌粉、7.3%的稀盐酸150g
(1)如图的曲线___________(填“甲”、“乙”或“丙”)代表的是实验III,从曲线甲、乙、丙得出探究结论是:_______________。
(2)实验前需要配制7.3%的稀盐酸150g,需要质量分数为36.5%的浓盐酸__________g。
(3)请计算以上任意一组实验中生成氢气的质量___________(写出具体计算过程)。
(4)分析上表数据,请在图中画出在6.5g锌中加入0~150g稀盐酸过程中,产生氢气质量对应的变化曲线图,并标注必要的数值。___________
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.D
4.A
5.C
6.C
7.A
8.C
9.A
10.D
11.B
12.B
13.B
14.A
15.D
16.B
17. Al Fe Cu Fe+CuSO4=FeSO4+Cu A 减小 2Cu +O2+2H2SO4=2CuSO4+2H2O SO2 1 除去空气中的二氧化碳和水 将B中残留的气体赶到CD装置 20.4g 46.4% 偏小 偏大
18. 稀盐酸的浓度在反应中逐渐降低 稀盐酸已全部反应完 94.7%。
19. 铝合金的硬度等机械强度要大 电 氧元素 2 不易 2Mg+TiCl4Ti+2MgCl2 弱 稀盐酸或稀硫酸
20. A﹥B﹥Cu 置换反应
可燃性(或还原性) 过滤 Zn、Cu
除去铜、锌混合物中的锌,转化为ZnSO4
21.(1)
(2) 铝丝表面有红色物质析出 Al C
(3) Zn2+、Cu2+ 混合物 3
22. 甲 在其他条件相同时,固体颗粒越小,反应速率越快; 30 0.2g
答案第1页,共2页
答案第1页,共2页
