6.3金属矿物与冶炼同步练习—2021-2022学年九年级化学科粤版(2012)下册(word版有答案)
文档属性
| 名称 | 6.3金属矿物与冶炼同步练习—2021-2022学年九年级化学科粤版(2012)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 427.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-28 22:17:10 | ||
图片预览

文档简介
科粤版九年级化学下册 6.3 金属矿物与冶炼 同步练习
一、单选题
1.符合下图装置设计意图的有( )
①说明CO具有还原性 ②既说明CO具有可燃性,又充分地利用了能源 ③说明CO得到氧后的产物是CO2 ④有效地防止了剧毒的CO对空气的污染
A.①② B.②④ C.②③④ D.①②③④
2.将草酸(H2C2O4),沸点约150℃,分解温度约190℃)隔绝空气加热,得到的混合物经充分冷却后,残余气体M(CO、CO2中的一种或两种)。为探究M的成分,设计如图所示实验。下列说法不正确的是( )
A.若甲试管内溶液变浑浊,则M中一定含有CO2
B.若丙中固体变黑、丁试管内溶液变浑浊,则M中一定含CO
C.若装置甲、乙位置互换,则无法判断M中是否含有CO
D.若加热所得混合物不经充分冷却,则M中可能混有草酸蒸气
3.把等质量的X、Y、Z、M四种金属分别加入到同体积、同浓度的足量稀盐酸中。再把X加入到Z (NO3)2溶液中,M加入到YNO3溶液中。反应关系如图所示。据此判断四种金属的活动性顺序为
A.Z>X>M>Y B.X>Z>M>Y C.X>Z>Y>M D.Y>M>Z>X
4.下图是CO与Fe2O3反应的实验装置图,下列说法不正确的是( )
A.实验开始时,先通入CO,在装置出口处验纯后,点燃酒精灯,再点燃酒精喷灯
B.实验过程中看到,玻璃管里的粉末由红棕色逐渐变为黑色
C.CO与Fe2O3反应的化学方程式为Fe2O3+CO2Fe+CO2
D.尾气处理时发生反应的化学方程式为2CO+O22CO2
5.工业上利用黄铁矿(主要成分是FeS2)生产硫酸。同时还能得到一种副产品氧化铁用于炼铁,其反应原理如下:
①4FeS2+11O22Fe2O3+8SO2 ②2SO2+O22SO3
③SO3+H2O=H2SO4 ④ Fe2O3+3CO2Fe+3CO2
下列说法不正确的是
A.反应①②④均是在高温条件下进行的
B.只有①②发生的是氧化反应
C.反应②③属于化合反应
D.反应①④不属于四种基本反应类型中的任何一种
6.考虑到实验的安全、成功等问题,化学实验中常常需要特别关注实验的先后顺序。下列实验的先后顺序关系错误的是
A.点燃甲烷等可燃性气体之前,要先验纯,后点燃
B.实验室制取气体时,要先检查装置的气密性,后加入试剂进行反应
C.用高锰酸钾制取氧气的实验结束时,要先把导气管从水槽中取出,后撤离酒精灯
D.利用CO与氧化铁反应制取铁的实验结束时,要先停止通入CO,后停止加热固体
7.用“W”型管进行微型实验,如图所示,下列说法错误的是
A.a处红棕色粉末变为黑色
B.a处实验结束时先停止,通入CO,后停止加热
C.b处澄清石灰水变浑浊证明有二氧化碳生成
D.可利用点燃的方法进行尾气处理
8.下图是甲是初中化学炼铁的基本原理。乙是工业炼铁高炉的结构图。下列说法错误的是
A.由甲图加热装置可知炼铁需要高温
B.乙图中焦炭燃烧产生高温也可以反应产生一氧化碳
C.乙图中出铁口应该比出渣口高一些
D.甲图中b处在操作时应该接尾气处理装置
9.探究金属活动性顺序时,将锌粒放入硫酸铜溶液中,锌粒表面有紫红色物质析出,还有无色无味气体产生的“异常”现象。推测该气体可能是
A.氢气 B.二氧化硫 C.二氧化碳 D.一氧化碳
10.钢铁厂会利用焦炭产生的还原性气体来炼铁,某同学用此原理按如图装置进行实验,下列说法不正确的是( )
A.该实验还需要增加尾气处理装置
B.加热前应先通入一段时间的CO,目的是排尽装置内的空气,防止发生爆炸
C.NaOH溶液的作用是检验反应后的产物
D.反应结束后,应先停止加热,继续通入CO至固体冷却为止
11.利用如图所示实验装置模拟工业炼铁。下列说法正确的是
A.反应前后Fe元素的化合价由+2价变为0价 B.充分加热,a处固体由黑色变为红色
C.b处可以用澄清石灰水检验生成的CO2 D.可用水吸收尾气中的CO
12.如图为一氧化碳还原氧化铁实验。下列说法中正确的是( )
A.开始时应先预热玻璃管,后通入一氧化碳
B.实验中玻璃管里粉末由黑色逐渐变成红棕色
C.参加反应的氧化铁和一氧化碳质量比为40:7
D.将尾气点燃或收集,可防止一氧化碳污染空气
13.某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制生铁。若要炼制含铁96%的生铁63 t,假设在炼制过程中损失10%铁元素,则理论上需要含杂质20%的赤铁矿石的质量是
A.120 t B.108 t C.96 t D.84 t
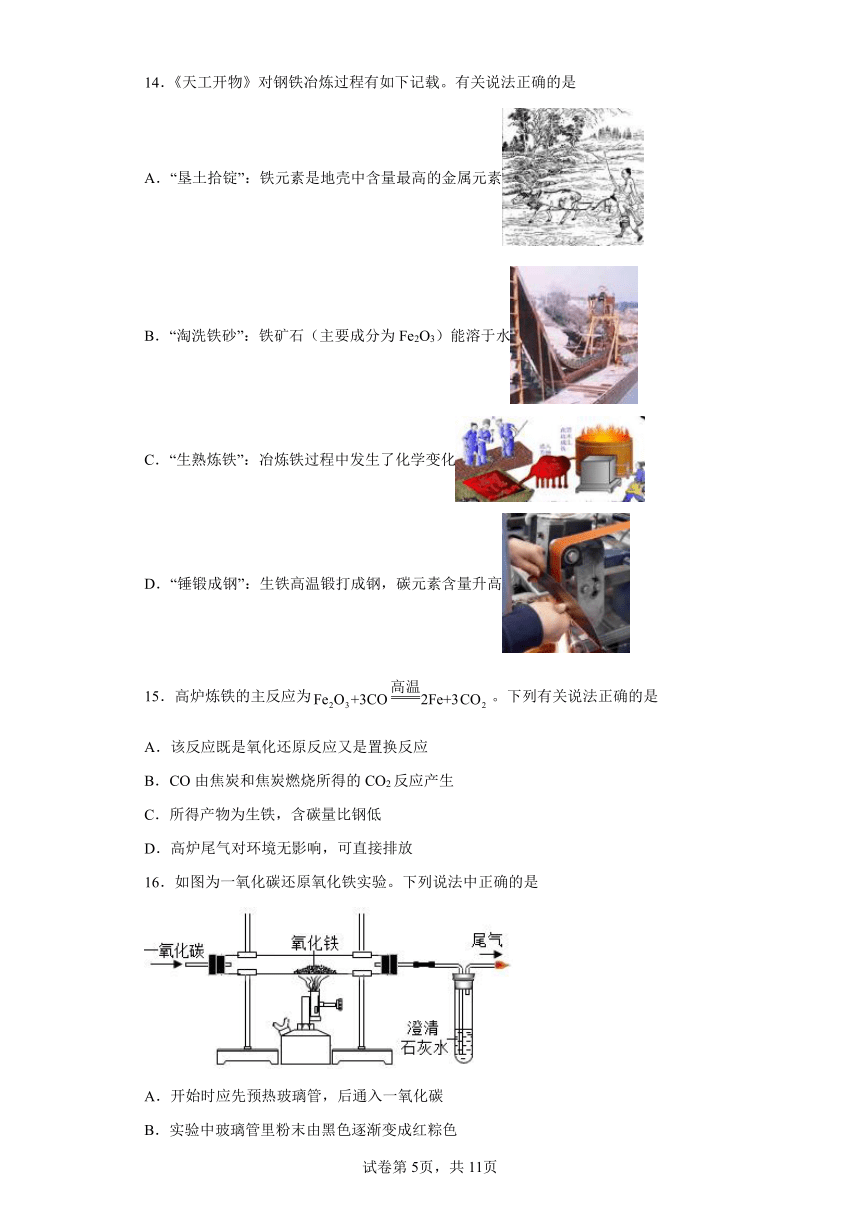
14.《天工开物》对钢铁冶炼过程有如下记载。有关说法正确的是
A.“垦土拾锭”:铁元素是地壳中含量最高的金属元素
B.“淘洗铁砂”:铁矿石(主要成分为Fe2O3)能溶于水
C.“生熟炼铁”:冶炼铁过程中发生了化学变化
D.“锤锻成钢”:生铁高温锻打成钢,碳元素含量升高
15.高炉炼铁的主反应为。下列有关说法正确的是
A.该反应既是氧化还原反应又是置换反应
B.CO由焦炭和焦炭燃烧所得的CO2反应产生
C.所得产物为生铁,含碳量比钢低
D.高炉尾气对环境无影响,可直接排放
16.如图为一氧化碳还原氧化铁实验。下列说法中正确的是
A.开始时应先预热玻璃管,后通入一氧化碳
B.实验中玻璃管里粉末由黑色逐渐变成红粽色
C.参加反应的一氧化碳具有氧化性
D.将尾气点燃或收集,可防止一氧化碳污染空气
二、综合应用题
17.某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分是Fe2O3)炼铁的主要反应原理。他们设计的实验装置如下图所示。
(1)写出一氧化碳还原氧化铁的化学方程式_______。
(2)实验中在甲装置中观察到的实验现象_______。
(3)甲装置中,设置酒精灯的目的_______,实验时应先点燃_______灯。
(4)乙装置与甲装置相比,它的主要优点是_______。
(5)每年因腐蚀而浪费掉的金属材料数量惊人,铁栅栏常采用的防锈措施是_______,除防止金属腐蚀外,保护金属资源的最有效途径还有_______(答一点即可)
(6)小王同学想测定某Cu-Zn合金中铜的质量分数,取合金粉末13g,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与生成氢气的质量关系如下图所示。回答:
①反应生成氢气的总质量为_______g。
②计算合金中铜的质量分数_______。
18.金属在各个领域中用途广泛。
(1)铝的抗腐蚀性能好在工业上用途广泛。中国科学院金属研究所研制的新型铝合金复合材料,其性能比铝轻,比钢硬、耐磨搁、抗腐蚀。这种材料大量用于制作”祝融号”火星车、“玉兔号"月球车及嫦娥、北斗、天宫等我国先进的航天设备。
①从上文中可获知合金的性能优势有_____(一条即可)。
②铝具有很好的抗腐蚀性能,主要是因为______(写化学方程式)。
(2)某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了如图实验,并对溶液A和固体B的成分进行了分析和实验探究。
①溶液A中的溶质可能有___种情况。
②写出探究过程中任一反应的化学方程式___。
(3)利用下图装置可做CO还原Fe2O3的实验,并检验该反应生成的气体产物。
①玻璃管中观察到的现象是___。
②气体通过装置的顺序是A→_____→_____→_____(装置不能重复使用)。
③写D中发生反应的化学方程式_____。
(4)高铁轨道铺设过程中可利用铝热反应焊接钢轨,其原理是把铝粉和三氧化二铁粉末按比例混合,高温条件下得到氧化铝和单质铁,并放出大量的热,若要制得11.2kg铁。理论上需要消耗铝的质量是_____?
19.在金属的性质复习课上,老师取下自己的黄金项链,请同学们帮忙鉴定,同学们提出了多种鉴别方案,进行了一节有意义的实验探究课。
(1)老师的金项链放入稀硫酸中看不到任何现象,小明把自己带来的“黄金戒指”放入稀硫酸中后发现有气泡产生。
①请你写出产生气泡的化学方程式___________。
②如果把小明的“黄金戒指”放入AgNO3溶液中片刻后拿出来,现象是_________。
(2)某化学小组向一定量的Mg(NO3)2、AgNO3和Cu(NO3)2混合溶液中加入一定量的锌粉,然后过滤,并对滤液和滤渣的成分进行了分析和实验探究。
①向滤渣上滴加稀盐酸,有气泡产生,则滤液中的溶质是_______。
②反应后所得溶液的质量与反应前溶液的质量相比,可能保持不变,为什么_____
(3)下图装置可做CO还原Fe2O3的实验,并检验该反应生成的气体产物,其中A装置的作用是将二氧化碳和炭粉在高温下转化为一氧化碳, D装置可以吸收二氧化碳。
①实验室中制取二氧化碳的化学方程式_________________。
②B装置玻璃管里发生反应的化学方程式为_________________。
③要达到实验目的,装置从左到右的连接顺序为_________________(装置不能重复使用)。
(4)工业上可利用“铝热反应”焊接钢轨、冶炼难熔金属等,其原理是在高温下用铝将某些金属从其氧化物中置换出来。若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少_____
20.下图1为实验室用一氧化碳还原氧化铁的实验装置图。
(1)检查完气密性后,先_________,再_________。(填字母序号)
A 点燃酒精喷灯 B 通一氧化碳气体
(2)硬质玻璃管中的实验现象是_________,该反应的化学方程式为_________。
右边试管中的澄清石灰水发生反应的化学方程式为_________。
(3)若将图1中虚线框内的装置换成图2,则图2装置的还起到的作用是_________。
(4)若反应一段时间后,硬质玻璃管中固体质量的变化情况如下图所示,则反应生成的二氧化碳的质量为
_________g。
21.如图为高炉冶铁、炼钢并用生产的钢来探究白铜成分的流程图。(已知硫酸镍的化学式为NiSO4)
(1)分析流程图,三脱装置中发生反应的基本反应类型是______。
(2)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中______的作用(填一种仪器的名称)。
(3)铁与镍相比,铁的金属活动性______镍(选填“>”、“=”或“<”),判断依据是______(用化学方程式表示)。
(4)通过以上信息,得出白铜的成分是______,其硬度比纯铜______(填“大”或“小”)。
(5)炼钢厂每天需消耗5000t含Fe2O376%的赤铁矿,该厂理论上可日产含Fe98%的生铁的质量是多少?
22.化学是一门以实验为基础的学科,实验是学习化学进行科学探究的重要途径。
(1)下列关于实验现象的描述中正确的是______。
A.铁丝在氧气中剧烈燃烧,火星四射,生成四氧化三铁
B.将氯化铵和熟石灰混合后研磨,有刺激性气味气体产生
C.将铜丝插入稀盐酸中,产生气泡,溶液逐渐变为蓝色
D.向盛有块状石灰石的试管中倒入稀硫酸,有气泡持续冒出
(2)下列是实验室制取气体的装置图。
①实验室利用A、C装置制取氧气,则A中发生反应的化学方程式为______;利用G装置收集到氧气的最佳时刻是______。
②B装置的球形管内固体为大理石,烧杯内 盛有稀盐酸反应的化学方程式为______,若要用F装置收集一瓶干燥的CO2(气体从导管h进入集气瓶内),并检验CO2的性质则所选用装置的导管接口从左到右的正确连接顺序为:a接______、______接______、______接______、______接______;与F装置匹配最合适的带导管的橡皮塞是图2中的______。
(3)图3是化学小组设计的模拟炼铁微型实验装置。
①实验开始时要先通入CO,把装置中的空气排尽后再加热,以防发生爆炸。检验装置中的气体已纯净的方法是______。
②我国是世界钢铁产量最大的国家,某冶炼厂按计划冶炼含铁质量分数为98%的生铁1000吨,试计算:若用含杂质质量分数为20%的赤铁矿冶炼,最少需要该赤铁矿多少吨?______
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.B
4.C
5.B
6.D
7.B
8.C
9.A
10.C
11.C
12.D
13.A
14.C
15.B
16.D
17. 3CO+Fe2O3 Fe+3CO2 红色固体变黑色,澄清石灰水变浑浊 进行尾气处理减少污染 酒精 点燃处理尾气时放出热量给装置加热,充分利用能源 涂油漆 废旧金属的回收再利用 0.1 解:设锌的质量为x
答:合金中铜的质量分数为75%。
18.(1) 抗腐蚀
(2) 3 (或)
(3) 红棕色粉末逐渐变黑 D B C
(4)解:设要制得 11.2kg 铁理论上需要消耗铝的质量是x。
答:理论上需要消耗铝的质量是5.4kg。
19. 有银白色金属析出,溶液变为无色或蓝色 和 锌与硝酸银溶液反应使溶液质量减少,与硝酸铜反应使溶液质量增加,所以溶液质量可能不变。 ADBC 10.8kg
20. B A 红色粉末变黑 3CO + Fe2O3 2Fe + 3CO2 CO2+Ca(OH)2= CaCO3↓+H2O 收集没反应的一氧化碳,防止污染环境 反应前物质的质量为13.6g,一段时间后物质的质量为11.2g,减少了13.6g-11.2g=2.4g;设生成二氧化碳的质量为x;
x=6.6g。
答:反应生成的二氧化碳质量为6.6g。
21.(1)化合反应
(2)玻璃棒
(3) >
(4) 铜、镍 大
(5)解:设可以炼出含铁98%的生铁的质量是x
答:可以炼出含铁98%的生铁的质量是2714.3t。
22.(1)B
(2) 导管口气泡连续均匀产生时 g f b c h m e 丙
(3) 在右端导气管口用排水法收集一试管气休,移近火焰点火,若发出轻微的爆鸣声,证明气体已纯净 设需要Fe2O3的质量为x
解得:x=1440t;
最少需要亦铁矿的质量为。
答:理论上可炼出纯铁1750吨。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.符合下图装置设计意图的有( )
①说明CO具有还原性 ②既说明CO具有可燃性,又充分地利用了能源 ③说明CO得到氧后的产物是CO2 ④有效地防止了剧毒的CO对空气的污染
A.①② B.②④ C.②③④ D.①②③④
2.将草酸(H2C2O4),沸点约150℃,分解温度约190℃)隔绝空气加热,得到的混合物经充分冷却后,残余气体M(CO、CO2中的一种或两种)。为探究M的成分,设计如图所示实验。下列说法不正确的是( )
A.若甲试管内溶液变浑浊,则M中一定含有CO2
B.若丙中固体变黑、丁试管内溶液变浑浊,则M中一定含CO
C.若装置甲、乙位置互换,则无法判断M中是否含有CO
D.若加热所得混合物不经充分冷却,则M中可能混有草酸蒸气
3.把等质量的X、Y、Z、M四种金属分别加入到同体积、同浓度的足量稀盐酸中。再把X加入到Z (NO3)2溶液中,M加入到YNO3溶液中。反应关系如图所示。据此判断四种金属的活动性顺序为
A.Z>X>M>Y B.X>Z>M>Y C.X>Z>Y>M D.Y>M>Z>X
4.下图是CO与Fe2O3反应的实验装置图,下列说法不正确的是( )
A.实验开始时,先通入CO,在装置出口处验纯后,点燃酒精灯,再点燃酒精喷灯
B.实验过程中看到,玻璃管里的粉末由红棕色逐渐变为黑色
C.CO与Fe2O3反应的化学方程式为Fe2O3+CO2Fe+CO2
D.尾气处理时发生反应的化学方程式为2CO+O22CO2
5.工业上利用黄铁矿(主要成分是FeS2)生产硫酸。同时还能得到一种副产品氧化铁用于炼铁,其反应原理如下:
①4FeS2+11O22Fe2O3+8SO2 ②2SO2+O22SO3
③SO3+H2O=H2SO4 ④ Fe2O3+3CO2Fe+3CO2
下列说法不正确的是
A.反应①②④均是在高温条件下进行的
B.只有①②发生的是氧化反应
C.反应②③属于化合反应
D.反应①④不属于四种基本反应类型中的任何一种
6.考虑到实验的安全、成功等问题,化学实验中常常需要特别关注实验的先后顺序。下列实验的先后顺序关系错误的是
A.点燃甲烷等可燃性气体之前,要先验纯,后点燃
B.实验室制取气体时,要先检查装置的气密性,后加入试剂进行反应
C.用高锰酸钾制取氧气的实验结束时,要先把导气管从水槽中取出,后撤离酒精灯
D.利用CO与氧化铁反应制取铁的实验结束时,要先停止通入CO,后停止加热固体
7.用“W”型管进行微型实验,如图所示,下列说法错误的是
A.a处红棕色粉末变为黑色
B.a处实验结束时先停止,通入CO,后停止加热
C.b处澄清石灰水变浑浊证明有二氧化碳生成
D.可利用点燃的方法进行尾气处理
8.下图是甲是初中化学炼铁的基本原理。乙是工业炼铁高炉的结构图。下列说法错误的是
A.由甲图加热装置可知炼铁需要高温
B.乙图中焦炭燃烧产生高温也可以反应产生一氧化碳
C.乙图中出铁口应该比出渣口高一些
D.甲图中b处在操作时应该接尾气处理装置
9.探究金属活动性顺序时,将锌粒放入硫酸铜溶液中,锌粒表面有紫红色物质析出,还有无色无味气体产生的“异常”现象。推测该气体可能是
A.氢气 B.二氧化硫 C.二氧化碳 D.一氧化碳
10.钢铁厂会利用焦炭产生的还原性气体来炼铁,某同学用此原理按如图装置进行实验,下列说法不正确的是( )
A.该实验还需要增加尾气处理装置
B.加热前应先通入一段时间的CO,目的是排尽装置内的空气,防止发生爆炸
C.NaOH溶液的作用是检验反应后的产物
D.反应结束后,应先停止加热,继续通入CO至固体冷却为止
11.利用如图所示实验装置模拟工业炼铁。下列说法正确的是
A.反应前后Fe元素的化合价由+2价变为0价 B.充分加热,a处固体由黑色变为红色
C.b处可以用澄清石灰水检验生成的CO2 D.可用水吸收尾气中的CO
12.如图为一氧化碳还原氧化铁实验。下列说法中正确的是( )
A.开始时应先预热玻璃管,后通入一氧化碳
B.实验中玻璃管里粉末由黑色逐渐变成红棕色
C.参加反应的氧化铁和一氧化碳质量比为40:7
D.将尾气点燃或收集,可防止一氧化碳污染空气
13.某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制生铁。若要炼制含铁96%的生铁63 t,假设在炼制过程中损失10%铁元素,则理论上需要含杂质20%的赤铁矿石的质量是
A.120 t B.108 t C.96 t D.84 t
14.《天工开物》对钢铁冶炼过程有如下记载。有关说法正确的是
A.“垦土拾锭”:铁元素是地壳中含量最高的金属元素
B.“淘洗铁砂”:铁矿石(主要成分为Fe2O3)能溶于水
C.“生熟炼铁”:冶炼铁过程中发生了化学变化
D.“锤锻成钢”:生铁高温锻打成钢,碳元素含量升高
15.高炉炼铁的主反应为。下列有关说法正确的是
A.该反应既是氧化还原反应又是置换反应
B.CO由焦炭和焦炭燃烧所得的CO2反应产生
C.所得产物为生铁,含碳量比钢低
D.高炉尾气对环境无影响,可直接排放
16.如图为一氧化碳还原氧化铁实验。下列说法中正确的是
A.开始时应先预热玻璃管,后通入一氧化碳
B.实验中玻璃管里粉末由黑色逐渐变成红粽色
C.参加反应的一氧化碳具有氧化性
D.将尾气点燃或收集,可防止一氧化碳污染空气
二、综合应用题
17.某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分是Fe2O3)炼铁的主要反应原理。他们设计的实验装置如下图所示。
(1)写出一氧化碳还原氧化铁的化学方程式_______。
(2)实验中在甲装置中观察到的实验现象_______。
(3)甲装置中,设置酒精灯的目的_______,实验时应先点燃_______灯。
(4)乙装置与甲装置相比,它的主要优点是_______。
(5)每年因腐蚀而浪费掉的金属材料数量惊人,铁栅栏常采用的防锈措施是_______,除防止金属腐蚀外,保护金属资源的最有效途径还有_______(答一点即可)
(6)小王同学想测定某Cu-Zn合金中铜的质量分数,取合金粉末13g,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与生成氢气的质量关系如下图所示。回答:
①反应生成氢气的总质量为_______g。
②计算合金中铜的质量分数_______。
18.金属在各个领域中用途广泛。
(1)铝的抗腐蚀性能好在工业上用途广泛。中国科学院金属研究所研制的新型铝合金复合材料,其性能比铝轻,比钢硬、耐磨搁、抗腐蚀。这种材料大量用于制作”祝融号”火星车、“玉兔号"月球车及嫦娥、北斗、天宫等我国先进的航天设备。
①从上文中可获知合金的性能优势有_____(一条即可)。
②铝具有很好的抗腐蚀性能,主要是因为______(写化学方程式)。
(2)某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了如图实验,并对溶液A和固体B的成分进行了分析和实验探究。
①溶液A中的溶质可能有___种情况。
②写出探究过程中任一反应的化学方程式___。
(3)利用下图装置可做CO还原Fe2O3的实验,并检验该反应生成的气体产物。
①玻璃管中观察到的现象是___。
②气体通过装置的顺序是A→_____→_____→_____(装置不能重复使用)。
③写D中发生反应的化学方程式_____。
(4)高铁轨道铺设过程中可利用铝热反应焊接钢轨,其原理是把铝粉和三氧化二铁粉末按比例混合,高温条件下得到氧化铝和单质铁,并放出大量的热,若要制得11.2kg铁。理论上需要消耗铝的质量是_____?
19.在金属的性质复习课上,老师取下自己的黄金项链,请同学们帮忙鉴定,同学们提出了多种鉴别方案,进行了一节有意义的实验探究课。
(1)老师的金项链放入稀硫酸中看不到任何现象,小明把自己带来的“黄金戒指”放入稀硫酸中后发现有气泡产生。
①请你写出产生气泡的化学方程式___________。
②如果把小明的“黄金戒指”放入AgNO3溶液中片刻后拿出来,现象是_________。
(2)某化学小组向一定量的Mg(NO3)2、AgNO3和Cu(NO3)2混合溶液中加入一定量的锌粉,然后过滤,并对滤液和滤渣的成分进行了分析和实验探究。
①向滤渣上滴加稀盐酸,有气泡产生,则滤液中的溶质是_______。
②反应后所得溶液的质量与反应前溶液的质量相比,可能保持不变,为什么_____
(3)下图装置可做CO还原Fe2O3的实验,并检验该反应生成的气体产物,其中A装置的作用是将二氧化碳和炭粉在高温下转化为一氧化碳, D装置可以吸收二氧化碳。
①实验室中制取二氧化碳的化学方程式_________________。
②B装置玻璃管里发生反应的化学方程式为_________________。
③要达到实验目的,装置从左到右的连接顺序为_________________(装置不能重复使用)。
(4)工业上可利用“铝热反应”焊接钢轨、冶炼难熔金属等,其原理是在高温下用铝将某些金属从其氧化物中置换出来。若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少_____
20.下图1为实验室用一氧化碳还原氧化铁的实验装置图。
(1)检查完气密性后,先_________,再_________。(填字母序号)
A 点燃酒精喷灯 B 通一氧化碳气体
(2)硬质玻璃管中的实验现象是_________,该反应的化学方程式为_________。
右边试管中的澄清石灰水发生反应的化学方程式为_________。
(3)若将图1中虚线框内的装置换成图2,则图2装置的还起到的作用是_________。
(4)若反应一段时间后,硬质玻璃管中固体质量的变化情况如下图所示,则反应生成的二氧化碳的质量为
_________g。
21.如图为高炉冶铁、炼钢并用生产的钢来探究白铜成分的流程图。(已知硫酸镍的化学式为NiSO4)
(1)分析流程图,三脱装置中发生反应的基本反应类型是______。
(2)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中______的作用(填一种仪器的名称)。
(3)铁与镍相比,铁的金属活动性______镍(选填“>”、“=”或“<”),判断依据是______(用化学方程式表示)。
(4)通过以上信息,得出白铜的成分是______,其硬度比纯铜______(填“大”或“小”)。
(5)炼钢厂每天需消耗5000t含Fe2O376%的赤铁矿,该厂理论上可日产含Fe98%的生铁的质量是多少?
22.化学是一门以实验为基础的学科,实验是学习化学进行科学探究的重要途径。
(1)下列关于实验现象的描述中正确的是______。
A.铁丝在氧气中剧烈燃烧,火星四射,生成四氧化三铁
B.将氯化铵和熟石灰混合后研磨,有刺激性气味气体产生
C.将铜丝插入稀盐酸中,产生气泡,溶液逐渐变为蓝色
D.向盛有块状石灰石的试管中倒入稀硫酸,有气泡持续冒出
(2)下列是实验室制取气体的装置图。
①实验室利用A、C装置制取氧气,则A中发生反应的化学方程式为______;利用G装置收集到氧气的最佳时刻是______。
②B装置的球形管内固体为大理石,烧杯内 盛有稀盐酸反应的化学方程式为______,若要用F装置收集一瓶干燥的CO2(气体从导管h进入集气瓶内),并检验CO2的性质则所选用装置的导管接口从左到右的正确连接顺序为:a接______、______接______、______接______、______接______;与F装置匹配最合适的带导管的橡皮塞是图2中的______。
(3)图3是化学小组设计的模拟炼铁微型实验装置。
①实验开始时要先通入CO,把装置中的空气排尽后再加热,以防发生爆炸。检验装置中的气体已纯净的方法是______。
②我国是世界钢铁产量最大的国家,某冶炼厂按计划冶炼含铁质量分数为98%的生铁1000吨,试计算:若用含杂质质量分数为20%的赤铁矿冶炼,最少需要该赤铁矿多少吨?______
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.B
4.C
5.B
6.D
7.B
8.C
9.A
10.C
11.C
12.D
13.A
14.C
15.B
16.D
17. 3CO+Fe2O3 Fe+3CO2 红色固体变黑色,澄清石灰水变浑浊 进行尾气处理减少污染 酒精 点燃处理尾气时放出热量给装置加热,充分利用能源 涂油漆 废旧金属的回收再利用 0.1 解:设锌的质量为x
答:合金中铜的质量分数为75%。
18.(1) 抗腐蚀
(2) 3 (或)
(3) 红棕色粉末逐渐变黑 D B C
(4)解:设要制得 11.2kg 铁理论上需要消耗铝的质量是x。
答:理论上需要消耗铝的质量是5.4kg。
19. 有银白色金属析出,溶液变为无色或蓝色 和 锌与硝酸银溶液反应使溶液质量减少,与硝酸铜反应使溶液质量增加,所以溶液质量可能不变。 ADBC 10.8kg
20. B A 红色粉末变黑 3CO + Fe2O3 2Fe + 3CO2 CO2+Ca(OH)2= CaCO3↓+H2O 收集没反应的一氧化碳,防止污染环境 反应前物质的质量为13.6g,一段时间后物质的质量为11.2g,减少了13.6g-11.2g=2.4g;设生成二氧化碳的质量为x;
x=6.6g。
答:反应生成的二氧化碳质量为6.6g。
21.(1)化合反应
(2)玻璃棒
(3) >
(4) 铜、镍 大
(5)解:设可以炼出含铁98%的生铁的质量是x
答:可以炼出含铁98%的生铁的质量是2714.3t。
22.(1)B
(2) 导管口气泡连续均匀产生时 g f b c h m e 丙
(3) 在右端导气管口用排水法收集一试管气休,移近火焰点火,若发出轻微的爆鸣声,证明气体已纯净 设需要Fe2O3的质量为x
解得:x=1440t;
最少需要亦铁矿的质量为。
答:理论上可炼出纯铁1750吨。
答案第1页,共2页
答案第1页,共2页
