6.4珍惜和保护金属资源同步练习—2021-2022学年九年级化学科粤版(2012)下册(word版有答案)
文档属性
| 名称 | 6.4珍惜和保护金属资源同步练习—2021-2022学年九年级化学科粤版(2012)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 299.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-28 22:18:39 | ||
图片预览



文档简介
科粤版九年级化学下册 6.4 珍惜和保护金属资源 同步练习
一、单选题
1.中国南车株洲时代集团生产的油电双动力公交车因省油、环保而在全国推广,双动力公交车制造需要大量使用金属材料。下列有关金属材料的说法正确的是
A.金属材料中一定不含有非金属元素
B.多数合金的抗腐蚀性能比组成它们的纯金属更好
C.双动力公交车所有部件都是由金属材料制造的
D.地球上的金属资源是取之不尽、用之不竭的
2.某同学根据铜锈的成分Cu2(OH)2CO3作出猜想:引起金属铜锈蚀的因素除有氧气和水外,还应该有二氧化碳。为证明“必须有二氧化碳”,需要进行下列实验中的
A.甲和乙 B.甲和丁 C.乙和丁 D.丙和丁
3.钢铁是使用最多的金属材料,但每年因锈蚀而损失的数量巨大,防止金属诱蚀已成为科学研究中的重大问题。以下有关金属锈蚀的叙述不正确的是
A.钢铁在潮湿的空气中比在干燥的空气中更易锈蚀
B.铝比钢铁中的铁活泼,因而铝的抗腐蚀性能比钢铁差
C.钢铁锈蚀的实质是铁与空气中的氧气、水蒸气等发生了化学反应
D.在钢铁表面刷漆或镀耐锈蚀金属都可防止钢铁锈蚀
4.金属腐蚀的快慢与外界条件密切相关,下列条件下,铁钉的腐蚀速度最快的是( )
A. B. C. D.
5.下列有关金属材料的说法正确的是( )
A.硬铝片比纯铝片硬度小 B.钢的性能优良,是很纯的铁
C.沙漠地区的铁制品锈蚀较快 D.为防止钢铁生锈,可在其表面涂油漆
6.下列防锈措施不合理的是
A.钢管存放在干燥的地方
B.用盐水清洗菜刀
C.及时清除铁制品表面的锈渍
D.在铁管表面镀上一层不易锈蚀的金属
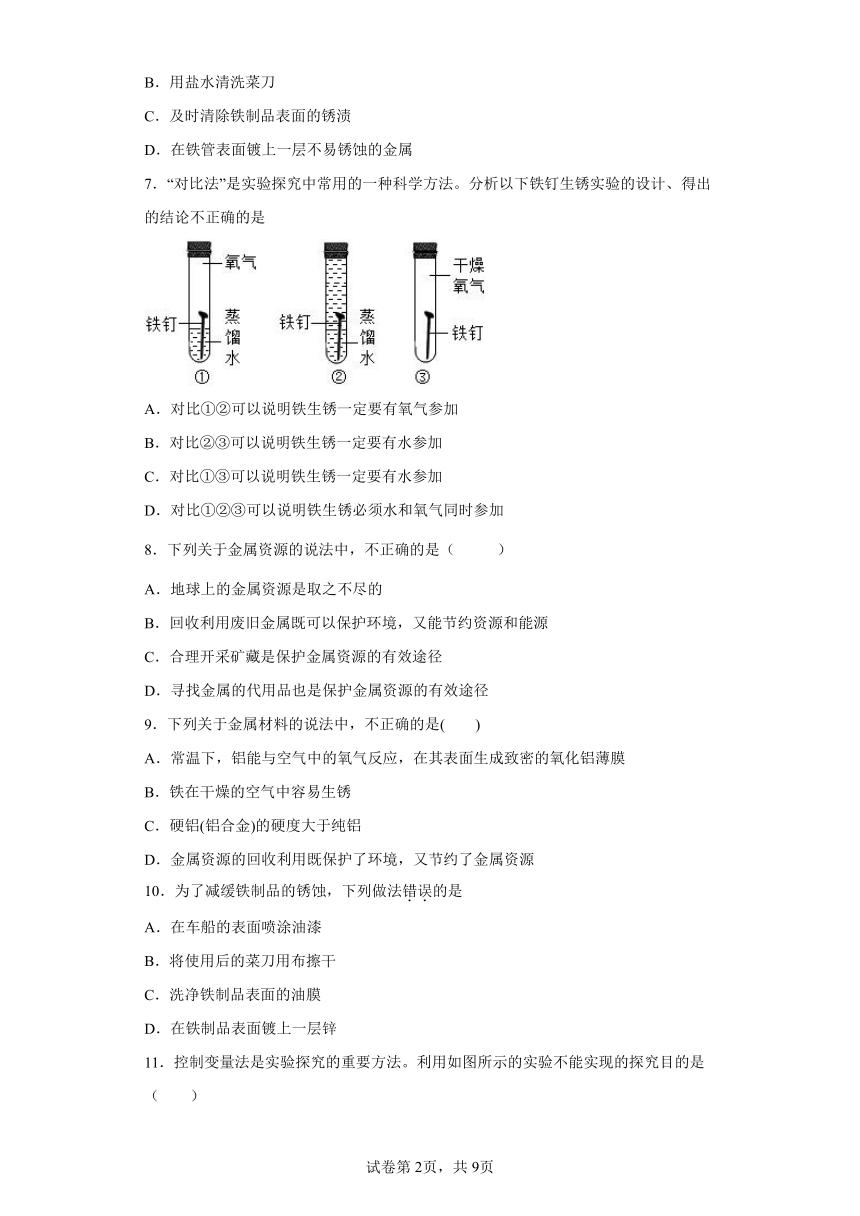
7.“对比法”是实验探究中常用的一种科学方法。分析以下铁钉生锈实验的设计、得出的结论不正确的是
A.对比①②可以说明铁生锈一定要有氧气参加
B.对比②③可以说明铁生锈一定要有水参加
C.对比①③可以说明铁生锈一定要有水参加
D.对比①②③可以说明铁生锈必须水和氧气同时参加
8.下列关于金属资源的说法中,不正确的是( )
A.地球上的金属资源是取之不尽的
B.回收利用废旧金属既可以保护环境,又能节约资源和能源
C.合理开采矿藏是保护金属资源的有效途径
D.寻找金属的代用品也是保护金属资源的有效途径
9.下列关于金属材料的说法中,不正确的是( )
A.常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜
B.铁在干燥的空气中容易生锈
C.硬铝(铝合金)的硬度大于纯铝
D.金属资源的回收利用既保护了环境,又节约了金属资源
10.为了减缓铁制品的锈蚀,下列做法错误的是
A.在车船的表面喷涂油漆
B.将使用后的菜刀用布擦干
C.洗净铁制品表面的油膜
D.在铁制品表面镀上一层锌
11.控制变量法是实验探究的重要方法。利用如图所示的实验不能实现的探究目的是( )
A.甲图中①②对比可探究铁的锈蚀与植物油是否有关
B.甲图中①③对比可探究铁的锈蚀与水是否有关
C.乙可探究可燃物的燃烧是否需要达到一定温度
D.乙可探究可燃物的燃烧是否需要与氧气接触
12.化学反应往往需要在一定的条件下进行.通过控制或改变反应条件可以加快、减缓甚至组织反应的行.下列所反映的措施中,能加快其化学反应速率的是
A.铁门表面喷漆
B.冰箱保存食物
C.用扇子扇煤炉火,火会更旺
D.将木头电线杆埋入地下的部分用火微微烧焦
13.下列措施有利于防止铁制品锈蚀的是( )
A.农具上铁锈不及时除去
B.切过酸菜的菜刀不及时清洗
C.工地上的钢管堆放在潮湿的地方
D.家用剪刀不用时,涂上油并放在干燥处
14.下列关于金属材料的说法中,不正确的是
A.生铁、硬铝、焊锡都属于合金
B.铜有良好的导电性,因而大量用于制作电线
C.铝表面易生成致密氧化铝薄膜,因而具有良好的抗腐蚀性
D.锈蚀后的铁制品没有回收价值
15.小明发现月饼盒里的脱氧剂部分呈红褐色,查阅资料得知脱氧剂中含有铁粉和活性炭.他猜想这包脱氧剂中可能含有:①Cu和C;②Fe2O3和C;③Fe3O4和C;④Fe3O4、C和Fe;⑤Fe2O3、C和Fe.其中猜想合理的是( )
A.①③⑤ B.②④⑤ C.②⑤ D.④⑤
16.下列有关金属资源的利用与防护解释不合理的是
A.在001A型国产航母金属外壳覆盖涂料,主要是为了美观
B.用“烤蓝”的方法处理钢铁表面,可减缓钢铁的腐蚀
C.用铝合金制造国产大飞机C919机壳,是利用铝合金强度大、质量轻、抗腐蚀
D.切菜后的菜刀用清水洗净擦干,可减缓菜刀生锈
二、综合应用题
17.铁和铁的化合物在工农业生产中有广泛的应用。
(一)铁的应用和防护
1.铁生锈的主要过程为:
(1)写出转化②的化学方程式 _______________ 。
(2)转化③生成Fe2O3·xH2O,则x≤ _____ (x为整数)。
2.请提出防止铁生锈的一条措施 _______________ 。
(二)铁的化合物应用
黄铁矿(主要成分是FeS2),是一种重要的化工原料,可用来制备硫酸和炼铁。
(1)工业上将黄铁矿粉碎的目的是 ______________ 。
(2)生产硫酸后的尾气中含有SO2,如直接排放可能会造成环境问题是 ________ 。
(3)沸腾炉中发生反应的化学方程式为 ___________ 。
(4)150t含FeS2 80%的黄铁矿理论上最多可以制得98%的浓硫酸 _________ t。
(三)铁的冶炼和探究
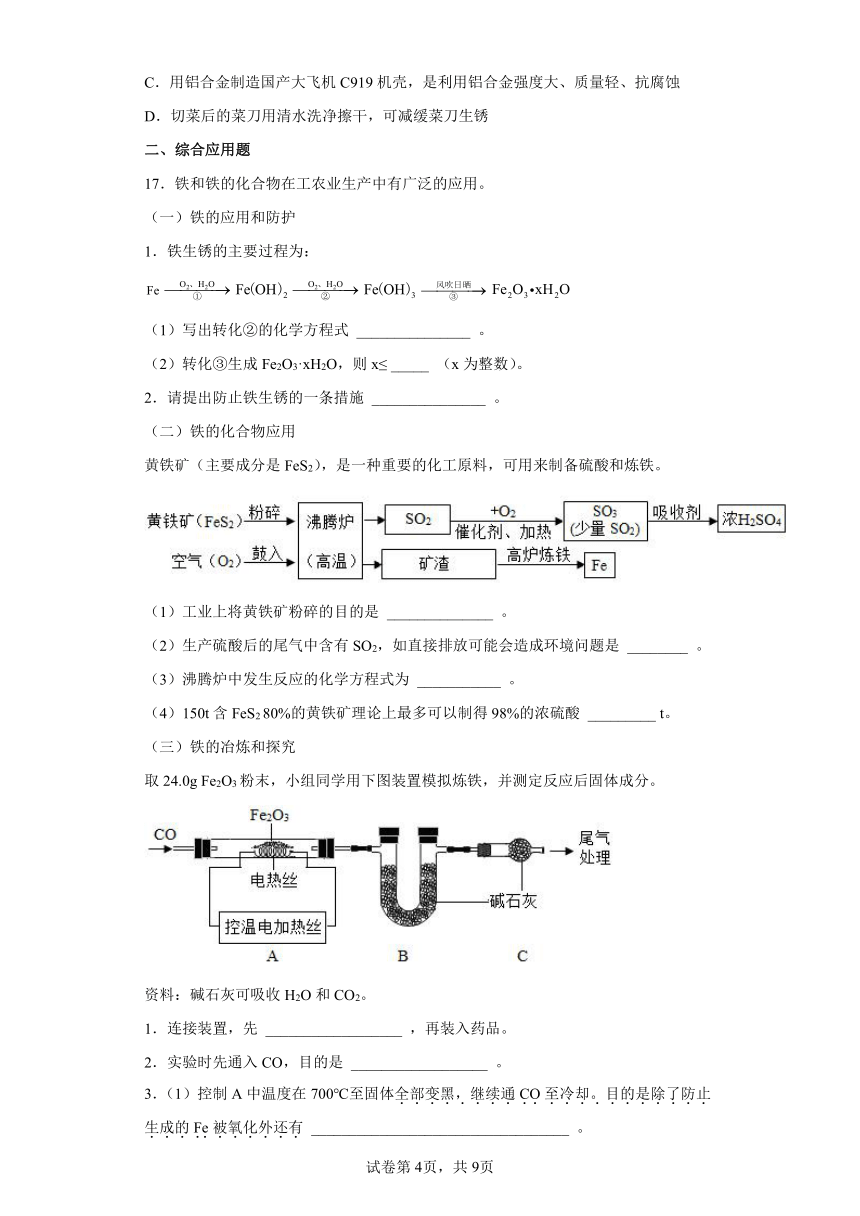
取24.0g Fe2O3粉末,小组同学用下图装置模拟炼铁,并测定反应后固体成分。
资料:碱石灰可吸收H2O和CO2。
1.连接装置,先 __________________ ,再装入药品。
2.实验时先通入CO,目的是 __________________ 。
3.(1)控制A中温度在700℃至固体全部变黑,继续通CO至冷却。目的是除了防止生成的Fe被氧化外还有 __________________________________ 。
(2)通过测定装置B中固体的质量变化,可准确求得装置A中剩余固体质量。装置C的作用是 _________________________________ 。
(3)现直接测得装置A中剩余固体质量为19.2g。则装置B中固体应增重 _______ g。
4.经分析A中剩余固体19.2g为Fe和FexOy的混合物,向其中加入足量的稀H2SO4充分反应,得H2 0.3g。
(1)固体中Fe质量为 ________ g。
(2)FexOy的化学式为 ________ 。
18.金属材料与人类的生产和生活密切相关。
(1)为防止钢铁锈蚀,常在其表面涂油漆或镀上其他金属,这些方法能防止钢铁锈蚀的原因是______。
(2)在古代,常常用“湿法炼铜”或“火法炼铜”。“湿法炼铜”的原理是:“曾青(硫酸铜溶液)得铁则化为铜”;“火法炼铜”中用辉铜矿(主要成分Cu2S)炼铜的原理是:Cu2S与氧气在高温条件下反应生成铜和一种会导致酸雨的气体(其相对分子质量为64)。“湿法炼铜”的反应类型为______,“火法炼铜”的化学方程式是______。
(3)某化学兴趣小组的同学想从含有A1 2(SO4)3、CuSO4的废液中回收金属铜,设计了如下实验。
步骤II中加入过量的稀硫酸的目的是______, 写出该步骤反应的化学方程式______。
(4)已知锌和锌的化合物存在以下转换关系:, ,
计算:198g Zn(OH)2理论上能得到Zn的质量为______g。
19.某化学兴趣小组进行铁生锈的实验探究活动。
(1)该兴趣小组将洁净无锈的铁钉分别置于如图所示装置中,经过一段时间观察,________(填装置序号)装置中出现了明显的锈迹。他们的结论:铁生锈是因为铁与空气中的_________等发生了化学反应。
(2)甲同学提出了疑问:空气中的氮气、二氧化碳没有参与铁的生锈过程吗?请设计实验为甲同学释疑。________,观察并记录现象即可证明。
(3)一些铁制品表面覆盖了某些涂层,不同的涂层被破坏后,铁生锈的速率不同。你认为下列________涂层破坏后,铁生锈的速率较快。
a.镀锌铁 b.镀锡铁
(4)一些建筑的大门刷上了一层银白色的金属,你认为该金属可能是________。
a.银粉 b.铜粉 c.镁粉
【交流与思考】(5)写出一种防止铁生锈的方法__________。
20.铁及其合金是重要的金属材料。
(1)下列物品所使用的主要材料属于合金的是_____(填字母序号)。
A 青花瓷瓶 B 橡胶充气艇 C 不锈钢锅
(2)①如图所示为某化学兴趣小组设计的铁钉锈蚀条件的探究实验,请在③方框内画出还需进行的实验的示意图_____。
②为了验证铁、铜的金属活动性顺序,除了选择用砂纸打磨干净的铁钉外,还需要选择的一种溶液是_______溶液(填化学式)。
(3)实验室可用如图所示装置模拟炼铁反应。
①实验开始时,应先通入一氧化碳气体再加热的原因是什么?_____。
②写出玻璃管中反应的化学方程式______。
③从环保角度考虑,还需对图中装置进行怎样的改进?______
④除一氧化碳外,还有哪些物质可以还原氧化铁?______ (请写一种物质的化学式)。
(4)把10g铁粉与铜粉的混合物放到盛有足量稀硫酸的烧杯中,充分反应后,烧杯中物质的总质量比反应前金属混合物与稀硫酸的总质量减少了0.1g,求混合物中铁的质量分数____。
21.金属是一种重要的资源,人类的生产、生活与金属密切相关。
(1)下列铁制品的用途中,利用金属导热性的是______(填字母)。
A.铁锤 B.铁锅
C.铜丝 D.水龙头
(2)铁制品暴露在空气中容易生锈。如图是某化学小组设计的探究铁钉锈蚀条件的实验。要达到实验目的还需补充的实验是______。
(3)金属钴(Co)与铁具有相似的化学性质。CoCl2固体是蓝色的,CoCl2溶液是粉红色的。将金属钴投入稀盐酸中,发生化学反应的方程式为______;该反应的实验现象为______。
(4)工业上炼铁的原理是利用一氧化碳和氧化铁的反应。某化学兴趣小组利用如图装置进行实验探究,请按要求回答下列问题。
①写出A中实验现象______。
②写出B中反应的化学方程式______。
③如果将B中的澄清石灰水换成氢氧化钠溶液,如何证明实验进行一段时间后,B中发生了化学反应?______(简要写出实验步骤、现象及结论)。
(5)请计算:用含Fe2O3 60%的赤铁矿石800t,理论上可炼出含杂质3%的生铁的质量是多少吨?______(结果保留一位小数)
22.铁是生活中常用的金属,请你根据学习回答下列问题。
(1)金属元素在自然界中分布很广,铁的矿物主要有赤铁矿、磁铁矿、黄铁矿等,生产生活中常用金属矿物冶炼金属,而一般情况下,不选择黄铁矿(FeS2)来炼铁,原因之一是______,原因二是生成的二氧化硫会污染空气。
(2)冬天使用的“取暖片”中,发热剂的主要成分有铁粉、活性炭、氯化钠、水等,发热剂需接触到空气才会发热,原因是铁要与______等物质共同作用才会“生锈”。
(3)第一种新型材料纳米级Fe粉在空气中易自燃,它能用作高效催化剂。实验室采用还原法制备纳米级Fe粉,其流程如图所示:
①完成上述制作工艺II中发生置换反应的化学方程式(氮气不参与反应):______。
②在制备纳米级Fe粉的工艺流程中,通入N2的目的是______。
(4)为了研究炼铁的主要反应原理,某化学兴趣小组的同学用一氧化碳还原氧化铁做实验。装置如图所示。请回答下列问题:
①组装好仪器后,检查气密性并在玻璃管中装入红色氧化铁粉末后的实验操作顺序为______。
a、通一氧化碳并点燃处理尾气的酒精灯
b、点燃给硬质玻璃管加热的酒精喷灯
c、检验一氧化碳的纯度
②实验中硬质玻璃管内可以观察到的现象为:______。
③某学校研究性学习小组为了测定某炼铁厂生产出来的生铁(铁碳合金, 其中含碳量2~ 4.3%)是否达到要求,取来了一些生铁样品,并取稀盐酸400g,平均分成4份,进行实验,结果如下:
实验 1 2 3 4
稀盐酸的质量/g 100 100 100 100
加入样品的质量/g 3 6 9 12
生成的H2质量/g 0.1 0.2 0.25 m
Ⅰ、上表中的m的数值为______。
Ⅱ、试计算这种生铁样品中碳的质量分数并判断是否达到要求______。
Ⅲ、试计算第2次实验后所得溶液的溶质质量分数。______(Ⅱ、Ⅲ写出计算过程,计算结果保留小数点后一位)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.B
3.B
4.A
5.D
6.B
7.B
8.A
9.B
10.C
11.A
12.C
13.D
14.D
15.C
16.A
17. 4Fe(OH)2 +2H2O + O2 = 4Fe(OH)3 2 可以使铁制品表面保持干燥或在铁制品表面涂上油漆等 增大接触面积,充分反应 酸雨 4FeS2+11O22Fe2O3+8SO2 199.5 检查装置的气密性 排尽装置的空气,防爆炸 把生成的CO2全部排出被B吸收 防右侧空气中的H2O、CO2被B吸收 13.2 8.4 Fe O
18. 使钢铁隔绝氧气(空气)和水 置换反应 除去固体A中过量的铁 130
19. A 氧气和水蒸气 将A装置中的空气换作氮气或二氧化碳 b c 刷油漆(其他合理答案均可)
20. C 排出装置内空气,防止一氧化碳与空气在高温下混合发生爆炸 在最右端放一盏点燃的酒精灯或者加一个收集装置 C或Al等 28%
21. B 取一支试管烘干后放入洁净的铁钉,用橡皮塞塞好试管,观察 金属溶解,生成气体,溶液变为粉红色 红色固体变黑色 取反应后溶液,滴加过量的稀盐酸,有气泡生成,证明二氧化碳和氢氧化钠反应了 解:化学反应前元素种类质量不变;铁矿石中铁元素等于生成生铁中铁元素,故可炼出含杂质3%的生铁的质量是 。
22. 黄铁矿含铁量低 氧气、水 排尽空气,防止铁粉遇到氧气自燃(防止铁粉被氧化) cab 红色固体变为黑色 0.25 根据实验1,3g样品中加入100g稀盐酸,生成0.1g氢气,设生铁样品中铁的质量是x
解得x=2.8g;
碳元素的质量分数为:,所以不符合要求。 第2次实验中,6g样品中加入100g稀盐酸,生成0.2g氢气,由Ⅱ中可知3g样品含杂质为3g-2.8g=0.2g,则6g样品中含杂质0.4g;设溶液中氯化亚铁的质量是y
y=12.7g;
。
答:第二次实验后溶液中的溶质质量分数是12.0%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.中国南车株洲时代集团生产的油电双动力公交车因省油、环保而在全国推广,双动力公交车制造需要大量使用金属材料。下列有关金属材料的说法正确的是
A.金属材料中一定不含有非金属元素
B.多数合金的抗腐蚀性能比组成它们的纯金属更好
C.双动力公交车所有部件都是由金属材料制造的
D.地球上的金属资源是取之不尽、用之不竭的
2.某同学根据铜锈的成分Cu2(OH)2CO3作出猜想:引起金属铜锈蚀的因素除有氧气和水外,还应该有二氧化碳。为证明“必须有二氧化碳”,需要进行下列实验中的
A.甲和乙 B.甲和丁 C.乙和丁 D.丙和丁
3.钢铁是使用最多的金属材料,但每年因锈蚀而损失的数量巨大,防止金属诱蚀已成为科学研究中的重大问题。以下有关金属锈蚀的叙述不正确的是
A.钢铁在潮湿的空气中比在干燥的空气中更易锈蚀
B.铝比钢铁中的铁活泼,因而铝的抗腐蚀性能比钢铁差
C.钢铁锈蚀的实质是铁与空气中的氧气、水蒸气等发生了化学反应
D.在钢铁表面刷漆或镀耐锈蚀金属都可防止钢铁锈蚀
4.金属腐蚀的快慢与外界条件密切相关,下列条件下,铁钉的腐蚀速度最快的是( )
A. B. C. D.
5.下列有关金属材料的说法正确的是( )
A.硬铝片比纯铝片硬度小 B.钢的性能优良,是很纯的铁
C.沙漠地区的铁制品锈蚀较快 D.为防止钢铁生锈,可在其表面涂油漆
6.下列防锈措施不合理的是
A.钢管存放在干燥的地方
B.用盐水清洗菜刀
C.及时清除铁制品表面的锈渍
D.在铁管表面镀上一层不易锈蚀的金属
7.“对比法”是实验探究中常用的一种科学方法。分析以下铁钉生锈实验的设计、得出的结论不正确的是
A.对比①②可以说明铁生锈一定要有氧气参加
B.对比②③可以说明铁生锈一定要有水参加
C.对比①③可以说明铁生锈一定要有水参加
D.对比①②③可以说明铁生锈必须水和氧气同时参加
8.下列关于金属资源的说法中,不正确的是( )
A.地球上的金属资源是取之不尽的
B.回收利用废旧金属既可以保护环境,又能节约资源和能源
C.合理开采矿藏是保护金属资源的有效途径
D.寻找金属的代用品也是保护金属资源的有效途径
9.下列关于金属材料的说法中,不正确的是( )
A.常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜
B.铁在干燥的空气中容易生锈
C.硬铝(铝合金)的硬度大于纯铝
D.金属资源的回收利用既保护了环境,又节约了金属资源
10.为了减缓铁制品的锈蚀,下列做法错误的是
A.在车船的表面喷涂油漆
B.将使用后的菜刀用布擦干
C.洗净铁制品表面的油膜
D.在铁制品表面镀上一层锌
11.控制变量法是实验探究的重要方法。利用如图所示的实验不能实现的探究目的是( )
A.甲图中①②对比可探究铁的锈蚀与植物油是否有关
B.甲图中①③对比可探究铁的锈蚀与水是否有关
C.乙可探究可燃物的燃烧是否需要达到一定温度
D.乙可探究可燃物的燃烧是否需要与氧气接触
12.化学反应往往需要在一定的条件下进行.通过控制或改变反应条件可以加快、减缓甚至组织反应的行.下列所反映的措施中,能加快其化学反应速率的是
A.铁门表面喷漆
B.冰箱保存食物
C.用扇子扇煤炉火,火会更旺
D.将木头电线杆埋入地下的部分用火微微烧焦
13.下列措施有利于防止铁制品锈蚀的是( )
A.农具上铁锈不及时除去
B.切过酸菜的菜刀不及时清洗
C.工地上的钢管堆放在潮湿的地方
D.家用剪刀不用时,涂上油并放在干燥处
14.下列关于金属材料的说法中,不正确的是
A.生铁、硬铝、焊锡都属于合金
B.铜有良好的导电性,因而大量用于制作电线
C.铝表面易生成致密氧化铝薄膜,因而具有良好的抗腐蚀性
D.锈蚀后的铁制品没有回收价值
15.小明发现月饼盒里的脱氧剂部分呈红褐色,查阅资料得知脱氧剂中含有铁粉和活性炭.他猜想这包脱氧剂中可能含有:①Cu和C;②Fe2O3和C;③Fe3O4和C;④Fe3O4、C和Fe;⑤Fe2O3、C和Fe.其中猜想合理的是( )
A.①③⑤ B.②④⑤ C.②⑤ D.④⑤
16.下列有关金属资源的利用与防护解释不合理的是
A.在001A型国产航母金属外壳覆盖涂料,主要是为了美观
B.用“烤蓝”的方法处理钢铁表面,可减缓钢铁的腐蚀
C.用铝合金制造国产大飞机C919机壳,是利用铝合金强度大、质量轻、抗腐蚀
D.切菜后的菜刀用清水洗净擦干,可减缓菜刀生锈
二、综合应用题
17.铁和铁的化合物在工农业生产中有广泛的应用。
(一)铁的应用和防护
1.铁生锈的主要过程为:
(1)写出转化②的化学方程式 _______________ 。
(2)转化③生成Fe2O3·xH2O,则x≤ _____ (x为整数)。
2.请提出防止铁生锈的一条措施 _______________ 。
(二)铁的化合物应用
黄铁矿(主要成分是FeS2),是一种重要的化工原料,可用来制备硫酸和炼铁。
(1)工业上将黄铁矿粉碎的目的是 ______________ 。
(2)生产硫酸后的尾气中含有SO2,如直接排放可能会造成环境问题是 ________ 。
(3)沸腾炉中发生反应的化学方程式为 ___________ 。
(4)150t含FeS2 80%的黄铁矿理论上最多可以制得98%的浓硫酸 _________ t。
(三)铁的冶炼和探究
取24.0g Fe2O3粉末,小组同学用下图装置模拟炼铁,并测定反应后固体成分。
资料:碱石灰可吸收H2O和CO2。
1.连接装置,先 __________________ ,再装入药品。
2.实验时先通入CO,目的是 __________________ 。
3.(1)控制A中温度在700℃至固体全部变黑,继续通CO至冷却。目的是除了防止生成的Fe被氧化外还有 __________________________________ 。
(2)通过测定装置B中固体的质量变化,可准确求得装置A中剩余固体质量。装置C的作用是 _________________________________ 。
(3)现直接测得装置A中剩余固体质量为19.2g。则装置B中固体应增重 _______ g。
4.经分析A中剩余固体19.2g为Fe和FexOy的混合物,向其中加入足量的稀H2SO4充分反应,得H2 0.3g。
(1)固体中Fe质量为 ________ g。
(2)FexOy的化学式为 ________ 。
18.金属材料与人类的生产和生活密切相关。
(1)为防止钢铁锈蚀,常在其表面涂油漆或镀上其他金属,这些方法能防止钢铁锈蚀的原因是______。
(2)在古代,常常用“湿法炼铜”或“火法炼铜”。“湿法炼铜”的原理是:“曾青(硫酸铜溶液)得铁则化为铜”;“火法炼铜”中用辉铜矿(主要成分Cu2S)炼铜的原理是:Cu2S与氧气在高温条件下反应生成铜和一种会导致酸雨的气体(其相对分子质量为64)。“湿法炼铜”的反应类型为______,“火法炼铜”的化学方程式是______。
(3)某化学兴趣小组的同学想从含有A1 2(SO4)3、CuSO4的废液中回收金属铜,设计了如下实验。
步骤II中加入过量的稀硫酸的目的是______, 写出该步骤反应的化学方程式______。
(4)已知锌和锌的化合物存在以下转换关系:, ,
计算:198g Zn(OH)2理论上能得到Zn的质量为______g。
19.某化学兴趣小组进行铁生锈的实验探究活动。
(1)该兴趣小组将洁净无锈的铁钉分别置于如图所示装置中,经过一段时间观察,________(填装置序号)装置中出现了明显的锈迹。他们的结论:铁生锈是因为铁与空气中的_________等发生了化学反应。
(2)甲同学提出了疑问:空气中的氮气、二氧化碳没有参与铁的生锈过程吗?请设计实验为甲同学释疑。________,观察并记录现象即可证明。
(3)一些铁制品表面覆盖了某些涂层,不同的涂层被破坏后,铁生锈的速率不同。你认为下列________涂层破坏后,铁生锈的速率较快。
a.镀锌铁 b.镀锡铁
(4)一些建筑的大门刷上了一层银白色的金属,你认为该金属可能是________。
a.银粉 b.铜粉 c.镁粉
【交流与思考】(5)写出一种防止铁生锈的方法__________。
20.铁及其合金是重要的金属材料。
(1)下列物品所使用的主要材料属于合金的是_____(填字母序号)。
A 青花瓷瓶 B 橡胶充气艇 C 不锈钢锅
(2)①如图所示为某化学兴趣小组设计的铁钉锈蚀条件的探究实验,请在③方框内画出还需进行的实验的示意图_____。
②为了验证铁、铜的金属活动性顺序,除了选择用砂纸打磨干净的铁钉外,还需要选择的一种溶液是_______溶液(填化学式)。
(3)实验室可用如图所示装置模拟炼铁反应。
①实验开始时,应先通入一氧化碳气体再加热的原因是什么?_____。
②写出玻璃管中反应的化学方程式______。
③从环保角度考虑,还需对图中装置进行怎样的改进?______
④除一氧化碳外,还有哪些物质可以还原氧化铁?______ (请写一种物质的化学式)。
(4)把10g铁粉与铜粉的混合物放到盛有足量稀硫酸的烧杯中,充分反应后,烧杯中物质的总质量比反应前金属混合物与稀硫酸的总质量减少了0.1g,求混合物中铁的质量分数____。
21.金属是一种重要的资源,人类的生产、生活与金属密切相关。
(1)下列铁制品的用途中,利用金属导热性的是______(填字母)。
A.铁锤 B.铁锅
C.铜丝 D.水龙头
(2)铁制品暴露在空气中容易生锈。如图是某化学小组设计的探究铁钉锈蚀条件的实验。要达到实验目的还需补充的实验是______。
(3)金属钴(Co)与铁具有相似的化学性质。CoCl2固体是蓝色的,CoCl2溶液是粉红色的。将金属钴投入稀盐酸中,发生化学反应的方程式为______;该反应的实验现象为______。
(4)工业上炼铁的原理是利用一氧化碳和氧化铁的反应。某化学兴趣小组利用如图装置进行实验探究,请按要求回答下列问题。
①写出A中实验现象______。
②写出B中反应的化学方程式______。
③如果将B中的澄清石灰水换成氢氧化钠溶液,如何证明实验进行一段时间后,B中发生了化学反应?______(简要写出实验步骤、现象及结论)。
(5)请计算:用含Fe2O3 60%的赤铁矿石800t,理论上可炼出含杂质3%的生铁的质量是多少吨?______(结果保留一位小数)
22.铁是生活中常用的金属,请你根据学习回答下列问题。
(1)金属元素在自然界中分布很广,铁的矿物主要有赤铁矿、磁铁矿、黄铁矿等,生产生活中常用金属矿物冶炼金属,而一般情况下,不选择黄铁矿(FeS2)来炼铁,原因之一是______,原因二是生成的二氧化硫会污染空气。
(2)冬天使用的“取暖片”中,发热剂的主要成分有铁粉、活性炭、氯化钠、水等,发热剂需接触到空气才会发热,原因是铁要与______等物质共同作用才会“生锈”。
(3)第一种新型材料纳米级Fe粉在空气中易自燃,它能用作高效催化剂。实验室采用还原法制备纳米级Fe粉,其流程如图所示:
①完成上述制作工艺II中发生置换反应的化学方程式(氮气不参与反应):______。
②在制备纳米级Fe粉的工艺流程中,通入N2的目的是______。
(4)为了研究炼铁的主要反应原理,某化学兴趣小组的同学用一氧化碳还原氧化铁做实验。装置如图所示。请回答下列问题:
①组装好仪器后,检查气密性并在玻璃管中装入红色氧化铁粉末后的实验操作顺序为______。
a、通一氧化碳并点燃处理尾气的酒精灯
b、点燃给硬质玻璃管加热的酒精喷灯
c、检验一氧化碳的纯度
②实验中硬质玻璃管内可以观察到的现象为:______。
③某学校研究性学习小组为了测定某炼铁厂生产出来的生铁(铁碳合金, 其中含碳量2~ 4.3%)是否达到要求,取来了一些生铁样品,并取稀盐酸400g,平均分成4份,进行实验,结果如下:
实验 1 2 3 4
稀盐酸的质量/g 100 100 100 100
加入样品的质量/g 3 6 9 12
生成的H2质量/g 0.1 0.2 0.25 m
Ⅰ、上表中的m的数值为______。
Ⅱ、试计算这种生铁样品中碳的质量分数并判断是否达到要求______。
Ⅲ、试计算第2次实验后所得溶液的溶质质量分数。______(Ⅱ、Ⅲ写出计算过程,计算结果保留小数点后一位)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.B
3.B
4.A
5.D
6.B
7.B
8.A
9.B
10.C
11.A
12.C
13.D
14.D
15.C
16.A
17. 4Fe(OH)2 +2H2O + O2 = 4Fe(OH)3 2 可以使铁制品表面保持干燥或在铁制品表面涂上油漆等 增大接触面积,充分反应 酸雨 4FeS2+11O22Fe2O3+8SO2 199.5 检查装置的气密性 排尽装置的空气,防爆炸 把生成的CO2全部排出被B吸收 防右侧空气中的H2O、CO2被B吸收 13.2 8.4 Fe O
18. 使钢铁隔绝氧气(空气)和水 置换反应 除去固体A中过量的铁 130
19. A 氧气和水蒸气 将A装置中的空气换作氮气或二氧化碳 b c 刷油漆(其他合理答案均可)
20. C 排出装置内空气,防止一氧化碳与空气在高温下混合发生爆炸 在最右端放一盏点燃的酒精灯或者加一个收集装置 C或Al等 28%
21. B 取一支试管烘干后放入洁净的铁钉,用橡皮塞塞好试管,观察 金属溶解,生成气体,溶液变为粉红色 红色固体变黑色 取反应后溶液,滴加过量的稀盐酸,有气泡生成,证明二氧化碳和氢氧化钠反应了 解:化学反应前元素种类质量不变;铁矿石中铁元素等于生成生铁中铁元素,故可炼出含杂质3%的生铁的质量是 。
22. 黄铁矿含铁量低 氧气、水 排尽空气,防止铁粉遇到氧气自燃(防止铁粉被氧化) cab 红色固体变为黑色 0.25 根据实验1,3g样品中加入100g稀盐酸,生成0.1g氢气,设生铁样品中铁的质量是x
解得x=2.8g;
碳元素的质量分数为:,所以不符合要求。 第2次实验中,6g样品中加入100g稀盐酸,生成0.2g氢气,由Ⅱ中可知3g样品含杂质为3g-2.8g=0.2g,则6g样品中含杂质0.4g;设溶液中氯化亚铁的质量是y
y=12.7g;
。
答:第二次实验后溶液中的溶质质量分数是12.0%。
答案第1页,共2页
答案第1页,共2页
