7.3溶液浓稀的表示同步练习—2021-2022学年九年级化学科粤版(2012)下册(word版有答案)
文档属性
| 名称 | 7.3溶液浓稀的表示同步练习—2021-2022学年九年级化学科粤版(2012)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 176.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-28 22:29:18 | ||
图片预览



文档简介
科粤版九年级化学下册 7.3 溶液浓稀的表示 同步练习
一、单选题
1.下列说法正确的是
A.凡是均一的、稳定的液体一定是溶液
B.洗涤剂能够洗涤油污是因为洗涤剂能够溶解油污
C.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
D.5g某物质完全溶于水配成100g溶液,所得溶液的溶质质量分数一定是5%
2.如图,对淡化膜右侧的海水加60倍大气压,水分子可以透过淡化膜进入左侧淡水池,而海水中的其它成分不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化进行分析,正确的是( )
A.溶质质量增加 B.溶剂质量不变
C.溶液的密度不变 D.溶质质量分数增大
3.下列条件下的氢氧化钙溶液最浓的是( )
A.80℃时的不饱和溶液 B.20℃时的不饱和溶液
C.80℃时的饱和溶液 D.20℃时的饱和溶液
4.现有100mL 20%的硫酸,其密度为1.14g/cm3,下列说法正确的是( )
A.该溶液含溶质20 g
B.该溶液中,溶质质量:溶液质量=1:6
C.该溶液中,溶质质量:溶剂质量=1:5
D.该溶液中,溶液质量:溶剂质量=5:4
5.现用质量分数为98%的浓硫酸(密度是1.84g/cm3)配制560g质量分数为14%的稀硫酸时,下列有关叙述正确的是( )
A.配制稀硫酸时,用到的玻璃仪器只需量筒和烧杯
B.配制稀硫酸时,将水加入到浓硫酸中并用玻璃杯不断搅拌
C.将80g98%的浓硫酸沿1000mL烧杯内壁缓缓倒入481.6mL水中,并不断搅拌
D.将43.5mL98%的浓硫酸沿1000mL烧杯内壁缓缓倒入480mL水中,并不断搅拌
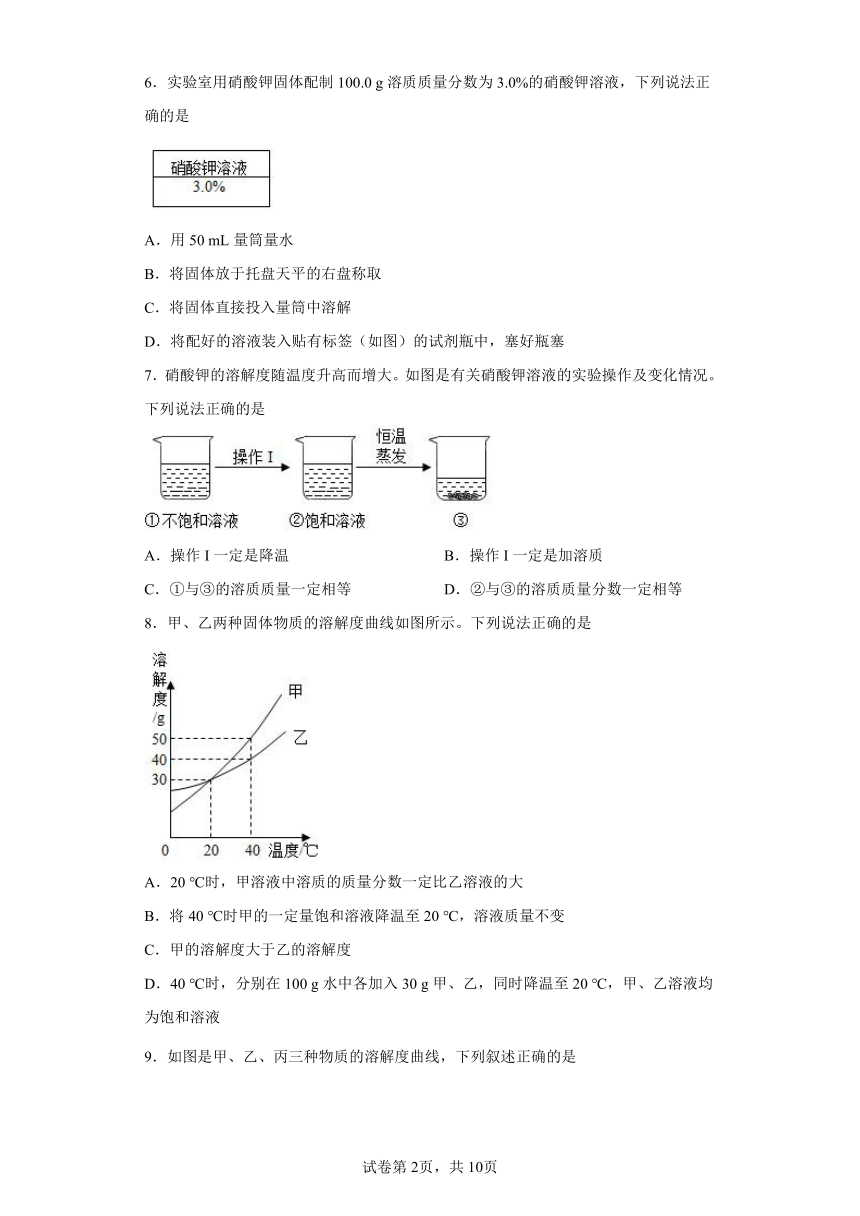
6.实验室用硝酸钾固体配制100.0 g溶质质量分数为3.0%的硝酸钾溶液,下列说法正确的是
A.用50 mL量筒量水
B.将固体放于托盘天平的右盘称取
C.将固体直接投入量筒中溶解
D.将配好的溶液装入贴有标签(如图)的试剂瓶中,塞好瓶塞
7.硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是
A.操作I一定是降温 B.操作I一定是加溶质
C.①与③的溶质质量一定相等 D.②与③的溶质质量分数一定相等
8.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是
A.20 ℃时,甲溶液中溶质的质量分数一定比乙溶液的大
B.将40 ℃时甲的一定量饱和溶液降温至20 ℃,溶液质量不变
C.甲的溶解度大于乙的溶解度
D.40 ℃时,分别在100 g水中各加入30 g甲、乙,同时降温至20 ℃,甲、乙溶液均为饱和溶液
9.如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是
A.t1 ℃时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲
B.t2 ℃时,20 g丙溶解于50 g水中能形成70 g溶液
C.分别将三种物质的饱和溶液从t3 ℃降温至t2 ℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙
D.若要将组成在N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
10.将质量均为30g的甲、乙两种固体分别加入到50g水中,充分搅拌后,剩余固体物质与温度的关系如图所示,下列说法正确的是( )
A.甲的溶解度随温度升高而增大
B.t1℃时,甲、乙的溶解度均为20g
C.温度由t2℃降低到t1℃时,甲溶液析出5g固体
D.a,b,c三点中溶质的质量分数由大到小的顺序是:c>a>b
11.小明自制了一杯蔗糖水(无固体剩余),用于缓解运动后出现的低血糖症状,之后他结合下表蔗糖的溶解度数据,归纳出以下问题,其中正确的是
温度/℃ 0 10 20 40 60 80 100
溶解度/g 182 191 204 238 287 362 487
A.配制的蔗糖溶液下层比上层甜
B.降温,糖水中一定有晶体析出
C.20℃时,蔗糖饱和溶液质量一定为304g
D.升温,糖水中蔗糖的质量分数不变
12.如图所示图像中,能正确反映对应变化关系的是( )
A B C D
向饱和石灰水中加入一定量CaO 一定温下,向不饱和硝酸钾溶液中加入硝酸钾固体 一定质量的红磷在密闭容器内燃烧 电解水生成氢气和氧气质量
A.A B.B C.C D.D
13.一定温度下,向图Ⅰ烧杯中加入一定量的水,如图Ⅱ所示,所得溶液与原溶液相比,判断一定正确的是
A.所得溶液是饱和溶液
B.溶质的质量分数变大
C.溶质的质量增加
D.氯化钾的溶解度变大
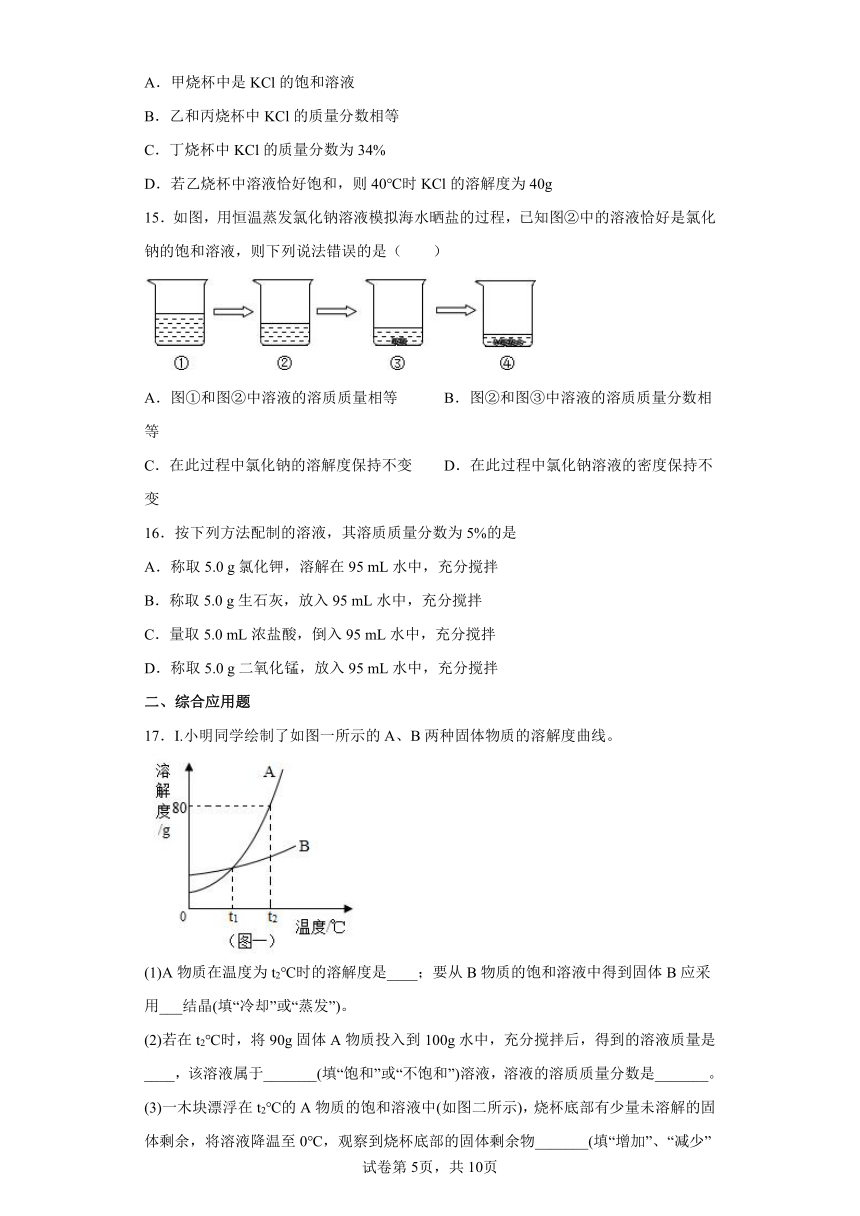
14.20℃时KCl的溶解度是34g。取65gKCl溶液放入甲烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( )
A.甲烧杯中是KCl的饱和溶液
B.乙和丙烧杯中KCl的质量分数相等
C.丁烧杯中KCl的质量分数为34%
D.若乙烧杯中溶液恰好饱和,则40℃时KCl的溶解度为40g
15.如图,用恒温蒸发氯化钠溶液模拟海水晒盐的过程,已知图②中的溶液恰好是氯化钠的饱和溶液,则下列说法错误的是( )
A.图①和图②中溶液的溶质质量相等 B.图②和图③中溶液的溶质质量分数相等
C.在此过程中氯化钠的溶解度保持不变 D.在此过程中氯化钠溶液的密度保持不变
16.按下列方法配制的溶液,其溶质质量分数为5%的是
A.称取5.0 g氯化钾,溶解在95 mL水中,充分搅拌
B.称取5.0 g生石灰,放入95 mL水中,充分搅拌
C.量取5.0 mL浓盐酸,倒入95 mL水中,充分搅拌
D.称取5.0 g二氧化锰,放入95 mL水中,充分搅拌
二、综合应用题
17.Ⅰ.小明同学绘制了如图一所示的A、B两种固体物质的溶解度曲线。
(1)A物质在温度为t2℃时的溶解度是____;要从B物质的饱和溶液中得到固体B应采用___结晶(填“冷却”或“蒸发”)。
(2)若在t2℃时,将90g固体A物质投入到100g水中,充分搅拌后,得到的溶液质量是____,该溶液属于_______(填“饱和”或“不饱和”)溶液,溶液的溶质质量分数是_______。
(3)一木块漂浮在t2℃的A物质的饱和溶液中(如图二所示),烧杯底部有少量未溶解的固体剩余,将溶液降温至0℃,观察到烧杯底部的固体剩余物_______(填“增加”、“减少”或“不变”),烧杯中的小木块变化情况是_______(填“上浮”“下沉”或“不变”)。
Ⅱ.某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和盐,同学们设计了如下图所示的实验方案。试回答:
(4)步骤①中锌粉过量的目的是_______。
(5)写出步骤①中发生的一个化学方程式:_______。
(6)要检验步骤④中加入的稀硫酸是否足量的方法是_______。
(7)若实验过程中的物质损失可以忽略,最终所得硫酸锌的质量_______(填“>”、“<”或“=”)原废液中硫酸锌的质量。要计算该废液中硫酸铜质量,必须要称量_______的质量。
18.硫酸是工农业生产中使用非常广泛的一种试剂。实验室用质量分数为98%的浓硫酸(密度为1.84/cm3)配制49 g质量分数为20%的硫酸。
(1)经计算,所需水的质量为________g,所需98%的浓硫酸的体积为________mL。
(2)量取上述体积的浓硫酸所选用的量筒规格为________。(填选项)
A 5 mL量筒 B 10 mL量筒 C 25 mL量筒 D 100 mL量筒
(3)稀释浓硫酸的操作是,将________缓慢倒入装有________的烧杯中,同时用玻璃棒不断搅拌。
(4)在烧杯中加入2.82 g在空气中久置的铝箔(只含两种物质),再滴加稀硫酸,放出气体的质量与所加质量分数为20%稀硫酸质量的关系如图所示:
①刚开始滴加稀硫酸没有氢气放出的原因是_________(用化学方程式表示)。
②根据图像计算出b-a=__________g。
③铝箔中铝元素的质量为__________g。
19.根据下列装置图,回答有关问题:
(1)写出有标号的仪器名称:①________,②________。
(2)实验室要制得干燥的O2,选择的实验制取装置是______,反应的化学方程式为________。
(3)实验室制取CO2,的化学方程式为______,利用该装置也可制备_______ 气体。
(4)现配制100g质量分数为7.3%的稀盐酸,若量取浓盐酸时俯视读数,则所配制的稀盐酸的质量分数将_______(填“偏大”、“偏小”)。将准确配制的上述稀盐酸全部加入盛有20g的石灰石样品的烧杯中,恰好能与石灰石样品中的碳酸钙完全反应(杂质不与稀盐酸反应),
则该石灰石样品中碳酸钙的质量分数是多少?(写出计算过程)____
20.2019年苏州市初中化学实验操作考查的内容是“氧气的实验室制备及其检验”。
(1)写出加热高锰酸钾制氧气的化学方程式: ______ 。
(2)实验室用加热高锰酸钾的方法制氧气,并收集一瓶较纯净的氧气,需要用到图I所示仪器中的①⑤⑥和 _____ (填序号)。
(3)欲调整试管倾斜角度,应调节图II中A、B、C哪个旋钮: ____ 。
(4)用排水法收集氧气,下图所示正确的是 ___ 。
(5)某同学用高锰酸钾制取氧气,并记录了实验过程如下:
①选择适当仪器,组装实验装置;
②在试管中加入高锰酸钾并旋紧胶塞,检查装置气密性;
③向集气瓶中加水,并倒置于盛有水的水槽中,集气瓶底部出现气泡;
④确定木块和酒精灯的高度,再将气体发生装置固定在铁架台的合适位置上;
⑤点燃酒精灯加热,待导管口有气泡产生,立即用集气瓶进行收集;
⑥气体收集完毕,先将集气瓶从水中取出,再盖上毛玻璃片正放于桌面上;
⑦先熄灭酒精灯,后将导管从水槽中取出;
⑧将带火星的木条伸入集气瓶中,木条没有复燃;
⑨实验结束后,先将大试管内取下放在石棉网上,冷却后再进行清洗。
请回答下列问题:
I.上述实验步骤中,存在错误的是 ____ ;(填序号)
II.步骤⑧中带火星木条没有复燃的原因可能是实验步骤 ____ 中出现的错误操作;(填序号)
Ⅲ.步骤⑤中,实验过程发现集气瓶中的水变红了,原因是: ____ ;
(6)实验室还可以用过氧化氢溶液制氧气。现要配制溶质质量分数为6%的过氧化氢溶液,需要向100g溶质质量分数为30%的市售双氧水中加入 ___ mL水。
21.下列三套装置都能用于实验室制取二氧化碳
(1)写出实验室制取二氧化碳的化学方程式: ____________________ ,
(2)仪器A的名称是 __________________
(3)利用图2装取制取二氧化碳时,长颈漏斗的下端管口必须浸没在溶液中,理由是 _____________ ,
(4)图1和图3装置相比.利用图1装置来制取二氧化碳,时主要的不足是 _______ (写一条即可)
(5)化学兴趣小组为了测定石灰石样品中碳酸钙的质量分数,取一定量的石灰石样品,将20g稀盐酸分4次加人样品中(样品中除碳酸钙外,其余成分不与盐酸反应,也不溶 于水).充分反应后经过过滤、千操等操作,最后称量,数据如下表
稀盐酸的用量 剩余固体的质量
第一次加入5g 1.5g
第二次加入5g 1.0g
第三次加入5g 0.5g
第四次加入5g 0.3g
①石灰石样品中碳酸钙的质量分数为 _________________
②原稀盐酸中溶质的质量分数为 ________ (写出计算过程)
22.如图给出了在实验室中制取气体时常用的部分仪器。
(1)实验室中用稀HCl和石灰石制取二氧化碳。
①反应原理可用化学方程式表示为_____;
②若用排水法收集CO2,则所需仪器有A、D、H、L、M、N、O和_____;
③配制73g 10%的稀盐酸,需20%的盐酸溶液的质量为_____,配制的主要操作步骤是:计算,_____,混溶。
(2)小明使用如图所示装置,在实验室中用过氧化氢溶液和二氧化锰制取氧气。
①实验前,小明先向分液漏斗中加入水,打开分液漏斗的活塞使水流入A瓶中,同时观察B瓶口处短导管口是否有气泡出现。他这样操作的目的是_____;
②小明将2.5gMnO2放入A瓶中,并通过分液漏斗向其中加入100g过氧化氢溶液,反应完全后,共收集到1.6g氧气。将A瓶中的剩余物过滤、洗涤并干燥后,所得滤渣的质量为_____;所用过氧化氢溶液中溶质的质量分数为_____。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.D
4.D
5.D
6.D
7.D
8.D
9.D
10.D
11.D
12.A
13.C
14.D
15.D
16.A
17.(1) 80g 蒸发
(2) 180g 饱和 44.4%
(3) 增加 下沉
(4)让CuSO4和FeSO4完全反应
(5)或
(6)取少量固体D于试管中,加入适量稀硫酸,无明显现象,说明步骤④加入稀硫酸已足量
(7) > 固体D的质量
18. 39 5.4 B 浓硫酸 蒸馏水 Al2O3 + 3H2SO4 = Al2(SO4)3 + H2O 49 2.34
19. 铁架台 长颈漏斗 AD 2KClO32KCl+3O2↑ 控制反应的发生与停止 H2 偏小 50%
20. ③⑧⑨ B C ②③⑤⑥⑦ ③⑤⑥ 没有在试管口塞一团棉花 400
21. 烧瓶 防止产生的气体从长颈漏斗中逸出 不能控制反应速率 85% 解:设5g稀盐酸中溶质的质量为x
答:原稀盐酸中溶质的质量分数为7.3%。
22. CaCO3+2HCl═CaCl2+H2O+CO2↑ C 36.5g 称量 检查装置气密性 2.5g 3.4%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列说法正确的是
A.凡是均一的、稳定的液体一定是溶液
B.洗涤剂能够洗涤油污是因为洗涤剂能够溶解油污
C.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
D.5g某物质完全溶于水配成100g溶液,所得溶液的溶质质量分数一定是5%
2.如图,对淡化膜右侧的海水加60倍大气压,水分子可以透过淡化膜进入左侧淡水池,而海水中的其它成分不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化进行分析,正确的是( )
A.溶质质量增加 B.溶剂质量不变
C.溶液的密度不变 D.溶质质量分数增大
3.下列条件下的氢氧化钙溶液最浓的是( )
A.80℃时的不饱和溶液 B.20℃时的不饱和溶液
C.80℃时的饱和溶液 D.20℃时的饱和溶液
4.现有100mL 20%的硫酸,其密度为1.14g/cm3,下列说法正确的是( )
A.该溶液含溶质20 g
B.该溶液中,溶质质量:溶液质量=1:6
C.该溶液中,溶质质量:溶剂质量=1:5
D.该溶液中,溶液质量:溶剂质量=5:4
5.现用质量分数为98%的浓硫酸(密度是1.84g/cm3)配制560g质量分数为14%的稀硫酸时,下列有关叙述正确的是( )
A.配制稀硫酸时,用到的玻璃仪器只需量筒和烧杯
B.配制稀硫酸时,将水加入到浓硫酸中并用玻璃杯不断搅拌
C.将80g98%的浓硫酸沿1000mL烧杯内壁缓缓倒入481.6mL水中,并不断搅拌
D.将43.5mL98%的浓硫酸沿1000mL烧杯内壁缓缓倒入480mL水中,并不断搅拌
6.实验室用硝酸钾固体配制100.0 g溶质质量分数为3.0%的硝酸钾溶液,下列说法正确的是
A.用50 mL量筒量水
B.将固体放于托盘天平的右盘称取
C.将固体直接投入量筒中溶解
D.将配好的溶液装入贴有标签(如图)的试剂瓶中,塞好瓶塞
7.硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是
A.操作I一定是降温 B.操作I一定是加溶质
C.①与③的溶质质量一定相等 D.②与③的溶质质量分数一定相等
8.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是
A.20 ℃时,甲溶液中溶质的质量分数一定比乙溶液的大
B.将40 ℃时甲的一定量饱和溶液降温至20 ℃,溶液质量不变
C.甲的溶解度大于乙的溶解度
D.40 ℃时,分别在100 g水中各加入30 g甲、乙,同时降温至20 ℃,甲、乙溶液均为饱和溶液
9.如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是
A.t1 ℃时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲
B.t2 ℃时,20 g丙溶解于50 g水中能形成70 g溶液
C.分别将三种物质的饱和溶液从t3 ℃降温至t2 ℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙
D.若要将组成在N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
10.将质量均为30g的甲、乙两种固体分别加入到50g水中,充分搅拌后,剩余固体物质与温度的关系如图所示,下列说法正确的是( )
A.甲的溶解度随温度升高而增大
B.t1℃时,甲、乙的溶解度均为20g
C.温度由t2℃降低到t1℃时,甲溶液析出5g固体
D.a,b,c三点中溶质的质量分数由大到小的顺序是:c>a>b
11.小明自制了一杯蔗糖水(无固体剩余),用于缓解运动后出现的低血糖症状,之后他结合下表蔗糖的溶解度数据,归纳出以下问题,其中正确的是
温度/℃ 0 10 20 40 60 80 100
溶解度/g 182 191 204 238 287 362 487
A.配制的蔗糖溶液下层比上层甜
B.降温,糖水中一定有晶体析出
C.20℃时,蔗糖饱和溶液质量一定为304g
D.升温,糖水中蔗糖的质量分数不变
12.如图所示图像中,能正确反映对应变化关系的是( )
A B C D
向饱和石灰水中加入一定量CaO 一定温下,向不饱和硝酸钾溶液中加入硝酸钾固体 一定质量的红磷在密闭容器内燃烧 电解水生成氢气和氧气质量
A.A B.B C.C D.D
13.一定温度下,向图Ⅰ烧杯中加入一定量的水,如图Ⅱ所示,所得溶液与原溶液相比,判断一定正确的是
A.所得溶液是饱和溶液
B.溶质的质量分数变大
C.溶质的质量增加
D.氯化钾的溶解度变大
14.20℃时KCl的溶解度是34g。取65gKCl溶液放入甲烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( )
A.甲烧杯中是KCl的饱和溶液
B.乙和丙烧杯中KCl的质量分数相等
C.丁烧杯中KCl的质量分数为34%
D.若乙烧杯中溶液恰好饱和,则40℃时KCl的溶解度为40g
15.如图,用恒温蒸发氯化钠溶液模拟海水晒盐的过程,已知图②中的溶液恰好是氯化钠的饱和溶液,则下列说法错误的是( )
A.图①和图②中溶液的溶质质量相等 B.图②和图③中溶液的溶质质量分数相等
C.在此过程中氯化钠的溶解度保持不变 D.在此过程中氯化钠溶液的密度保持不变
16.按下列方法配制的溶液,其溶质质量分数为5%的是
A.称取5.0 g氯化钾,溶解在95 mL水中,充分搅拌
B.称取5.0 g生石灰,放入95 mL水中,充分搅拌
C.量取5.0 mL浓盐酸,倒入95 mL水中,充分搅拌
D.称取5.0 g二氧化锰,放入95 mL水中,充分搅拌
二、综合应用题
17.Ⅰ.小明同学绘制了如图一所示的A、B两种固体物质的溶解度曲线。
(1)A物质在温度为t2℃时的溶解度是____;要从B物质的饱和溶液中得到固体B应采用___结晶(填“冷却”或“蒸发”)。
(2)若在t2℃时,将90g固体A物质投入到100g水中,充分搅拌后,得到的溶液质量是____,该溶液属于_______(填“饱和”或“不饱和”)溶液,溶液的溶质质量分数是_______。
(3)一木块漂浮在t2℃的A物质的饱和溶液中(如图二所示),烧杯底部有少量未溶解的固体剩余,将溶液降温至0℃,观察到烧杯底部的固体剩余物_______(填“增加”、“减少”或“不变”),烧杯中的小木块变化情况是_______(填“上浮”“下沉”或“不变”)。
Ⅱ.某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和盐,同学们设计了如下图所示的实验方案。试回答:
(4)步骤①中锌粉过量的目的是_______。
(5)写出步骤①中发生的一个化学方程式:_______。
(6)要检验步骤④中加入的稀硫酸是否足量的方法是_______。
(7)若实验过程中的物质损失可以忽略,最终所得硫酸锌的质量_______(填“>”、“<”或“=”)原废液中硫酸锌的质量。要计算该废液中硫酸铜质量,必须要称量_______的质量。
18.硫酸是工农业生产中使用非常广泛的一种试剂。实验室用质量分数为98%的浓硫酸(密度为1.84/cm3)配制49 g质量分数为20%的硫酸。
(1)经计算,所需水的质量为________g,所需98%的浓硫酸的体积为________mL。
(2)量取上述体积的浓硫酸所选用的量筒规格为________。(填选项)
A 5 mL量筒 B 10 mL量筒 C 25 mL量筒 D 100 mL量筒
(3)稀释浓硫酸的操作是,将________缓慢倒入装有________的烧杯中,同时用玻璃棒不断搅拌。
(4)在烧杯中加入2.82 g在空气中久置的铝箔(只含两种物质),再滴加稀硫酸,放出气体的质量与所加质量分数为20%稀硫酸质量的关系如图所示:
①刚开始滴加稀硫酸没有氢气放出的原因是_________(用化学方程式表示)。
②根据图像计算出b-a=__________g。
③铝箔中铝元素的质量为__________g。
19.根据下列装置图,回答有关问题:
(1)写出有标号的仪器名称:①________,②________。
(2)实验室要制得干燥的O2,选择的实验制取装置是______,反应的化学方程式为________。
(3)实验室制取CO2,的化学方程式为______,利用该装置也可制备_______ 气体。
(4)现配制100g质量分数为7.3%的稀盐酸,若量取浓盐酸时俯视读数,则所配制的稀盐酸的质量分数将_______(填“偏大”、“偏小”)。将准确配制的上述稀盐酸全部加入盛有20g的石灰石样品的烧杯中,恰好能与石灰石样品中的碳酸钙完全反应(杂质不与稀盐酸反应),
则该石灰石样品中碳酸钙的质量分数是多少?(写出计算过程)____
20.2019年苏州市初中化学实验操作考查的内容是“氧气的实验室制备及其检验”。
(1)写出加热高锰酸钾制氧气的化学方程式: ______ 。
(2)实验室用加热高锰酸钾的方法制氧气,并收集一瓶较纯净的氧气,需要用到图I所示仪器中的①⑤⑥和 _____ (填序号)。
(3)欲调整试管倾斜角度,应调节图II中A、B、C哪个旋钮: ____ 。
(4)用排水法收集氧气,下图所示正确的是 ___ 。
(5)某同学用高锰酸钾制取氧气,并记录了实验过程如下:
①选择适当仪器,组装实验装置;
②在试管中加入高锰酸钾并旋紧胶塞,检查装置气密性;
③向集气瓶中加水,并倒置于盛有水的水槽中,集气瓶底部出现气泡;
④确定木块和酒精灯的高度,再将气体发生装置固定在铁架台的合适位置上;
⑤点燃酒精灯加热,待导管口有气泡产生,立即用集气瓶进行收集;
⑥气体收集完毕,先将集气瓶从水中取出,再盖上毛玻璃片正放于桌面上;
⑦先熄灭酒精灯,后将导管从水槽中取出;
⑧将带火星的木条伸入集气瓶中,木条没有复燃;
⑨实验结束后,先将大试管内取下放在石棉网上,冷却后再进行清洗。
请回答下列问题:
I.上述实验步骤中,存在错误的是 ____ ;(填序号)
II.步骤⑧中带火星木条没有复燃的原因可能是实验步骤 ____ 中出现的错误操作;(填序号)
Ⅲ.步骤⑤中,实验过程发现集气瓶中的水变红了,原因是: ____ ;
(6)实验室还可以用过氧化氢溶液制氧气。现要配制溶质质量分数为6%的过氧化氢溶液,需要向100g溶质质量分数为30%的市售双氧水中加入 ___ mL水。
21.下列三套装置都能用于实验室制取二氧化碳
(1)写出实验室制取二氧化碳的化学方程式: ____________________ ,
(2)仪器A的名称是 __________________
(3)利用图2装取制取二氧化碳时,长颈漏斗的下端管口必须浸没在溶液中,理由是 _____________ ,
(4)图1和图3装置相比.利用图1装置来制取二氧化碳,时主要的不足是 _______ (写一条即可)
(5)化学兴趣小组为了测定石灰石样品中碳酸钙的质量分数,取一定量的石灰石样品,将20g稀盐酸分4次加人样品中(样品中除碳酸钙外,其余成分不与盐酸反应,也不溶 于水).充分反应后经过过滤、千操等操作,最后称量,数据如下表
稀盐酸的用量 剩余固体的质量
第一次加入5g 1.5g
第二次加入5g 1.0g
第三次加入5g 0.5g
第四次加入5g 0.3g
①石灰石样品中碳酸钙的质量分数为 _________________
②原稀盐酸中溶质的质量分数为 ________ (写出计算过程)
22.如图给出了在实验室中制取气体时常用的部分仪器。
(1)实验室中用稀HCl和石灰石制取二氧化碳。
①反应原理可用化学方程式表示为_____;
②若用排水法收集CO2,则所需仪器有A、D、H、L、M、N、O和_____;
③配制73g 10%的稀盐酸,需20%的盐酸溶液的质量为_____,配制的主要操作步骤是:计算,_____,混溶。
(2)小明使用如图所示装置,在实验室中用过氧化氢溶液和二氧化锰制取氧气。
①实验前,小明先向分液漏斗中加入水,打开分液漏斗的活塞使水流入A瓶中,同时观察B瓶口处短导管口是否有气泡出现。他这样操作的目的是_____;
②小明将2.5gMnO2放入A瓶中,并通过分液漏斗向其中加入100g过氧化氢溶液,反应完全后,共收集到1.6g氧气。将A瓶中的剩余物过滤、洗涤并干燥后,所得滤渣的质量为_____;所用过氧化氢溶液中溶质的质量分数为_____。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.D
4.D
5.D
6.D
7.D
8.D
9.D
10.D
11.D
12.A
13.C
14.D
15.D
16.A
17.(1) 80g 蒸发
(2) 180g 饱和 44.4%
(3) 增加 下沉
(4)让CuSO4和FeSO4完全反应
(5)或
(6)取少量固体D于试管中,加入适量稀硫酸,无明显现象,说明步骤④加入稀硫酸已足量
(7) > 固体D的质量
18. 39 5.4 B 浓硫酸 蒸馏水 Al2O3 + 3H2SO4 = Al2(SO4)3 + H2O 49 2.34
19. 铁架台 长颈漏斗 AD 2KClO32KCl+3O2↑ 控制反应的发生与停止 H2 偏小 50%
20. ③⑧⑨ B C ②③⑤⑥⑦ ③⑤⑥ 没有在试管口塞一团棉花 400
21. 烧瓶 防止产生的气体从长颈漏斗中逸出 不能控制反应速率 85% 解:设5g稀盐酸中溶质的质量为x
答:原稀盐酸中溶质的质量分数为7.3%。
22. CaCO3+2HCl═CaCl2+H2O+CO2↑ C 36.5g 称量 检查装置气密性 2.5g 3.4%
答案第1页,共2页
答案第1页,共2页
