8.4常见的盐同步练习—2021-2022学年九年级化学科粤版(2012)下册(word版有答案)
文档属性
| 名称 | 8.4常见的盐同步练习—2021-2022学年九年级化学科粤版(2012)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 150.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-28 23:13:38 | ||
图片预览



文档简介
科粤版九年级化学下册 8.4 常见的盐 同步练习
一、单选题
1.下列各组离子在无色透明溶液中能大量共存的是
A.Cu2+、Na+、SO42-、Cl- B.K+、Na+、CO32—、NO3-
C.OH-、CO32-、Ca2+、Na+ D.Mg2+、Na+、OH-、CO32-
2.图1中甲、乙、丙、丁表示相邻两物质相互混合过程中溶液酸碱度的变化,其中可能符合图2所示变化关系的是
A.甲
B.乙
C.丙
D.丁
3.关于复分解反应说法一定正确的是( )
A.反应物为酸和碱 B.伴随有明显现象
C.生成物为盐和水 D.元素化合价不变
4.下列物质间能够发生反应,但没有出现明显现象的是
A.将稀盐酸滴入盛石灰石的试管中
B.将CO2通入NaOH溶液中
C.将碳酸钠溶液滴入澄清石灰水中
D.将稀硫酸滴入NaCl溶液中
5.下列物质间的转化一步就能实现的是
A.CaCO3→Na2CO3 B. C.CO2→O2 D.H2O2→H2
6.已知某无色溶液中大量共存的物质有KNO3、NaOH、X、BaCl2,其中X可能是
A.CuSO4
B.K2CO3
C.NaNO3
D.MgCl2
7.下列物质的用途,利用了其物理性质的是
A.生石灰用作干燥剂 B.铁粉用作食品保鲜吸氧剂
C.氦气填充飞艇 D.小苏打用于治疗胃酸过多
8.兴趣小组的同学利用下图装置,探究化学反应前后物质的质量是否守恒。应选用的药品是
A.铁粉和稀盐酸液体中
B.硝酸钾晶体和水
C.碳酸钡粉末和稀硫酸
D.铜粉和硝酸银溶液
9.下列反应属于复分解反应的是
A.4P+5O22P2O5 B.Fe+2HCl=FeCl2+H2↑
C.2H2O2H2↑+O2↑ D.Na2CO3+MgCl2=MgCO3↓+2NaCl
10.下列各组常见的固体物质中,用水不能区分的是
A.NaOH和NH4NO3
B.CuSO4和Na2SO4
C.Na2CO3和CaCO3
D.NaCl和KCl
11.把 CaCO3、NaCl、MgCl2三种固体物质组成的混合物逐一分离所需要的试剂依次是
A.H2ONaOHHCl
B.H2O KOH HCl
C.H2O NaOH H2SO4
D.H2O KOH H2SO4
12.下列应用、对应的化学方程式及基本反应类型都正确的是
A.用一氧化碳还原氧化铁: 置换反应
B.用氢氧化钠溶液吸收二氧化碳: 复分解反应
C.用铁桶盛装农药波尔多液: 置换反应
D.用生石灰制熟石灰: 化合反应
13.下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是
A.NaCl
B.NaOH
C.NaHCO3
D.Na2SO4
14.下列除去杂质的方法中,正确的是( )
选项 物质(括号内为杂质) 除去杂质的方法
A FeSO4溶液(CuSO4) 加入过量Fe粉、过滤
B CaO(CaCO3) 加水溶解、过滤
C CO2(CO) 通入适量氧气、点燃
D 盐酸(硫酸) 先加入适量的Ba(NO3)2溶液、再过滤
A.A B.B C.C D.D
15.2020年世界水日的主题是“水与气候变化”。下列关于水的说法正确的是
A.生活中硬水转化为软水的方法是煮沸
B.电解水实验中产生氢气和氧气的体积比为1:8
C.化合物之间有水生成的反应一定是复分解反应
D.过滤后的河水为纯净水
16.粗盐提纯实验包含称量,溶解、过滤和蒸发,下列装置和操作能达到实验目的的是
A.量取10mL水 B.溶解粗盐
C.过滤悬浊液 D.蒸发滤液
二、综合应用题
17.实验室长期存放石灰水的瓶壁上附着一层白色固体物质,该物质是 ________ (填化学式);形成的原因: ________ (用化学方程式表示),要除去这层白色固体,需先用________ 洗,再用水冲洗.
18.我国制碱工业先驱侯德榜发明了“侯氏制碱法”
(1)A~E是初中化学常见的五种不同类别的物质,它们的转化关系如图(“-”表示两种物质能反应,“→”表示两种物质能转化,部分物质和反应条件略去) A是目前世界年产量最大的金属;B是红棕色粉末;E是“侯氏制碱法”中的“碱”,则C的化学式为_______,反应②的化学方程式为_______
(2)“侯氏制碱法”的模拟工艺流程如图:
①操作a的名称是__________,进行此操作所需的玻璃仪器有烧杯、玻璃棒、_______
②反应Ⅱ的化学方程式为____________
③为了提高产率,你认为应向饱和食盐水中先通入_______(填“CO2”或“NH3”)一段时间,后通另一种气体,理由是_______________ (已知氨气极易溶于水)
④上述流程中可以循环利用的物质是____________(填化学式)
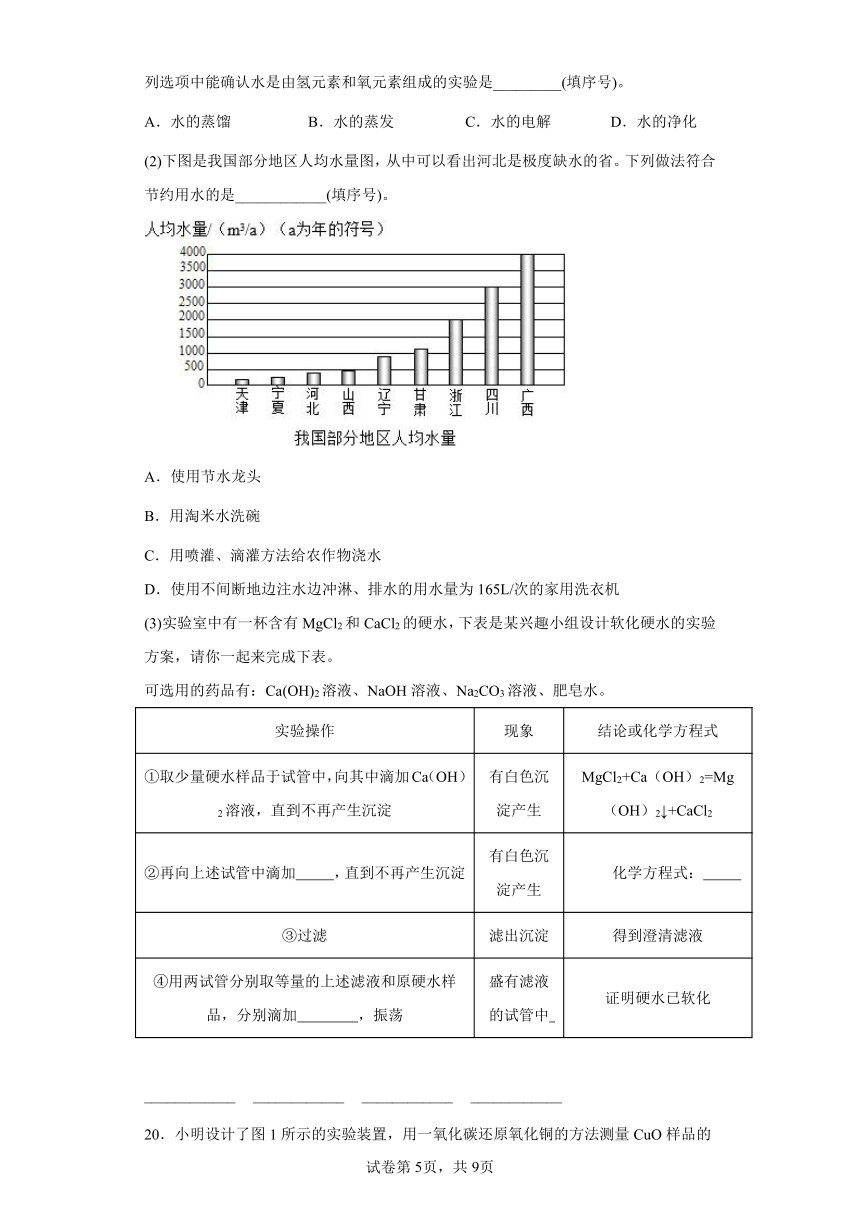
19.2010年春我国西南大部分地区发生严重的旱灾,我们在抗旱救灾的同时,更应倡导保护水环境、珍惜水资源。请回答下列问题:
(1)不论是自来水还是纯净水,你认为保持水的化学性质的最小微粒是___________。下列选项中能确认水是由氢元素和氧元素组成的实验是_________(填序号)。
A.水的蒸馏 B.水的蒸发 C.水的电解 D.水的净化
(2)下图是我国部分地区人均水量图,从中可以看出河北是极度缺水的省。下列做法符合节约用水的是____________(填序号)。
A.使用节水龙头
B.用淘米水洗碗
C.用喷灌、滴灌方法给农作物浇水
D.使用不间断地边注水边冲淋、排水的用水量为165L/次的家用洗衣机
(3)实验室中有一杯含有MgCl2和CaCl2的硬水,下表是某兴趣小组设计软化硬水的实验方案,请你一起来完成下表。
可选用的药品有:Ca(OH)2溶液、NaOH溶液、Na2CO3溶液、肥皂水。
实验操作 现象 结论或化学方程式
①取少量硬水样品于试管中,向其中滴加Ca(OH)2溶液,直到不再产生沉淀 有白色沉淀产生 MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
②再向上述试管中滴加 ,直到不再产生沉淀 有白色沉淀产生 化学方程式:
③过滤 滤出沉淀 得到澄清滤液
④用两试管分别取等量的上述滤液和原硬水样品,分别滴加 ,振荡 盛有滤液的试管中 证明硬水已软化
____________ ____________ ____________ ____________
20.小明设计了图1所示的实验装置,用一氧化碳还原氧化铜的方法测量CuO样品的纯度,小明准确称取了10g干燥的样品进行实验。试回答:
反应前 反应后
装置A 50g 48.4g
(1)该装置的不足之处是_______。
(2)实验开始时,先要进行的操作是______(填序号)。
①通一氧化碳 ②加热
(3)实验过程中,A处观察到的现象是______,B处澄清石灰水变浑浊的方程式为______。
(4)请根据表,计算出CuO样品的纯度为_______。
(5)为分离A装置中反应排出的一氧化碳和二氧化碳,小明又设计了如图2所示的装置(铁架台、铁夹等固定装置已略去,a、b为活塞)。
①当关闭活塞b,打开活塞a时,可分离得到______。
②然后关闭活塞a,再打开活塞b,可分离得到另一种气体。
21.“鱼浮灵”俗称固体双氧水,主要成分是过碳酸钠(xNa2CO3·yH2O2),为深入了解其相关知识进行如下探究。
查阅资料
①工业上可利用Na2CO3溶液与H2O2反应制备过碳酸钠
②工业Na2CO3中常常含有少量Fe3+、Mn2+等金属离子,这些金属离子会促进H2O2分解,造成H2O2的损失,需加入絮凝剂对Na2CO3进一步精制除杂
③浓硫酸具有吸水性,常用作干燥剂
④过碳酸钠与稀硫酸反应放出CO2和O2
⑤碱石灰为氧化钙和氢氧化钠的固体混合物,可吸收H2O、CO2,不能吸收O2
回答下列问题
Ⅰ工业制备
(1)流程中加絮凝剂的目的是_______________,该步骤所发生的变化属于______(填“物理”或“化学”)变化;操作Ⅰ、Ⅱ都要使用玻璃棒,其作用是_______________。
(2)加入过氧化氢溶液制备过碳酸钠的过程中,测得过碳酸钠的产率与反应温度的关系如下表:
温度范围/℃ 5~10 10~15 15~20 20~25
过碳酸钠的产率/% 84.49 85.78 88.38 83.01
分析数据,制备过碳酸钠的最佳温度范围是________℃。温度过高,产率反而降低,从制备过碳酸钠原料的性质分析产率降低的原因是______________________(用化学方程式表示)。
Ⅱ性质探究
(3)取少量过碳酸钠样品于试管中加水,观察到样品表面有气泡缓慢冒出:再向该试管中加入少量MnO2粉末,迅速有大量气泡产生;将带火星的木条伸入试管中部,观察到___________________,说明有O2生成,取反应后的上层清液于另一支试管,如入过量硫酸,又有大量气泡产生;将该气体通入澄清石灰水,观察到石灰水变浑浊,该气体为__________(写化学式)。
实验结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质。
Ⅲ组成测定
(4)为测定过碳酸钠(xNa2CO3·yH2O2)中x:y的值。称取相等质量的两份过碳酸钠样品,利用图甲、图乙两装置分别进行相应实验
①利用图甲进行实验时,共收集到V升气体,欲计算该气体的质量,须查阅的数据为相同温度和压强下该气体的__________________。
②图乙中装置B的作用是__________________。
③利用图乙进行实验时,先打开弹簧夹K1、K2,关闭弹簧夹K3,缓慢通入一段时间N2的目的是_____________。再关闭K1、K2,打开K3,缓慢滴加稀硫酸且过量的目的是______________。当过碳酸钠完全反应后,需打开K1继续缓慢通入一段时间的N2。若此时不继续通入N2会导致x:y的值__________(填“偏大”或“偏小”)。
(5)数据处理:利用图甲实验所得数据,结合查阅数据计算所得气体质量为1.2g利用图乙进行实验中,装置C增重2.2g,则x:y=_______________。
22.某化学兴趣小组欲探究实验室制 CO2后某剩余废液的成分组成,其实验步骤及对应实验现象如下图所示:
根据上述信息,试回答下列问题:
(1)由上图中的实验现象,可推知该剩余废液中的溶质组成为___________(填序号)。
A 只有 CaCl2 B CaCl2和 HCl C CaCl2和 CaCO3
(2)操作②的名称为___________。
(3)操作③中,加入稀盐酸的目的是___________。
(4)在上述实验过程中,产生白色沉淀的质量与加入溶质质量分数为 10%的 Na2CO3溶液的质量关系如图所示。
试计算:该剩余废液中氯化钙的质量分数?___________ (计算 结果精确到 0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.D
3.D
4.B
5.C
6.C
7.C
8.D
9.D
10.D
11.A
12.D
13.C
14.A
15.A
16.B
17. CaCO3; Ca(OH)2+CO2═CaCO3↓+H2O; 稀盐酸.
18. HCl(或H2SO4) 或 过滤 漏斗 NH3 氨气在水中的溶解度大,先通氨气使溶液呈碱性,会吸收更多的二氧化碳,生成更多的碳酸氢钠 CO2
19. 水分子 C ABC Na2CO3溶液 CaCl2+Na2CO3═2NaCl+CaCO3↓ 等量的肥皂水 产生较多泡沫
20. 未进行尾气处理 ① 黑色固体逐渐变红 CO2+Ca(OH)2=CaCO3↓+H2O 80% CO
21. 除去Na2CO3中的Fe3+、Mn2+ 化学 引流 15℃~20℃ 2H2O22H2O+O2↑ 木条复燃 CO2 密度 除去气体中的水蒸气、便于观察和控制气流速度 排尽装置内的空气(二氧化碳),避免产生实验误差 使过碳酸钠完全分解 偏小 2:3
22. B 过滤 除去过量的 Na2CO3 27.8%;
解:由图像可知,与 CaCl2反应的碳酸钠的质量为
设剩余废液中 CaCl2质量为 x
x=5.55g
该剩余废液中氯化钙溶质的质量分数
≈27.8%
答:剩余废液中氯化钙的质量分数 27.8%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列各组离子在无色透明溶液中能大量共存的是
A.Cu2+、Na+、SO42-、Cl- B.K+、Na+、CO32—、NO3-
C.OH-、CO32-、Ca2+、Na+ D.Mg2+、Na+、OH-、CO32-
2.图1中甲、乙、丙、丁表示相邻两物质相互混合过程中溶液酸碱度的变化,其中可能符合图2所示变化关系的是
A.甲
B.乙
C.丙
D.丁
3.关于复分解反应说法一定正确的是( )
A.反应物为酸和碱 B.伴随有明显现象
C.生成物为盐和水 D.元素化合价不变
4.下列物质间能够发生反应,但没有出现明显现象的是
A.将稀盐酸滴入盛石灰石的试管中
B.将CO2通入NaOH溶液中
C.将碳酸钠溶液滴入澄清石灰水中
D.将稀硫酸滴入NaCl溶液中
5.下列物质间的转化一步就能实现的是
A.CaCO3→Na2CO3 B. C.CO2→O2 D.H2O2→H2
6.已知某无色溶液中大量共存的物质有KNO3、NaOH、X、BaCl2,其中X可能是
A.CuSO4
B.K2CO3
C.NaNO3
D.MgCl2
7.下列物质的用途,利用了其物理性质的是
A.生石灰用作干燥剂 B.铁粉用作食品保鲜吸氧剂
C.氦气填充飞艇 D.小苏打用于治疗胃酸过多
8.兴趣小组的同学利用下图装置,探究化学反应前后物质的质量是否守恒。应选用的药品是
A.铁粉和稀盐酸液体中
B.硝酸钾晶体和水
C.碳酸钡粉末和稀硫酸
D.铜粉和硝酸银溶液
9.下列反应属于复分解反应的是
A.4P+5O22P2O5 B.Fe+2HCl=FeCl2+H2↑
C.2H2O2H2↑+O2↑ D.Na2CO3+MgCl2=MgCO3↓+2NaCl
10.下列各组常见的固体物质中,用水不能区分的是
A.NaOH和NH4NO3
B.CuSO4和Na2SO4
C.Na2CO3和CaCO3
D.NaCl和KCl
11.把 CaCO3、NaCl、MgCl2三种固体物质组成的混合物逐一分离所需要的试剂依次是
A.H2ONaOHHCl
B.H2O KOH HCl
C.H2O NaOH H2SO4
D.H2O KOH H2SO4
12.下列应用、对应的化学方程式及基本反应类型都正确的是
A.用一氧化碳还原氧化铁: 置换反应
B.用氢氧化钠溶液吸收二氧化碳: 复分解反应
C.用铁桶盛装农药波尔多液: 置换反应
D.用生石灰制熟石灰: 化合反应
13.下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是
A.NaCl
B.NaOH
C.NaHCO3
D.Na2SO4
14.下列除去杂质的方法中,正确的是( )
选项 物质(括号内为杂质) 除去杂质的方法
A FeSO4溶液(CuSO4) 加入过量Fe粉、过滤
B CaO(CaCO3) 加水溶解、过滤
C CO2(CO) 通入适量氧气、点燃
D 盐酸(硫酸) 先加入适量的Ba(NO3)2溶液、再过滤
A.A B.B C.C D.D
15.2020年世界水日的主题是“水与气候变化”。下列关于水的说法正确的是
A.生活中硬水转化为软水的方法是煮沸
B.电解水实验中产生氢气和氧气的体积比为1:8
C.化合物之间有水生成的反应一定是复分解反应
D.过滤后的河水为纯净水
16.粗盐提纯实验包含称量,溶解、过滤和蒸发,下列装置和操作能达到实验目的的是
A.量取10mL水 B.溶解粗盐
C.过滤悬浊液 D.蒸发滤液
二、综合应用题
17.实验室长期存放石灰水的瓶壁上附着一层白色固体物质,该物质是 ________ (填化学式);形成的原因: ________ (用化学方程式表示),要除去这层白色固体,需先用________ 洗,再用水冲洗.
18.我国制碱工业先驱侯德榜发明了“侯氏制碱法”
(1)A~E是初中化学常见的五种不同类别的物质,它们的转化关系如图(“-”表示两种物质能反应,“→”表示两种物质能转化,部分物质和反应条件略去) A是目前世界年产量最大的金属;B是红棕色粉末;E是“侯氏制碱法”中的“碱”,则C的化学式为_______,反应②的化学方程式为_______
(2)“侯氏制碱法”的模拟工艺流程如图:
①操作a的名称是__________,进行此操作所需的玻璃仪器有烧杯、玻璃棒、_______
②反应Ⅱ的化学方程式为____________
③为了提高产率,你认为应向饱和食盐水中先通入_______(填“CO2”或“NH3”)一段时间,后通另一种气体,理由是_______________ (已知氨气极易溶于水)
④上述流程中可以循环利用的物质是____________(填化学式)
19.2010年春我国西南大部分地区发生严重的旱灾,我们在抗旱救灾的同时,更应倡导保护水环境、珍惜水资源。请回答下列问题:
(1)不论是自来水还是纯净水,你认为保持水的化学性质的最小微粒是___________。下列选项中能确认水是由氢元素和氧元素组成的实验是_________(填序号)。
A.水的蒸馏 B.水的蒸发 C.水的电解 D.水的净化
(2)下图是我国部分地区人均水量图,从中可以看出河北是极度缺水的省。下列做法符合节约用水的是____________(填序号)。
A.使用节水龙头
B.用淘米水洗碗
C.用喷灌、滴灌方法给农作物浇水
D.使用不间断地边注水边冲淋、排水的用水量为165L/次的家用洗衣机
(3)实验室中有一杯含有MgCl2和CaCl2的硬水,下表是某兴趣小组设计软化硬水的实验方案,请你一起来完成下表。
可选用的药品有:Ca(OH)2溶液、NaOH溶液、Na2CO3溶液、肥皂水。
实验操作 现象 结论或化学方程式
①取少量硬水样品于试管中,向其中滴加Ca(OH)2溶液,直到不再产生沉淀 有白色沉淀产生 MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
②再向上述试管中滴加 ,直到不再产生沉淀 有白色沉淀产生 化学方程式:
③过滤 滤出沉淀 得到澄清滤液
④用两试管分别取等量的上述滤液和原硬水样品,分别滴加 ,振荡 盛有滤液的试管中 证明硬水已软化
____________ ____________ ____________ ____________
20.小明设计了图1所示的实验装置,用一氧化碳还原氧化铜的方法测量CuO样品的纯度,小明准确称取了10g干燥的样品进行实验。试回答:
反应前 反应后
装置A 50g 48.4g
(1)该装置的不足之处是_______。
(2)实验开始时,先要进行的操作是______(填序号)。
①通一氧化碳 ②加热
(3)实验过程中,A处观察到的现象是______,B处澄清石灰水变浑浊的方程式为______。
(4)请根据表,计算出CuO样品的纯度为_______。
(5)为分离A装置中反应排出的一氧化碳和二氧化碳,小明又设计了如图2所示的装置(铁架台、铁夹等固定装置已略去,a、b为活塞)。
①当关闭活塞b,打开活塞a时,可分离得到______。
②然后关闭活塞a,再打开活塞b,可分离得到另一种气体。
21.“鱼浮灵”俗称固体双氧水,主要成分是过碳酸钠(xNa2CO3·yH2O2),为深入了解其相关知识进行如下探究。
查阅资料
①工业上可利用Na2CO3溶液与H2O2反应制备过碳酸钠
②工业Na2CO3中常常含有少量Fe3+、Mn2+等金属离子,这些金属离子会促进H2O2分解,造成H2O2的损失,需加入絮凝剂对Na2CO3进一步精制除杂
③浓硫酸具有吸水性,常用作干燥剂
④过碳酸钠与稀硫酸反应放出CO2和O2
⑤碱石灰为氧化钙和氢氧化钠的固体混合物,可吸收H2O、CO2,不能吸收O2
回答下列问题
Ⅰ工业制备
(1)流程中加絮凝剂的目的是_______________,该步骤所发生的变化属于______(填“物理”或“化学”)变化;操作Ⅰ、Ⅱ都要使用玻璃棒,其作用是_______________。
(2)加入过氧化氢溶液制备过碳酸钠的过程中,测得过碳酸钠的产率与反应温度的关系如下表:
温度范围/℃ 5~10 10~15 15~20 20~25
过碳酸钠的产率/% 84.49 85.78 88.38 83.01
分析数据,制备过碳酸钠的最佳温度范围是________℃。温度过高,产率反而降低,从制备过碳酸钠原料的性质分析产率降低的原因是______________________(用化学方程式表示)。
Ⅱ性质探究
(3)取少量过碳酸钠样品于试管中加水,观察到样品表面有气泡缓慢冒出:再向该试管中加入少量MnO2粉末,迅速有大量气泡产生;将带火星的木条伸入试管中部,观察到___________________,说明有O2生成,取反应后的上层清液于另一支试管,如入过量硫酸,又有大量气泡产生;将该气体通入澄清石灰水,观察到石灰水变浑浊,该气体为__________(写化学式)。
实验结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质。
Ⅲ组成测定
(4)为测定过碳酸钠(xNa2CO3·yH2O2)中x:y的值。称取相等质量的两份过碳酸钠样品,利用图甲、图乙两装置分别进行相应实验
①利用图甲进行实验时,共收集到V升气体,欲计算该气体的质量,须查阅的数据为相同温度和压强下该气体的__________________。
②图乙中装置B的作用是__________________。
③利用图乙进行实验时,先打开弹簧夹K1、K2,关闭弹簧夹K3,缓慢通入一段时间N2的目的是_____________。再关闭K1、K2,打开K3,缓慢滴加稀硫酸且过量的目的是______________。当过碳酸钠完全反应后,需打开K1继续缓慢通入一段时间的N2。若此时不继续通入N2会导致x:y的值__________(填“偏大”或“偏小”)。
(5)数据处理:利用图甲实验所得数据,结合查阅数据计算所得气体质量为1.2g利用图乙进行实验中,装置C增重2.2g,则x:y=_______________。
22.某化学兴趣小组欲探究实验室制 CO2后某剩余废液的成分组成,其实验步骤及对应实验现象如下图所示:
根据上述信息,试回答下列问题:
(1)由上图中的实验现象,可推知该剩余废液中的溶质组成为___________(填序号)。
A 只有 CaCl2 B CaCl2和 HCl C CaCl2和 CaCO3
(2)操作②的名称为___________。
(3)操作③中,加入稀盐酸的目的是___________。
(4)在上述实验过程中,产生白色沉淀的质量与加入溶质质量分数为 10%的 Na2CO3溶液的质量关系如图所示。
试计算:该剩余废液中氯化钙的质量分数?___________ (计算 结果精确到 0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.D
3.D
4.B
5.C
6.C
7.C
8.D
9.D
10.D
11.A
12.D
13.C
14.A
15.A
16.B
17. CaCO3; Ca(OH)2+CO2═CaCO3↓+H2O; 稀盐酸.
18. HCl(或H2SO4) 或 过滤 漏斗 NH3 氨气在水中的溶解度大,先通氨气使溶液呈碱性,会吸收更多的二氧化碳,生成更多的碳酸氢钠 CO2
19. 水分子 C ABC Na2CO3溶液 CaCl2+Na2CO3═2NaCl+CaCO3↓ 等量的肥皂水 产生较多泡沫
20. 未进行尾气处理 ① 黑色固体逐渐变红 CO2+Ca(OH)2=CaCO3↓+H2O 80% CO
21. 除去Na2CO3中的Fe3+、Mn2+ 化学 引流 15℃~20℃ 2H2O22H2O+O2↑ 木条复燃 CO2 密度 除去气体中的水蒸气、便于观察和控制气流速度 排尽装置内的空气(二氧化碳),避免产生实验误差 使过碳酸钠完全分解 偏小 2:3
22. B 过滤 除去过量的 Na2CO3 27.8%;
解:由图像可知,与 CaCl2反应的碳酸钠的质量为
设剩余废液中 CaCl2质量为 x
x=5.55g
该剩余废液中氯化钙溶质的质量分数
≈27.8%
答:剩余废液中氯化钙的质量分数 27.8%。
答案第1页,共2页
答案第1页,共2页
