9.3溶解度-2021-2022学年九年级化学京改版(2013)下册(word版含解析)
文档属性
| 名称 | 9.3溶解度-2021-2022学年九年级化学京改版(2013)下册(word版含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 176.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-28 23:23:51 | ||
图片预览




文档简介
9.3溶解度
一、选择题(共16题)
1.测定某温度下某物质的溶解度时所用溶液必须是
A.浓溶液 B.稀溶液
C.饱和溶液 D.不饱和溶液
2.下列有关溶液的说法正确的是( )
A.稀溶液一定是不饱和溶液
B.溶质可以是固体、液体或气体
C.均一、稳定的液体都是溶液
D.一种溶液中溶质只能有一种
3.如图是三种物质的溶解度曲线,分析曲线得到的信息中,错误的是
A.约在64℃时,KCl和Na2SO4的溶解度相等
B.在40℃时,40gKCl固体溶于60g水得到40%的KCl溶液
C.在室温至100℃区间,随温度升高,Na2SO4的溶解度先增大后减小,醋酸钙则相反
D.分离含少量KCl的溶液,采用先蒸发浓缩,后降温结晶的方法
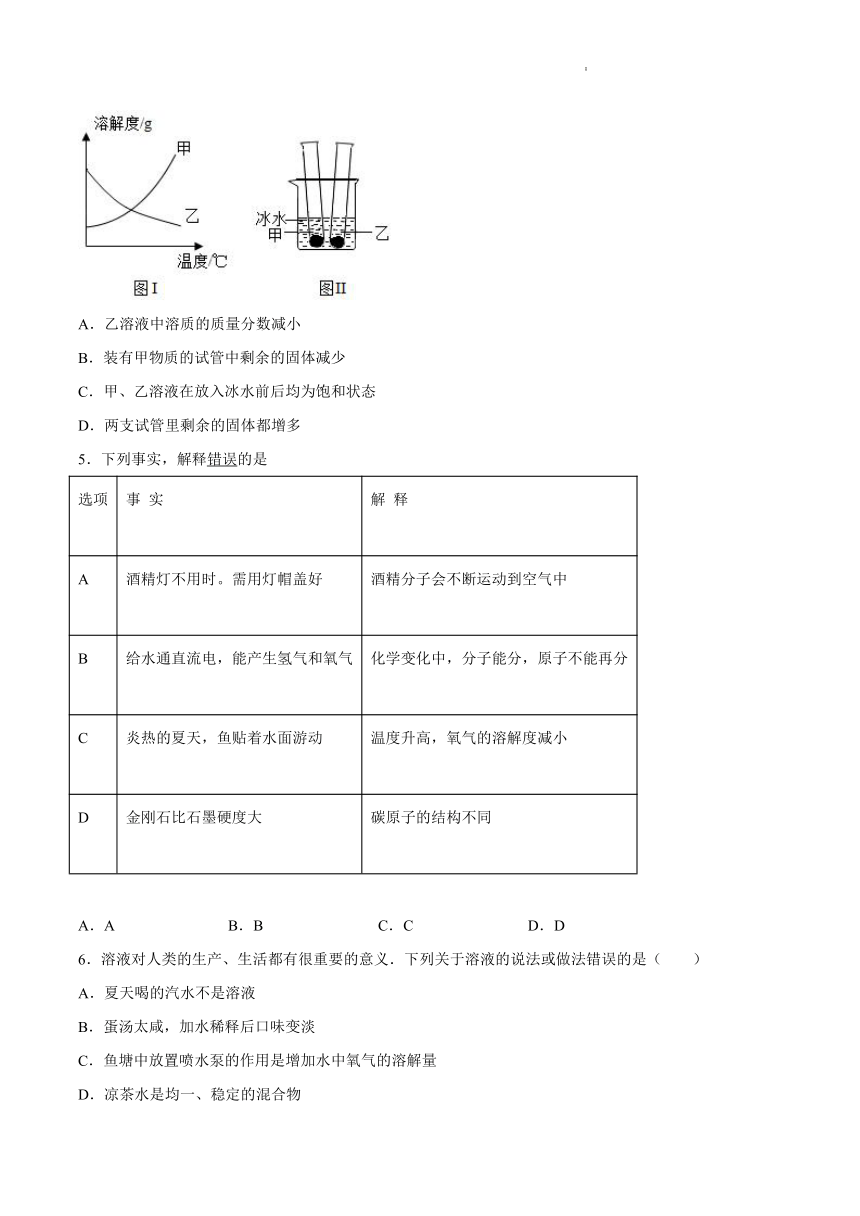
4.甲、乙两种固体物质的溶解度曲线如图I所示。在常温下,先分别向装有适量甲、乙物质的两支试管里加入等量的蒸馏水,充分振荡后,两支试管底部均有未溶解的固体;再将两支试管放进盛有冰水混合物的烧杯里,如图Ⅱ所示。关于该实验,下列说法中正确的是( )
A.乙溶液中溶质的质量分数减小
B.装有甲物质的试管中剩余的固体减少
C.甲、乙溶液在放入冰水前后均为饱和状态
D.两支试管里剩余的固体都增多
5.下列事实,解释错误的是
选项 事 实 解 释
A 酒精灯不用时。需用灯帽盖好 酒精分子会不断运动到空气中
B 给水通直流电,能产生氢气和氧气 化学变化中,分子能分,原子不能再分
C 炎热的夏天,鱼贴着水面游动 温度升高,氧气的溶解度减小
D 金刚石比石墨硬度大 碳原子的结构不同
A.A B.B C.C D.D
6.溶液对人类的生产、生活都有很重要的意义.下列关于溶液的说法或做法错误的是( )
A.夏天喝的汽水不是溶液
B.蛋汤太咸,加水稀释后口味变淡
C.鱼塘中放置喷水泵的作用是增加水中氧气的溶解量
D.凉茶水是均一、稳定的混合物
7.如图是甲、乙、丙三种固体物质的溶解度曲线,下列叙述正确的是
A.甲乙丙三种物质的溶解度都随温度的升高而增大
B.t2℃时,甲、丙两种物质的溶液中溶质的质量分数相等
C.t2℃时,30g甲物质放入50g水中得到75g溶液
D.t3℃的甲、乙、丙的饱和溶液分别降温至t2℃,析出晶体的质量甲>乙>丙
8.下图为甲、乙两种固体物质(不考虑结晶水)的溶解度曲线。下列说法错误的是
A.甲、乙的溶解度都随温度的升高而增大
B.20℃时,甲、乙饱和溶液的质量分数相等
C.20℃时,可用质量分数为25%的甲溶液配制10%的甲溶液
D.50℃时,甲和乙各30g分别加入100g水中,充分溶解后同时降温,则乙溶液先成为饱和溶液。
9.如图为a、b、c三种固体物质的溶解度曲线,下列说法中正确的是
A.将t2℃的a、b、c的饱和溶液降温到t1℃,溶液中溶质质量分数的关系是b>a=c
B.t1℃时,将20gc加入50g水中充分溶解,得到70g饱和溶液
C.t2℃时,a溶液的溶质质量分数一定大于b溶液的溶质质量分数
D.t1℃时,分别将11g的a、b、c溶于50g的水中,所得溶液的溶质质量分数最大的是b
10.20℃时,向一盛有40g氯化钠的烧杯内加入100g水,充分搅拌后静置,烧杯底部仍有未溶解的氯化钠,过滤得到4g固体和澄清溶液。下列有关叙述错误的是
A.该溶液中溶质的质量等于36g
B.20℃时氯化钠在水中的溶解度为36g
C.加水后该澄清溶液会变为不饱和溶液
D.该澄清溶液中溶质的质量分数等于36%
11.下图是甲、乙、丙三种固体物质的溶解度曲线。下列说法错误是
A.t1℃时,甲、丙两种物质的饱和溶液溶质质量分数相同
B.t2℃时,30g甲加入到50g水中充分溶解,所得溶液中溶质质量分数为37.5%
C.要从甲物质的饱和溶液中获得晶体甲,可以采用降温的方法
D.将三种物质的饱和溶液从t2℃降温至t1℃,所得溶液中溶质质量分数乙﹥甲﹥丙
12.如图为氯化铵和硫酸钠的溶解度曲线。下列说法错误的是
A.氯化铵的溶解度随温度的升高而增大
B.30℃时,氯化铵、硫酸钠的溶解度相同
C.40℃时硫酸钠饱和溶液溶质的质量分数约为33.3%
D.将50℃时硫酸钠的饱和溶液降低温度,始终有晶体析出
13.如图为A、B两种不带结晶水的固体物质溶解度曲线,下列说法不正确的是
A.30℃时,A物质的溶解度为20g
B.20℃时,A和B的溶解度相同
C.10℃时,等质量的A和B饱和溶液中,B的溶剂最少
D.等质量的A和B的饱和溶液从30℃降到20℃时,B析出的晶体最多
14.下图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列有关说法正确的是( )
A.t2℃时,在两个各盛有100g水的烧杯中,分别加入50g的甲、乙两种固体,充分搅拌,所得甲、乙溶液中溶质的质量不等
B.t1℃时,等质量甲、乙溶液中所含溶剂的质量甲等于乙
C.乙中含有少量甲,可以用冷却热饱和溶液的方法提纯甲
D.t2℃时,将甲、乙的饱和溶液降温至t1℃,甲溶液析出晶体的质量大于乙
15.甲、乙两支试管中各盛有10.0g水,向试管中分别加入3.0gKNO3和3.0gNaC1固体,按图1进行实验,两种物质的溶解度曲线如图2所示,下列说法中正确的是
A.甲中加入的固体是KNO3
B.0℃时,甲中溶液可能饱和,乙中溶液一定饱和
C.40℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量大于乙中加入对应的溶质质量
D.KNO3中含有少量NaC1杂质,可用冷却KNO3热饱和溶液的方法提纯
16.盐场晒盐后所得的卤水中含有MgCl2,KCl和MgSO4等物质,它们的溶解度曲线如图所示,下列说法正确的是
A.t1℃时,KCl和MgSO4两饱和溶液所含溶质质量一定相等
B.t2℃时,MgSO4的饱和溶液升高温度和降低温度都能析出晶体
C.t3℃时,100gMgCl2的饱和溶液中含有agMgCl2
D.将t3℃时的KCl溶液降温到t1℃,溶液的溶质质量分数变小
二、综合题(共6题)
17.如图所示是氢氧化钠的溶解度曲线,请回答下列问题:
(1)t℃时氢氧化钠饱和溶液的溶质质量分数是 _______
(2)室温为20℃时,小芳同学向100g20℃的水中加入150g氢氧化钠,发现氢氧化钠全部溶解,于是对此曲线的准确性提出了质疑,其理由是_______小明同学经过认真分析后对出现上述现象的原因作出了合理的解释,你认为出现这种现象的原因是_______
(3)他们想继续测定室温(20℃)时氢氧化钠的溶解度,小芳提出:将(2)中所得溶液冷却到20℃、过滤、干燥、称量固体质量为m1g,由此得出室温(20℃)时氢氧化钠的溶解度为_______g。
交流与反思:
(4)经讨论他们发现上述方案从操作的角度看,是因为_______使固体质量m1偏大,从而会使测定结果偏_______。
(5)最后一致同意按如下方案进行实验:
①将(2)中所得溶液冷却到20℃后,取溶液20.9g,向其中慢慢滴加MgCl2溶液至氢氧化钠完全反应(MgCl2+2NaOH=2NaCl+Mg(OH)2↓),表明氢氧化钠也完全反应的现象是_______
②过滤、洗涤、干燥、称量得固体质量为m2g,从而计算出室温(20℃)时氢氧化钠的溶解度,若室温(20℃)时氢氧化钠的溶解度确实为109g,则m2=____g
18.(1)回答有关燃料的问题:
①三大矿物燃料包括:煤、石油和___;
②天然气的主要成分甲烷完全燃烧的化学方程式是_______。
③燃烧发电时,将煤块粉碎成煤粉,目的是_______,使燃料充分燃烧;化石燃料燃烧都会产生温室气体二氧化碳,科学家致力于研究将过多的二氧化碳和氢气在催化剂和加热的条件下反应,生成水和甲烷。该反应化学方程式为______。
(2)如图是甲、乙、丙三种物质的溶解度曲线。请根据图中信息回答下列问题:
①甲、乙两种物质在_____℃时溶解度相等;
②t3℃时,把30克甲充分溶解在50克水中,所得溶液质量是_____g。
③t3℃时,甲、乙、丙三种物质的等质量饱和溶液中,所含溶剂质量最多的是_____。
④若甲中混有少量乙,要得到纯净的甲,常用的提纯方法是_____。
19.水和溶液与我们的生活息息相关。
(1)将厨房中的下列物质:胡椒、花生油、面粉、白糖分别放入水中,能形成溶液的是_____。
(2)消毒液碘酒中的溶剂是_____(写名称)。
(3)甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题:
①在t2°C时,甲的溶解度为_____,把30g甲溶解在50g水中得到溶液的质量为_____克。
②把N点甲的溶液转化为M点溶液的方法(写一种)_____。
③将甲、乙、丙三种物质的饱和溶液从t3°C降到t2°C,溶质质量分数由大到小的顺序是_____。
④要配制等质量t3°C的甲、乙、丙三种物质的饱和溶液,所需水的质量最多是_____。配制过程中若量取水时仰视读数,则会造成所配溶液的溶质质量分数_____。(“偏大”或“偏小”)
20.水和以水为溶剂制成的溶液,与人们的生活有着密切的关系.
(1)生理盐水中的溶剂是 _____ .
(2)市售的一种罐装饮料,在饮料罐的夹层中分别装入一种固体物质和水,饮用前摇动饮料罐使它们混合,饮料温度就会降低,这种固体物质可能是 _____ (填字母).
A 烧碱 B 食盐 C 硝酸铵 D 生石灰
(3)如图为a、b两种固体物质的溶解度曲线,请依据曲线图得出三条相关信息:
①在t3℃时,100g水中最多能够溶解a物质的质量是 _____ ;
②在 _____ ℃时,a物质的饱和溶液和b物质的饱和溶液中,溶质的质量分数相等.
③通过观察与思考,你还能得出的一条信息是 _____ (信息中要求包含两种物质)
(4)现有一瓶浓硫酸,标签如图所示.欲将该瓶浓硫酸完全稀释成20%的稀硫酸,需要水的质量是 _____ g.
21.20℃时,将等质量的甲、乙两种固体分别放入盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两物质的溶解度曲线如图3.请结合图示回答下列问题:
(1)p点表示30℃时甲、乙两物质的溶解度____________。
(2)图3中N表示的是 ______物质的溶解度曲线。
(3)图1中甲一定是__________溶液,乙__________是不饱和溶液。
22.溶解度与速度、密度一样,都是控制某变量,度量另一变量,以表达事物固有属性。
(1)20℃时NaCl的溶解度为36g,其含义是_______。
(2)影响固体溶解度大小的因素有 (填字母,下同)。
A.温度 B.压强 C.溶质、溶剂的种类
D.搅拌 E.颗粒大小 F.溶质、溶剂的质量
(3)影响固体物质溶解速度快慢的因素有 。
A.温度 B.搅拌 C.颗粒大小 D.振荡
(4)不同温度下,O2的溶解度随压强的变化如图所示,图中t1对应的温度为40℃,则t2对应的温度 。
A.大于40℃ B.小于40% C.无法确定
(5)某学生在教师的指导下完成KNO3溶解度的测定实验。
步骤1:分别准确称取3.5g、1.5g、2.0gKNO3.加入药品后发现托盘天平指针偏向右边,则接下来的操作是________。
A.添加KNO3直至天平平衡 B.取出KNO3直至天平平衡
C.改变砝码、游码,直至天平平衡 D.重新调节平衡螺母至天平平衡
步骤2:将3.5gKNO3放入大试管中,并用量筒量取10.0mL蒸馏水于试管内。注意量筒必须放平稳,视线要与液体_______保持水平。
步骤3:振荡大试管,发现有固体未溶解,于是用如下图所示方法进行水浴加热,使固体全部溶解,则此加热方法的优点是________。
步骤4:取出大试管,插入温度计,用玻璃棒轻轻搅拌并摩擦试管壁,同时观察温度计的读数。当刚有晶体析出时,立即记下此时的温度T1。
步骤5:此时在大试管中再加入1.5gKNO3,重复步骤3、4,记录温度为T2;
同样方法,再加入2.0gKNO3实验,记录温度为T3.则T3时KNO3的溶解度为_____g。
实验交流与反思:
交流1:判断溶液的饱和状态是溶解度测量的关键点。欲使接近饱和的KNO3溶液变为饱和溶液的三种方法是_______。
交流2:依据学生实验后绘制的下图溶解度曲线,下列说法正确的是_______。
A.NaCl的溶解度小于KNO3的溶解度
B.分别将b℃时,两种物质的饱和溶液降温至a℃,KNO3溶液析出的晶体多
C.在a℃时若配制等质量的两物质的饱和溶液,KNO3所需的水量多
D.从含有少量NaCl的KNO3中提纯KNO3,可采用降温结晶的方法
试卷第1页,共3页
参考答案:
1.C
【详解】
溶解度是在一定温度100克溶剂下达到饱和状态时所溶解的溶质的量。故测定溶解度时溶液是饱和的,浓溶液与稀溶液是相对的时候溶质质量分数的大致表示,与溶解度关系不大。故选C。
2.B
【详解】
A、浓溶液、稀溶液指的是溶液的浓度,通常用溶质的质量分数来表示,饱和溶液和不饱和溶液指的是一定温度下一定量溶剂中溶质还能否继续溶解,因此稀溶液可能是不饱和溶液,也可能是饱和溶液,A选项说法不正确,不符合题意;
B、溶质可以是固体、液体或气体,B选项说法正确,符合题意;
C、均一、稳定的液体可能是溶液,也可能是纯液体,例如蒸馏水等,C选项说法不正确,不符合题意;
D、一种溶液中溶质可能有多种,例如日常生活中喝的一些饮料,D选项说法不正确,不符合题意。故选B。
3.B
【详解】
A、由溶解度曲线可知,约在64℃时,KCl和Na2SO4有相交点,即溶解度相等,正确;B、在40℃时,氯化钾的溶解度为40g,即该温度时,100g水中溶解度40g氯化钾固体前后形成饱和溶液,那么60g水中最多溶解24g,溶质的质量分数= =28.6%,错误;C、由溶解度曲线可知,在室温至100℃区间,随温度升高,Na2SO4的溶解度先增大后减小,醋酸钙则相反,正确;D、氯化钾的溶解度随温度的变化变化较大,分离含少量KCl的溶液,采用先蒸发浓缩使其变成饱和溶液,再采用降温结晶的方法即可分离出氯化钾,正确。故选B。
4.C
【详解】
A.乙物质的溶解度曲线表明,温度降低物质的溶解度变大,所以放入冰水后,随温度降低乙物质的溶解度变大,试管底部固体物质乙继续溶解,溶液的溶质质量分数增大,故A错误;
B.甲物质的溶解度曲线表明,温度降低物质的溶解度减小,所以放入冰水后,随温度降低甲物质的溶解度变小,试管内饱和溶液析出晶体,底部固体物质甲增加,故B错误;
C.甲、乙溶液在放入冰水前后均有未溶解的固体,所以均为饱和状态,故C正确;
D.综合以上A、B两项的分析可得,盛甲物质的试管内固体物质增加,而盛乙物质的试管内固体物质减少,故D错误。
故选C。
5.D
【详解】
试题分析∶A.酒精灯不用时,需用灯帽盖好,防止酒精分子会不断运动到空气中。故A正确。B.给水通直流电,能产生氢气和氧气。可以说化学变化中,分子能分,原子不能再分。故B正确。C.炎热的夏天,鱼贴着水面游动。温度升高,氧气的溶解度减少。故C正确。D.金刚石比石墨硬度大,主要是碳原子的排列方式不同。故D错误。
6.A
【详解】
试题分析:A、汽水是一种均一、稳定的混合物,属于溶液,故A说法错误;
B、蛋汤太咸,加水稀释后,汤的浓度小了,变稀了,口味变淡,故B说法正确;
C、鱼塘中放置喷水泵是为了增大水与空气的接触面积,增加水中氧气的溶解量,故C说法正确;
D、凉茶水是均一、稳定的混合物属于溶液,故D说法正确.
故选A.
7.C
【详解】
A、由溶解度曲线可知,丙物质的溶解度随温度升高而减小,说法错误;
B、t2℃时,甲和丙的溶解度相等,甲、丙两种物质的饱和溶液中溶质的质量分数相等,但本题没说溶液是否饱和,溶质质量分数不一定相等,说法错误;
C、t2℃时,甲的溶解度为50g,30g甲物质放入50g水中,25g甲溶解,得到75g溶液,说法正确;
D、饱和溶液的溶质质量分数大小与溶解度有关,溶解度大,溶质质量分数就大,所以t3℃时,甲、乙、丙饱和溶液中溶质质量分数大小是:甲>乙>丙,降低温度到t2℃时,甲和乙的溶解度都变小,都会析出晶体,所以降温后谁的溶解度大,谁的溶质质量分数就大,所以降温后甲和乙的溶质质量分数大小是:乙>甲,降温后,丙物质的溶解度增大,由饱和变为不饱和,丙物质的溶质质量分数不变,又因为t2℃时甲的溶解度大于t3℃时丙的溶解度,所以分别将t3℃时三种物质的饱和溶液降温至t2℃,所得溶液溶质质量分数的大小关系为乙>甲>丙,说法错误。
故选:C。
8.C
【详解】
A、甲、乙的溶解度都随温度的升高而增大,不符合题意;
B、饱和溶液溶质的质量分数=×100%,通过分析溶解度曲线可知,20℃时,甲、乙具有相同的溶解度,即具有相同的质量分数,不符合题意;
C、20℃时,甲物质的溶解度是25g,所以饱和溶液的质量分数为:×100%=20%,所以没有25%的甲溶液,故不能用质量分数为25%的甲溶液配制溶质10%的甲溶液,符合题意;
D、50℃时,甲物质的溶解度大于乙物质的溶解度,所以甲和乙各30g分别加入100g水中,充分溶解后同时等速降温,则乙溶液先成为饱和溶液,不符合题意。故选C。
9.D
【详解】
A、将t2℃时a、b、c三种物质的饱和溶液降温到t1℃时,a、b的溶解度减小,c的溶解度随温度的降低而增大,a、b有晶体析出,质量分数变小溶液仍为饱和溶液,c没有晶体析出,质量分数不变,一定温度下饱和溶液的溶质质量分数=,溶解度越大,质量分数越大,t1℃时b的溶解度大于a的溶解度大于t2℃时c的溶解度,所以将t2℃的a、b、c的饱和溶液降温到t1℃,溶液中溶质质量分数的关系是b>a>c,错误。
B、t1°C时,c的溶解度为20g,100g水最多溶解20gc。即50g水最多溶解10gc。所以将20gc加入50g水中充分溶解,得到60克饱和溶液,错误。
C、未告知溶液是否为饱和溶液,无法判断溶液的溶质质量分数,错误。
D、t1℃时100g水中最多溶解20ga、c。可以溶解b的质量多于20g。即50g水中最多溶解10ga、c。可以溶解b的质量大于10g。所以所得溶液的溶质质量分数最大的是b。正确。
故选D。
10.D
【详解】
A、在20℃时,将40g氯化钠加入水中,充分溶解后过滤出4g固体,并得到澄清溶液,过滤出4g固体说明有4g氯化钠没有溶解,而溶解了36g氯化钠,则该溶液已经是饱和溶液,且溶质质量为36g,故A正确;
B、由于已经达到饱和状态,说明在20℃时,氯化钠在水中溶解度为36g,故B正确;
C、该溶液达到了饱和状态,加入水后则溶质质量不变,溶剂质量增加,即变为不饱和溶液,故C正确;
D、溶质质量分数计算公式为:,则该澄清溶液中的溶质质量分数为: ,故D错误。
故选D
11.B
【详解】
根据溶解度曲线可知A选项t1℃时,甲、丙两种物质的饱和溶液溶质质量分数相同,是正确的叙述;B选项是错误的叙述,在t2℃时,30g甲加入到50g水中充分溶解,但只能溶解25g,所得溶液的溶质质量分数为33.3%;C选项是正确的叙述,因为甲物质的溶解度受温度的影响较大;D选项根据溶解度的变化趋势可知,将三种物质的饱和溶液从t2℃降温至t1℃,所得溶液中溶质质量分数乙﹥甲﹥丙,是正确的叙述;故答案选择B
12.D
【详解】
由溶解度曲线图可知,溶解度曲线的相交点表示在此温度下两物质的溶解度相等.可以看出氯化铵的溶解度随温度的改变的变化趋势;由40℃,硫酸钠的溶解度,可以计算饱和溶液中溶质的质量分数;由硫酸钠的溶解度随温度的变化趋势可以判断50℃时硫酸钠的饱和溶液降低温度时,有无晶体析出.
解答:解:A、由溶解度曲线图可知:氯化铵的溶解度随温度的升高而增大.
B、30℃时氯化铵、硫酸钠的溶解度曲线交于一点,故它们的溶解度相同.
C、40℃,硫酸钠的溶解度为50g,它的饱和溶液中溶质的质量分数为×100%=33.3%.
D、将50℃时降温至40℃时,硫酸钠的溶解度随着温度的降低而增大,没有晶体析出.该选项说法不正确.
故选D.
13.D
【详解】
由溶解度曲线可知,A、B正确;10℃时,两物质的溶解度B大于A,故10℃时AB两种物质等质量的两种饱和溶液中,B物质的饱和溶液含有的溶质多,含有的溶剂少,C正确;由于A物质的溶解度受温度的影响比B大,故等质量的A、B的饱和溶液从30℃降温到20℃时,A析出的晶体最多,D不正确。
14.A
【详解】
试题分析:A、从溶解度曲线可看出,t2℃时,甲的溶解度=50g,而乙的溶解度<50g,故在两个各盛有l00g水的烧杯中,分别加入50g的甲、乙两种固体,充分搅拌,甲能全部溶解,而乙有剩余,故所得甲、乙溶液中溶质的质量不等,正确,B、t1℃时,甲、乙物质的溶解度相等,但没有指明是饱和溶液,故等质量甲、乙溶液中所含溶剂的质量甲不一定等于乙,错误, C、从溶解度曲线可看出,甲的溶解度随温度的升高变化较大,而乙的溶解度随温度的升高而变化较小,故乙中含有少量甲,可以用冷却热饱和溶液的方法提纯乙,错误,D、没有指明高温时的溶液是否是等质量,故无法判断析出晶体量的多少,错误,故选A
15.D
【详解】
A、甲中加入的固体是NaC1,此选项错误;
B、由溶解度曲线可知,0℃时,氯化钠的溶解度是35.7g,则10.0g水最多能溶解3.57g氯化钠,所以甲溶液是不饱和溶液,由于乙中有固体物质,乙溶液一定是饱和溶液,此选项错误;
C、40℃时,硝酸钾的溶解度大于氯化钠的溶解度,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量小于乙中加入对应的溶质质量,此选项错误;
D、KNO3的溶解度受温度影响较大,对于溶解度受温度影响较大的物质,一般采用冷却热饱和溶液的方法提纯,所以KNO3中含有少量NaC1杂质,可用冷却KNO3热饱和溶液的方法提纯,此选项正确。
故选D。
16.B
【详解】
A. t1℃时,质量不相等的KCl和MgSO4两饱和溶液所含溶质质量不相等,错误;B. t2℃时,MgSO4的饱和溶液升高温度和降低温度溶解度都变小,故都能析出晶体,正确;C. t3℃时,(100+a)gMgCl2的饱和溶液中含有agMgCl2 ,错误;D. 将t3℃时的KCl的饱和溶液溶液降温到t1℃,溶液的溶质质量分数变小,错误。故选B。
17. 37.5% 20℃时氢氧化钠溶解度为109g,100g20℃的水中最多可溶解氢氧化钠的质量为109g 氢氧化钠溶于水放热,使水温升高,氢氧化钠溶解度增大,使氢氧化钠全部溶解 (150- m1) 过滤所得的氢氧化钠固体附带氢氧化钠溶液 小 不再产生白色沉淀 7.9
【详解】
(1)t℃时氢氧化钠的溶解度是60g,所以氢氧化钠饱和溶液的溶质质量分数是 。
(2)室温为20℃时,小芳同学向100g20℃的水中加入150g氢氧化钠,发现氢氧化钠全部溶解,于是对此曲线的准确性提出了质疑,其理由是20℃时氢氧化钠溶解度为109g,100g20℃的水中最多可溶解氢氧化钠的质量为109g,小明同学经过认真分析后对出现上述现象的原因作出了合理的解释,出现这种现象的原因是氢氧化钠溶于水放热,使水温升高,氢氧化钠溶解度增大,使氢氧化钠全部溶解。
(3)他们想继续测定室温(20℃)时氢氧化钠的溶解度,小芳提出:将(2)中所得溶液冷却到20℃、过滤、干燥、称量固体质量为m1g,由此得出室温(20℃)时氢氧化钠的溶解度为(150- m1)g。
交流与反思:
(4)经讨论他们发现上述方案从操作的角度看,是因为过滤所得的氢氧化钠固体附带氢氧化钠溶液,使固体质量m1偏大,从而会使测定结果偏小。
(5)①将(2)中所得溶液冷却到20℃后,取溶液20.9g,向其中慢慢滴加MgCl2溶液至氢氧化钠 (MgCl2+2NaOH=2NaCl+Mg(OH)2↓),表明氢氧化钠也完全反应的现象是不再产生白色沉淀。
②过滤、洗涤、干燥、称量得固体质量为m2g,从而计算出室温(20℃)时氢氧化钠的溶解度,若室温(20℃)时氢氧化钠的溶解度确实为109g,20.9g氢氧化钠饱和溶液中溶质质量为,则
解得m2=7.9g。
18. 天然气 CH4+2O2CO2+2H2O 增大与氧气的接触面积 CO2+4H22H2O+CH4 t2 75 丙 冷却热饱和溶液
【详解】
(1)①三大矿物燃料包括:煤、石油和天然气,故填:天然气。
②甲烷完全燃烧生成二氧化碳和水,化学方程式为CH4+2O2CO2+2H2O,故填:CH4+2O2CO2+2H2O。
③燃烧发电时,将煤块粉碎成煤粉,目的是增大与氧气的接触面积,二氧化碳和氢气在催化剂和加热的条件下反应,生成水和甲烷化学方程式为CO2+4H22H2O+CH4,故填:增大与氧气的接触面积;CO2+4H22H2O+CH4。
(2)①在t2°C 时,甲与丙的溶解度曲线交于一点,表示该温度下二者的溶解度相等。
②在t3°C 时甲的溶解度是50g,即100g水中最多溶解50g的甲,所以把30g甲溶解于50g水中最多溶解25g,得到75g溶液。
③t3℃时,有甲、乙、丙三种物质的等质量饱和溶液,由于此温度下溶解度甲>乙>丙,该温度下的饱和溶液的溶质的质量分数甲>乙>丙,所以溶质的质量甲>乙>丙。溶液的质量=溶质的质量+溶剂的质量,因为此时溶液的质量相等,所以溶剂的质量应为:丙>乙>甲。
④由甲、乙物质的溶解度曲线可以知道,甲物质的溶解度随温度的升高而明显增大,乙物质的溶解度随温度的升高变化不大,所以若在混有少量乙的甲中提纯甲,应采用冷却热饱和溶液的方法。
19. 白糖 酒精 30g 65 添加溶质 乙大于甲大于丙 丙 偏小
【详解】
(1)溶液是一种或几种物质分散到另一种物质里形成的均一、稳定的混合物。胡椒不溶于水、花生油不溶于水、面粉不溶于水、白糖可溶于水,故能形成溶液的是白糖;
(2)溶质:被溶解的物质,溶剂:能溶解其他物质的物质。消毒液碘酒中被溶解的是碘,溶解其他物质的是酒精,故溶剂是酒精;
(3)
①由图知,在t2°C时,甲的溶解度为30g,即100g水中可以溶解30g甲,在50g水中只能溶解15g甲,得到溶液的质量=溶剂的质量+溶液的质量=50g+15g=65g,为65克。
②在t3°C时,N点位于甲的溶解度曲线下方,属于不饱和溶液,M点位于甲的溶解度曲线上,属于饱和溶液,故把N点甲的溶液转化为M点溶液的方法为可以增加溶质;
③一定温度下饱和溶液的溶质质量分数=,溶解度越大,溶质的质量分数越大,将甲、乙、丙三种物质的饱和溶液从t3°C降到t2°C,甲、乙的溶解度减小,溶质析出,但仍为饱和溶液,此时乙的溶解度大于甲,溶质的质量分数乙大于甲;丙的溶解度增大,没有晶体析出,溶质质量分数不变,故由大到小的顺序是乙大于甲大于丙。
④要配制等质量t3°C的甲、乙、丙三种物质的饱和溶液,溶解度越小所需要的水越多,溶解度:甲大于乙大于丙,故所需水的质量最多是丙。配制过程中若量取水时仰视读数,则所量取的水体积偏大,则会造成所配溶液的溶质质量分数偏小。
20. 水 C 60 t2 a、b两种固体物质的溶解度都随温度的升高而增大 3510
【分析】
根据固体的溶解度曲线可以:①查出某物质在某温度下的溶解度,②比较不同物质在同一温度下的溶解度大小,从而确定在同温度下的饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况等;浓溶液加水稀释的过程中,溶质的质量不变。
【详解】
(1)生理盐水即氯化钠的水溶液,溶质是氯化钠,溶剂是水,故答案为水
(2)初中阶段常见的物质中,溶于水能够使温度升高的物质有:生石灰、氢氧化钠、浓硫酸,能够使温度降低的有硝酸铵,故答案为C
(3)①在t3℃时,a的溶解度是60g,即在100g水中最多溶解60g该物质,故答案为60
②在某温度下,两物质的饱和溶液中溶质的质量分数相等,说明该温度下,两物质的溶解度相等,故答案为t2
③根据两物质的溶解度曲线不难看出,在t1℃,b的溶解度大于a的溶解度;a和b的溶解度都随温度的升高而增大,故答案为a、b两种固体物质的溶解度都随温度的升高而增大
(4)由于在稀释的过程中溶质的质量不变,加水的质量则为稀浓溶液质量之差,因此加水的质量为,故答案为3510
21. 相等 乙 饱和 不一定
【详解】
(1)p点表示30℃时甲、乙两物质的溶解度相等。
(2)20℃时,将等质量的甲、乙两种固体分别放入盛有100g水的烧杯中,甲物部分溶解,乙物质全部溶解,20℃时乙物质的溶解度大于甲物质,所以图3中N表示的是乙物质的溶解度曲线。
(3)图1中甲固体有剩余,一定是饱和溶液,乙固体全部溶解,不一定是不饱和溶液。
22.(1)20℃时,在100g水中溶解36gNaCl形成饱和溶液
(2)AC
(3)ABCD
(4)A
(5) A 凹液面最低处 温度可控、受热均匀 70 加入溶质硝酸钾、蒸发水、降低温度 CD
【解析】
(1)
20℃时NaCl的溶解度为36g,其含义是20℃时,在100g水中溶解36gNaCl形成饱和溶液。
(2)
影响固体溶解度大小的因素有溶质种类、溶剂种类、温度,压强几乎不影响固体溶解度,搅拌、颗粒大小、溶质、溶剂质量都不会影响溶解度;
故选AC。
(3)
A. 温度升高,微粒运动加快,可以加快物质溶解,正确;
B. 搅拌可以加快物质溶解,正确;
C. 颗粒越小,与溶剂接触面积越大,溶解越快,正确;
D. 振荡可以加速物质溶解,正确。
故选ABCD。
(4)
气体溶解度随温度升高而减小,随压强增大而增大;图中t1对应的温度为40℃,同压强下t2对应的溶解度更小,故温度大于40℃;
故选A。
(5)
步骤1:称取一定质量药品,发现托盘天平指针偏向右边,说明药品质量偏小,则接下来的操作是添加KNO3直至天平平衡;
故选A。
步骤2:量筒必须放平稳,视线要与液体凹液面最低处保持水平。
步骤3:水浴加热,使固体全部溶解,则此加热方法的优点是温度可控、受热均匀。
步骤5:由题意可知,水的质量为10mL,则水的质量为10g;T3时溶解溶质质量为3.5+1.5+2.0=7.0g,则T3时KNO3的溶解度为。
实验交流与反思:
交流1:欲使接近饱和的KNO3溶液变为饱和溶液的三种方法是加入溶质硝酸钾、蒸发水、降低温度。
交流2:
A.没有指明具体温度,不能判断NaCl的溶解度小于KNO3的溶解度,错误;
B.没有确定两种物质溶液质量大小,不能判断将b℃时两种物质的饱和溶液降温至a℃时KNO3溶液析出的晶体的多少,错误;
C.在a℃时,氯化钠溶解度大于硝酸钾,若配制等质量的两物质的饱和溶液,则硝酸钾所需的水量多,正确;
D.硝酸钾溶解度受温度影响较大,从含有少量NaCl的KNO3中提纯KNO3,可采用降温结晶的方法,正确。
故选CD。
答案第1页,共2页
一、选择题(共16题)
1.测定某温度下某物质的溶解度时所用溶液必须是
A.浓溶液 B.稀溶液
C.饱和溶液 D.不饱和溶液
2.下列有关溶液的说法正确的是( )
A.稀溶液一定是不饱和溶液
B.溶质可以是固体、液体或气体
C.均一、稳定的液体都是溶液
D.一种溶液中溶质只能有一种
3.如图是三种物质的溶解度曲线,分析曲线得到的信息中,错误的是
A.约在64℃时,KCl和Na2SO4的溶解度相等
B.在40℃时,40gKCl固体溶于60g水得到40%的KCl溶液
C.在室温至100℃区间,随温度升高,Na2SO4的溶解度先增大后减小,醋酸钙则相反
D.分离含少量KCl的溶液,采用先蒸发浓缩,后降温结晶的方法
4.甲、乙两种固体物质的溶解度曲线如图I所示。在常温下,先分别向装有适量甲、乙物质的两支试管里加入等量的蒸馏水,充分振荡后,两支试管底部均有未溶解的固体;再将两支试管放进盛有冰水混合物的烧杯里,如图Ⅱ所示。关于该实验,下列说法中正确的是( )
A.乙溶液中溶质的质量分数减小
B.装有甲物质的试管中剩余的固体减少
C.甲、乙溶液在放入冰水前后均为饱和状态
D.两支试管里剩余的固体都增多
5.下列事实,解释错误的是
选项 事 实 解 释
A 酒精灯不用时。需用灯帽盖好 酒精分子会不断运动到空气中
B 给水通直流电,能产生氢气和氧气 化学变化中,分子能分,原子不能再分
C 炎热的夏天,鱼贴着水面游动 温度升高,氧气的溶解度减小
D 金刚石比石墨硬度大 碳原子的结构不同
A.A B.B C.C D.D
6.溶液对人类的生产、生活都有很重要的意义.下列关于溶液的说法或做法错误的是( )
A.夏天喝的汽水不是溶液
B.蛋汤太咸,加水稀释后口味变淡
C.鱼塘中放置喷水泵的作用是增加水中氧气的溶解量
D.凉茶水是均一、稳定的混合物
7.如图是甲、乙、丙三种固体物质的溶解度曲线,下列叙述正确的是
A.甲乙丙三种物质的溶解度都随温度的升高而增大
B.t2℃时,甲、丙两种物质的溶液中溶质的质量分数相等
C.t2℃时,30g甲物质放入50g水中得到75g溶液
D.t3℃的甲、乙、丙的饱和溶液分别降温至t2℃,析出晶体的质量甲>乙>丙
8.下图为甲、乙两种固体物质(不考虑结晶水)的溶解度曲线。下列说法错误的是
A.甲、乙的溶解度都随温度的升高而增大
B.20℃时,甲、乙饱和溶液的质量分数相等
C.20℃时,可用质量分数为25%的甲溶液配制10%的甲溶液
D.50℃时,甲和乙各30g分别加入100g水中,充分溶解后同时降温,则乙溶液先成为饱和溶液。
9.如图为a、b、c三种固体物质的溶解度曲线,下列说法中正确的是
A.将t2℃的a、b、c的饱和溶液降温到t1℃,溶液中溶质质量分数的关系是b>a=c
B.t1℃时,将20gc加入50g水中充分溶解,得到70g饱和溶液
C.t2℃时,a溶液的溶质质量分数一定大于b溶液的溶质质量分数
D.t1℃时,分别将11g的a、b、c溶于50g的水中,所得溶液的溶质质量分数最大的是b
10.20℃时,向一盛有40g氯化钠的烧杯内加入100g水,充分搅拌后静置,烧杯底部仍有未溶解的氯化钠,过滤得到4g固体和澄清溶液。下列有关叙述错误的是
A.该溶液中溶质的质量等于36g
B.20℃时氯化钠在水中的溶解度为36g
C.加水后该澄清溶液会变为不饱和溶液
D.该澄清溶液中溶质的质量分数等于36%
11.下图是甲、乙、丙三种固体物质的溶解度曲线。下列说法错误是
A.t1℃时,甲、丙两种物质的饱和溶液溶质质量分数相同
B.t2℃时,30g甲加入到50g水中充分溶解,所得溶液中溶质质量分数为37.5%
C.要从甲物质的饱和溶液中获得晶体甲,可以采用降温的方法
D.将三种物质的饱和溶液从t2℃降温至t1℃,所得溶液中溶质质量分数乙﹥甲﹥丙
12.如图为氯化铵和硫酸钠的溶解度曲线。下列说法错误的是
A.氯化铵的溶解度随温度的升高而增大
B.30℃时,氯化铵、硫酸钠的溶解度相同
C.40℃时硫酸钠饱和溶液溶质的质量分数约为33.3%
D.将50℃时硫酸钠的饱和溶液降低温度,始终有晶体析出
13.如图为A、B两种不带结晶水的固体物质溶解度曲线,下列说法不正确的是
A.30℃时,A物质的溶解度为20g
B.20℃时,A和B的溶解度相同
C.10℃时,等质量的A和B饱和溶液中,B的溶剂最少
D.等质量的A和B的饱和溶液从30℃降到20℃时,B析出的晶体最多
14.下图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列有关说法正确的是( )
A.t2℃时,在两个各盛有100g水的烧杯中,分别加入50g的甲、乙两种固体,充分搅拌,所得甲、乙溶液中溶质的质量不等
B.t1℃时,等质量甲、乙溶液中所含溶剂的质量甲等于乙
C.乙中含有少量甲,可以用冷却热饱和溶液的方法提纯甲
D.t2℃时,将甲、乙的饱和溶液降温至t1℃,甲溶液析出晶体的质量大于乙
15.甲、乙两支试管中各盛有10.0g水,向试管中分别加入3.0gKNO3和3.0gNaC1固体,按图1进行实验,两种物质的溶解度曲线如图2所示,下列说法中正确的是
A.甲中加入的固体是KNO3
B.0℃时,甲中溶液可能饱和,乙中溶液一定饱和
C.40℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量大于乙中加入对应的溶质质量
D.KNO3中含有少量NaC1杂质,可用冷却KNO3热饱和溶液的方法提纯
16.盐场晒盐后所得的卤水中含有MgCl2,KCl和MgSO4等物质,它们的溶解度曲线如图所示,下列说法正确的是
A.t1℃时,KCl和MgSO4两饱和溶液所含溶质质量一定相等
B.t2℃时,MgSO4的饱和溶液升高温度和降低温度都能析出晶体
C.t3℃时,100gMgCl2的饱和溶液中含有agMgCl2
D.将t3℃时的KCl溶液降温到t1℃,溶液的溶质质量分数变小
二、综合题(共6题)
17.如图所示是氢氧化钠的溶解度曲线,请回答下列问题:
(1)t℃时氢氧化钠饱和溶液的溶质质量分数是 _______
(2)室温为20℃时,小芳同学向100g20℃的水中加入150g氢氧化钠,发现氢氧化钠全部溶解,于是对此曲线的准确性提出了质疑,其理由是_______小明同学经过认真分析后对出现上述现象的原因作出了合理的解释,你认为出现这种现象的原因是_______
(3)他们想继续测定室温(20℃)时氢氧化钠的溶解度,小芳提出:将(2)中所得溶液冷却到20℃、过滤、干燥、称量固体质量为m1g,由此得出室温(20℃)时氢氧化钠的溶解度为_______g。
交流与反思:
(4)经讨论他们发现上述方案从操作的角度看,是因为_______使固体质量m1偏大,从而会使测定结果偏_______。
(5)最后一致同意按如下方案进行实验:
①将(2)中所得溶液冷却到20℃后,取溶液20.9g,向其中慢慢滴加MgCl2溶液至氢氧化钠完全反应(MgCl2+2NaOH=2NaCl+Mg(OH)2↓),表明氢氧化钠也完全反应的现象是_______
②过滤、洗涤、干燥、称量得固体质量为m2g,从而计算出室温(20℃)时氢氧化钠的溶解度,若室温(20℃)时氢氧化钠的溶解度确实为109g,则m2=____g
18.(1)回答有关燃料的问题:
①三大矿物燃料包括:煤、石油和___;
②天然气的主要成分甲烷完全燃烧的化学方程式是_______。
③燃烧发电时,将煤块粉碎成煤粉,目的是_______,使燃料充分燃烧;化石燃料燃烧都会产生温室气体二氧化碳,科学家致力于研究将过多的二氧化碳和氢气在催化剂和加热的条件下反应,生成水和甲烷。该反应化学方程式为______。
(2)如图是甲、乙、丙三种物质的溶解度曲线。请根据图中信息回答下列问题:
①甲、乙两种物质在_____℃时溶解度相等;
②t3℃时,把30克甲充分溶解在50克水中,所得溶液质量是_____g。
③t3℃时,甲、乙、丙三种物质的等质量饱和溶液中,所含溶剂质量最多的是_____。
④若甲中混有少量乙,要得到纯净的甲,常用的提纯方法是_____。
19.水和溶液与我们的生活息息相关。
(1)将厨房中的下列物质:胡椒、花生油、面粉、白糖分别放入水中,能形成溶液的是_____。
(2)消毒液碘酒中的溶剂是_____(写名称)。
(3)甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题:
①在t2°C时,甲的溶解度为_____,把30g甲溶解在50g水中得到溶液的质量为_____克。
②把N点甲的溶液转化为M点溶液的方法(写一种)_____。
③将甲、乙、丙三种物质的饱和溶液从t3°C降到t2°C,溶质质量分数由大到小的顺序是_____。
④要配制等质量t3°C的甲、乙、丙三种物质的饱和溶液,所需水的质量最多是_____。配制过程中若量取水时仰视读数,则会造成所配溶液的溶质质量分数_____。(“偏大”或“偏小”)
20.水和以水为溶剂制成的溶液,与人们的生活有着密切的关系.
(1)生理盐水中的溶剂是 _____ .
(2)市售的一种罐装饮料,在饮料罐的夹层中分别装入一种固体物质和水,饮用前摇动饮料罐使它们混合,饮料温度就会降低,这种固体物质可能是 _____ (填字母).
A 烧碱 B 食盐 C 硝酸铵 D 生石灰
(3)如图为a、b两种固体物质的溶解度曲线,请依据曲线图得出三条相关信息:
①在t3℃时,100g水中最多能够溶解a物质的质量是 _____ ;
②在 _____ ℃时,a物质的饱和溶液和b物质的饱和溶液中,溶质的质量分数相等.
③通过观察与思考,你还能得出的一条信息是 _____ (信息中要求包含两种物质)
(4)现有一瓶浓硫酸,标签如图所示.欲将该瓶浓硫酸完全稀释成20%的稀硫酸,需要水的质量是 _____ g.
21.20℃时,将等质量的甲、乙两种固体分别放入盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两物质的溶解度曲线如图3.请结合图示回答下列问题:
(1)p点表示30℃时甲、乙两物质的溶解度____________。
(2)图3中N表示的是 ______物质的溶解度曲线。
(3)图1中甲一定是__________溶液,乙__________是不饱和溶液。
22.溶解度与速度、密度一样,都是控制某变量,度量另一变量,以表达事物固有属性。
(1)20℃时NaCl的溶解度为36g,其含义是_______。
(2)影响固体溶解度大小的因素有 (填字母,下同)。
A.温度 B.压强 C.溶质、溶剂的种类
D.搅拌 E.颗粒大小 F.溶质、溶剂的质量
(3)影响固体物质溶解速度快慢的因素有 。
A.温度 B.搅拌 C.颗粒大小 D.振荡
(4)不同温度下,O2的溶解度随压强的变化如图所示,图中t1对应的温度为40℃,则t2对应的温度 。
A.大于40℃ B.小于40% C.无法确定
(5)某学生在教师的指导下完成KNO3溶解度的测定实验。
步骤1:分别准确称取3.5g、1.5g、2.0gKNO3.加入药品后发现托盘天平指针偏向右边,则接下来的操作是________。
A.添加KNO3直至天平平衡 B.取出KNO3直至天平平衡
C.改变砝码、游码,直至天平平衡 D.重新调节平衡螺母至天平平衡
步骤2:将3.5gKNO3放入大试管中,并用量筒量取10.0mL蒸馏水于试管内。注意量筒必须放平稳,视线要与液体_______保持水平。
步骤3:振荡大试管,发现有固体未溶解,于是用如下图所示方法进行水浴加热,使固体全部溶解,则此加热方法的优点是________。
步骤4:取出大试管,插入温度计,用玻璃棒轻轻搅拌并摩擦试管壁,同时观察温度计的读数。当刚有晶体析出时,立即记下此时的温度T1。
步骤5:此时在大试管中再加入1.5gKNO3,重复步骤3、4,记录温度为T2;
同样方法,再加入2.0gKNO3实验,记录温度为T3.则T3时KNO3的溶解度为_____g。
实验交流与反思:
交流1:判断溶液的饱和状态是溶解度测量的关键点。欲使接近饱和的KNO3溶液变为饱和溶液的三种方法是_______。
交流2:依据学生实验后绘制的下图溶解度曲线,下列说法正确的是_______。
A.NaCl的溶解度小于KNO3的溶解度
B.分别将b℃时,两种物质的饱和溶液降温至a℃,KNO3溶液析出的晶体多
C.在a℃时若配制等质量的两物质的饱和溶液,KNO3所需的水量多
D.从含有少量NaCl的KNO3中提纯KNO3,可采用降温结晶的方法
试卷第1页,共3页
参考答案:
1.C
【详解】
溶解度是在一定温度100克溶剂下达到饱和状态时所溶解的溶质的量。故测定溶解度时溶液是饱和的,浓溶液与稀溶液是相对的时候溶质质量分数的大致表示,与溶解度关系不大。故选C。
2.B
【详解】
A、浓溶液、稀溶液指的是溶液的浓度,通常用溶质的质量分数来表示,饱和溶液和不饱和溶液指的是一定温度下一定量溶剂中溶质还能否继续溶解,因此稀溶液可能是不饱和溶液,也可能是饱和溶液,A选项说法不正确,不符合题意;
B、溶质可以是固体、液体或气体,B选项说法正确,符合题意;
C、均一、稳定的液体可能是溶液,也可能是纯液体,例如蒸馏水等,C选项说法不正确,不符合题意;
D、一种溶液中溶质可能有多种,例如日常生活中喝的一些饮料,D选项说法不正确,不符合题意。故选B。
3.B
【详解】
A、由溶解度曲线可知,约在64℃时,KCl和Na2SO4有相交点,即溶解度相等,正确;B、在40℃时,氯化钾的溶解度为40g,即该温度时,100g水中溶解度40g氯化钾固体前后形成饱和溶液,那么60g水中最多溶解24g,溶质的质量分数= =28.6%,错误;C、由溶解度曲线可知,在室温至100℃区间,随温度升高,Na2SO4的溶解度先增大后减小,醋酸钙则相反,正确;D、氯化钾的溶解度随温度的变化变化较大,分离含少量KCl的溶液,采用先蒸发浓缩使其变成饱和溶液,再采用降温结晶的方法即可分离出氯化钾,正确。故选B。
4.C
【详解】
A.乙物质的溶解度曲线表明,温度降低物质的溶解度变大,所以放入冰水后,随温度降低乙物质的溶解度变大,试管底部固体物质乙继续溶解,溶液的溶质质量分数增大,故A错误;
B.甲物质的溶解度曲线表明,温度降低物质的溶解度减小,所以放入冰水后,随温度降低甲物质的溶解度变小,试管内饱和溶液析出晶体,底部固体物质甲增加,故B错误;
C.甲、乙溶液在放入冰水前后均有未溶解的固体,所以均为饱和状态,故C正确;
D.综合以上A、B两项的分析可得,盛甲物质的试管内固体物质增加,而盛乙物质的试管内固体物质减少,故D错误。
故选C。
5.D
【详解】
试题分析∶A.酒精灯不用时,需用灯帽盖好,防止酒精分子会不断运动到空气中。故A正确。B.给水通直流电,能产生氢气和氧气。可以说化学变化中,分子能分,原子不能再分。故B正确。C.炎热的夏天,鱼贴着水面游动。温度升高,氧气的溶解度减少。故C正确。D.金刚石比石墨硬度大,主要是碳原子的排列方式不同。故D错误。
6.A
【详解】
试题分析:A、汽水是一种均一、稳定的混合物,属于溶液,故A说法错误;
B、蛋汤太咸,加水稀释后,汤的浓度小了,变稀了,口味变淡,故B说法正确;
C、鱼塘中放置喷水泵是为了增大水与空气的接触面积,增加水中氧气的溶解量,故C说法正确;
D、凉茶水是均一、稳定的混合物属于溶液,故D说法正确.
故选A.
7.C
【详解】
A、由溶解度曲线可知,丙物质的溶解度随温度升高而减小,说法错误;
B、t2℃时,甲和丙的溶解度相等,甲、丙两种物质的饱和溶液中溶质的质量分数相等,但本题没说溶液是否饱和,溶质质量分数不一定相等,说法错误;
C、t2℃时,甲的溶解度为50g,30g甲物质放入50g水中,25g甲溶解,得到75g溶液,说法正确;
D、饱和溶液的溶质质量分数大小与溶解度有关,溶解度大,溶质质量分数就大,所以t3℃时,甲、乙、丙饱和溶液中溶质质量分数大小是:甲>乙>丙,降低温度到t2℃时,甲和乙的溶解度都变小,都会析出晶体,所以降温后谁的溶解度大,谁的溶质质量分数就大,所以降温后甲和乙的溶质质量分数大小是:乙>甲,降温后,丙物质的溶解度增大,由饱和变为不饱和,丙物质的溶质质量分数不变,又因为t2℃时甲的溶解度大于t3℃时丙的溶解度,所以分别将t3℃时三种物质的饱和溶液降温至t2℃,所得溶液溶质质量分数的大小关系为乙>甲>丙,说法错误。
故选:C。
8.C
【详解】
A、甲、乙的溶解度都随温度的升高而增大,不符合题意;
B、饱和溶液溶质的质量分数=×100%,通过分析溶解度曲线可知,20℃时,甲、乙具有相同的溶解度,即具有相同的质量分数,不符合题意;
C、20℃时,甲物质的溶解度是25g,所以饱和溶液的质量分数为:×100%=20%,所以没有25%的甲溶液,故不能用质量分数为25%的甲溶液配制溶质10%的甲溶液,符合题意;
D、50℃时,甲物质的溶解度大于乙物质的溶解度,所以甲和乙各30g分别加入100g水中,充分溶解后同时等速降温,则乙溶液先成为饱和溶液,不符合题意。故选C。
9.D
【详解】
A、将t2℃时a、b、c三种物质的饱和溶液降温到t1℃时,a、b的溶解度减小,c的溶解度随温度的降低而增大,a、b有晶体析出,质量分数变小溶液仍为饱和溶液,c没有晶体析出,质量分数不变,一定温度下饱和溶液的溶质质量分数=,溶解度越大,质量分数越大,t1℃时b的溶解度大于a的溶解度大于t2℃时c的溶解度,所以将t2℃的a、b、c的饱和溶液降温到t1℃,溶液中溶质质量分数的关系是b>a>c,错误。
B、t1°C时,c的溶解度为20g,100g水最多溶解20gc。即50g水最多溶解10gc。所以将20gc加入50g水中充分溶解,得到60克饱和溶液,错误。
C、未告知溶液是否为饱和溶液,无法判断溶液的溶质质量分数,错误。
D、t1℃时100g水中最多溶解20ga、c。可以溶解b的质量多于20g。即50g水中最多溶解10ga、c。可以溶解b的质量大于10g。所以所得溶液的溶质质量分数最大的是b。正确。
故选D。
10.D
【详解】
A、在20℃时,将40g氯化钠加入水中,充分溶解后过滤出4g固体,并得到澄清溶液,过滤出4g固体说明有4g氯化钠没有溶解,而溶解了36g氯化钠,则该溶液已经是饱和溶液,且溶质质量为36g,故A正确;
B、由于已经达到饱和状态,说明在20℃时,氯化钠在水中溶解度为36g,故B正确;
C、该溶液达到了饱和状态,加入水后则溶质质量不变,溶剂质量增加,即变为不饱和溶液,故C正确;
D、溶质质量分数计算公式为:,则该澄清溶液中的溶质质量分数为: ,故D错误。
故选D
11.B
【详解】
根据溶解度曲线可知A选项t1℃时,甲、丙两种物质的饱和溶液溶质质量分数相同,是正确的叙述;B选项是错误的叙述,在t2℃时,30g甲加入到50g水中充分溶解,但只能溶解25g,所得溶液的溶质质量分数为33.3%;C选项是正确的叙述,因为甲物质的溶解度受温度的影响较大;D选项根据溶解度的变化趋势可知,将三种物质的饱和溶液从t2℃降温至t1℃,所得溶液中溶质质量分数乙﹥甲﹥丙,是正确的叙述;故答案选择B
12.D
【详解】
由溶解度曲线图可知,溶解度曲线的相交点表示在此温度下两物质的溶解度相等.可以看出氯化铵的溶解度随温度的改变的变化趋势;由40℃,硫酸钠的溶解度,可以计算饱和溶液中溶质的质量分数;由硫酸钠的溶解度随温度的变化趋势可以判断50℃时硫酸钠的饱和溶液降低温度时,有无晶体析出.
解答:解:A、由溶解度曲线图可知:氯化铵的溶解度随温度的升高而增大.
B、30℃时氯化铵、硫酸钠的溶解度曲线交于一点,故它们的溶解度相同.
C、40℃,硫酸钠的溶解度为50g,它的饱和溶液中溶质的质量分数为×100%=33.3%.
D、将50℃时降温至40℃时,硫酸钠的溶解度随着温度的降低而增大,没有晶体析出.该选项说法不正确.
故选D.
13.D
【详解】
由溶解度曲线可知,A、B正确;10℃时,两物质的溶解度B大于A,故10℃时AB两种物质等质量的两种饱和溶液中,B物质的饱和溶液含有的溶质多,含有的溶剂少,C正确;由于A物质的溶解度受温度的影响比B大,故等质量的A、B的饱和溶液从30℃降温到20℃时,A析出的晶体最多,D不正确。
14.A
【详解】
试题分析:A、从溶解度曲线可看出,t2℃时,甲的溶解度=50g,而乙的溶解度<50g,故在两个各盛有l00g水的烧杯中,分别加入50g的甲、乙两种固体,充分搅拌,甲能全部溶解,而乙有剩余,故所得甲、乙溶液中溶质的质量不等,正确,B、t1℃时,甲、乙物质的溶解度相等,但没有指明是饱和溶液,故等质量甲、乙溶液中所含溶剂的质量甲不一定等于乙,错误, C、从溶解度曲线可看出,甲的溶解度随温度的升高变化较大,而乙的溶解度随温度的升高而变化较小,故乙中含有少量甲,可以用冷却热饱和溶液的方法提纯乙,错误,D、没有指明高温时的溶液是否是等质量,故无法判断析出晶体量的多少,错误,故选A
15.D
【详解】
A、甲中加入的固体是NaC1,此选项错误;
B、由溶解度曲线可知,0℃时,氯化钠的溶解度是35.7g,则10.0g水最多能溶解3.57g氯化钠,所以甲溶液是不饱和溶液,由于乙中有固体物质,乙溶液一定是饱和溶液,此选项错误;
C、40℃时,硝酸钾的溶解度大于氯化钠的溶解度,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量小于乙中加入对应的溶质质量,此选项错误;
D、KNO3的溶解度受温度影响较大,对于溶解度受温度影响较大的物质,一般采用冷却热饱和溶液的方法提纯,所以KNO3中含有少量NaC1杂质,可用冷却KNO3热饱和溶液的方法提纯,此选项正确。
故选D。
16.B
【详解】
A. t1℃时,质量不相等的KCl和MgSO4两饱和溶液所含溶质质量不相等,错误;B. t2℃时,MgSO4的饱和溶液升高温度和降低温度溶解度都变小,故都能析出晶体,正确;C. t3℃时,(100+a)gMgCl2的饱和溶液中含有agMgCl2 ,错误;D. 将t3℃时的KCl的饱和溶液溶液降温到t1℃,溶液的溶质质量分数变小,错误。故选B。
17. 37.5% 20℃时氢氧化钠溶解度为109g,100g20℃的水中最多可溶解氢氧化钠的质量为109g 氢氧化钠溶于水放热,使水温升高,氢氧化钠溶解度增大,使氢氧化钠全部溶解 (150- m1) 过滤所得的氢氧化钠固体附带氢氧化钠溶液 小 不再产生白色沉淀 7.9
【详解】
(1)t℃时氢氧化钠的溶解度是60g,所以氢氧化钠饱和溶液的溶质质量分数是 。
(2)室温为20℃时,小芳同学向100g20℃的水中加入150g氢氧化钠,发现氢氧化钠全部溶解,于是对此曲线的准确性提出了质疑,其理由是20℃时氢氧化钠溶解度为109g,100g20℃的水中最多可溶解氢氧化钠的质量为109g,小明同学经过认真分析后对出现上述现象的原因作出了合理的解释,出现这种现象的原因是氢氧化钠溶于水放热,使水温升高,氢氧化钠溶解度增大,使氢氧化钠全部溶解。
(3)他们想继续测定室温(20℃)时氢氧化钠的溶解度,小芳提出:将(2)中所得溶液冷却到20℃、过滤、干燥、称量固体质量为m1g,由此得出室温(20℃)时氢氧化钠的溶解度为(150- m1)g。
交流与反思:
(4)经讨论他们发现上述方案从操作的角度看,是因为过滤所得的氢氧化钠固体附带氢氧化钠溶液,使固体质量m1偏大,从而会使测定结果偏小。
(5)①将(2)中所得溶液冷却到20℃后,取溶液20.9g,向其中慢慢滴加MgCl2溶液至氢氧化钠 (MgCl2+2NaOH=2NaCl+Mg(OH)2↓),表明氢氧化钠也完全反应的现象是不再产生白色沉淀。
②过滤、洗涤、干燥、称量得固体质量为m2g,从而计算出室温(20℃)时氢氧化钠的溶解度,若室温(20℃)时氢氧化钠的溶解度确实为109g,20.9g氢氧化钠饱和溶液中溶质质量为,则
解得m2=7.9g。
18. 天然气 CH4+2O2CO2+2H2O 增大与氧气的接触面积 CO2+4H22H2O+CH4 t2 75 丙 冷却热饱和溶液
【详解】
(1)①三大矿物燃料包括:煤、石油和天然气,故填:天然气。
②甲烷完全燃烧生成二氧化碳和水,化学方程式为CH4+2O2CO2+2H2O,故填:CH4+2O2CO2+2H2O。
③燃烧发电时,将煤块粉碎成煤粉,目的是增大与氧气的接触面积,二氧化碳和氢气在催化剂和加热的条件下反应,生成水和甲烷化学方程式为CO2+4H22H2O+CH4,故填:增大与氧气的接触面积;CO2+4H22H2O+CH4。
(2)①在t2°C 时,甲与丙的溶解度曲线交于一点,表示该温度下二者的溶解度相等。
②在t3°C 时甲的溶解度是50g,即100g水中最多溶解50g的甲,所以把30g甲溶解于50g水中最多溶解25g,得到75g溶液。
③t3℃时,有甲、乙、丙三种物质的等质量饱和溶液,由于此温度下溶解度甲>乙>丙,该温度下的饱和溶液的溶质的质量分数甲>乙>丙,所以溶质的质量甲>乙>丙。溶液的质量=溶质的质量+溶剂的质量,因为此时溶液的质量相等,所以溶剂的质量应为:丙>乙>甲。
④由甲、乙物质的溶解度曲线可以知道,甲物质的溶解度随温度的升高而明显增大,乙物质的溶解度随温度的升高变化不大,所以若在混有少量乙的甲中提纯甲,应采用冷却热饱和溶液的方法。
19. 白糖 酒精 30g 65 添加溶质 乙大于甲大于丙 丙 偏小
【详解】
(1)溶液是一种或几种物质分散到另一种物质里形成的均一、稳定的混合物。胡椒不溶于水、花生油不溶于水、面粉不溶于水、白糖可溶于水,故能形成溶液的是白糖;
(2)溶质:被溶解的物质,溶剂:能溶解其他物质的物质。消毒液碘酒中被溶解的是碘,溶解其他物质的是酒精,故溶剂是酒精;
(3)
①由图知,在t2°C时,甲的溶解度为30g,即100g水中可以溶解30g甲,在50g水中只能溶解15g甲,得到溶液的质量=溶剂的质量+溶液的质量=50g+15g=65g,为65克。
②在t3°C时,N点位于甲的溶解度曲线下方,属于不饱和溶液,M点位于甲的溶解度曲线上,属于饱和溶液,故把N点甲的溶液转化为M点溶液的方法为可以增加溶质;
③一定温度下饱和溶液的溶质质量分数=,溶解度越大,溶质的质量分数越大,将甲、乙、丙三种物质的饱和溶液从t3°C降到t2°C,甲、乙的溶解度减小,溶质析出,但仍为饱和溶液,此时乙的溶解度大于甲,溶质的质量分数乙大于甲;丙的溶解度增大,没有晶体析出,溶质质量分数不变,故由大到小的顺序是乙大于甲大于丙。
④要配制等质量t3°C的甲、乙、丙三种物质的饱和溶液,溶解度越小所需要的水越多,溶解度:甲大于乙大于丙,故所需水的质量最多是丙。配制过程中若量取水时仰视读数,则所量取的水体积偏大,则会造成所配溶液的溶质质量分数偏小。
20. 水 C 60 t2 a、b两种固体物质的溶解度都随温度的升高而增大 3510
【分析】
根据固体的溶解度曲线可以:①查出某物质在某温度下的溶解度,②比较不同物质在同一温度下的溶解度大小,从而确定在同温度下的饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况等;浓溶液加水稀释的过程中,溶质的质量不变。
【详解】
(1)生理盐水即氯化钠的水溶液,溶质是氯化钠,溶剂是水,故答案为水
(2)初中阶段常见的物质中,溶于水能够使温度升高的物质有:生石灰、氢氧化钠、浓硫酸,能够使温度降低的有硝酸铵,故答案为C
(3)①在t3℃时,a的溶解度是60g,即在100g水中最多溶解60g该物质,故答案为60
②在某温度下,两物质的饱和溶液中溶质的质量分数相等,说明该温度下,两物质的溶解度相等,故答案为t2
③根据两物质的溶解度曲线不难看出,在t1℃,b的溶解度大于a的溶解度;a和b的溶解度都随温度的升高而增大,故答案为a、b两种固体物质的溶解度都随温度的升高而增大
(4)由于在稀释的过程中溶质的质量不变,加水的质量则为稀浓溶液质量之差,因此加水的质量为,故答案为3510
21. 相等 乙 饱和 不一定
【详解】
(1)p点表示30℃时甲、乙两物质的溶解度相等。
(2)20℃时,将等质量的甲、乙两种固体分别放入盛有100g水的烧杯中,甲物部分溶解,乙物质全部溶解,20℃时乙物质的溶解度大于甲物质,所以图3中N表示的是乙物质的溶解度曲线。
(3)图1中甲固体有剩余,一定是饱和溶液,乙固体全部溶解,不一定是不饱和溶液。
22.(1)20℃时,在100g水中溶解36gNaCl形成饱和溶液
(2)AC
(3)ABCD
(4)A
(5) A 凹液面最低处 温度可控、受热均匀 70 加入溶质硝酸钾、蒸发水、降低温度 CD
【解析】
(1)
20℃时NaCl的溶解度为36g,其含义是20℃时,在100g水中溶解36gNaCl形成饱和溶液。
(2)
影响固体溶解度大小的因素有溶质种类、溶剂种类、温度,压强几乎不影响固体溶解度,搅拌、颗粒大小、溶质、溶剂质量都不会影响溶解度;
故选AC。
(3)
A. 温度升高,微粒运动加快,可以加快物质溶解,正确;
B. 搅拌可以加快物质溶解,正确;
C. 颗粒越小,与溶剂接触面积越大,溶解越快,正确;
D. 振荡可以加速物质溶解,正确。
故选ABCD。
(4)
气体溶解度随温度升高而减小,随压强增大而增大;图中t1对应的温度为40℃,同压强下t2对应的溶解度更小,故温度大于40℃;
故选A。
(5)
步骤1:称取一定质量药品,发现托盘天平指针偏向右边,说明药品质量偏小,则接下来的操作是添加KNO3直至天平平衡;
故选A。
步骤2:量筒必须放平稳,视线要与液体凹液面最低处保持水平。
步骤3:水浴加热,使固体全部溶解,则此加热方法的优点是温度可控、受热均匀。
步骤5:由题意可知,水的质量为10mL,则水的质量为10g;T3时溶解溶质质量为3.5+1.5+2.0=7.0g,则T3时KNO3的溶解度为。
实验交流与反思:
交流1:欲使接近饱和的KNO3溶液变为饱和溶液的三种方法是加入溶质硝酸钾、蒸发水、降低温度。
交流2:
A.没有指明具体温度,不能判断NaCl的溶解度小于KNO3的溶解度,错误;
B.没有确定两种物质溶液质量大小,不能判断将b℃时两种物质的饱和溶液降温至a℃时KNO3溶液析出的晶体的多少,错误;
C.在a℃时,氯化钠溶解度大于硝酸钾,若配制等质量的两物质的饱和溶液,则硝酸钾所需的水量多,正确;
D.硝酸钾溶解度受温度影响较大,从含有少量NaCl的KNO3中提纯KNO3,可采用降温结晶的方法,正确。
故选CD。
答案第1页,共2页
