2012年济宁市优质课(兖州)常见的酸和碱 (复习)
文档属性
| 名称 | 2012年济宁市优质课(兖州)常见的酸和碱 (复习) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-01-15 08:51:26 | ||
图片预览









文档简介
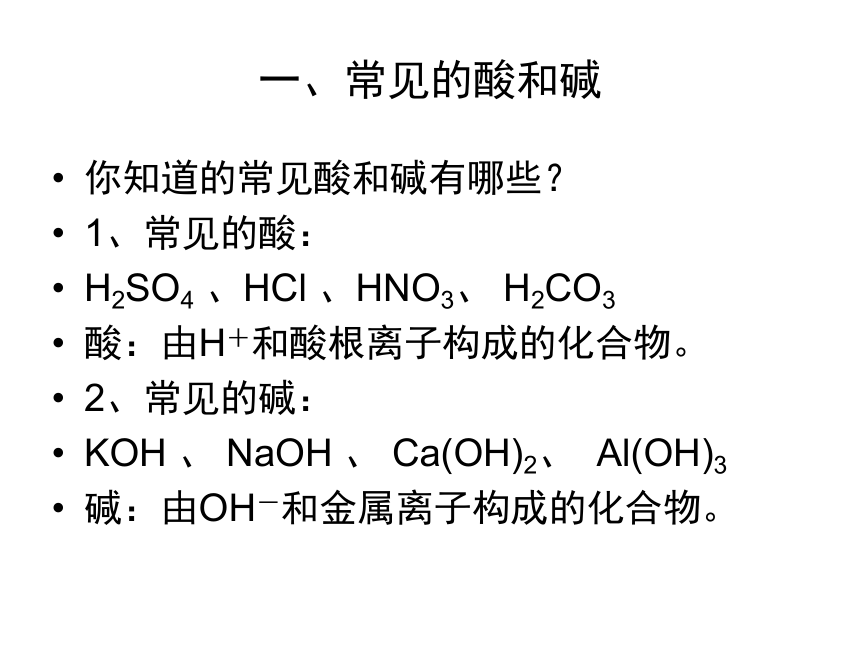
课件37张PPT。常见的酸和碱 (复习)兖州市兴隆庄煤矿学校 卢新华 一、常见的酸和碱你知道的常见酸和碱有哪些? ?
1、常见的酸:
H2SO4 、HCl 、HNO3、 H2CO3?
酸:由H+和酸根离子构成的化合物。
2、常见的碱:
KOH 、 NaOH 、 Ca(OH)2、? Al(OH)3
碱:由OH-和金属离子构成的化合物。二、通过实验探究活动,熟悉酸碱的性质。现在有无色溶液,可能是盐酸、硫酸、醋酸、氢氧化钠溶液、氢氧化钙溶液。
怎样把无色溶液鉴别出来呢?
实验探究提供的药品有:
(1)紫色石蕊试液(2)无色酚酞试液
(3)镁带(4)带锈铁钉
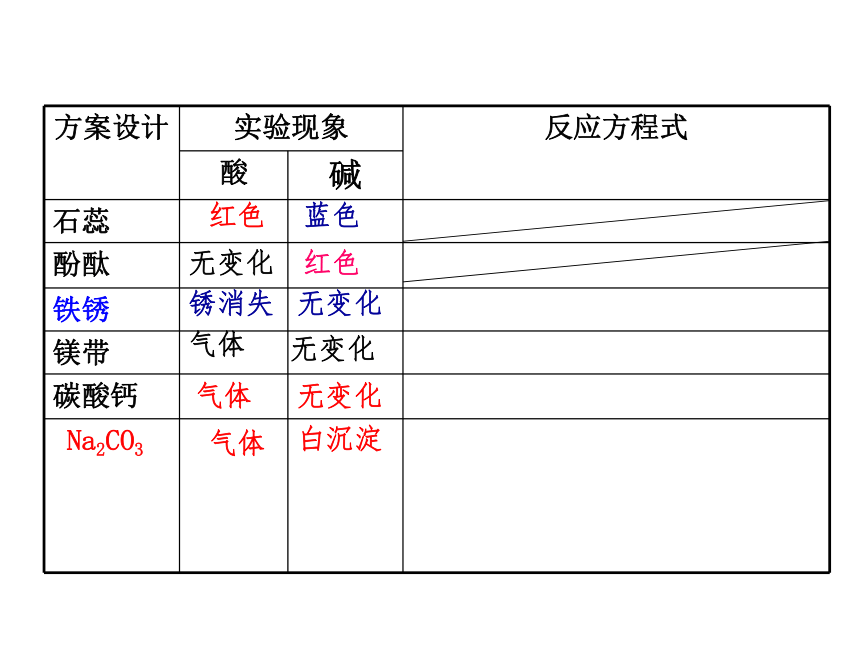
(5)大理石(6)碳酸钠粉末固体思考与设计(一)确定无色溶液是酸溶液还是碱溶液?实验操作步骤:
取1~2滴管无色溶液,分别加入到盛有(1)紫色石蕊试液(2)无色酚酞试液 (3)碳酸钠粉末固体(4)镁带(5)带锈铁钉(6)大理石的反应滴板中,观察现象。
1无色溶液+紫色石蕊试液:
2无色溶液+无色酚酞试液:
3无色溶液+碳酸钠粉末固体:
4无色溶液+镁带:
5无色溶液+带锈铁钉:
6无色溶液+大理石:
结论:我们这组的无色溶液是 (酸/碱)溶液。蓝色无变化红色锈消失无变化白沉淀气体红色气体无变化无变化气体(二)确定:溶液的酸碱性的强弱程度。测定溶液的PH。
实验操作步骤:取一张PH试纸放在表面皿上,用滴管滴一滴无色溶液于PH试纸上,把试纸显示的颜色与标准比色卡比较。PH= 。
结论:我们这组的酸溶液(碱溶液)酸性(碱性) 强(弱)。
酸性较弱的酸是 酸。剩余两种酸性较强的酸是 酸和 酸。问题:怎样区分是盐酸还是硫酸?方法1:取少量酸溶液,滴加氯化钡溶液,现象: (有/无)白色沉淀生成的是 酸。
方法2:在两个蒸发皿中各放一块滤纸,分别滴加两种酸性较强的酸溶液。然后在酒精灯上加热,观察滤纸的变化。
现象结论:滤纸 黑的是 酸,
滤纸 黑的是 酸。
浓 酸具有 性,浓 酸具有 性。问题:怎样区分氢氧化钠溶液和氢氧化钙溶液?方法1:碱性较弱的碱是 。碱性较强的碱是 。
方法2:碳酸钠溶液变浑浊的是 溶液;
碳酸钠溶液澄清的是 溶液。
方法3:向碱溶液中吹入呼出气体,溶液 (变/不变)浑浊的是 溶液。写出反应化学方程式(1)用化学方程式表示鉴别酸的方法(一种类型的反应只写一个)。
(2)用化学方程式表示鉴别碱的方法 。
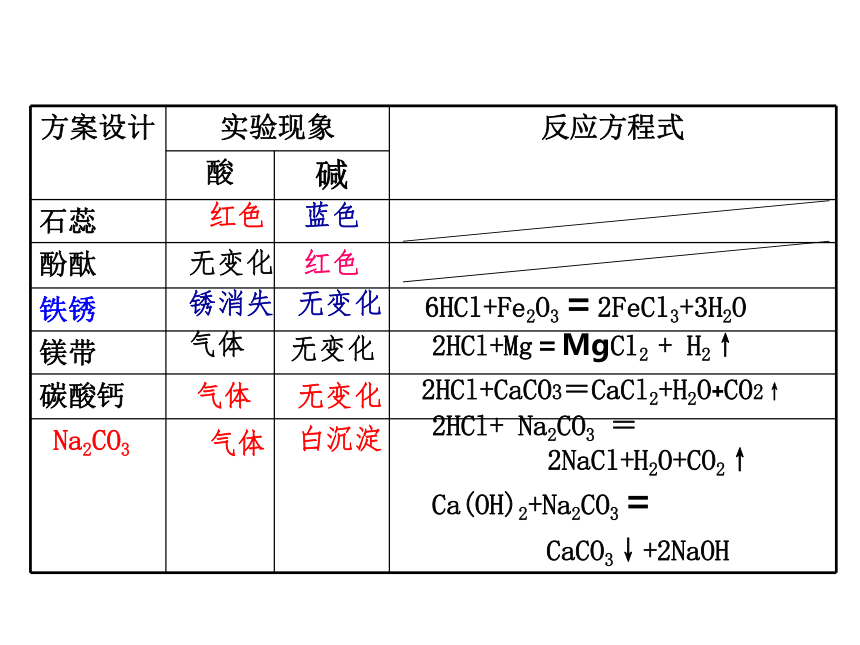
2HCl+ Na2CO3 = 2NaCl+H2O+CO2↑
Ca(OH)2+Na2CO3= CaCO3↓+2NaOH蓝色无变化红色锈消失无变化白沉淀气体红色气体无变化无变化气体2HCl+Mg=MgCl2 + H2↑2HCl+CaCO3=CaCl2+H2O+CO2↑6HCl+Fe2O3=2FeCl3+3H2O三、 ﹙一﹚常见酸的化学性质酸溶液中都含有__,因此酸类物质具有相__的化学性质。
①酸跟指示剂作用:酸能使紫色石蕊试液变__,__能使无色酚酞试液变色。
②酸跟活泼金属反应生成__和氢气。 ③酸跟金属氧化物反应生成__和水? ④酸跟碱反应生成__和水
⑤酸跟某些盐反应生成新的__和新的__。 酸使指示剂变色与活泼金属反应金属氧化物碱某些盐盐+水盐+水新盐+新酸盐+氢气 酸的化学性质 三、﹙二﹚常见碱的化学性质碱溶液中都含有__,因此碱类物质具有__的化学性质。
①碱跟指示剂作用:碱能使紫色石蕊试液变__,能使无色酚酞试液变__。
②碱跟非金属氧化物反应生成__和水。
③碱跟酸反应生成__和水。
④碱跟某些盐反应生成新的_和新的__。 碱的化学性质碱盐酸非金属氧化物酸碱指示剂四、常见酸的特性﹙一﹚不同的酸,具有不同的酸根离子,所以,不同的酸具有不同的性质。四、常见酸的特性1. 浓盐酸的特性:
纯净的盐酸是__色有____性气味的液体。
浓盐酸易挥发出氯化氢气体,遇空气中的水蒸汽呈白雾(____的小液滴)。有__味。浓盐酸中的HCl的质量分数为37%~38%密度1.19克/厘米3。
浓盐酸的特性:____性,有强烈的____性。
2. 浓硫酸的特性:
____的浓硫酸是____颜色、__稠、__状的液体,不容易____。常用浓硫酸中H2SO4的质量分数为__%,密度为1.84克/厘米3。
浓硫酸具有____性和强烈的____性。无色黏稠油状液体无气味有刺激性气味无明显现象白雾无色液体浓盐酸和浓硫酸物理性质的比较有强腐蚀性吸水性
溶于水放热有腐蚀性四、常见酸的特性在稀释浓硫酸时,一定要把___沿器壁慢慢注入__里,并不断搅拌。只能把浓硫酸沿烧杯壁慢慢地倒进水中,并不断搅拌;禁止将水倒入浓硫酸里四、常见碱的特性﹙二﹚不同的碱,具有不同的金属阳离子,所以,不同的碱具有不同的性质。四、常见酸和碱的特性1. 氢氧化钠的特性:
氢氧化钠是__色固体,__溶于水,溶解时放出____。暴露在空气中的固体氢氧化钠容易吸收空气中的____而逐渐溶解。
氢氧化钠对皮肤、纸张、织物等有强烈的____性,故俗称___、____或____。氢 氧 化 钠白色固体极易溶于水,放出大量的热强腐蚀性 火碱、烧碱、苛性钠易潮解 保存氢氧化钠要密封四、常见酸和碱的特性2. 氢氧化钙的特性:
氢氧化钙俗称____或____,是一种_色粉末状物质,__溶于水,其水溶液俗称____。氢氧化钙对皮肤、衣服等有腐蚀作用。氢 氧 化 钙白色固体微溶于水,其水溶液即澄清石灰水其制法:CaO+H2O=Ca(OH)2生石灰与水反应同时放出大量的热熟石灰、消石灰、氢氧化钙物质分类 性质决定用途1.酸跟活泼金属反应生成盐和氢气:制取__
2. 酸跟金属氧化物反应生成盐和水:除__
3. 酸跟碱发生中和反应生成盐和水:
医药卫生:Al(OH)3治疗胃酸__多;
改变土壤的酸碱性:用熟石灰Ca(OH)2改良_性土壤;
处理工业废水:用熟石灰Ca(OH)2进行__处理;
调节溶液的___性。
4. 酸跟某些盐反应生成新的盐和新的酸。制取__气体。课堂练习:二、浓盐酸、浓硫酸:
1.具有挥发性,在空气中会生成白雾的是 ;
2.具有吸水性,可作干燥剂的是 ;
3.敞口放置在空气中,质量会增加的是 ,质量会减小的是 ,溶质的质量分数减小的是 ;
4.具有脱水性,能使纸张、木材等炭化的是 ;
5.具有刺激性气味的酸是课堂练习:三、写出下列物质的化学式,并注明所属类别(指酸、碱、盐或氧化物)
1.碳酸 ( )
2.氯化亚铁 ( )
3.四氧化三铁 ( )
4.氢氧化钙 ( )
5.硫酸 ( )
6.硝酸银 ( )课堂练习:四、盐酸和稀硫酸都可以用来清洗钢铁制品表面的铁锈,试写出反应的化学方程式。
。
课堂练习:五、烧水的铝壶中常结有一层水垢(水垢的主要成分是CaCO3),用适量的稀盐酸可以除去它,反应的化学方程式是 。
若盐酸的用量过多,会损坏铝壶,反应的化学方程式是 。课堂练习:六、氢氧化钠俗称 、 、 ,它易吸收空气中的 而潮解,又会吸收空气中的 而变质,有关的化学方程式为 ,因此氢氧化钠固体必须 保存。 下列各组内表示的是同种物质的是( )
A. 氢氧化钠 、烧碱、火碱
B .氢氧化钙、消石灰、生石灰
C .盐酸、氯化氢、食盐
D .冰、干冰、水A 写出今天实验涉及到的化学方程式收获与感悟作业布置:
用化学方程式总结:常见酸和碱的性质。 再见 2012年9月27日 一分辛劳 一分收获
有志者 事竟成
祝你取得成功!
1、常见的酸:
H2SO4 、HCl 、HNO3、 H2CO3?
酸:由H+和酸根离子构成的化合物。
2、常见的碱:
KOH 、 NaOH 、 Ca(OH)2、? Al(OH)3
碱:由OH-和金属离子构成的化合物。二、通过实验探究活动,熟悉酸碱的性质。现在有无色溶液,可能是盐酸、硫酸、醋酸、氢氧化钠溶液、氢氧化钙溶液。
怎样把无色溶液鉴别出来呢?
实验探究提供的药品有:
(1)紫色石蕊试液(2)无色酚酞试液
(3)镁带(4)带锈铁钉
(5)大理石(6)碳酸钠粉末固体思考与设计(一)确定无色溶液是酸溶液还是碱溶液?实验操作步骤:
取1~2滴管无色溶液,分别加入到盛有(1)紫色石蕊试液(2)无色酚酞试液 (3)碳酸钠粉末固体(4)镁带(5)带锈铁钉(6)大理石的反应滴板中,观察现象。
1无色溶液+紫色石蕊试液:
2无色溶液+无色酚酞试液:
3无色溶液+碳酸钠粉末固体:
4无色溶液+镁带:
5无色溶液+带锈铁钉:
6无色溶液+大理石:
结论:我们这组的无色溶液是 (酸/碱)溶液。蓝色无变化红色锈消失无变化白沉淀气体红色气体无变化无变化气体(二)确定:溶液的酸碱性的强弱程度。测定溶液的PH。
实验操作步骤:取一张PH试纸放在表面皿上,用滴管滴一滴无色溶液于PH试纸上,把试纸显示的颜色与标准比色卡比较。PH= 。
结论:我们这组的酸溶液(碱溶液)酸性(碱性) 强(弱)。
酸性较弱的酸是 酸。剩余两种酸性较强的酸是 酸和 酸。问题:怎样区分是盐酸还是硫酸?方法1:取少量酸溶液,滴加氯化钡溶液,现象: (有/无)白色沉淀生成的是 酸。
方法2:在两个蒸发皿中各放一块滤纸,分别滴加两种酸性较强的酸溶液。然后在酒精灯上加热,观察滤纸的变化。
现象结论:滤纸 黑的是 酸,
滤纸 黑的是 酸。
浓 酸具有 性,浓 酸具有 性。问题:怎样区分氢氧化钠溶液和氢氧化钙溶液?方法1:碱性较弱的碱是 。碱性较强的碱是 。
方法2:碳酸钠溶液变浑浊的是 溶液;
碳酸钠溶液澄清的是 溶液。
方法3:向碱溶液中吹入呼出气体,溶液 (变/不变)浑浊的是 溶液。写出反应化学方程式(1)用化学方程式表示鉴别酸的方法(一种类型的反应只写一个)。
(2)用化学方程式表示鉴别碱的方法 。
2HCl+ Na2CO3 = 2NaCl+H2O+CO2↑
Ca(OH)2+Na2CO3= CaCO3↓+2NaOH蓝色无变化红色锈消失无变化白沉淀气体红色气体无变化无变化气体2HCl+Mg=MgCl2 + H2↑2HCl+CaCO3=CaCl2+H2O+CO2↑6HCl+Fe2O3=2FeCl3+3H2O三、 ﹙一﹚常见酸的化学性质酸溶液中都含有__,因此酸类物质具有相__的化学性质。
①酸跟指示剂作用:酸能使紫色石蕊试液变__,__能使无色酚酞试液变色。
②酸跟活泼金属反应生成__和氢气。 ③酸跟金属氧化物反应生成__和水? ④酸跟碱反应生成__和水
⑤酸跟某些盐反应生成新的__和新的__。 酸使指示剂变色与活泼金属反应金属氧化物碱某些盐盐+水盐+水新盐+新酸盐+氢气 酸的化学性质 三、﹙二﹚常见碱的化学性质碱溶液中都含有__,因此碱类物质具有__的化学性质。
①碱跟指示剂作用:碱能使紫色石蕊试液变__,能使无色酚酞试液变__。
②碱跟非金属氧化物反应生成__和水。
③碱跟酸反应生成__和水。
④碱跟某些盐反应生成新的_和新的__。 碱的化学性质碱盐酸非金属氧化物酸碱指示剂四、常见酸的特性﹙一﹚不同的酸,具有不同的酸根离子,所以,不同的酸具有不同的性质。四、常见酸的特性1. 浓盐酸的特性:
纯净的盐酸是__色有____性气味的液体。
浓盐酸易挥发出氯化氢气体,遇空气中的水蒸汽呈白雾(____的小液滴)。有__味。浓盐酸中的HCl的质量分数为37%~38%密度1.19克/厘米3。
浓盐酸的特性:____性,有强烈的____性。
2. 浓硫酸的特性:
____的浓硫酸是____颜色、__稠、__状的液体,不容易____。常用浓硫酸中H2SO4的质量分数为__%,密度为1.84克/厘米3。
浓硫酸具有____性和强烈的____性。无色黏稠油状液体无气味有刺激性气味无明显现象白雾无色液体浓盐酸和浓硫酸物理性质的比较有强腐蚀性吸水性
溶于水放热有腐蚀性四、常见酸的特性在稀释浓硫酸时,一定要把___沿器壁慢慢注入__里,并不断搅拌。只能把浓硫酸沿烧杯壁慢慢地倒进水中,并不断搅拌;禁止将水倒入浓硫酸里四、常见碱的特性﹙二﹚不同的碱,具有不同的金属阳离子,所以,不同的碱具有不同的性质。四、常见酸和碱的特性1. 氢氧化钠的特性:
氢氧化钠是__色固体,__溶于水,溶解时放出____。暴露在空气中的固体氢氧化钠容易吸收空气中的____而逐渐溶解。
氢氧化钠对皮肤、纸张、织物等有强烈的____性,故俗称___、____或____。氢 氧 化 钠白色固体极易溶于水,放出大量的热强腐蚀性 火碱、烧碱、苛性钠易潮解 保存氢氧化钠要密封四、常见酸和碱的特性2. 氢氧化钙的特性:
氢氧化钙俗称____或____,是一种_色粉末状物质,__溶于水,其水溶液俗称____。氢氧化钙对皮肤、衣服等有腐蚀作用。氢 氧 化 钙白色固体微溶于水,其水溶液即澄清石灰水其制法:CaO+H2O=Ca(OH)2生石灰与水反应同时放出大量的热熟石灰、消石灰、氢氧化钙物质分类 性质决定用途1.酸跟活泼金属反应生成盐和氢气:制取__
2. 酸跟金属氧化物反应生成盐和水:除__
3. 酸跟碱发生中和反应生成盐和水:
医药卫生:Al(OH)3治疗胃酸__多;
改变土壤的酸碱性:用熟石灰Ca(OH)2改良_性土壤;
处理工业废水:用熟石灰Ca(OH)2进行__处理;
调节溶液的___性。
4. 酸跟某些盐反应生成新的盐和新的酸。制取__气体。课堂练习:二、浓盐酸、浓硫酸:
1.具有挥发性,在空气中会生成白雾的是 ;
2.具有吸水性,可作干燥剂的是 ;
3.敞口放置在空气中,质量会增加的是 ,质量会减小的是 ,溶质的质量分数减小的是 ;
4.具有脱水性,能使纸张、木材等炭化的是 ;
5.具有刺激性气味的酸是课堂练习:三、写出下列物质的化学式,并注明所属类别(指酸、碱、盐或氧化物)
1.碳酸 ( )
2.氯化亚铁 ( )
3.四氧化三铁 ( )
4.氢氧化钙 ( )
5.硫酸 ( )
6.硝酸银 ( )课堂练习:四、盐酸和稀硫酸都可以用来清洗钢铁制品表面的铁锈,试写出反应的化学方程式。
。
课堂练习:五、烧水的铝壶中常结有一层水垢(水垢的主要成分是CaCO3),用适量的稀盐酸可以除去它,反应的化学方程式是 。
若盐酸的用量过多,会损坏铝壶,反应的化学方程式是 。课堂练习:六、氢氧化钠俗称 、 、 ,它易吸收空气中的 而潮解,又会吸收空气中的 而变质,有关的化学方程式为 ,因此氢氧化钠固体必须 保存。 下列各组内表示的是同种物质的是( )
A. 氢氧化钠 、烧碱、火碱
B .氢氧化钙、消石灰、生石灰
C .盐酸、氯化氢、食盐
D .冰、干冰、水A 写出今天实验涉及到的化学方程式收获与感悟作业布置:
用化学方程式总结:常见酸和碱的性质。 再见 2012年9月27日 一分辛劳 一分收获
有志者 事竟成
祝你取得成功!
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
