2012年济宁市参评优质课(金乡)常见的酸和碱复习课(第2课时)
文档属性
| 名称 | 2012年济宁市参评优质课(金乡)常见的酸和碱复习课(第2课时) |

|
|
| 格式 | zip | ||
| 文件大小 | 477.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-01-15 00:00:00 | ||
图片预览








文档简介
课件27张PPT。常见的酸和碱复习课(第2课时)金乡县实验中学:朱景芳 “迷失”的标签我是谁?【还我标签一】:
在实验室中,有一批失去标签的药品,其
中有两瓶无色溶液,分别是稀硫酸和氢氧化钙
溶液,利用酸或碱的化学性质,你能用哪些方法把
它们区分开? 酸碱指示剂、PH试纸、石蕊试纸
活泼金属
金属氧化物
碳酸盐
难溶性碱
CO2
FeCl3 、CuCl2等盐溶液
稀硫酸H2SO4氢氧化钙Ca(OH)2【大家来帮忙】:小亮在做“盐酸中和氢氧化钠
溶液”的实验时,滴加盐酸前忘了加入指示剂,导
致无法判断该中和反应进行的程度。于是他对所得
溶液的酸碱性进行探究。
【探究目的】探究所得溶液的酸碱性
【提出猜想】所得溶液可能呈碱性,
也可能呈 性,还可能呈 性。
【实验验证】
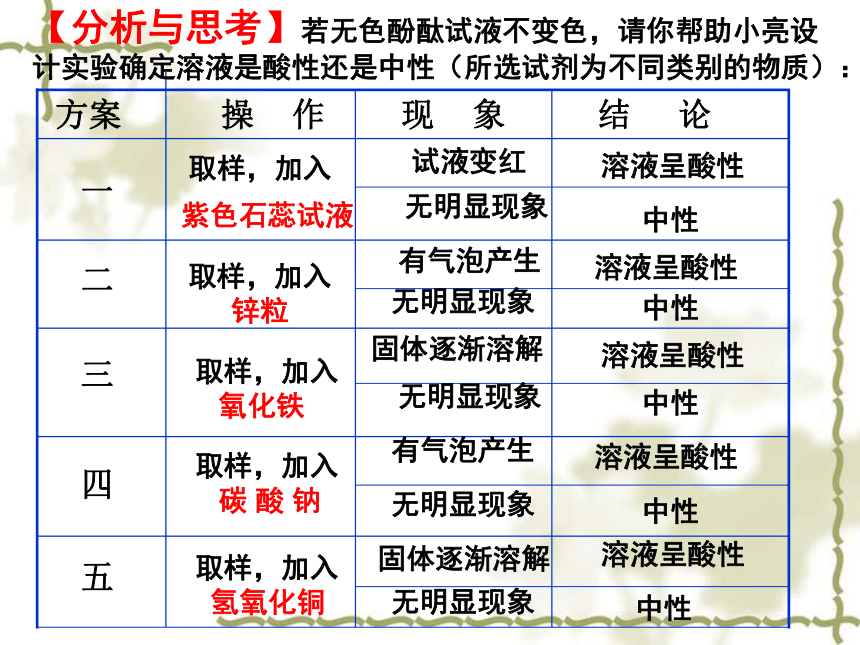
酸 中红 酸性或中 四 五 三 二
一 结 论 现 象 操 作 方案紫色石蕊试液试液变红溶液呈酸性无明显现象中性取样,加入取样,加入
碳 酸 钠取样,加入
氢氧化铜取样,加入
氧化铁取样,加入
锌粒无明显现象无明显现象无明显现象无明显现象中性中性中性中性有气泡产生固体逐渐溶解固体逐渐溶解有气泡产生溶液呈酸性溶液呈酸性溶液呈酸性溶液呈酸性【分析与思考】若无色酚酞试液不变色,请你帮助小亮设
计实验确定溶液是酸性还是中性(所选试剂为不同类别的物质):【还我标签二】:
1. 在放置酸类药品的橱柜里,有两瓶失去标签的
无色液体,分别是浓盐酸和浓硫酸,你能利用它们的物理性质把它们区分开吗?
浓盐酸
HCl浓硫酸
H2SO4怎样区分稀盐酸和稀硫酸?请同
学们讨论实验方案,并写出有关
化学方程式。H2SO4+Ba(NO3)2===2HNO3+BaSO4↓【大家来帮忙】: 小红同学对一瓶未知无色待测液的成分进行
探究,小红用试管取适量未知溶液并滴加了
氯化钡溶液和稀硝酸,产生了白色沉淀,于是
小红认为该溶液中一定含有硫酸根离子,你认
为她的结论正确吗?溶液中可能含有Ag+ 或者SO42-【还我标签三】:
1. 在放置碱类药品的橱柜里有两瓶标签模糊的
溶液:分别是氢氧化钠溶液和澄清的石灰水, 如何把二者区分开?氢氧化钠
NaOH氢氧化钙
Ca(OH)2Ca(OH)2+CO2===CaCO3↓+H2OCa(OH)2+Na2CO3===CaCO3↓+2NaOH2NaOH+CO2===Na2CO3+H2O2. 如果是氢氧化钠和氢氧化钙固体,利用它们
的物理性质,你能用哪些方法把它们区分开?(1)露置在空气中观察是否潮解;
(2)取相同质量的固体放入等体积的适量水中
比较剩余固体的多少;
(3)取相同质量的固体溶解在等量的水中,
比较固体溶解时温度的变化。【学以致用】:化学反应往往伴随着一些现象发生,
但CO2与NaOH溶液的反应没有明显的现象。为了通
过一些明显现象说明CO2与NaOH发生了反应,某班
同学分两组作了如下探究实验:
(1)第一组同学把一支收集满CO2的
试管倒立在装有浓NaOH溶液的烧杯中
(如图),看到试管内液面上升。这种
现象是因为试管内外产生了 ( )
A、温度差 B、重力差
C、压强差 D、浮力差
CCO2浓NaOH溶液(2)第二组同学从中得到启发,也设计了下图实验
装置进行探究:
A中现象为 ;
B中现象为 ;
C中现象为 .
(3)同学们经过分析讨论,认为第一组的实验中产生
液面上升现象的原因可能有两种。一种是因为CO2与溶
液中的NaOH反应,消耗了CO2,你认为另一种原因
是 。
(4)为了进一步证实CO2与NaOH溶液已经发生了反应,
他们设计了如下方案:取上述实验后的溶液滴加 ,
现象为 ,可以证实CO2与NaOH溶液已经发生
了反应。塑料瓶变瘪鸡蛋被吞进集气瓶气球胀大二氧化碳能溶于水稀盐酸产生气泡氢氧化钙产生白色沉淀物质的鉴别思路:(1)根据被鉴别物质具有的特征性质(物理性质、化学性质)进行鉴别; (2)实验方案应操作简单,现象明显。
【科学探究】:“除垢净”的秘密
小明在使用“除垢净”去除暖水瓶上
的水垢时,发现有大量气泡产生。联
想到水垢的主要成分是碳酸钙,小明
猜想“除垢净”中可能含有酸。1、利用提供的药品,你能设计实验验证小明的
猜想吗?2、如果“除垢净”中含有盐酸或者硫酸中的一种,
利用提供的药品你能再设计一个实验证明它是
哪种酸吗? 3、根据以上你对“除垢净”的了解,你认为在使用“除垢净”时应该注意什么问题?不可长时间浸泡金属制品、
不能与碱性物质混合使用、
避免接触到皮肤衣物等。
我的收获。。。。。【实战演练】
1、氢氧化铯是一种可溶性碱,其化学式CsOH,
则下列叙述中不正确的是( )
A、CsOH溶液能与CO2反应
B、CsOH溶液能使酚酞溶液变红
C、CsOH溶液与硫酸反应生成的盐的化学式为CsSO4
D、CsOH在水中能电离出Cs+、OH-
2、实验室配制溶液用蒸馏水,一般不用自来水,
因为自来水含有少量氯离子等。现有一瓶自来
水和一瓶蒸馏水,区别它们的最简单方法是( )
A、观察颜色
B、测密度
C、浇花,观察植物生长情况
D、取少量分别滴加硝酸银溶液
CD3、只用一种试剂就能将澄清石灰水、氢氧化钠溶液、
稀盐酸三种无色溶液区别开来的是( )
A.无色酚酞试液 B.二氧化碳气体
C.碳酸钠溶液 D.氯化钡溶液
4、下图是盐酸滴入氢氧化钠
溶液中有关粒子之间反应的示
意图。下列说法错误的是( )
A、盐酸溶液中含有氢离子和氯离子
B、氢氧化钠溶液中含有钠离子和氢氧根离子
C、两种溶液混合时,氢离子与氢氧根离子结
合生成了水分子
D、两种溶液混合时,钠离子与氯离子结合生
成了氯化钠离子
CD5、用石灰浆新抹的墙壁上掉下一块白色固体,
小红为探究其成分,她选用的试剂除水外还
需要( )
A、酚酞、氢氧化钠溶液
B、酚酞、稀盐酸
C、酚酞、氯化钠溶液
D、盐酸、氢氧化钠溶液
6、(1)小华同学用pH试纸按正确操作测定洗
发剂的pH略大于7,则洗发剂显 性;
护发剂PH略小于7,则护发剂显 性。
(2)弱酸性有益于头发的健康。想一想,
洗发时应先用 剂,后用 剂。 B碱酸洗发护发7、人的胃液里含有适量的盐酸,
可以帮助消化,但如果胃酸分泌
过多,人会感到胃痛。小军拿来
了一种抗酸药(治疗胃酸过多的
药物),该药物说明书的部分内容
如图所示。
为了验证该药物的主要成分是碳酸盐,
他进行了如下实验:首先将药片放入试管中,
向其中加入适量的稀盐酸,有 ,然后
(写实验操作和实验现象)。
当小军看到药物说明书上的服用方法后,对此产生了
探究的兴趣,请你和他一起完成探究活动。
【提出问题】抗酸药为什么嚼碎后服用?
【作出猜想】他的猜想是 。气泡产生 将气体通入
澄清的石灰水,石灰水变浑浊嚼碎后接触面积变大,反应速度加快【设计实验】
实验一:将一片完整的药片放入试管中,
向其中加入5mL5%的稀盐酸;
实验二:将 放入试管中,向其中加入5mL5%的稀盐酸。
【现象与结论】实验二比实验一反应快。证明小军的猜想正确。
【拓展探究】(1)氢氧化镁、碳酸钙、碳酸氢钠等也常用于制作抗酸药。这些物质必须具备两个条件:一是能与胃酸作用;二是 。
(2)患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药,其原因是 。 。一片药片研碎后对人体无害碳酸盐和盐酸反应会产生二氧化碳气体,会造成胃穿孔8、某化学试剂厂A、B、C、D四个车间排放的
污水中,分别含有污染物CuCl2、HCl、NaOH、
Na2CO3中的一种,现对污水作如下处理:
①将A的污水与B的蓝色污水通入第一反应池,
产生蓝色沉淀;
②将C的污水与D的酸性污水通入第二反应池,
产生大量的气泡;
③将第一反应池上层的碱性污水和第二反应池
上层的酸性污水通入第三反应池,最终污水显
中性,再向外排放。
(1)试推断各车间污水的污染物分别为:
A B C 。
(2)最终向外排放的水中含有的溶质是 。
写出第三反应池中反应的化学方程式:
。 NaOHCuCl2Na2CO3NaClNaOH+HCl===NaCl+H2O谢谢!再见!
在实验室中,有一批失去标签的药品,其
中有两瓶无色溶液,分别是稀硫酸和氢氧化钙
溶液,利用酸或碱的化学性质,你能用哪些方法把
它们区分开? 酸碱指示剂、PH试纸、石蕊试纸
活泼金属
金属氧化物
碳酸盐
难溶性碱
CO2
FeCl3 、CuCl2等盐溶液
稀硫酸H2SO4氢氧化钙Ca(OH)2【大家来帮忙】:小亮在做“盐酸中和氢氧化钠
溶液”的实验时,滴加盐酸前忘了加入指示剂,导
致无法判断该中和反应进行的程度。于是他对所得
溶液的酸碱性进行探究。
【探究目的】探究所得溶液的酸碱性
【提出猜想】所得溶液可能呈碱性,
也可能呈 性,还可能呈 性。
【实验验证】
酸 中红 酸性或中 四 五 三 二
一 结 论 现 象 操 作 方案紫色石蕊试液试液变红溶液呈酸性无明显现象中性取样,加入取样,加入
碳 酸 钠取样,加入
氢氧化铜取样,加入
氧化铁取样,加入
锌粒无明显现象无明显现象无明显现象无明显现象中性中性中性中性有气泡产生固体逐渐溶解固体逐渐溶解有气泡产生溶液呈酸性溶液呈酸性溶液呈酸性溶液呈酸性【分析与思考】若无色酚酞试液不变色,请你帮助小亮设
计实验确定溶液是酸性还是中性(所选试剂为不同类别的物质):【还我标签二】:
1. 在放置酸类药品的橱柜里,有两瓶失去标签的
无色液体,分别是浓盐酸和浓硫酸,你能利用它们的物理性质把它们区分开吗?
浓盐酸
HCl浓硫酸
H2SO4怎样区分稀盐酸和稀硫酸?请同
学们讨论实验方案,并写出有关
化学方程式。H2SO4+Ba(NO3)2===2HNO3+BaSO4↓【大家来帮忙】: 小红同学对一瓶未知无色待测液的成分进行
探究,小红用试管取适量未知溶液并滴加了
氯化钡溶液和稀硝酸,产生了白色沉淀,于是
小红认为该溶液中一定含有硫酸根离子,你认
为她的结论正确吗?溶液中可能含有Ag+ 或者SO42-【还我标签三】:
1. 在放置碱类药品的橱柜里有两瓶标签模糊的
溶液:分别是氢氧化钠溶液和澄清的石灰水, 如何把二者区分开?氢氧化钠
NaOH氢氧化钙
Ca(OH)2Ca(OH)2+CO2===CaCO3↓+H2OCa(OH)2+Na2CO3===CaCO3↓+2NaOH2NaOH+CO2===Na2CO3+H2O2. 如果是氢氧化钠和氢氧化钙固体,利用它们
的物理性质,你能用哪些方法把它们区分开?(1)露置在空气中观察是否潮解;
(2)取相同质量的固体放入等体积的适量水中
比较剩余固体的多少;
(3)取相同质量的固体溶解在等量的水中,
比较固体溶解时温度的变化。【学以致用】:化学反应往往伴随着一些现象发生,
但CO2与NaOH溶液的反应没有明显的现象。为了通
过一些明显现象说明CO2与NaOH发生了反应,某班
同学分两组作了如下探究实验:
(1)第一组同学把一支收集满CO2的
试管倒立在装有浓NaOH溶液的烧杯中
(如图),看到试管内液面上升。这种
现象是因为试管内外产生了 ( )
A、温度差 B、重力差
C、压强差 D、浮力差
CCO2浓NaOH溶液(2)第二组同学从中得到启发,也设计了下图实验
装置进行探究:
A中现象为 ;
B中现象为 ;
C中现象为 .
(3)同学们经过分析讨论,认为第一组的实验中产生
液面上升现象的原因可能有两种。一种是因为CO2与溶
液中的NaOH反应,消耗了CO2,你认为另一种原因
是 。
(4)为了进一步证实CO2与NaOH溶液已经发生了反应,
他们设计了如下方案:取上述实验后的溶液滴加 ,
现象为 ,可以证实CO2与NaOH溶液已经发生
了反应。塑料瓶变瘪鸡蛋被吞进集气瓶气球胀大二氧化碳能溶于水稀盐酸产生气泡氢氧化钙产生白色沉淀物质的鉴别思路:(1)根据被鉴别物质具有的特征性质(物理性质、化学性质)进行鉴别; (2)实验方案应操作简单,现象明显。
【科学探究】:“除垢净”的秘密
小明在使用“除垢净”去除暖水瓶上
的水垢时,发现有大量气泡产生。联
想到水垢的主要成分是碳酸钙,小明
猜想“除垢净”中可能含有酸。1、利用提供的药品,你能设计实验验证小明的
猜想吗?2、如果“除垢净”中含有盐酸或者硫酸中的一种,
利用提供的药品你能再设计一个实验证明它是
哪种酸吗? 3、根据以上你对“除垢净”的了解,你认为在使用“除垢净”时应该注意什么问题?不可长时间浸泡金属制品、
不能与碱性物质混合使用、
避免接触到皮肤衣物等。
我的收获。。。。。【实战演练】
1、氢氧化铯是一种可溶性碱,其化学式CsOH,
则下列叙述中不正确的是( )
A、CsOH溶液能与CO2反应
B、CsOH溶液能使酚酞溶液变红
C、CsOH溶液与硫酸反应生成的盐的化学式为CsSO4
D、CsOH在水中能电离出Cs+、OH-
2、实验室配制溶液用蒸馏水,一般不用自来水,
因为自来水含有少量氯离子等。现有一瓶自来
水和一瓶蒸馏水,区别它们的最简单方法是( )
A、观察颜色
B、测密度
C、浇花,观察植物生长情况
D、取少量分别滴加硝酸银溶液
CD3、只用一种试剂就能将澄清石灰水、氢氧化钠溶液、
稀盐酸三种无色溶液区别开来的是( )
A.无色酚酞试液 B.二氧化碳气体
C.碳酸钠溶液 D.氯化钡溶液
4、下图是盐酸滴入氢氧化钠
溶液中有关粒子之间反应的示
意图。下列说法错误的是( )
A、盐酸溶液中含有氢离子和氯离子
B、氢氧化钠溶液中含有钠离子和氢氧根离子
C、两种溶液混合时,氢离子与氢氧根离子结
合生成了水分子
D、两种溶液混合时,钠离子与氯离子结合生
成了氯化钠离子
CD5、用石灰浆新抹的墙壁上掉下一块白色固体,
小红为探究其成分,她选用的试剂除水外还
需要( )
A、酚酞、氢氧化钠溶液
B、酚酞、稀盐酸
C、酚酞、氯化钠溶液
D、盐酸、氢氧化钠溶液
6、(1)小华同学用pH试纸按正确操作测定洗
发剂的pH略大于7,则洗发剂显 性;
护发剂PH略小于7,则护发剂显 性。
(2)弱酸性有益于头发的健康。想一想,
洗发时应先用 剂,后用 剂。 B碱酸洗发护发7、人的胃液里含有适量的盐酸,
可以帮助消化,但如果胃酸分泌
过多,人会感到胃痛。小军拿来
了一种抗酸药(治疗胃酸过多的
药物),该药物说明书的部分内容
如图所示。
为了验证该药物的主要成分是碳酸盐,
他进行了如下实验:首先将药片放入试管中,
向其中加入适量的稀盐酸,有 ,然后
(写实验操作和实验现象)。
当小军看到药物说明书上的服用方法后,对此产生了
探究的兴趣,请你和他一起完成探究活动。
【提出问题】抗酸药为什么嚼碎后服用?
【作出猜想】他的猜想是 。气泡产生 将气体通入
澄清的石灰水,石灰水变浑浊嚼碎后接触面积变大,反应速度加快【设计实验】
实验一:将一片完整的药片放入试管中,
向其中加入5mL5%的稀盐酸;
实验二:将 放入试管中,向其中加入5mL5%的稀盐酸。
【现象与结论】实验二比实验一反应快。证明小军的猜想正确。
【拓展探究】(1)氢氧化镁、碳酸钙、碳酸氢钠等也常用于制作抗酸药。这些物质必须具备两个条件:一是能与胃酸作用;二是 。
(2)患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药,其原因是 。 。一片药片研碎后对人体无害碳酸盐和盐酸反应会产生二氧化碳气体,会造成胃穿孔8、某化学试剂厂A、B、C、D四个车间排放的
污水中,分别含有污染物CuCl2、HCl、NaOH、
Na2CO3中的一种,现对污水作如下处理:
①将A的污水与B的蓝色污水通入第一反应池,
产生蓝色沉淀;
②将C的污水与D的酸性污水通入第二反应池,
产生大量的气泡;
③将第一反应池上层的碱性污水和第二反应池
上层的酸性污水通入第三反应池,最终污水显
中性,再向外排放。
(1)试推断各车间污水的污染物分别为:
A B C 。
(2)最终向外排放的水中含有的溶质是 。
写出第三反应池中反应的化学方程式:
。 NaOHCuCl2Na2CO3NaClNaOH+HCl===NaCl+H2O谢谢!再见!
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
