粤教版化学九年级下册同步提优训练 7.4 结晶现象(word版有答案)
文档属性
| 名称 | 粤教版化学九年级下册同步提优训练 7.4 结晶现象(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 183.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-29 16:17:27 | ||
图片预览

文档简介
数学
化学
7.4 结晶现象
如图是粗盐提纯过程中的几项实验操作,请回答下列问题。
(1)除去粗盐中难溶性杂质的操作步骤的顺序为 。
(2)操作A中玻璃棒的作用是 ,操作B中玻璃棒的作用是 ,操作C中玻璃棒的作用是 。
(3)下列各组试剂也可利用上述操作进行分离的是 。
A.从碳酸钠和碳酸钙的固体混合物中分离出碳酸钙
B.从氯化钾和二氧化锰的混合物中分离出氯化钾
C.从硝酸钾和氯化钠的混合物中分离出硝酸钾
D.从铜粉和铁粉的混合物中分离出铜粉
[核心知识]
1.结晶方法的选择依据:所要提纯物质的溶解度受温度的影响情况。
2. 结晶的方法:①蒸发结晶;②冷却结晶(降温结晶)。
3. 混合物分离方法:①过滤(过滤要点“一贴、二低、三靠”);②结晶。
[易错点拨] 溶解时玻璃棒的作用是搅拌,加速固体溶解;过滤时玻璃棒的作用是引流;蒸发时玻璃棒的作用是搅拌,防止液体因局部温度过高而造成液滴飞溅。
1.下列关于结晶的说法不正确的是 ( )
A.结晶是指有规则几何形状的晶体从溶液中析出的过程
B.不同晶体从溶液中析出后,其几何形状可能不相同
C.结晶必须在蒸发溶剂的时候才能进行
D.把硝酸钾晶体从其溶液中结晶出来最好采用冷却结晶法
2.大量硝酸钾固体中混有少量的氯化钠,常采用降温结晶的方式除杂,其中氯化钠不析出的原因是 ( )
A.氯化钠在降温时其溶解能力反而增强
B.氯化钠的溶解度随温度的降低变化较大
C.氯化钠量少,在降温后形成的仍是不饱和溶液
D.硝酸钾的溶解度比氯化钠的大
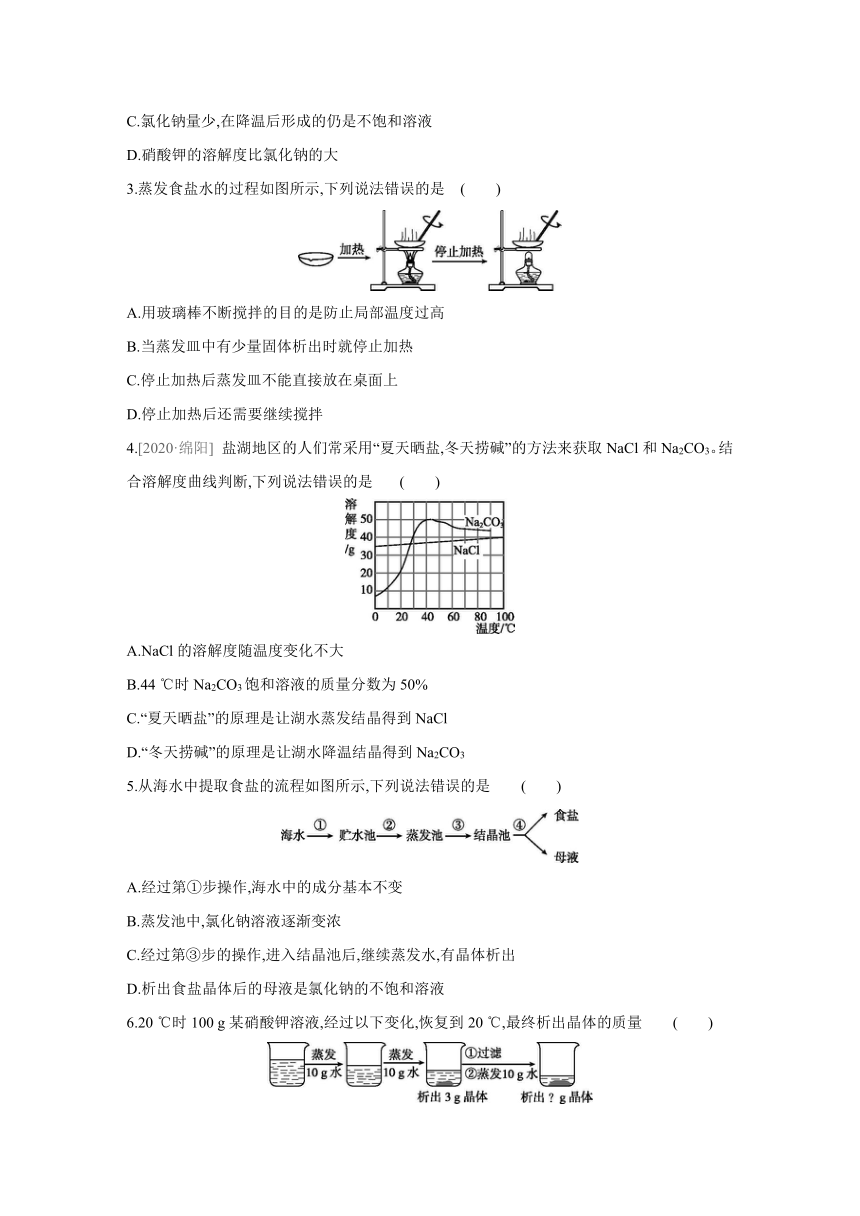
3.蒸发食盐水的过程如图所示,下列说法错误的是 ( )
A.用玻璃棒不断搅拌的目的是防止局部温度过高
B.当蒸发皿中有少量固体析出时就停止加热
C.停止加热后蒸发皿不能直接放在桌面上
D.停止加热后还需要继续搅拌
4.[2020·绵阳] 盐湖地区的人们常采用“夏天晒盐,冬天捞碱”的方法来获取NaCl和Na2CO3。结合溶解度曲线判断,下列说法错误的是 ( )
A.NaCl的溶解度随温度变化不大
B.44 ℃时Na2CO3饱和溶液的质量分数为50%
C.“夏天晒盐”的原理是让湖水蒸发结晶得到NaCl
D.“冬天捞碱”的原理是让湖水降温结晶得到Na2CO3
5.从海水中提取食盐的流程如图所示,下列说法错误的是 ( )
A.经过第①步操作,海水中的成分基本不变
B.蒸发池中,氯化钠溶液逐渐变浓
C.经过第③步的操作,进入结晶池后,继续蒸发水,有晶体析出
D.析出食盐晶体后的母液是氯化钠的不饱和溶液
6.20 ℃时100 g某硝酸钾溶液,经过以下变化,恢复到20 ℃,最终析出晶体的质量 ( )
A.小于3 g B.等于3 g
C.大于3 g D.大于或等于3 g
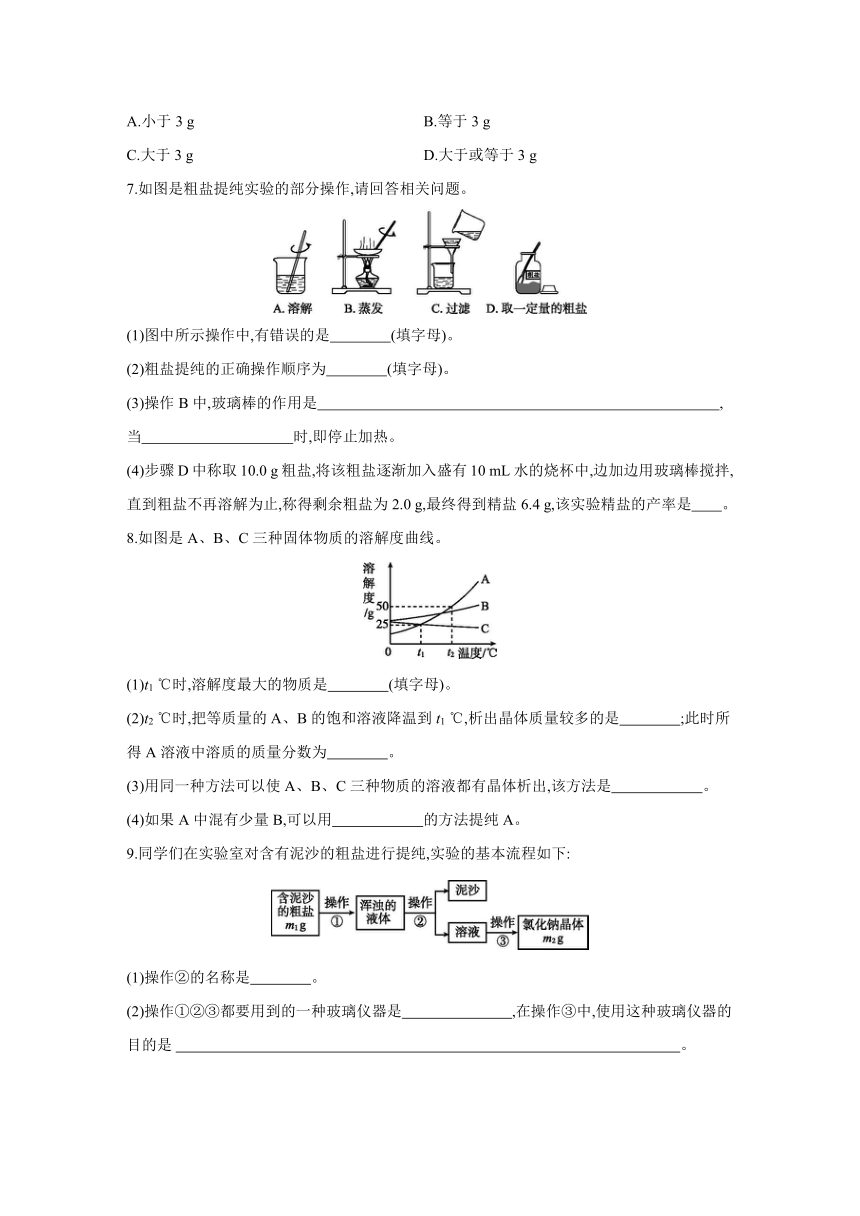
7.如图是粗盐提纯实验的部分操作,请回答相关问题。
(1)图中所示操作中,有错误的是 (填字母)。
(2)粗盐提纯的正确操作顺序为 (填字母)。
(3)操作B中,玻璃棒的作用是 ,当 时,即停止加热。
(4)步骤D中称取10.0 g粗盐,将该粗盐逐渐加入盛有10 mL水的烧杯中,边加边用玻璃棒搅拌,直到粗盐不再溶解为止,称得剩余粗盐为2.0 g,最终得到精盐6.4 g,该实验精盐的产率是 。
8.如图是A、B、C三种固体物质的溶解度曲线。
(1)t1 ℃时,溶解度最大的物质是 (填字母)。
(2)t2 ℃时,把等质量的A、B的饱和溶液降温到t1 ℃,析出晶体质量较多的是 ;此时所得A溶液中溶质的质量分数为 。
(3)用同一种方法可以使A、B、C三种物质的溶液都有晶体析出,该方法是 。
(4)如果A中混有少量B,可以用 的方法提纯A。
9.同学们在实验室对含有泥沙的粗盐进行提纯,实验的基本流程如下:
(1)操作②的名称是 。
(2)操作①②③都要用到的一种玻璃仪器是 ,在操作③中,使用这种玻璃仪器的目的是 。
(3)计算所获得的氯化钠产率,发现产率偏低,由实验不当导致的可能原因是 (只写一种原因)。
(4)用提纯所得的氯化钠晶体配制100 g溶质质量分数为6%的氯化钠溶液,若实际所配溶液的溶质质量分数大于6%,可能的原因是 (填字母)。
a.称量氯化钠所用天平砝码沾有杂质
b.用量筒取水时俯视读数
c.用量筒取水时仰视读数
d.配制溶液的烧杯用蒸馏水润洗过
(5)若用6%的氯化钠溶液(密度为1.04 g/cm3)配制16 g质量分数为3%的氯化钠溶液,需要6%的氯化钠溶液 mL(结果保留到小数点后一位)。
10.苯甲酸有抑制真菌、细菌、霉菌生长的作用,常用作药物或防腐剂。苯甲酸常温下为片状或针状结晶,在100 ℃时会迅速升华。苯甲酸在水中的溶解度见下表:
温度 20 ℃ 25 ℃ 50 ℃ 75 ℃ 95 ℃
溶解度 0.17 g 0.35 g 0.95 g 2.2 g 6.8 g
为了提纯某苯甲酸样品(其中含有难溶于水的杂质),某化学小组进行了如下实验:
(1)取约1 g样品放入烧杯中,加入50 mL蒸馏水充分搅拌,发现样品几乎没溶解。原因是苯甲酸属于 (填“易溶”“可溶”“微溶”或“难溶”)物。
(2)将(1)中烧杯放在石棉网上加热至样品充分溶解,再加少量蒸馏水,然后趁热过滤。趁热过滤的目的是 。
(3)将所得滤液 ,使苯甲酸以晶体的形式析出,然后过滤得到较纯净的苯甲酸晶体。
(4)(3)中过滤后的滤液是苯甲酸的 (填“饱和”或“不饱和”)溶液。
答案
(1)BAC (2)引流 搅拌,加速粗盐的溶解 搅拌,防止液体因局部温度过高而造成液滴飞溅 (3)B
[应考能力提升练]
1.C 结晶分为蒸发结晶和降温结晶。
常用的结晶方法有蒸发结晶和降温结晶(冷却热饱和溶液结晶)。二者的使用方法为:
2.C 3.B 4.B
5.D 析出食盐晶体后的母液是氯化钠的饱和溶液。
6.D 若第一次蒸发10 g水恰好形成的是饱和溶液,根据第二次蒸发10 g水析出3 g晶体,说明10 g水恰好溶解3 g晶体,则第三次蒸发10 g水析出晶体的质量是3 g;若第一次蒸发10 g水形成的是不饱和溶液,则第二次蒸发10 g水析出3 g晶体,需要先蒸发一部分水形成饱和溶液,再蒸发水才能析出晶体,说明10 g水中能溶解的晶体的质量大于3 g,故第三次蒸发10 g 水,析出晶体的质量大于3 g。
7.(1)C (2)DACB (3)搅拌,防止液体因局部温度过高造成液滴飞溅 有较多固体析出 (4)80%
(1)过滤时没用玻璃棒引流。(2)粗盐提纯的步骤是溶解、过滤、蒸发结晶。(3)蒸发操作时用玻璃棒搅拌的目的是使溶液均匀受热,防止局部温度过高造成液滴飞溅。当出现较多固体时,停止加热,利用余热将晶体蒸干。(4)精盐的产率为6.4 g÷(10.0 g-2.0 g)×100%=80%。
8.(1)B (2)A 20%
(3)蒸发结晶 (4)降温结晶
(1)由三种物质的溶解度曲线可知,在t1 ℃时,三种物质的溶解度大小关系是B>A=C。(2)由于A和B的溶解度都随温度的升高而增大,但A的溶解度受温度的影响较大,因此将等质量的A、B的饱和溶液分别由t2 ℃降温到t1 ℃,A溶液中析出的晶体质量较大;析出晶体后的溶液是饱和溶液,此时A溶液中溶质的质量分数为×100%=20%。(3)无论是什么溶液,都可通过蒸发溶剂结晶。(4)A的溶解度受温度影响大,且随温度的升高而增大,B的溶解度受温度影响不大,故可以用降温结晶的方法。
9.(1)过滤
(2)玻璃棒 搅拌,防止液体因局部温度过高而造成液滴飞溅
(3)加入的水量不足,粗盐没有完全溶解(合理即可)
(4)ab (5)7.7
(4)称量氯化钠所用天平砝码沾有杂质时,称量的氯化钠的质量大于需要的氯化钠的质量;用量筒取水时俯视读数,量取水的体积会比需要的体积偏小,这两种情况都会使结果偏大,即都会使实际所配溶液的溶质质量分数大于6%。(5)设需要6%的氯化钠溶液的体积为x,根据稀释前后,溶液中溶质的质量不变,则1.04 g/cm3×x×6%=16 g×3%,x=7.7 mL。
[初高衔接拓展练]
10.(1)微溶
(2)避免过滤除去难溶性杂质时,苯甲酸因降温析出而损耗
(3)降温结晶
(4)饱和
(1)判断物质的溶解性需根据其20 ℃时的溶解度,苯甲酸20 ℃时的溶解度只有0.17 g,属于微溶物。(2)温度低时,苯甲酸溶解度很小,易析出,过滤时会使苯甲酸晶体与杂质一起被除去,造成损失。(3)降温使苯甲酸晶体析出,能得到较纯净的晶体。(4)有晶体析出的母液一定是该物质的饱和溶液,则滤液是苯甲酸的饱和溶液。
化学
7.4 结晶现象
如图是粗盐提纯过程中的几项实验操作,请回答下列问题。
(1)除去粗盐中难溶性杂质的操作步骤的顺序为 。
(2)操作A中玻璃棒的作用是 ,操作B中玻璃棒的作用是 ,操作C中玻璃棒的作用是 。
(3)下列各组试剂也可利用上述操作进行分离的是 。
A.从碳酸钠和碳酸钙的固体混合物中分离出碳酸钙
B.从氯化钾和二氧化锰的混合物中分离出氯化钾
C.从硝酸钾和氯化钠的混合物中分离出硝酸钾
D.从铜粉和铁粉的混合物中分离出铜粉
[核心知识]
1.结晶方法的选择依据:所要提纯物质的溶解度受温度的影响情况。
2. 结晶的方法:①蒸发结晶;②冷却结晶(降温结晶)。
3. 混合物分离方法:①过滤(过滤要点“一贴、二低、三靠”);②结晶。
[易错点拨] 溶解时玻璃棒的作用是搅拌,加速固体溶解;过滤时玻璃棒的作用是引流;蒸发时玻璃棒的作用是搅拌,防止液体因局部温度过高而造成液滴飞溅。
1.下列关于结晶的说法不正确的是 ( )
A.结晶是指有规则几何形状的晶体从溶液中析出的过程
B.不同晶体从溶液中析出后,其几何形状可能不相同
C.结晶必须在蒸发溶剂的时候才能进行
D.把硝酸钾晶体从其溶液中结晶出来最好采用冷却结晶法
2.大量硝酸钾固体中混有少量的氯化钠,常采用降温结晶的方式除杂,其中氯化钠不析出的原因是 ( )
A.氯化钠在降温时其溶解能力反而增强
B.氯化钠的溶解度随温度的降低变化较大
C.氯化钠量少,在降温后形成的仍是不饱和溶液
D.硝酸钾的溶解度比氯化钠的大
3.蒸发食盐水的过程如图所示,下列说法错误的是 ( )
A.用玻璃棒不断搅拌的目的是防止局部温度过高
B.当蒸发皿中有少量固体析出时就停止加热
C.停止加热后蒸发皿不能直接放在桌面上
D.停止加热后还需要继续搅拌
4.[2020·绵阳] 盐湖地区的人们常采用“夏天晒盐,冬天捞碱”的方法来获取NaCl和Na2CO3。结合溶解度曲线判断,下列说法错误的是 ( )
A.NaCl的溶解度随温度变化不大
B.44 ℃时Na2CO3饱和溶液的质量分数为50%
C.“夏天晒盐”的原理是让湖水蒸发结晶得到NaCl
D.“冬天捞碱”的原理是让湖水降温结晶得到Na2CO3
5.从海水中提取食盐的流程如图所示,下列说法错误的是 ( )
A.经过第①步操作,海水中的成分基本不变
B.蒸发池中,氯化钠溶液逐渐变浓
C.经过第③步的操作,进入结晶池后,继续蒸发水,有晶体析出
D.析出食盐晶体后的母液是氯化钠的不饱和溶液
6.20 ℃时100 g某硝酸钾溶液,经过以下变化,恢复到20 ℃,最终析出晶体的质量 ( )
A.小于3 g B.等于3 g
C.大于3 g D.大于或等于3 g
7.如图是粗盐提纯实验的部分操作,请回答相关问题。
(1)图中所示操作中,有错误的是 (填字母)。
(2)粗盐提纯的正确操作顺序为 (填字母)。
(3)操作B中,玻璃棒的作用是 ,当 时,即停止加热。
(4)步骤D中称取10.0 g粗盐,将该粗盐逐渐加入盛有10 mL水的烧杯中,边加边用玻璃棒搅拌,直到粗盐不再溶解为止,称得剩余粗盐为2.0 g,最终得到精盐6.4 g,该实验精盐的产率是 。
8.如图是A、B、C三种固体物质的溶解度曲线。
(1)t1 ℃时,溶解度最大的物质是 (填字母)。
(2)t2 ℃时,把等质量的A、B的饱和溶液降温到t1 ℃,析出晶体质量较多的是 ;此时所得A溶液中溶质的质量分数为 。
(3)用同一种方法可以使A、B、C三种物质的溶液都有晶体析出,该方法是 。
(4)如果A中混有少量B,可以用 的方法提纯A。
9.同学们在实验室对含有泥沙的粗盐进行提纯,实验的基本流程如下:
(1)操作②的名称是 。
(2)操作①②③都要用到的一种玻璃仪器是 ,在操作③中,使用这种玻璃仪器的目的是 。
(3)计算所获得的氯化钠产率,发现产率偏低,由实验不当导致的可能原因是 (只写一种原因)。
(4)用提纯所得的氯化钠晶体配制100 g溶质质量分数为6%的氯化钠溶液,若实际所配溶液的溶质质量分数大于6%,可能的原因是 (填字母)。
a.称量氯化钠所用天平砝码沾有杂质
b.用量筒取水时俯视读数
c.用量筒取水时仰视读数
d.配制溶液的烧杯用蒸馏水润洗过
(5)若用6%的氯化钠溶液(密度为1.04 g/cm3)配制16 g质量分数为3%的氯化钠溶液,需要6%的氯化钠溶液 mL(结果保留到小数点后一位)。
10.苯甲酸有抑制真菌、细菌、霉菌生长的作用,常用作药物或防腐剂。苯甲酸常温下为片状或针状结晶,在100 ℃时会迅速升华。苯甲酸在水中的溶解度见下表:
温度 20 ℃ 25 ℃ 50 ℃ 75 ℃ 95 ℃
溶解度 0.17 g 0.35 g 0.95 g 2.2 g 6.8 g
为了提纯某苯甲酸样品(其中含有难溶于水的杂质),某化学小组进行了如下实验:
(1)取约1 g样品放入烧杯中,加入50 mL蒸馏水充分搅拌,发现样品几乎没溶解。原因是苯甲酸属于 (填“易溶”“可溶”“微溶”或“难溶”)物。
(2)将(1)中烧杯放在石棉网上加热至样品充分溶解,再加少量蒸馏水,然后趁热过滤。趁热过滤的目的是 。
(3)将所得滤液 ,使苯甲酸以晶体的形式析出,然后过滤得到较纯净的苯甲酸晶体。
(4)(3)中过滤后的滤液是苯甲酸的 (填“饱和”或“不饱和”)溶液。
答案
(1)BAC (2)引流 搅拌,加速粗盐的溶解 搅拌,防止液体因局部温度过高而造成液滴飞溅 (3)B
[应考能力提升练]
1.C 结晶分为蒸发结晶和降温结晶。
常用的结晶方法有蒸发结晶和降温结晶(冷却热饱和溶液结晶)。二者的使用方法为:
2.C 3.B 4.B
5.D 析出食盐晶体后的母液是氯化钠的饱和溶液。
6.D 若第一次蒸发10 g水恰好形成的是饱和溶液,根据第二次蒸发10 g水析出3 g晶体,说明10 g水恰好溶解3 g晶体,则第三次蒸发10 g水析出晶体的质量是3 g;若第一次蒸发10 g水形成的是不饱和溶液,则第二次蒸发10 g水析出3 g晶体,需要先蒸发一部分水形成饱和溶液,再蒸发水才能析出晶体,说明10 g水中能溶解的晶体的质量大于3 g,故第三次蒸发10 g 水,析出晶体的质量大于3 g。
7.(1)C (2)DACB (3)搅拌,防止液体因局部温度过高造成液滴飞溅 有较多固体析出 (4)80%
(1)过滤时没用玻璃棒引流。(2)粗盐提纯的步骤是溶解、过滤、蒸发结晶。(3)蒸发操作时用玻璃棒搅拌的目的是使溶液均匀受热,防止局部温度过高造成液滴飞溅。当出现较多固体时,停止加热,利用余热将晶体蒸干。(4)精盐的产率为6.4 g÷(10.0 g-2.0 g)×100%=80%。
8.(1)B (2)A 20%
(3)蒸发结晶 (4)降温结晶
(1)由三种物质的溶解度曲线可知,在t1 ℃时,三种物质的溶解度大小关系是B>A=C。(2)由于A和B的溶解度都随温度的升高而增大,但A的溶解度受温度的影响较大,因此将等质量的A、B的饱和溶液分别由t2 ℃降温到t1 ℃,A溶液中析出的晶体质量较大;析出晶体后的溶液是饱和溶液,此时A溶液中溶质的质量分数为×100%=20%。(3)无论是什么溶液,都可通过蒸发溶剂结晶。(4)A的溶解度受温度影响大,且随温度的升高而增大,B的溶解度受温度影响不大,故可以用降温结晶的方法。
9.(1)过滤
(2)玻璃棒 搅拌,防止液体因局部温度过高而造成液滴飞溅
(3)加入的水量不足,粗盐没有完全溶解(合理即可)
(4)ab (5)7.7
(4)称量氯化钠所用天平砝码沾有杂质时,称量的氯化钠的质量大于需要的氯化钠的质量;用量筒取水时俯视读数,量取水的体积会比需要的体积偏小,这两种情况都会使结果偏大,即都会使实际所配溶液的溶质质量分数大于6%。(5)设需要6%的氯化钠溶液的体积为x,根据稀释前后,溶液中溶质的质量不变,则1.04 g/cm3×x×6%=16 g×3%,x=7.7 mL。
[初高衔接拓展练]
10.(1)微溶
(2)避免过滤除去难溶性杂质时,苯甲酸因降温析出而损耗
(3)降温结晶
(4)饱和
(1)判断物质的溶解性需根据其20 ℃时的溶解度,苯甲酸20 ℃时的溶解度只有0.17 g,属于微溶物。(2)温度低时,苯甲酸溶解度很小,易析出,过滤时会使苯甲酸晶体与杂质一起被除去,造成损失。(3)降温使苯甲酸晶体析出,能得到较纯净的晶体。(4)有晶体析出的母液一定是该物质的饱和溶液,则滤液是苯甲酸的饱和溶液。
