10.1食物中的有机物-2021-2022学年九年级化学鲁教版下册(word版含解析)
文档属性
| 名称 | 10.1食物中的有机物-2021-2022学年九年级化学鲁教版下册(word版含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 149.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-30 00:00:00 | ||
图片预览




文档简介
10.1 食物中的有机物
一、选择题(共16题)
1.下列物质中,属于碳水化合物的是( )
A.油脂 B.醋酸 C.葡萄糖 D.食盐
2.下列元素中,摄入不足会影响青少年骨骼发育的是( )
A.钙 B.氟 C.碘 D.硒
3.下列广受新疆消费者欢迎的食品中主要含糖类的是
A.红花醋 B.馕
C.蔬菜 D.烤肉
4.有研究表明,“MERS”(中东呼吸综合征)病毒进入人体后,会破坏呼吸系统细胞里的酶,使其丧失应有的功能,从而导致患者呼吸窘迫。这里的“酶”其实是一种
A.维生素 B.蛋白质 C.糖类 D.油脂
5.分类是一种重要的研究方法。以下对常见物质(或其主要成分)的分类正确的是( )
A.有机物:CH4、H2CO3、CH3COOH B.盐:纯碱、食盐、石灰石
C.混合物:石油、蔗糖水、冰水混合物 D.金属材料:不锈钢、铜丝、金刚石
6.“关爱生命,拥抱健康”是永恒的主题。下列做法不会损害人体健康的是
A.用甲醛的水溶液浸泡海产品延长保质期 B.用含小苏打的发酵粉焙制糕点
C.使用聚氯乙烯薄膜包装食品 D.用“瘦肉精”提高猪的瘦肉率
7.推理是化学学习中常用的思维方法,下列推理正确的是
A.碱溶液一定显碱性,则显碱性的溶液一定是碱溶液
B.有机物都含有碳元素,则含碳元素的化合物一定是有机物
C.单质由同种元素组成,则由同种元素组成的纯净物一定是单质
D.洗涤剂除油污是利用乳化原理,则汽油除油污也是利用乳化原理
8.葡萄糖是己醛糖,化学式C6H12O6,白色晶体,易溶于水。下列有关叙述正确的是
A.葡萄糖是由碳、氢、氧三种原子构成
B.葡萄糖分子中碳、氢、氧元素的原子个数比1:2:1
C.葡萄糖中碳元素的质量分数最大
D.葡萄糖是有机高分子化合物
9.以甲为原料合成化工产品丁的微观过程如图。下列说法正确的是
A.该过程体现无机物与有机物可相互转化 B.乙、丁为氧化物
C.甲中氢元素的质量分数小于丁 D.转化①中乙和丙的分子个数之比为1:1
10.以下归纳和总结完全正确的一组是
A.对酸的认识 B.对碱的认识
①酸雨的pH小于5.6 ②人体胃液中含有硫酸帮助消化 ①碱溶液中都存在OH– ②氢氧化钙俗称消石灰、生石灰
C.对盐的认识 D.对有机物的认识
①盐溶液都是中性的 ②纯碱不是碱而是碳酸盐 ①有机物都含有碳元素 ②甲烷是最简单的有机物
A.A B.B C.C D.D
11.已知:① ;② 。下列说法不正确的是( )
A.X的化学式为CO2 B.淀粉、葡萄糖都属于糖类
C.用加碘食盐可区分淀粉和葡萄糖 D.酒精燃烧生成二氧化碳和水
12.推理是化学学习中常用的方法。下列推理正确的是
A.酸与碱反应生成盐和水,生成盐和水的反应一定是酸与碱的反应
B.收集比空气轻的气体可用向下排气法,能用向下排气法收集的气体一定比空气轻
C.有机物是指含碳元素的化合物,含碳元素的化合物一定是有机物
D.活泼金属与稀硫酸反应放出气体,能与稀硫酸反应放出气体的物质一定是金属
13.食醋是厨房中的一种调味品,其中含有少量醋酸,醋酸的分子结构模型如图所示,下列有关醋酸的说法正确的是
A.醋酸不属于有机化合物
B.醋酸是由两个碳原子、四个氢原子和两个氧原子构成
C.醋酸中氧元素的质量分数最大
D.醋酸的相对分子质量为60g
14.环已胺(C6H11NH2)与NaOH反应能合成甜蜜素。下列对环己胺的叙述正确的是
A.从类别上看:环已胺属于有机高分子
B.从性质上看:环己胺可以与碱发生反应
C.从组成上看:环己胺中氢元素质量分数最大
D.从结构上看:环己胺由6个碳原子、13个氢原子、1个氮原子构成
15.“信阳毛尖”是一种绿茶,绿茶中含有的单宁酸(化学式为)具有抑制血压上升,清热解毒等功效。下列有关单宁酸的说法不正确的是
A.它属于有机物 B.它的分子由碳原子、氢原子和氧原子构成的
C.氢元素的质量分数最小 D.碳、氧两种元素的质量比为76:46
16.有机玻璃是由甲基丙烯酸甲酯(C5H8O2)聚合而成的,下列关于甲基丙烯酸甲酯的说法正确的是
A.甲基丙烯酸甲酯是有机高分子化合物
B.甲基丙烯酸甲酯分子中碳、氢原子个数比为5:8
C.甲基丙烯酸甲酯是由碳、氢、氧三个元素组成的
D.甲基丙烯酸甲酯分子中氢元素的质量分数最小
二、综合题(共6题)
17.醋是常用的调味品,某厂生产的“XX牌”白醋色泽透亮、酸味醇正。
(1)传统醋酸多以碎米为原料,经过一系列工艺处理后,再用酵母发酵成乙醇,最后氧化为醋酸(CH3COOH)。乙醇和醋酸属于_____(填“有机物”或“无机物”)。
(2)醋酸中H、O两种元素的质量比为_____(填最简整数比)。
(3)兴趣小组为测定该品牌白醋中醋酸的质量分数(白醋中的酸均视为醋酸),进行了如下实验:
步骤1:取溶质质量分数为4%的氢氧化钠溶液10g于烧杯中,滴入几滴酚酞试液;
步骤2:向烧杯中逐滴滴加该白醋,_____(填操作),当红色恰好变成无色时,消耗白醋12g。(测定原理:,请计算该白醋中醋酸的质量分数。_____。
18.请运用你在初中学过的化学知识和技能,解决下列生活中的实际问题
(1)潮湿的铁器生锈,还需____________;铁锅的把柄应是木柄或____________塑料柄(填“热塑性”或“热固性”)
(2)一个“小火星”引燃了油库燃烧大爆炸,从燃烧的三个条件认识,“小火星”的作用是____________________________________________
(3)用木柴烧火做饭,木柴架空燃烧,火更旺,原因是______________________
(4)目前一种叫碘酸钙[Ca(IO3)2]的保健品已进入一些超市,Ca(IO3)2中I的化合价为_________。
(5)打开食醋的瓶盖,会闻到一股酸味,粗略测定食醋的酸度,常用________________;用食醋凉拌黄瓜生吃能补充人体需要的_______________
19.葡萄糖(C6H12O6)是生物体内新陈代谢不可缺少的营养它的氧化反应放出热量是人类生命活动所需能量的重要来源。
(1)葡萄糖属于_____(填“有机”或“无机”)化合物。
(2)葡萄糖中碳、氢、氧元素的质量比为 _____,葡萄糖中氧元素质量分数为____(精确到0.1%)。
(3)葡萄糖在氧气中燃烧,生成二氧化碳和水。该反应的化学方程式为_______________,若反应生成了44g二氧化碳,消耗了葡萄糖____g。
20.某品牌梳打饼干的配料和营养成分如下表,研究性学习小组对其成分进行了探究。
配料 营养成分(每100克)
小麦粉、食用植物油、洋葱粉、食用盐、碳酸钙、食品添加剂(碳酸氢钠)、香葱、酵母、麦精、食用香精等 能量 蛋白质 脂肪 碳水化合物 钠 钙 2017千焦 8.5克 21.0克 63.5克 500毫克 280毫克
说明:饼干制作的烘焙过程中,配料中的碳酸氢钠全部受热分解转化为碳酸钠,而碳酸钙不分解。
Ⅰ.定性判断:饼干中有关成分的确认。
取一小包饼干,研碎后放入烧杯,加入适量蒸馏水,用玻璃棒搅拌,得到待检液。
实验操作和现象 实验结论
碳酸盐的检验 取少量待检液于试管中,加入足量稀盐酸,有气泡产生; 将产生的气体通入澄清石灰水,澄清石灰水变浑浊。 饼干中含有____________(填离子符号)
【交流讨论】
(1)饼干中的_________可以提供能量供给人体生命活动需要。
(2)上述实验中石灰水变浑浊的原因是(用化学方程式表示):__________。
【深入探究】如何进一步确认饼干中含有两种碳酸盐?
将剩余待检液过滤,用蒸馏水洗涤固体2至3次;将_________与稀盐酸反应,根据相应的现象,则可证明饼干中既有碳酸钙,又有碳酸钠。
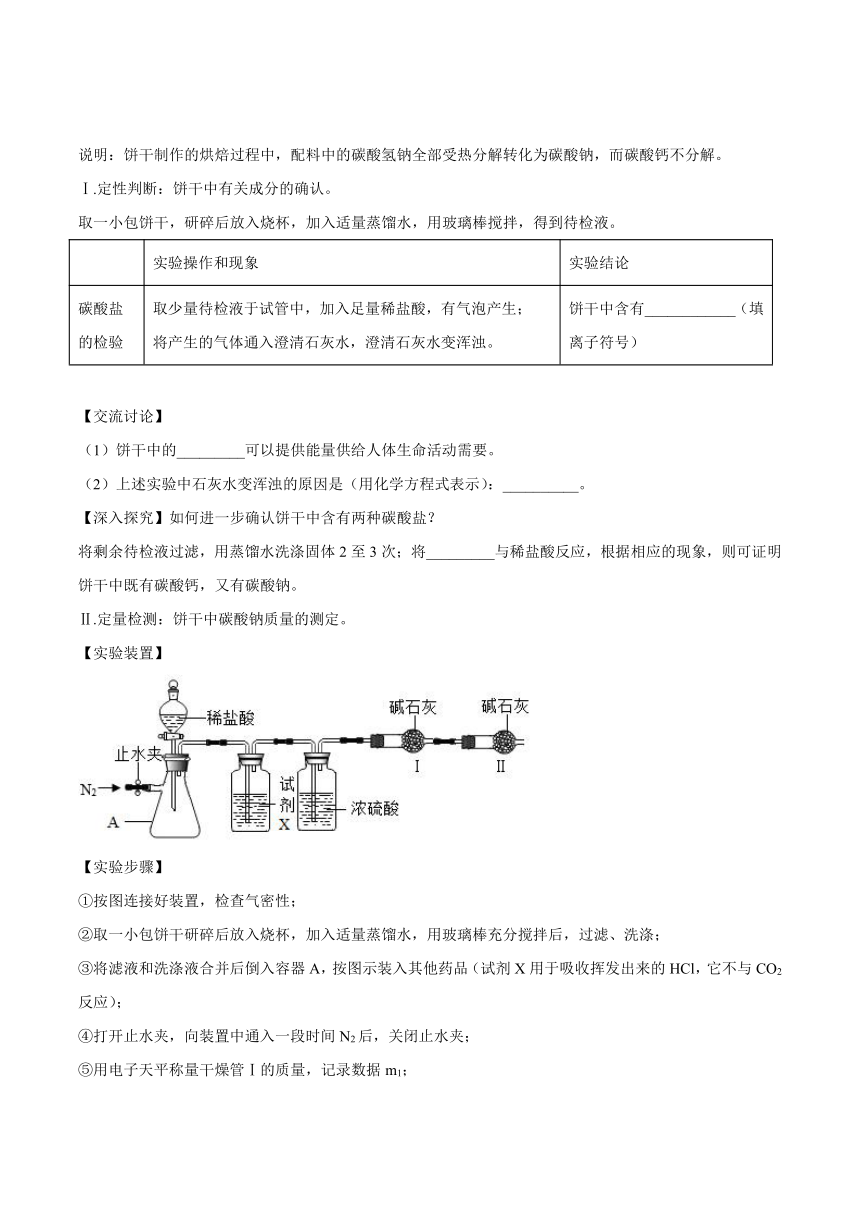
Ⅱ.定量检测:饼干中碳酸钠质量的测定。
【实验装置】
【实验步骤】
①按图连接好装置,检查气密性;
②取一小包饼干研碎后放入烧杯,加入适量蒸馏水,用玻璃棒充分搅拌后,过滤、洗涤;
③将滤液和洗涤液合并后倒入容器A,按图示装入其他药品(试剂X用于吸收挥发出来的HCl,它不与CO2反应);
④打开止水夹,向装置中通入一段时间N2后,关闭止水夹;
⑤用电子天平称量干燥管Ⅰ的质量,记录数据m1;
⑥逐滴加入稀盐酸至不再产生气泡时,停止滴加;
⑦__________。
⑧重复步骤⑤,记录数据m2。
【交流讨论】步骤③将滤液和洗涤液合并的原因是__________。
【数据处理】m2-m1=0.088g,则这包饼干中碳酸钠的质量为__________g。
21.2019 年 2 月 26 日,我国“海洋地质十号”调查船完成中巴印度洋联合海洋地质科学考察,返抵广州。“海洋地质十号”由中国自主设计、建造,可以实现在全球无限航区开展海洋地质调查工作。它助力科学家们对海底世界的新认知,新发现与新开发。
(1)人类正在运用各种方法,开采、提取多种海洋资源。
①海水化学资源:工业上常采用___法从海水中获取大量淡水,解决淡水危机。利用_______的基本原理从海水中提取大量盐类,用作化工原料。
②海底矿产资源:海底蕴含着煤、石油、天然气等数百种矿产资源。
③海洋鱼类、海参、龙虾富含的营养素是_______________。
(2)某工厂利用海水制造纯碱,生产工艺流程如图所示:
①对于流程Ⅰ中加入的三种溶液,下列说法正确的是_______________。
A.加入的三种溶液的顺序不可以调整
B.按流程Ⅰ所加溶液的顺序除杂,过滤后得到三种沉淀
C.加入三种溶液将粗盐水中的、Mg2+、Ca2+转化为沉淀
②经过流程Ⅱ过滤后的滤液主要含有_______________。
③从原料和循环利用的角度分析海水制碱生产流程的优点_______________。
(3)目前世界上60%的镁是从海水中提取的,其主要步骤如图所示:
部分物质的溶解性表
Na+ Mg2+ Ca2+
Cl- 溶 溶 溶
OH- 溶 不 微
溶 微 不
①已知部分化工原料的市场价格为:烧碱3200元/吨,熟石灰1200元/吨。工业上为了达到更高的生产效率效益,你认为如图中的试剂X应该选择上述化工原料中的____更适宜。
②加入试剂X后,发生反应的化学方程式为_______。
③综合如图和表中的信息,试分析工业上通常不选择碳酸钠作试剂X的理由___。
22.我国有漫长的海岸线,海洋蕴藏着丰富的资源。请按要求填空:
(1)海洋为我们提供了营养丰富的食材。鱼虾富含的_____是机体生长及修补受损组织的主要原料,海带富含的_____可以预防 甲状腺肿大。
(2)海水淡化可缓解淡水资源匮乏问题。
①从海水中获得淡水可采取的方法是_____(填字母) ;
A 过滤法 B 蒸馏法 C 吸附法
②水变成水蒸气的过程中,发生变化的是_____ (填字母序号)。
A 分子个数
B 分子质量
C 分子间隔
D 分子种类
(3)为了除去粗盐溶液中的Ca2+、Mg2+、SO42-,可按照下列实验步骤进行:①加过量BaC12溶液②加过量NaOH溶液③加过量Na2CO3溶液④过滤⑤加入适量盐酸。其中步骤③加过量Na2CO3溶液的目的是_____。
(4)利用苦卤制取镁,主要流程如图:
①步骤II中的试剂a的化学式是_____;
②步骤Ⅲ是一个分解反应,则另一生成物的化学式:_____。
(5)下表为氯化钠在不同温度时的溶解度。结合表中数据回答:
温度/°C 30 50 70 100
溶解度/g 36.3 37.0 37.8 39.8
配制200克10%的氯化钠溶液时,需50°C氯化钠饱和溶液中质量为_____ g(精确到0.1克)。
试卷第1页,共3页
参考答案:
1.C
【详解】
糖类物质由碳、氢、氧三种元素组成,且其中氢、氧原子个数比等于2:1,所以被称为碳水化合物,葡萄糖属于糖类,故选C。
2.A
【详解】
A、幼儿及青少年缺钙会得佝偻病和发育不良,老年人缺钙会发生骨质疏松,容易骨折,正确;
B、氟能防治龋齿,缺乏易患龋齿,错误;
C、碘是合成甲状腺激素的主要元素,缺乏会患甲状腺肿大和呆小症,错误;
D、硒有防癌抗癌作用,缺少硒易患表皮角化和癌症,错误。
故选A。
3.B
【详解】
A、红花醋中含有醋酸、水等,不属于糖类,错误;
B、馕中富含淀粉,淀粉属于糖类,正确;
C、蔬菜中富含维生素,错误;
D、烤肉中富含油脂和蛋白质,错误。故选B。
4.B
【详解】
酶(enzyme)由生物体内活细胞产生的一种生物催化剂。大多数由蛋白质组成(少数为RNA)。能在机体中十分温和的条件下,高效率地催化各种生物化学反应,促进生物体的新陈代谢。生命活动中的消化、吸收、呼吸、运动和生殖都是酶促反应过程。酶是细胞赖以生存的基础。细胞新陈代谢包括的所有化学反应几乎都是在酶的催化下进行的。故选B。
5.B
【详解】
A、H2CO3属于无机物,分类错误;
B、纯碱(碳酸钠)、食盐(氯化钠)、石灰石(碳酸钙)均属于盐,分类正确;
C、冰水混合物中只含水一种物质,是纯净物,分类错误;
D、金刚石是碳单质,属于非金属,分类错误。
故选:B。
6.B
【详解】
A、甲醛有毒,能破坏人体蛋白质的结构,使蛋白质变性,不能用甲醛水溶液浸泡海产品,不符合题意;B、小苏打是碳酸氢钠,能与面粉发酵时生成的酸性物质反应生成二氧化碳气体使糕点疏松,可用作发酵粉,不会损害人体健康,符合题意;C、聚氯乙烯塑料在使用时会分解出对健康有害的物质而污染食品,不宜用来包装食品,不符合题意;D、食用含有瘦肉精的肉会对身体产生危害,常见的有恶心、头晕、四肢无力、手颤等中毒症状,特别对心脏病、高血压患者危害更大,长期食用则可能导致染色体基变,诱发恶性肿瘤,不符合题意。故选B。
7.C
【详解】
A、碱溶液一定显碱性,显碱性的溶液不一定是碱溶液,如:碳酸钠溶液显碱性,但碳酸钠属于盐,此选项错误;
B、有机物都含有碳元素,含碳元素的化合物不一定是有机物,如:一氧化碳、二氧化碳含有碳元素,但属于无机物,此选项错误;
C、单质由同种元素组成,由同种元素组成的纯净物一定是单质,此选项正确;
D、洗涤剂除油污是利用乳化原理,汽油除油污是利用溶解原理,此选项错误。
故选C。
8.B
【详解】
A、葡萄糖是由葡萄糖分子构成,;葡萄糖分子由C、H、O三种原子构成,错误;
B、根据化学式可知,葡萄糖分子中碳、氢、氧元素的原子个数比6:12:6=1:2:1,正确;
C、葡萄糖中碳、氢、氧元素的质量比为(12×6):12:(16×6)=6:1:8,故氧元素的质量分数最大,错误;
D、葡萄糖含碳元素,属于有机物,但是相对分子质量较小,不是有机高分子化合物,错误。
故选B。
9.A
【详解】
A、反应①②的化学方程式可知,该过程体现无机物与有机物可相互转化,故选项正确;
B、由物质的微观构成可知,甲为CH4、乙为CO、丙为H2、丁为C2H5OH,CO属于氧化物,C2H5OH不属于氧化物,故选项错误;
C、甲(CH4)中氢元素的质量分数为,丁(C2H5OH)中氢元素的质量分数为 ,故选项错误;
D、根据反应①的化学方程式可知,转化①中乙和丙的分子个数之比为1:2,故选项错误。
故选:A。
10.D
【详解】
A、①酸雨的pH小于5.6,说法正确;
②人体胃液中含有盐酸帮助消化,错误;
不完全正确,不符合题意;
B、①电离时产生的阴离子都是氢氧根离子的化合物是碱,故碱溶液中都存在OH–,正确;
②氢氧化钙俗称消石灰、熟石灰,生石灰是氧化钙的俗称,错误;
不完全正确,不符合题意;
C、①盐溶液不都是中性的,如碳酸钠显碱性,错误;
②纯碱是碳酸钠的俗称,碳酸钠是由钠离子和碳酸根离子构成的化合物,属于盐,正确;
不完全正确,不符合题意;
D、①有机物都含有碳元素,说法正确;
②甲烷是最简单的有机物,说法正确。
完全正确,符合题意。
故选D。
11.C
【详解】
A、由质量守恒定律可知,化学反应前后,原子的种类与数目保持不变。反应前有:6个碳原子、12个氢原子和6个氧原子;反应后有:4个碳原子、12个氢原子和2个氧原子,所以2X中含有2个碳原子和4个氧原子,则X的化学式为CO2,选项说法正确;
B、淀粉、葡萄糖都属于糖类,选项说法正确;
C、淀粉遇到碘的单质会变蓝色,而加碘食盐中没有碘的单质,遇到淀粉和葡萄糖均无任何现象,无法区分,选项说法错误;
D、酒精燃烧生成二氧化碳和水,选项说法正确。
故选C。
12.B
【详解】
A、酸与碱相互交换成分生成盐和水,而有盐和水生成的反应不一定是酸与碱的反应,如金属氧化物与酸反应、非金属氧化物与碱反应等,故错误。
B、收集比空气轻的气体可用向下排空气法,能用向下排空气法收集的气体一定比空气轻, 故正确。
C、根据把含碳元素的一类化合物称之为有机物,而含碳化合物不都是有机物,如CO、CO2、 碳酸钙等化合物属于无机物,故错误。
D、活泼金属与稀硫酸反应放出气体,能与稀硫酸反应放出气体的物质不一定是金属,例如碳酸钙与盐酸反应放出二氧化碳气体,故错。
故选B。
13.C
【详解】
化学式为:C2H4O2;A.醋酸属于有机化合物,选项错误;B.一个醋酸分子是由两个碳原子、四个氢原子和两个氧原子构成,选项错误;C.醋酸中碳氢氧的所占的相对质量依次为:24、4、32,其中养养神的相对质量最大,故氧元素的质量分数最大,故选项正确;D.相对分子质量的单位为一,不是g,选项错误;故选C
14.B
【详解】
A、环已胺含碳元素,属于有机物,但是相对分子质量很小,不属于高分子化合物,不符合题意;
B、由题意可知,环已胺与NaOH反应能合成甜蜜素,故可以与碱反应,符合题意;
C、环己胺中C、H、N元素的质量比为:(12×6):13:14,故氢元素的质量分数最小,不符合题意;
D、环己胺由环己胺分子构成,每个环己胺分子由6个碳原子、13个氢原子、1个氮原子构成,不符合题意。
故选B。
15.D
【详解】
A、由化学式可知,单宁酸是由碳、氢、氧三种元素组成,符合有机物的结构特点,属于有机物,选项正确,不符合题意;
B、由图可知,单宁酸的分子是由碳原子、氢原子和氧原子直接构成的,选项正确,不符合题意;
C、单宁酸中,碳、氢、氧三种元素的质量比为(12×76):(1×52):(16×46)=228:13:184,所以单宁酸中氢元素的质量分数最小,选项正确,不符合题意;
D、单宁酸中碳、氧两种元素的质量比(12×76):(16×46)=57: 46,选项错误,符合题意,故选D。
16.B
【详解】
A、由结构示意图,甲基丙烯酸甲酯的化学式为C5H8O2,甲基丙烯酸甲酯是碳元素化合物,但其相对分子质量比较小,属有机小分子,故选项说法错误;
B、一个甲基丙烯酸甲酯分子由5个碳原子、8个氢原子和2个氧原子构成,所以一个甲基丙烯酸甲酯分子中碳、氢原子个数比为5:8,故选项说法正确;
C、物质由元素组成,甲基丙烯酸甲酯是由碳、氢、氧三种元素组成的,元素是宏观概念,只讲种类,不讲个数,故选项说法错误;
D、甲基丙烯酸甲酯中碳、氢、氧三种元素的质量比为(12×5):(1×8):(16×2)=15:2:8,所以甲基丙烯酸甲酯中氢元素的质量分数最小,但不能说甲基丙烯酸甲酯分子中氢元素的质量分数最小,故选项说法错误。
故选B。
17. 有机物 1:8 不断搅拌 5%
【详解】
(1)乙醇和醋酸都是含碳化合物且具有有机物的性质,所以属于有机物。
(2)醋酸(CH 3COOH)中H、O两种元素的质量比为(1×4):(16×2)=1:8。
(3)向烧杯中逐滴滴加该白醋,不断搅拌,当红色恰好变成无色时,消耗白醋12g。可知消耗的氢氧化钠的质量为10g×4%=0.4g
设该白醋中醋酸的质量分数为x
x=5%。
故答案为(1)有机物。(2)1:8。(3)不断搅拌; 5%。
18. 氧气(O2) 、 热固性 使温度达到着火点 增大木柴与空气的接触面积 +5 pH试纸 维生素
【详解】
(1)铁生锈的条件是与氧气、水接触,潮湿的铁器生锈还需氧气(O2);铁锅的把柄应是木柄或热固性塑料柄;(2)一个“小火星”引燃了油库燃烧大爆炸,从燃烧的三个条件认识,“小火星”的作用是使温度达到着火点;(3) (3)用木柴烧火做饭,木柴架空燃烧,火更旺,原因是:增大木柴与空气的接触面积;(4)碘酸钙[Ca(IO3)2]中含有钙、氧、碘三种元素,其中属于微量元素的是碘;钙元素显+2,氧元素显-2,设碘素的化合价是x,根据在化合物中正负化合价代数和为零,则(+2)+2x+(-2)×3×2=0,则x=+5;(5)常用pH试纸测定食醋酸度,用食醋凉拌黄瓜生吃能补充人体需要的维生素。
19.(1)有机
(2)6:1:8;53.3%
(3)C6H12O6+6O26CO2+6H2O;30
【详解】
(1)有机物指含有碳元素的化合物,除了碳的氧化物、碳酸盐等少数不具备有机化合物特点的化合物,葡萄糖中含有碳元素且具备有机化合物特点,因此属于有机物。故填:有机。
(2)根据葡萄糖的化学式C6H12O6可计算C、H、O三种元素的质量比为,葡萄糖中氧元素的质量分数为:。故填:6:1:8,53.3%。
(3)葡萄糖在氧气中燃烧,生成二氧化碳和水,化学方程式为:,若反应生成了44g二氧化碳,设消耗葡萄糖的质量为x,则
x=30g
因此,消耗的葡萄糖的质量为30g。故填:,30。
20. 小麦粉、食用植物油 洗涤液和残留固体 打开止水夹,向装置内通入一段时间氮气,关闭止水夹 确保样品中碳酸钠不损失,全部参与反应 0.212
【详解】
Ⅰ.定性判断:取少量待检液于试管中,加入足量稀盐酸,有气泡产生;
将产生的气体通入澄清石灰水,澄清石灰水变浑浊, 饼干中含有;
[交流讨论](1)饼干中的小麦粉、食用植物油可以提供糖类和脂肪供给人体生命需要;
(2)二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,该反应的化学方程式为:;
[深入探究]碳酸钙、碳酸钠都属于碳酸盐,都含有碳酸根能够和稀盐酸反应生成二氧化碳,但碳酸钙是不溶于水的物质,将剩余待检液过滤,用蒸馏水洗涤固体2至3次,将洗涤液和残留固体分别与稀盐酸反应,均有气泡产生,则可证明饼干中既有碳酸钙,又有碳酸钠;
[实验步骤] ⑦实验前开始通氮气是将装置内的二氧化碳、水蒸气除去,防止干扰实验结果,实验结束后再通入氮气是将残留再装置内的二氧化碳全部被吸收,具体操作为打开止水夹,向装置内通入一段时间氮气,关闭止水夹;
[交流讨论]步骤③将滤液和洗涤液合并的原因:确保样品中碳酸钠不损失,全部参与反应;
[数据处理] m2-m1=0.088g,说明生成了0.088g二氧化碳,设这包饼干中碳酸钠的质量为
答:这包饼干中碳酸钠质量为0.212g。
21.(1) 蒸馏 蒸发结晶 蛋白质
(2) C 氯化铵##NH4Cl 原料易得,经济,且氨气、二氧化碳可循环利用
(3) 熟石灰
碳酸钠会与母液中的氯化钙、氯化镁反应生成难溶于水的碳酸钙和微溶于水的碳酸镁,导致镁元素的沉淀富集效率降低,且混合沉淀难以分离
【分析】
(1)
①工业上常采用蒸馏法从海水中获取大量淡水,解决淡水危机;利用蒸发结晶的基本原理从海水中提取大量盐类,用作化工原料;
③海洋鱼类、海参、龙虾富含的营养素是蛋白质;
(2)
①A、加入过量的氯化钡溶液,氯化钡和硫酸钠反应生成硫酸钡和氯化钠,加入过量的氢氧化钠溶液,氢氧化钠和氯化镁反应生成氢氧化镁和氯化钠,加入过量的碳酸钠溶液,碳酸钠和氯化钙反应生成碳酸钙和氯化钠,碳酸钠和过量的氯化钡反应生成碳酸钡和氯化钠,故加入的三种溶液的顺序可以调整,但是加入碳酸钠一定要在加入氯化钡之后,才能将氯化钡除去,不符合题意;
B、由以上分析可知,按流程Ⅰ所加溶液的顺序除杂,过滤后得到碳酸钙、碳酸钡、氢氧化镁、硫酸钡四种沉淀,不符合题意;
C、由以上分析可知,加入三种溶液将粗盐水中的、Mg2+、Ca2+转化为沉淀,符合题意。
故选C;
②流程Ⅱ中,氯化钠、氨气、二氧化碳和水反应生成碳酸氢钠和氯化铵,碳酸氢钠结晶析出,过滤后的滤液主要含有氯化铵;
③从原料和循环利用的角度分析,海水制碱是以氯化钠溶液、氨气、二氧化碳为原料,原料易得,经济,且氨气、二氧化碳可循环利用;
(3)
①假设用氢氧化钠和氢氧化钙分别制取m吨氢氧化镁,所需氢氧化钠的质量为:
所需氢氧化钙的质量为:
购买氢氧化钠的价格为:;
购买氢氧化钙的价格为:
故试剂X应该选择上述化工原料中的熟石灰更适宜;
②加入试剂X后,氢氧化钙和氯化镁反应生成氢氧化镁和氯化钙,该反应的化学方程式为:;
③碳酸钠会与母液中的氯化钙、氯化镁反应生成难溶于水的碳酸钙和微溶于水的碳酸镁,导致镁元素的沉淀富集效率降低,且混合沉淀难以分离。故不选择碳酸钠。
22. 蛋白质 I或碘元素 C C 除去溶液中的Ca2+、Ba2+ HCl Cl2 74.1g
【详解】
(1)鱼虾富含的蛋白质是机体生长及修补受损组织的主要原料,海带富含的I或碘元素可以预防甲状腺肿大。
(2)①从海水中获得淡水可采取的方法是吸附法,故选C。
②水变成水蒸气的过程中,没有新物质生成,发生变化的是分子间隔,分子个数、分子质量、分子种类均不变,故选C。
(3)镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡;完全反应后,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子;故步骤③加过量Na2CO3溶液的目的是除去溶液中的钙离子和钡离子。
(4)①步骤II中反应是氢氧化镁和稀盐酸反应生成氯化镁和水,试剂a的化学式是HCl。
②步骤Ⅲ是一个分解反应,反应是氯化镁通电生成镁和氯气,则另一生成物的化学式为Cl2。
(5)50°C氯化钠饱和溶液的质量分数为,配制200克10%的氯化钠溶液时,设需50°C氯化钠饱和溶液质量为x,,,则需50°C氯化钠饱和溶液中质量为74.1g。
答案第1页,共2页
一、选择题(共16题)
1.下列物质中,属于碳水化合物的是( )
A.油脂 B.醋酸 C.葡萄糖 D.食盐
2.下列元素中,摄入不足会影响青少年骨骼发育的是( )
A.钙 B.氟 C.碘 D.硒
3.下列广受新疆消费者欢迎的食品中主要含糖类的是
A.红花醋 B.馕
C.蔬菜 D.烤肉
4.有研究表明,“MERS”(中东呼吸综合征)病毒进入人体后,会破坏呼吸系统细胞里的酶,使其丧失应有的功能,从而导致患者呼吸窘迫。这里的“酶”其实是一种
A.维生素 B.蛋白质 C.糖类 D.油脂
5.分类是一种重要的研究方法。以下对常见物质(或其主要成分)的分类正确的是( )
A.有机物:CH4、H2CO3、CH3COOH B.盐:纯碱、食盐、石灰石
C.混合物:石油、蔗糖水、冰水混合物 D.金属材料:不锈钢、铜丝、金刚石
6.“关爱生命,拥抱健康”是永恒的主题。下列做法不会损害人体健康的是
A.用甲醛的水溶液浸泡海产品延长保质期 B.用含小苏打的发酵粉焙制糕点
C.使用聚氯乙烯薄膜包装食品 D.用“瘦肉精”提高猪的瘦肉率
7.推理是化学学习中常用的思维方法,下列推理正确的是
A.碱溶液一定显碱性,则显碱性的溶液一定是碱溶液
B.有机物都含有碳元素,则含碳元素的化合物一定是有机物
C.单质由同种元素组成,则由同种元素组成的纯净物一定是单质
D.洗涤剂除油污是利用乳化原理,则汽油除油污也是利用乳化原理
8.葡萄糖是己醛糖,化学式C6H12O6,白色晶体,易溶于水。下列有关叙述正确的是
A.葡萄糖是由碳、氢、氧三种原子构成
B.葡萄糖分子中碳、氢、氧元素的原子个数比1:2:1
C.葡萄糖中碳元素的质量分数最大
D.葡萄糖是有机高分子化合物
9.以甲为原料合成化工产品丁的微观过程如图。下列说法正确的是
A.该过程体现无机物与有机物可相互转化 B.乙、丁为氧化物
C.甲中氢元素的质量分数小于丁 D.转化①中乙和丙的分子个数之比为1:1
10.以下归纳和总结完全正确的一组是
A.对酸的认识 B.对碱的认识
①酸雨的pH小于5.6 ②人体胃液中含有硫酸帮助消化 ①碱溶液中都存在OH– ②氢氧化钙俗称消石灰、生石灰
C.对盐的认识 D.对有机物的认识
①盐溶液都是中性的 ②纯碱不是碱而是碳酸盐 ①有机物都含有碳元素 ②甲烷是最简单的有机物
A.A B.B C.C D.D
11.已知:① ;② 。下列说法不正确的是( )
A.X的化学式为CO2 B.淀粉、葡萄糖都属于糖类
C.用加碘食盐可区分淀粉和葡萄糖 D.酒精燃烧生成二氧化碳和水
12.推理是化学学习中常用的方法。下列推理正确的是
A.酸与碱反应生成盐和水,生成盐和水的反应一定是酸与碱的反应
B.收集比空气轻的气体可用向下排气法,能用向下排气法收集的气体一定比空气轻
C.有机物是指含碳元素的化合物,含碳元素的化合物一定是有机物
D.活泼金属与稀硫酸反应放出气体,能与稀硫酸反应放出气体的物质一定是金属
13.食醋是厨房中的一种调味品,其中含有少量醋酸,醋酸的分子结构模型如图所示,下列有关醋酸的说法正确的是
A.醋酸不属于有机化合物
B.醋酸是由两个碳原子、四个氢原子和两个氧原子构成
C.醋酸中氧元素的质量分数最大
D.醋酸的相对分子质量为60g
14.环已胺(C6H11NH2)与NaOH反应能合成甜蜜素。下列对环己胺的叙述正确的是
A.从类别上看:环已胺属于有机高分子
B.从性质上看:环己胺可以与碱发生反应
C.从组成上看:环己胺中氢元素质量分数最大
D.从结构上看:环己胺由6个碳原子、13个氢原子、1个氮原子构成
15.“信阳毛尖”是一种绿茶,绿茶中含有的单宁酸(化学式为)具有抑制血压上升,清热解毒等功效。下列有关单宁酸的说法不正确的是
A.它属于有机物 B.它的分子由碳原子、氢原子和氧原子构成的
C.氢元素的质量分数最小 D.碳、氧两种元素的质量比为76:46
16.有机玻璃是由甲基丙烯酸甲酯(C5H8O2)聚合而成的,下列关于甲基丙烯酸甲酯的说法正确的是
A.甲基丙烯酸甲酯是有机高分子化合物
B.甲基丙烯酸甲酯分子中碳、氢原子个数比为5:8
C.甲基丙烯酸甲酯是由碳、氢、氧三个元素组成的
D.甲基丙烯酸甲酯分子中氢元素的质量分数最小
二、综合题(共6题)
17.醋是常用的调味品,某厂生产的“XX牌”白醋色泽透亮、酸味醇正。
(1)传统醋酸多以碎米为原料,经过一系列工艺处理后,再用酵母发酵成乙醇,最后氧化为醋酸(CH3COOH)。乙醇和醋酸属于_____(填“有机物”或“无机物”)。
(2)醋酸中H、O两种元素的质量比为_____(填最简整数比)。
(3)兴趣小组为测定该品牌白醋中醋酸的质量分数(白醋中的酸均视为醋酸),进行了如下实验:
步骤1:取溶质质量分数为4%的氢氧化钠溶液10g于烧杯中,滴入几滴酚酞试液;
步骤2:向烧杯中逐滴滴加该白醋,_____(填操作),当红色恰好变成无色时,消耗白醋12g。(测定原理:,请计算该白醋中醋酸的质量分数。_____。
18.请运用你在初中学过的化学知识和技能,解决下列生活中的实际问题
(1)潮湿的铁器生锈,还需____________;铁锅的把柄应是木柄或____________塑料柄(填“热塑性”或“热固性”)
(2)一个“小火星”引燃了油库燃烧大爆炸,从燃烧的三个条件认识,“小火星”的作用是____________________________________________
(3)用木柴烧火做饭,木柴架空燃烧,火更旺,原因是______________________
(4)目前一种叫碘酸钙[Ca(IO3)2]的保健品已进入一些超市,Ca(IO3)2中I的化合价为_________。
(5)打开食醋的瓶盖,会闻到一股酸味,粗略测定食醋的酸度,常用________________;用食醋凉拌黄瓜生吃能补充人体需要的_______________
19.葡萄糖(C6H12O6)是生物体内新陈代谢不可缺少的营养它的氧化反应放出热量是人类生命活动所需能量的重要来源。
(1)葡萄糖属于_____(填“有机”或“无机”)化合物。
(2)葡萄糖中碳、氢、氧元素的质量比为 _____,葡萄糖中氧元素质量分数为____(精确到0.1%)。
(3)葡萄糖在氧气中燃烧,生成二氧化碳和水。该反应的化学方程式为_______________,若反应生成了44g二氧化碳,消耗了葡萄糖____g。
20.某品牌梳打饼干的配料和营养成分如下表,研究性学习小组对其成分进行了探究。
配料 营养成分(每100克)
小麦粉、食用植物油、洋葱粉、食用盐、碳酸钙、食品添加剂(碳酸氢钠)、香葱、酵母、麦精、食用香精等 能量 蛋白质 脂肪 碳水化合物 钠 钙 2017千焦 8.5克 21.0克 63.5克 500毫克 280毫克
说明:饼干制作的烘焙过程中,配料中的碳酸氢钠全部受热分解转化为碳酸钠,而碳酸钙不分解。
Ⅰ.定性判断:饼干中有关成分的确认。
取一小包饼干,研碎后放入烧杯,加入适量蒸馏水,用玻璃棒搅拌,得到待检液。
实验操作和现象 实验结论
碳酸盐的检验 取少量待检液于试管中,加入足量稀盐酸,有气泡产生; 将产生的气体通入澄清石灰水,澄清石灰水变浑浊。 饼干中含有____________(填离子符号)
【交流讨论】
(1)饼干中的_________可以提供能量供给人体生命活动需要。
(2)上述实验中石灰水变浑浊的原因是(用化学方程式表示):__________。
【深入探究】如何进一步确认饼干中含有两种碳酸盐?
将剩余待检液过滤,用蒸馏水洗涤固体2至3次;将_________与稀盐酸反应,根据相应的现象,则可证明饼干中既有碳酸钙,又有碳酸钠。
Ⅱ.定量检测:饼干中碳酸钠质量的测定。
【实验装置】
【实验步骤】
①按图连接好装置,检查气密性;
②取一小包饼干研碎后放入烧杯,加入适量蒸馏水,用玻璃棒充分搅拌后,过滤、洗涤;
③将滤液和洗涤液合并后倒入容器A,按图示装入其他药品(试剂X用于吸收挥发出来的HCl,它不与CO2反应);
④打开止水夹,向装置中通入一段时间N2后,关闭止水夹;
⑤用电子天平称量干燥管Ⅰ的质量,记录数据m1;
⑥逐滴加入稀盐酸至不再产生气泡时,停止滴加;
⑦__________。
⑧重复步骤⑤,记录数据m2。
【交流讨论】步骤③将滤液和洗涤液合并的原因是__________。
【数据处理】m2-m1=0.088g,则这包饼干中碳酸钠的质量为__________g。
21.2019 年 2 月 26 日,我国“海洋地质十号”调查船完成中巴印度洋联合海洋地质科学考察,返抵广州。“海洋地质十号”由中国自主设计、建造,可以实现在全球无限航区开展海洋地质调查工作。它助力科学家们对海底世界的新认知,新发现与新开发。
(1)人类正在运用各种方法,开采、提取多种海洋资源。
①海水化学资源:工业上常采用___法从海水中获取大量淡水,解决淡水危机。利用_______的基本原理从海水中提取大量盐类,用作化工原料。
②海底矿产资源:海底蕴含着煤、石油、天然气等数百种矿产资源。
③海洋鱼类、海参、龙虾富含的营养素是_______________。
(2)某工厂利用海水制造纯碱,生产工艺流程如图所示:
①对于流程Ⅰ中加入的三种溶液,下列说法正确的是_______________。
A.加入的三种溶液的顺序不可以调整
B.按流程Ⅰ所加溶液的顺序除杂,过滤后得到三种沉淀
C.加入三种溶液将粗盐水中的、Mg2+、Ca2+转化为沉淀
②经过流程Ⅱ过滤后的滤液主要含有_______________。
③从原料和循环利用的角度分析海水制碱生产流程的优点_______________。
(3)目前世界上60%的镁是从海水中提取的,其主要步骤如图所示:
部分物质的溶解性表
Na+ Mg2+ Ca2+
Cl- 溶 溶 溶
OH- 溶 不 微
溶 微 不
①已知部分化工原料的市场价格为:烧碱3200元/吨,熟石灰1200元/吨。工业上为了达到更高的生产效率效益,你认为如图中的试剂X应该选择上述化工原料中的____更适宜。
②加入试剂X后,发生反应的化学方程式为_______。
③综合如图和表中的信息,试分析工业上通常不选择碳酸钠作试剂X的理由___。
22.我国有漫长的海岸线,海洋蕴藏着丰富的资源。请按要求填空:
(1)海洋为我们提供了营养丰富的食材。鱼虾富含的_____是机体生长及修补受损组织的主要原料,海带富含的_____可以预防 甲状腺肿大。
(2)海水淡化可缓解淡水资源匮乏问题。
①从海水中获得淡水可采取的方法是_____(填字母) ;
A 过滤法 B 蒸馏法 C 吸附法
②水变成水蒸气的过程中,发生变化的是_____ (填字母序号)。
A 分子个数
B 分子质量
C 分子间隔
D 分子种类
(3)为了除去粗盐溶液中的Ca2+、Mg2+、SO42-,可按照下列实验步骤进行:①加过量BaC12溶液②加过量NaOH溶液③加过量Na2CO3溶液④过滤⑤加入适量盐酸。其中步骤③加过量Na2CO3溶液的目的是_____。
(4)利用苦卤制取镁,主要流程如图:
①步骤II中的试剂a的化学式是_____;
②步骤Ⅲ是一个分解反应,则另一生成物的化学式:_____。
(5)下表为氯化钠在不同温度时的溶解度。结合表中数据回答:
温度/°C 30 50 70 100
溶解度/g 36.3 37.0 37.8 39.8
配制200克10%的氯化钠溶液时,需50°C氯化钠饱和溶液中质量为_____ g(精确到0.1克)。
试卷第1页,共3页
参考答案:
1.C
【详解】
糖类物质由碳、氢、氧三种元素组成,且其中氢、氧原子个数比等于2:1,所以被称为碳水化合物,葡萄糖属于糖类,故选C。
2.A
【详解】
A、幼儿及青少年缺钙会得佝偻病和发育不良,老年人缺钙会发生骨质疏松,容易骨折,正确;
B、氟能防治龋齿,缺乏易患龋齿,错误;
C、碘是合成甲状腺激素的主要元素,缺乏会患甲状腺肿大和呆小症,错误;
D、硒有防癌抗癌作用,缺少硒易患表皮角化和癌症,错误。
故选A。
3.B
【详解】
A、红花醋中含有醋酸、水等,不属于糖类,错误;
B、馕中富含淀粉,淀粉属于糖类,正确;
C、蔬菜中富含维生素,错误;
D、烤肉中富含油脂和蛋白质,错误。故选B。
4.B
【详解】
酶(enzyme)由生物体内活细胞产生的一种生物催化剂。大多数由蛋白质组成(少数为RNA)。能在机体中十分温和的条件下,高效率地催化各种生物化学反应,促进生物体的新陈代谢。生命活动中的消化、吸收、呼吸、运动和生殖都是酶促反应过程。酶是细胞赖以生存的基础。细胞新陈代谢包括的所有化学反应几乎都是在酶的催化下进行的。故选B。
5.B
【详解】
A、H2CO3属于无机物,分类错误;
B、纯碱(碳酸钠)、食盐(氯化钠)、石灰石(碳酸钙)均属于盐,分类正确;
C、冰水混合物中只含水一种物质,是纯净物,分类错误;
D、金刚石是碳单质,属于非金属,分类错误。
故选:B。
6.B
【详解】
A、甲醛有毒,能破坏人体蛋白质的结构,使蛋白质变性,不能用甲醛水溶液浸泡海产品,不符合题意;B、小苏打是碳酸氢钠,能与面粉发酵时生成的酸性物质反应生成二氧化碳气体使糕点疏松,可用作发酵粉,不会损害人体健康,符合题意;C、聚氯乙烯塑料在使用时会分解出对健康有害的物质而污染食品,不宜用来包装食品,不符合题意;D、食用含有瘦肉精的肉会对身体产生危害,常见的有恶心、头晕、四肢无力、手颤等中毒症状,特别对心脏病、高血压患者危害更大,长期食用则可能导致染色体基变,诱发恶性肿瘤,不符合题意。故选B。
7.C
【详解】
A、碱溶液一定显碱性,显碱性的溶液不一定是碱溶液,如:碳酸钠溶液显碱性,但碳酸钠属于盐,此选项错误;
B、有机物都含有碳元素,含碳元素的化合物不一定是有机物,如:一氧化碳、二氧化碳含有碳元素,但属于无机物,此选项错误;
C、单质由同种元素组成,由同种元素组成的纯净物一定是单质,此选项正确;
D、洗涤剂除油污是利用乳化原理,汽油除油污是利用溶解原理,此选项错误。
故选C。
8.B
【详解】
A、葡萄糖是由葡萄糖分子构成,;葡萄糖分子由C、H、O三种原子构成,错误;
B、根据化学式可知,葡萄糖分子中碳、氢、氧元素的原子个数比6:12:6=1:2:1,正确;
C、葡萄糖中碳、氢、氧元素的质量比为(12×6):12:(16×6)=6:1:8,故氧元素的质量分数最大,错误;
D、葡萄糖含碳元素,属于有机物,但是相对分子质量较小,不是有机高分子化合物,错误。
故选B。
9.A
【详解】
A、反应①②的化学方程式可知,该过程体现无机物与有机物可相互转化,故选项正确;
B、由物质的微观构成可知,甲为CH4、乙为CO、丙为H2、丁为C2H5OH,CO属于氧化物,C2H5OH不属于氧化物,故选项错误;
C、甲(CH4)中氢元素的质量分数为,丁(C2H5OH)中氢元素的质量分数为 ,故选项错误;
D、根据反应①的化学方程式可知,转化①中乙和丙的分子个数之比为1:2,故选项错误。
故选:A。
10.D
【详解】
A、①酸雨的pH小于5.6,说法正确;
②人体胃液中含有盐酸帮助消化,错误;
不完全正确,不符合题意;
B、①电离时产生的阴离子都是氢氧根离子的化合物是碱,故碱溶液中都存在OH–,正确;
②氢氧化钙俗称消石灰、熟石灰,生石灰是氧化钙的俗称,错误;
不完全正确,不符合题意;
C、①盐溶液不都是中性的,如碳酸钠显碱性,错误;
②纯碱是碳酸钠的俗称,碳酸钠是由钠离子和碳酸根离子构成的化合物,属于盐,正确;
不完全正确,不符合题意;
D、①有机物都含有碳元素,说法正确;
②甲烷是最简单的有机物,说法正确。
完全正确,符合题意。
故选D。
11.C
【详解】
A、由质量守恒定律可知,化学反应前后,原子的种类与数目保持不变。反应前有:6个碳原子、12个氢原子和6个氧原子;反应后有:4个碳原子、12个氢原子和2个氧原子,所以2X中含有2个碳原子和4个氧原子,则X的化学式为CO2,选项说法正确;
B、淀粉、葡萄糖都属于糖类,选项说法正确;
C、淀粉遇到碘的单质会变蓝色,而加碘食盐中没有碘的单质,遇到淀粉和葡萄糖均无任何现象,无法区分,选项说法错误;
D、酒精燃烧生成二氧化碳和水,选项说法正确。
故选C。
12.B
【详解】
A、酸与碱相互交换成分生成盐和水,而有盐和水生成的反应不一定是酸与碱的反应,如金属氧化物与酸反应、非金属氧化物与碱反应等,故错误。
B、收集比空气轻的气体可用向下排空气法,能用向下排空气法收集的气体一定比空气轻, 故正确。
C、根据把含碳元素的一类化合物称之为有机物,而含碳化合物不都是有机物,如CO、CO2、 碳酸钙等化合物属于无机物,故错误。
D、活泼金属与稀硫酸反应放出气体,能与稀硫酸反应放出气体的物质不一定是金属,例如碳酸钙与盐酸反应放出二氧化碳气体,故错。
故选B。
13.C
【详解】
化学式为:C2H4O2;A.醋酸属于有机化合物,选项错误;B.一个醋酸分子是由两个碳原子、四个氢原子和两个氧原子构成,选项错误;C.醋酸中碳氢氧的所占的相对质量依次为:24、4、32,其中养养神的相对质量最大,故氧元素的质量分数最大,故选项正确;D.相对分子质量的单位为一,不是g,选项错误;故选C
14.B
【详解】
A、环已胺含碳元素,属于有机物,但是相对分子质量很小,不属于高分子化合物,不符合题意;
B、由题意可知,环已胺与NaOH反应能合成甜蜜素,故可以与碱反应,符合题意;
C、环己胺中C、H、N元素的质量比为:(12×6):13:14,故氢元素的质量分数最小,不符合题意;
D、环己胺由环己胺分子构成,每个环己胺分子由6个碳原子、13个氢原子、1个氮原子构成,不符合题意。
故选B。
15.D
【详解】
A、由化学式可知,单宁酸是由碳、氢、氧三种元素组成,符合有机物的结构特点,属于有机物,选项正确,不符合题意;
B、由图可知,单宁酸的分子是由碳原子、氢原子和氧原子直接构成的,选项正确,不符合题意;
C、单宁酸中,碳、氢、氧三种元素的质量比为(12×76):(1×52):(16×46)=228:13:184,所以单宁酸中氢元素的质量分数最小,选项正确,不符合题意;
D、单宁酸中碳、氧两种元素的质量比(12×76):(16×46)=57: 46,选项错误,符合题意,故选D。
16.B
【详解】
A、由结构示意图,甲基丙烯酸甲酯的化学式为C5H8O2,甲基丙烯酸甲酯是碳元素化合物,但其相对分子质量比较小,属有机小分子,故选项说法错误;
B、一个甲基丙烯酸甲酯分子由5个碳原子、8个氢原子和2个氧原子构成,所以一个甲基丙烯酸甲酯分子中碳、氢原子个数比为5:8,故选项说法正确;
C、物质由元素组成,甲基丙烯酸甲酯是由碳、氢、氧三种元素组成的,元素是宏观概念,只讲种类,不讲个数,故选项说法错误;
D、甲基丙烯酸甲酯中碳、氢、氧三种元素的质量比为(12×5):(1×8):(16×2)=15:2:8,所以甲基丙烯酸甲酯中氢元素的质量分数最小,但不能说甲基丙烯酸甲酯分子中氢元素的质量分数最小,故选项说法错误。
故选B。
17. 有机物 1:8 不断搅拌 5%
【详解】
(1)乙醇和醋酸都是含碳化合物且具有有机物的性质,所以属于有机物。
(2)醋酸(CH 3COOH)中H、O两种元素的质量比为(1×4):(16×2)=1:8。
(3)向烧杯中逐滴滴加该白醋,不断搅拌,当红色恰好变成无色时,消耗白醋12g。可知消耗的氢氧化钠的质量为10g×4%=0.4g
设该白醋中醋酸的质量分数为x
x=5%。
故答案为(1)有机物。(2)1:8。(3)不断搅拌; 5%。
18. 氧气(O2) 、 热固性 使温度达到着火点 增大木柴与空气的接触面积 +5 pH试纸 维生素
【详解】
(1)铁生锈的条件是与氧气、水接触,潮湿的铁器生锈还需氧气(O2);铁锅的把柄应是木柄或热固性塑料柄;(2)一个“小火星”引燃了油库燃烧大爆炸,从燃烧的三个条件认识,“小火星”的作用是使温度达到着火点;(3) (3)用木柴烧火做饭,木柴架空燃烧,火更旺,原因是:增大木柴与空气的接触面积;(4)碘酸钙[Ca(IO3)2]中含有钙、氧、碘三种元素,其中属于微量元素的是碘;钙元素显+2,氧元素显-2,设碘素的化合价是x,根据在化合物中正负化合价代数和为零,则(+2)+2x+(-2)×3×2=0,则x=+5;(5)常用pH试纸测定食醋酸度,用食醋凉拌黄瓜生吃能补充人体需要的维生素。
19.(1)有机
(2)6:1:8;53.3%
(3)C6H12O6+6O26CO2+6H2O;30
【详解】
(1)有机物指含有碳元素的化合物,除了碳的氧化物、碳酸盐等少数不具备有机化合物特点的化合物,葡萄糖中含有碳元素且具备有机化合物特点,因此属于有机物。故填:有机。
(2)根据葡萄糖的化学式C6H12O6可计算C、H、O三种元素的质量比为,葡萄糖中氧元素的质量分数为:。故填:6:1:8,53.3%。
(3)葡萄糖在氧气中燃烧,生成二氧化碳和水,化学方程式为:,若反应生成了44g二氧化碳,设消耗葡萄糖的质量为x,则
x=30g
因此,消耗的葡萄糖的质量为30g。故填:,30。
20. 小麦粉、食用植物油 洗涤液和残留固体 打开止水夹,向装置内通入一段时间氮气,关闭止水夹 确保样品中碳酸钠不损失,全部参与反应 0.212
【详解】
Ⅰ.定性判断:取少量待检液于试管中,加入足量稀盐酸,有气泡产生;
将产生的气体通入澄清石灰水,澄清石灰水变浑浊, 饼干中含有;
[交流讨论](1)饼干中的小麦粉、食用植物油可以提供糖类和脂肪供给人体生命需要;
(2)二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,该反应的化学方程式为:;
[深入探究]碳酸钙、碳酸钠都属于碳酸盐,都含有碳酸根能够和稀盐酸反应生成二氧化碳,但碳酸钙是不溶于水的物质,将剩余待检液过滤,用蒸馏水洗涤固体2至3次,将洗涤液和残留固体分别与稀盐酸反应,均有气泡产生,则可证明饼干中既有碳酸钙,又有碳酸钠;
[实验步骤] ⑦实验前开始通氮气是将装置内的二氧化碳、水蒸气除去,防止干扰实验结果,实验结束后再通入氮气是将残留再装置内的二氧化碳全部被吸收,具体操作为打开止水夹,向装置内通入一段时间氮气,关闭止水夹;
[交流讨论]步骤③将滤液和洗涤液合并的原因:确保样品中碳酸钠不损失,全部参与反应;
[数据处理] m2-m1=0.088g,说明生成了0.088g二氧化碳,设这包饼干中碳酸钠的质量为
答:这包饼干中碳酸钠质量为0.212g。
21.(1) 蒸馏 蒸发结晶 蛋白质
(2) C 氯化铵##NH4Cl 原料易得,经济,且氨气、二氧化碳可循环利用
(3) 熟石灰
碳酸钠会与母液中的氯化钙、氯化镁反应生成难溶于水的碳酸钙和微溶于水的碳酸镁,导致镁元素的沉淀富集效率降低,且混合沉淀难以分离
【分析】
(1)
①工业上常采用蒸馏法从海水中获取大量淡水,解决淡水危机;利用蒸发结晶的基本原理从海水中提取大量盐类,用作化工原料;
③海洋鱼类、海参、龙虾富含的营养素是蛋白质;
(2)
①A、加入过量的氯化钡溶液,氯化钡和硫酸钠反应生成硫酸钡和氯化钠,加入过量的氢氧化钠溶液,氢氧化钠和氯化镁反应生成氢氧化镁和氯化钠,加入过量的碳酸钠溶液,碳酸钠和氯化钙反应生成碳酸钙和氯化钠,碳酸钠和过量的氯化钡反应生成碳酸钡和氯化钠,故加入的三种溶液的顺序可以调整,但是加入碳酸钠一定要在加入氯化钡之后,才能将氯化钡除去,不符合题意;
B、由以上分析可知,按流程Ⅰ所加溶液的顺序除杂,过滤后得到碳酸钙、碳酸钡、氢氧化镁、硫酸钡四种沉淀,不符合题意;
C、由以上分析可知,加入三种溶液将粗盐水中的、Mg2+、Ca2+转化为沉淀,符合题意。
故选C;
②流程Ⅱ中,氯化钠、氨气、二氧化碳和水反应生成碳酸氢钠和氯化铵,碳酸氢钠结晶析出,过滤后的滤液主要含有氯化铵;
③从原料和循环利用的角度分析,海水制碱是以氯化钠溶液、氨气、二氧化碳为原料,原料易得,经济,且氨气、二氧化碳可循环利用;
(3)
①假设用氢氧化钠和氢氧化钙分别制取m吨氢氧化镁,所需氢氧化钠的质量为:
所需氢氧化钙的质量为:
购买氢氧化钠的价格为:;
购买氢氧化钙的价格为:
故试剂X应该选择上述化工原料中的熟石灰更适宜;
②加入试剂X后,氢氧化钙和氯化镁反应生成氢氧化镁和氯化钙,该反应的化学方程式为:;
③碳酸钠会与母液中的氯化钙、氯化镁反应生成难溶于水的碳酸钙和微溶于水的碳酸镁,导致镁元素的沉淀富集效率降低,且混合沉淀难以分离。故不选择碳酸钠。
22. 蛋白质 I或碘元素 C C 除去溶液中的Ca2+、Ba2+ HCl Cl2 74.1g
【详解】
(1)鱼虾富含的蛋白质是机体生长及修补受损组织的主要原料,海带富含的I或碘元素可以预防甲状腺肿大。
(2)①从海水中获得淡水可采取的方法是吸附法,故选C。
②水变成水蒸气的过程中,没有新物质生成,发生变化的是分子间隔,分子个数、分子质量、分子种类均不变,故选C。
(3)镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡;完全反应后,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子;故步骤③加过量Na2CO3溶液的目的是除去溶液中的钙离子和钡离子。
(4)①步骤II中反应是氢氧化镁和稀盐酸反应生成氯化镁和水,试剂a的化学式是HCl。
②步骤Ⅲ是一个分解反应,反应是氯化镁通电生成镁和氯气,则另一生成物的化学式为Cl2。
(5)50°C氯化钠饱和溶液的质量分数为,配制200克10%的氯化钠溶液时,设需50°C氯化钠饱和溶液质量为x,,,则需50°C氯化钠饱和溶液中质量为74.1g。
答案第1页,共2页
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
