第9章溶液基础夯实--2021-2022学年九年级化学京改版(2013)下册(word版含解析)
文档属性
| 名称 | 第9章溶液基础夯实--2021-2022学年九年级化学京改版(2013)下册(word版含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 199.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-30 00:00:00 | ||
图片预览


文档简介
第9章溶液
一、选择题(共16题)
1.现有两杯20℃时的食盐饱和溶液,甲为500g,乙为1000g,在温度不变的情况下分别蒸发掉15g水,析出食盐晶体的质量分别为m克和n克,则m、n的关系是
A.n=2m B.n=m C.m=2n D.无法确定
2.下列物质分别放入水中,能形成溶液的是
A.碳酸钙粉末 B.白砂糖 C.菜籽油 D.面粉
3.下列饮料中,不属于溶液的是
A.汽水 B.白酒 C.牛奶 D.苏打水
4.下列有关溶液的说法中,正确的是( )
A.溶液都是无色、透明的
B.均一、稳定的液体都是溶液
C.溶液中只能有两种物质
D.一种物质以分子或离子的形式分散到另一种物质中
5.把下列厨房里的调味剂分别放入水中,充分搅拌,不能形成溶液的是
A.味精 B.花生油 C.蔗糖 D.食盐
6.实验室中,区分下列物质的两个实验方案都合理的是
选项 需区分的物质 方案一 方案二
A 5mL汽油和5mL蒸馏水 分别投入1-2小粒碘 点燃
B 硝酸铵和氯化钠 溶于水,测温度 尝味道
C 蒸馏水和5%的过氧化氢溶液 加入少量二氧化锰 伸入带火星的木条
D 木炭粉和氧化铜粉末 看颜色 点燃
A.A B.B C.C D.D
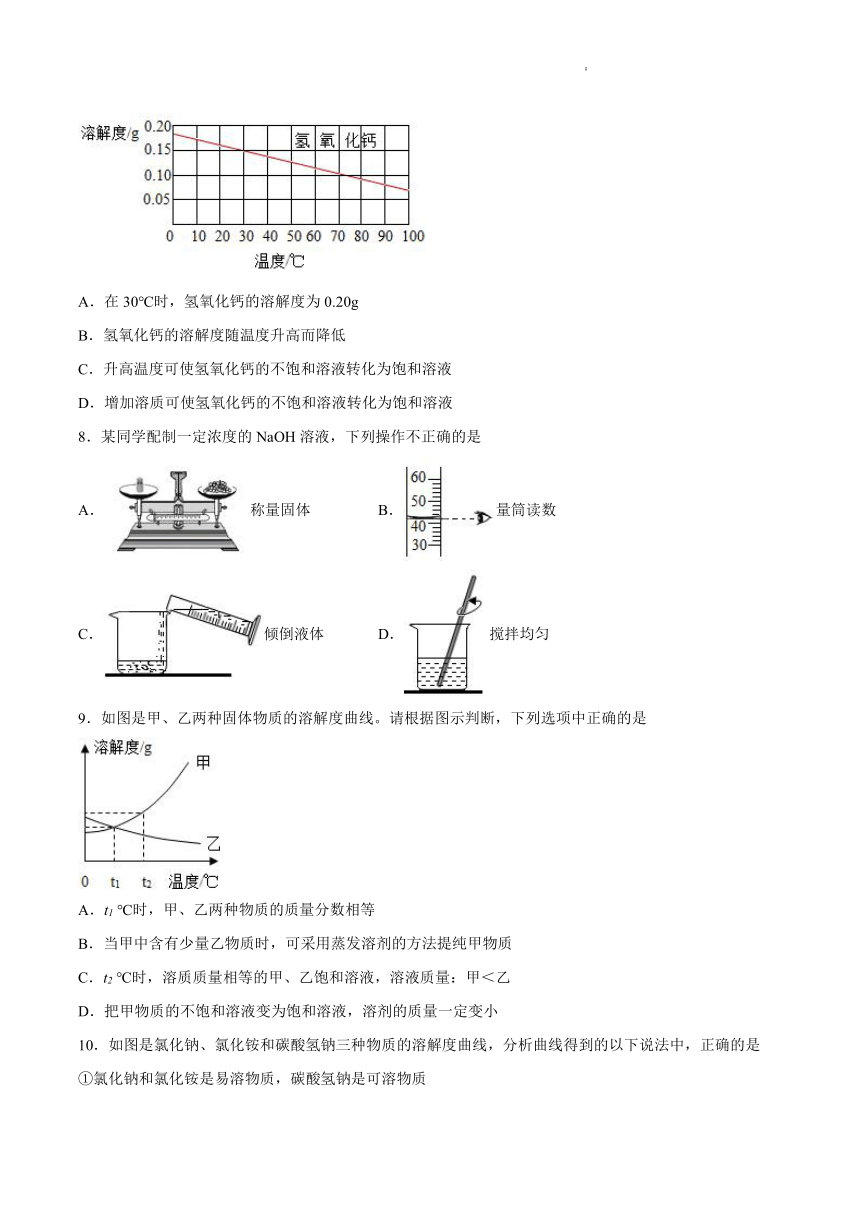
7.如图是氢氧化钙的溶解度曲线图,下列有关叙述错误的是
A.在30℃时,氢氧化钙的溶解度为0.20g
B.氢氧化钙的溶解度随温度升高而降低
C.升高温度可使氢氧化钙的不饱和溶液转化为饱和溶液
D.增加溶质可使氢氧化钙的不饱和溶液转化为饱和溶液
8.某同学配制一定浓度的NaOH溶液,下列操作不正确的是
A.称量固体 B.量筒读数
C.倾倒液体 D.搅拌均匀
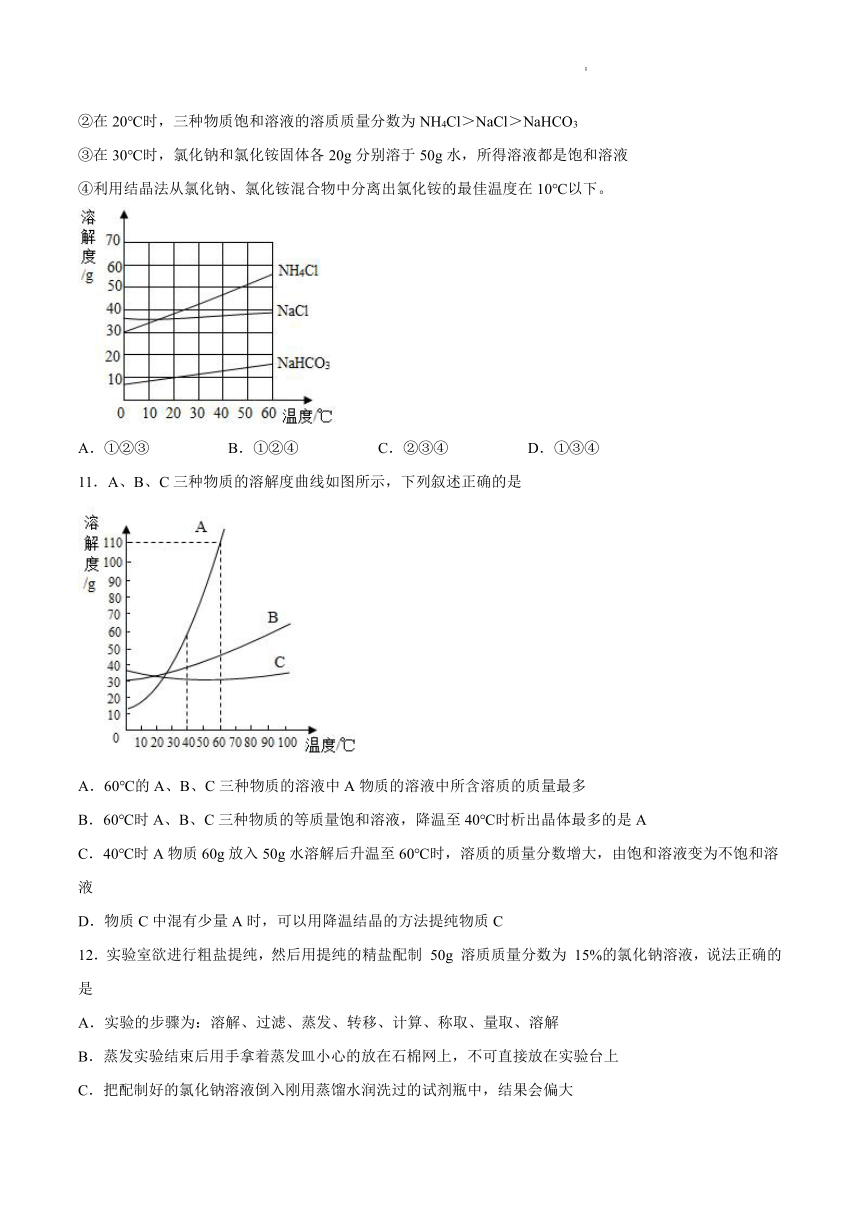
9.如图是甲、乙两种固体物质的溶解度曲线。请根据图示判断,下列选项中正确的是
A.t1 ℃时,甲、乙两种物质的质量分数相等
B.当甲中含有少量乙物质时,可采用蒸发溶剂的方法提纯甲物质
C.t2 ℃时,溶质质量相等的甲、乙饱和溶液,溶液质量:甲<乙
D.把甲物质的不饱和溶液变为饱和溶液,溶剂的质量一定变小
10.如图是氯化钠、氯化铵和碳酸氢钠三种物质的溶解度曲线,分析曲线得到的以下说法中,正确的是
①氯化钠和氯化铵是易溶物质,碳酸氢钠是可溶物质
②在20℃时,三种物质饱和溶液的溶质质量分数为NH4Cl>NaCl>NaHCO3
③在30℃时,氯化钠和氯化铵固体各20g分别溶于50g水,所得溶液都是饱和溶液
④利用结晶法从氯化钠、氯化铵混合物中分离出氯化铵的最佳温度在10℃以下。
A.①②③ B.①②④ C.②③④ D.①③④
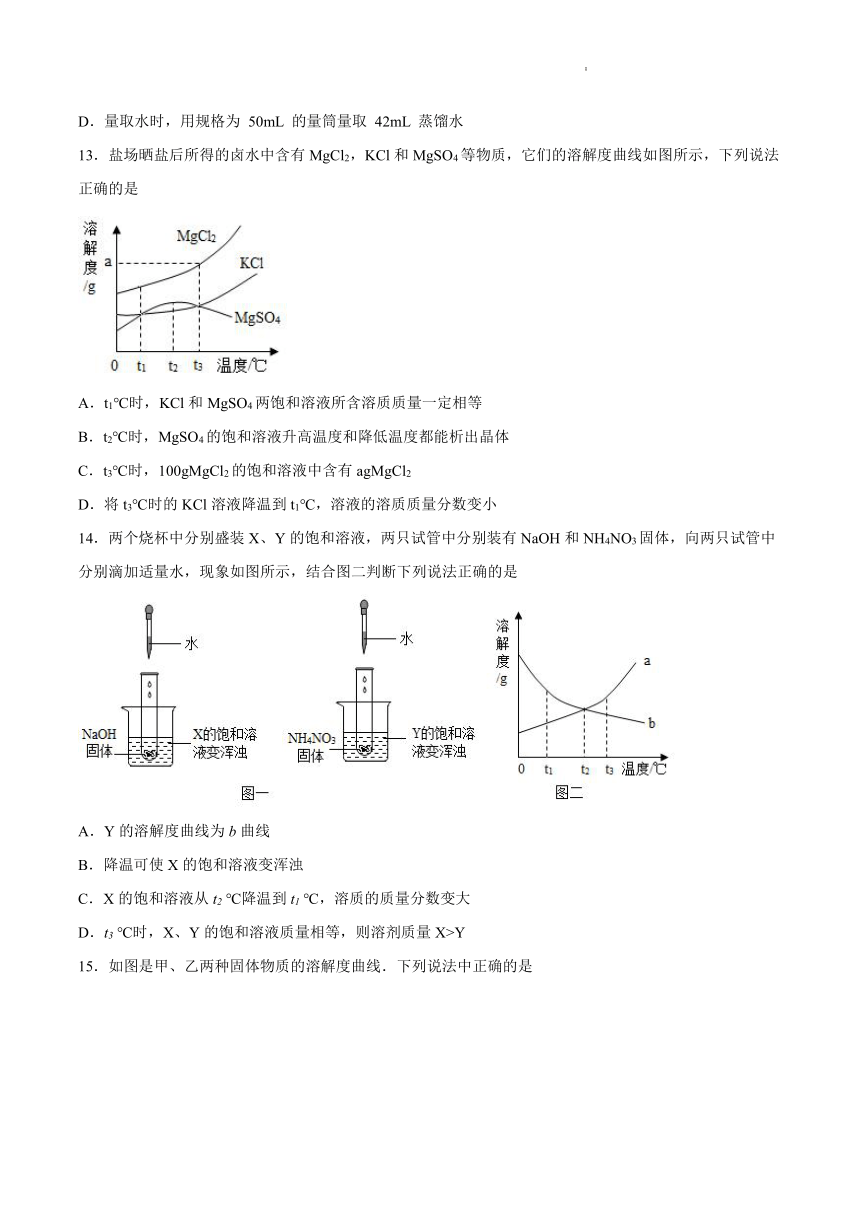
11.A、B、C三种物质的溶解度曲线如图所示,下列叙述正确的是
A.60℃的A、B、C三种物质的溶液中A物质的溶液中所含溶质的质量最多
B.60℃时A、B、C三种物质的等质量饱和溶液,降温至40℃时析出晶体最多的是A
C.40℃时A物质60g放入50g水溶解后升温至60℃时,溶质的质量分数增大,由饱和溶液变为不饱和溶液
D.物质C中混有少量A时,可以用降温结晶的方法提纯物质C
12.实验室欲进行粗盐提纯,然后用提纯的精盐配制 50g 溶质质量分数为 15%的氯化钠溶液,说法正确的是
A.实验的步骤为:溶解、过滤、蒸发、转移、计算、称取、量取、溶解
B.蒸发实验结束后用手拿着蒸发皿小心的放在石棉网上,不可直接放在实验台上
C.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,结果会偏大
D.量取水时,用规格为 50mL 的量筒量取 42mL 蒸馏水
13.盐场晒盐后所得的卤水中含有MgCl2,KCl和MgSO4等物质,它们的溶解度曲线如图所示,下列说法正确的是
A.t1℃时,KCl和MgSO4两饱和溶液所含溶质质量一定相等
B.t2℃时,MgSO4的饱和溶液升高温度和降低温度都能析出晶体
C.t3℃时,100gMgCl2的饱和溶液中含有agMgCl2
D.将t3℃时的KCl溶液降温到t1℃,溶液的溶质质量分数变小
14.两个烧杯中分别盛装X、Y的饱和溶液,两只试管中分别装有NaOH和NH4NO3固体,向两只试管中分别滴加适量水,现象如图所示,结合图二判断下列说法正确的是
A.Y的溶解度曲线为b曲线
B.降温可使X的饱和溶液变浑浊
C.X的饱和溶液从t2 ℃降温到t1 ℃,溶质的质量分数变大
D.t3 ℃时,X、Y的饱和溶液质量相等,则溶剂质量X>Y
15.如图是甲、乙两种固体物质的溶解度曲线.下列说法中正确的是
A.甲的溶解度大于乙的溶解度
B.30℃时,甲的饱和溶液中溶质的质量分数为30%
C.乙物质的溶解度受温度变化的影响较小,甲物质的溶解度受温度变化的影响较大
D.甲中含有少量乙时,用蒸发溶剂的方法提纯甲
16.将家庭中常用的四种调味品分别放入水中,不能形成溶液的是( )
A.醋
B.蔗糖
C.面粉
D.食盐
二、综合题(共6题)
17.某铁矿粉,主要成分为铁的氧化物(Fe2O3),一学生利用实验作进一步分析。过程及数据如下(注:铁矿粉中杂质不参与下列过程的反应)
步骤一:取29g该铁矿粉在CO气流中充分加热,将反应后的气体用烧碱溶液充分吸收,烧碱溶液增重13.2g。
步骤二:将上述加热后的固体取出后,再向固体图滴加入稀硫酸,测得产生气体与滴入稀硫酸的质量关系如图:
通过计算回答下列问题:
(1)步骤一中生产气体的质量_____g,步骤二中固体充分燃充分反应后,产生气体的质量为______g。
(2)所用稀硫酸溶液的溶质质量分数为_________________(写出具体计算步骤)。
(3)该铁的氧化物化学式为( )(填字母)。
A.Fe2O3 B.FeO C.Fe3O4
18.在实验室中可选择如图装置制取气体。
(1)图中标号①的仪器名称是_______。
(2)若选择A、F组合一套装置制取了某气体,请写出有关反应的化学方程式_______。
(3)①收集二氧化碳所选用的装置为_______。(填字母)
②若用D装置收集氧气,则验满的方法是_______。
③已知某气体可用E装置收集,若改用G装置收集,则该气体应从_______口进(填“a”或“b”)。
(4)实验室制取二氧化碳,其发生装置可选择B或C,与B相比较,C的主要优点是什么?_____。写出实验室制取二氧化碳的方程式:_______。
(5)100g某硫酸溶液恰好和13g锌完全反应。试计算这种硫酸溶液中溶质的质量分数_____。
19.用珍珠加工成的“珍珠粉”是一种名贵中药材、保健品,可近年来市场上出现了一些假冒的“珍珠粉”,仅用肉眼观察难辨真假.为了向消费者提供鉴别方法,须找出真假“珍珠粉”理化性质上的差异.为此,某工商局提供了真、假“珍珠粉”样品和有关真假珍珠粉的资料如表:
品种 外观 成分 制作过程
真珍珠粉 白色无味粉末 主要为碳酸钙,可能含少量碳酸镁、壳角蛋白等. 直接将珍珠磨成粉末.
假珍珠粉 白色无味粉末 贝壳粉(主要成分为CaCO3),可能含少量碳酸镁并掺有少量淀粉. 将贝壳漂白(漂白过程中用到过NaOH),然后磨成粉末.
其中,真珍珠粉中的壳角蛋白(蛋白质的一种)不溶于水,加入浓硝酸加热后会变黄色.某研究性学习小组对提供的真假珍珠粉进行了如下探究.
【探究一】对真假珍珠粉的初步鉴定:
(1)真、假珍珠粉均属于 _____ (“纯净物”或“混合物”).取少量珍珠粉样品于试管中,加入 _____ 并加热,若观察到变黄色,则该样品是真珍珠粉.
(2)另取少量市售廉价珍珠粉于试管中,加入足量水振荡后静置,将上层清液分别倒入2支试管中,向一支试管中滴加 _____ ,混合液变成蓝色,说明其中掺有淀粉;再向另一支试管中加入1~2滴 _____ ,溶液变成微红色,说明在漂白贝壳的过程中用到过氢氧化钠,使溶液呈碱性.
【探究二】测定市售珍珠粉中碳酸钙的质量分数:
步骤Ⅰ:连接仪器组成如图1所示实验装置.某学生堵住C末端玻璃导管口,在A中装入少量水并取下上部塞子,打开玻璃活塞,A中水不能全部滴下,你认为该装置是否漏气? _____ (填“漏气”或“不漏气”)
步骤Ⅱ:准确称取5.00g珍珠粉样品装入仪器B中,在A中装入一定浓度的稀盐酸.
步骤Ⅲ:向B中珍珠粉样品中滴加足量的稀盐酸.在仪器B、C中可观察到的现象分别为 _____ 、 _____ .
步骤Ⅳ:完全反应后C中的混合液经 _____ 、 _____ 、干燥,称得白色固体的质量为9.85g(不考虑装置中原有空气及装置外空气的影响),由此求得珍珠粉样品中碳酸钙的质量分数为100%.
【实验反思】这个测定结果令研究小组的同学们感到难以理解,经过讨论分析,大家认为可能的原因是 _____ .(填数字序号)
①样品中含有碳酸镁 ②盐酸未滴加足量
③CO2气流速度太快导致未被Ba(OH)2完全吸收 ④装置B中水蒸气、HCl等进入装置C中
【拓展延伸】同学们根据测定数据计算出样品中碳酸根离子的质量分数为 _____ %.
有同学提出在探究二中不需要装置C,只要用电子天平准确称量装置A、B反应前后的总质量,也可以求得珍珠粉样品中碳酸根离子的质量分数.你认为这样求得的碳酸根离子的质量分数与上面所得数值相比,将会 _____ (填“不变”、“偏大”或“偏小”).后来,同学们经过精确测定,得到所加稀盐酸与产生的二氧化碳气体质量关系如图2所示.
【分析讨论】
(1)在加入稀盐酸的过程中,开始没有气体产生,是因为固体样品中还含有少量 _____ (填“碳酸镁”或“氢氧化钠”)的缘故.
(2)根据图示,求出所用稀盐酸的溶质质量分数 ____ ?(需有计算过程)
20.人类的日常生活和工农业生产离不开水和溶液。请回答下列问题:
(1)如图所示,三个实验分别用到水。
请回答:
①实验A中热水的作用是提供热量和 ________ 。
②实验B能说明CO2可溶于水,同时发生的化学反应方程式为 ______ 。
③实验C,滴加水后看到U型管中 ______ (填“左边”或“右边”)液面升高。
(2)如图D是甲乙两种物质的溶解度曲线(不含结晶水)请回答下列问题:
①t1℃时,甲的溶解度是 _____ 。 ②下列说法一定正确的是 _______
A.甲的溶解度比乙的溶解度大
B.t1℃时,甲、乙的饱和溶液的溶质的质量分数相等
C.常温下,乙易溶于水
D.从t2℃降至t1℃,甲、乙溶液中均有晶体析出
③某同学设计的鉴别甲、乙固体的方案如下:t2℃时,取4.0g甲和4.0g乙分别放入两只小烧杯中,各加入10mL水(水的密度为1g/mL),用玻璃棒充分搅拌后,观察现象。你认为此方案是否可行?并说明理由 ____ 。
④甲中混有少量的乙,要提纯甲,实验步骤:加水溶解,蒸发浓缩, __________ ,然后过滤。
21.水是宝贵的自然资料,让我们一起走进“水”的世界。
①下图电解水实验中,反应的化学方程式是___。水电解过程发生改变的微粒名称是______。
②医疗上常用0.9%NaCl溶液作生理盐水,配制1000g生理盐水需要氯化钠固体的质量为_______还可以制取碳酸饮料,该过程中发生反应的化学方程式为_____________。
③某化学兴趣小组欲进行粗盐的初步提纯。粗盐的提纯实验步骤包括:a计算产率,b过滤,c溶解,d蒸发,e称量。实验步骤的正确顺序是:e、_________、a(填序号)。若NaCl的产率偏低,则可能的原因是_________(填字母)。
A.过滤时滤纸有破损B.蒸发后所得精盐未完全蒸干,含有水
C.溶解含泥沙的粗食盐时,加入的水量不足
提示:产率=×100%
④已知KCl的溶解度20℃时为34g/100g水,40℃时为40g/100g水。某实验小组做了如下实验。
A中所得溶液中溶质与溶剂的质量比为__________;溶质的质量分数相等的是___________。
I. B和CII. B和EⅢ. C和DIV. D和E
22.水是宝贵的自然资源,对于人类生活、生产都具有重要意义。
(1)水的组成
有关水的组成和结构的叙述中,正确的是____(填字母);
A.水中氢、氧元素的质量比为2 :1 B.水是由水分子构成的
C.水分子是由氢分子和氧原子构成的 D.保持水的化学性质的最小微粒是氢原子和氧原子
(2)水的性质
① 少量下列物质加入到水中,充分搅拌后,可以得到溶液的是_______。
A.牛奶 B.蔗糖 C.面粉 D.花生油
② 实验室中用5g氯化钠配成溶质质量分数为10%的氯化钠溶液,则需加入蒸馏水______mL,所配溶液质量分数偏小的原因可能是______________。(填一种即可)
③ 甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图。下列说法不正确的是_______。
A.t1℃时,三种物质的溶解度:乙>甲=丙
B.20℃时,将30g甲放入50g水中,充分搅拌,所得溶液的质量是70g
C.分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体质量最大
D.t2℃时将相同质量的甲、乙、丙三种物质分别加入到100g水中充分溶解后,若只有一种固体物质没有完全溶解,则该固体一定是丙
(3)水的用途
①实验A中水作_____(填“溶剂”或“溶质”)。
②实验B中水的作用是提供热量和______________。
③实验C中的水作________________。
④灭火时将水喷成细雾状的主要原因是______(选填编号)。
A.降低着火点 B.增大与可燃物接触面积 C.与空气中气体反应生成CO2 D.隔离氧气
试卷第1页,共3页
参考答案:
1.B
【详解】
两溶液为相同温度下,同溶质的饱和溶液,析出的食盐可看作是蒸发掉的水中溶解的食盐,蒸发掉的水的质量相同,则析出食盐晶体的质量也相同。故选B。
2.B
【详解】
A、碳酸钙粉末不溶于水,与水混合形成的是悬浊液,故A错误;
B、白砂糖易溶于水,形成均一、稳定的混合物,属于溶液,故B正确;
C、菜籽油不溶于水,与水混合形成的是乳浊液,不均一、不稳定,故C错误;
D、面粉不溶于水,混合后形成的是悬浊液,故D错误。故选B。
3.C
【详解】
A、汽水是均一稳定的混合物,是溶液。
B、白酒是均一稳定的混合物,是溶液。
C、牛奶不是均一稳定的混合物,不是溶液。
D、苏打水是均一稳定的混合物,是溶液。
故选C。
4.D
【详解】
A、溶液不一定是无色的,如常见的硫酸铜溶液(蓝色)、氯化铁溶液(黄色)等都是有色溶液,故A错误;
B、均一、稳定的液体可以是单一液体,即纯净物,比如水等,故B错误;
C、溶液里最少含有两种物质,也可以含有多种物质,故C错误;
D、在分散时该种物质(即溶质)可以以离子或分子的形式分散到另一种物质里(即溶剂),故D正确;
故选D。
5.B
【详解】
A、味精能溶于水形成均一稳定的溶液,故不符合题意;
B、花生油不溶于水,放入水中不能形成均一稳定的溶液,故符合题意;
C、蔗糖能溶于水形成均一稳定的溶液,故不符合题意;
D、食盐能溶于水形成均一稳定的溶液,故不符合题意。
6.A
【详解】
A、取样品,加入碘,可以溶解碘的是汽油,不能溶解碘的是蒸馏水,现象不同,可以鉴别;点燃,可以燃烧的是汽油,不能燃烧的是蒸馏水,现象不同,可以鉴别,故A正确;B、在实验室不能品尝任何药品的味道,故B错误;C、5%的过氧化氢溶液在不加催化剂的条件下,放出氧气的速率较慢,也不能使带火星的木条复燃,蒸馏水也不会放出氧气,现象相同,不能鉴别,故C错误;D、氧化铜和木炭粉都是黑色粉末,观察颜色的方法不能鉴别,故D错误。故选A。
7.A
【详解】
A、根据氢氧化钙的溶解度曲线图,不难看出,在30℃时,氢氧化钙的溶解度为0.15g,故A错误;
B、根据溶解度曲线图可知氢氧化钙的溶解度随温度的升高而减小,故B正确;
C、由于氢氧化钙的溶解度随温度的升高而减小,因此升高温度可使氢氧化钙的不饱和溶液转化饱和溶液,故C正确;
D、对于任何物质的溶液而言,都可以通过增加溶质的方法使它的不饱和溶液转化为饱和溶液,故D正确。
故选A。
8.A
【详解】
A、称量固体要左物右码,且氢氧化钠要放在玻璃器皿中称量,错误;
B、量筒读数时,视线要与凹液面最低处水平,正确;
C、倾倒液体时容器口紧挨,沿器壁慢慢倒入,正确;
D、使用玻璃棒可以搅拌均匀,正确;
故选A。
9.C
【详解】
A.由图可知,t1 ℃时,甲、乙两种物质的溶解度相等,质量分数不一定相等,故错误;
B.由图可知,甲的溶解度受温度的影响变化较大,当甲中含有少量乙物质时,可采用降温结晶的方法提纯甲物质,故错误;
C. t2 ℃时,甲的溶解度大于乙的溶解度,溶质质量相等的甲、乙饱和溶液,溶液质量:甲<乙,正确;
D. 把甲物质的不饱和溶液变为饱和溶液,若采用增加溶质的方法则溶剂的质量不变,故错误。
故选C。
10.B
【详解】
①在20℃时,氯化钠和氯化铵的溶解度大于10g,是易溶物质;碳酸氢钠的溶解度大于1g小于10g,是可溶物质,故正确;
②在20℃时,三种物质的溶解度是为NH4Cl>NaCl>NaHCO3,由饱和溶液的溶质质量分数=100%,故三种物质饱和溶液的溶质质量分数为NH4Cl>NaCl>NaHCO3 ,故正确;
③30℃时,氯化铵的溶解度大于40g,20g氯化铵能完全溶于50g水,所得溶液不是饱和溶液,氯化钠的溶解度小于40g,20g氯化钠不能全部溶解,所得溶液是饱和溶液,故错误;
④10℃以下氯化铵的溶解度比氯化钠的溶解度小很多,利用结晶法从氯化钠、氯化铵混合物中分离出氯化铵的最佳温度在10℃以下,故正确。
答案B。
11.B
【详解】
试题分析:A、60℃时,A、B、C三种物质的溶解度大小关系是A>B>C>,所以A、B、C三种物质的饱和溶液中A物质的溶液中所含溶质的质量最多,而这里没有指明是饱和溶液,错误,B、通过溶解度曲线图,可看出物质A的溶解度随温度的升高而变化最大,所以60℃时A、B、C三种物质的等质量饱和溶液,降温至40℃时析出晶体最多的是A,正确, C、60℃时,A的溶解度小于110g,表示在100g溶剂中,达到饱和状态溶解A的质量最多是110g,所以在50 g水中最多能溶解55g,故40℃时A物质60g放入50g水溶解后升温至60℃时,固体不能全部溶解,溶液仍然是饱和,错误,D、由于C物质的溶解度随温度的升高而变化不大,所以物质C中混有少量A时,可以用蒸发结晶的方法提纯C,错误,故选B
12.A
【详解】
A. 粗盐提纯的实验步骤是:溶解、过滤、蒸发、转移;配制 50g 溶质质量分数为 15%的氯化钠溶液实验的步骤为:计算、称取、量取、溶解,此选项正确;
B. 蒸发实验结束后用坩埚钳拿着蒸发皿小心的放在石棉网上,不能用手去拿,不可直接放在实验台上,此选项错误;
C. 刚用蒸馏水润洗过的试剂瓶,瓶壁沾有水,把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,溶剂增多,结果会偏小,此选项错误;
D. 所需水的质量为:50g×(1-15%)=42.5g,量取水时,用规格为 50mL 的量筒量取 42.5mL 蒸馏水,此选项错误。故选A。
13.B
【详解】
A. t1℃时,质量不相等的KCl和MgSO4两饱和溶液所含溶质质量不相等,错误;B. t2℃时,MgSO4的饱和溶液升高温度和降低温度溶解度都变小,故都能析出晶体,正确;C. t3℃时,(100+a)gMgCl2的饱和溶液中含有agMgCl2 ,错误;D. 将t3℃时的KCl的饱和溶液溶液降温到t1℃,溶液的溶质质量分数变小,错误。故选B。
14.D
【详解】
NaOH溶于水放热,NH4NO3 溶于水吸热。A. Y的溶解度曲线为a曲线,故A错误;B.升温可使X的饱和溶液变浑浊,故B错误;C. X的饱和溶液溶解度曲线是b,从t2 ℃降温到t1 ℃,溶质的质量分数不变,故C错误;D. t3 ℃时,X溶解度小于Y溶解度,饱和溶液质量相等,则溶剂质量X>Y,故D正确。
15.C
【详解】
A.在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。由图可知,温度会影响物质的溶解度,不说明温度时,不能比较溶解度的大小。
B、饱和溶液溶质的质量分数=溶解度÷(溶解度+100g)×100%,30℃时,甲的溶解度为30g,其饱和溶液中溶质的质量分数为30g÷(30g+100g) ×100%<30%;
C. 由图可知,当温度变化时,乙物质的溶解度变化较小,所以乙物质的溶解度受温度变化的影响较小,当温度变化时,甲物质的溶解度会有较大的改变,甲物质的溶解度受温度变化的影响较大;
D. 甲物质的溶解度受温度变化的影响较大,且随温度降低而减小;乙物质的溶解度受温度变化的影响较小,而甲中含有少量乙时,用降温结晶的方法提纯甲;选C。
16.C
【详解】
A、醋易溶于水,形成均一、稳定的混合物,属于溶液,选项正确;
B、蔗糖易溶于水,形成均一、稳定的混合物,属于溶液,选项正确;
C、面粉难溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,选项错误;
D、食盐易溶于水,形成均一、稳定的混合物,属于溶液,选项正确,故选C。
17. 13.2 0.6 4.9% B
18. 长颈漏斗 D 将带火星的木条平放在集气瓶口,若木条复燃,证明氧气已满 b 可以控制反应速率 19.6%
19. 混合物 浓硝酸 碘酒或碘水 酚酞 不漏气 产生大量气泡 溶液变浑浊 过滤 洗涤 ① 60% 偏大 NaOH 10%.
20. 隔绝氧气 CO2+H2O=H2CO3 左边 20g BC 可行,t2℃时4g甲能溶解在10g水中形成溶液,而4g乙不能全部溶解在10g水中形成溶液 降温结晶
【详解】
(1)①实验A中热水的作用是提供热量和隔绝氧气,让铜片上的白磷和热水中的白磷形成对比,说明温度达到可燃物的着火点才能燃烧。②二氧化碳与水反应生成碳酸。③硝酸铵溶于水吸收大量的热,锥形瓶内温度降低,压强变小,在大气压的作用下,U型管中左边液面升高。
(2)①由溶解度曲线看出,t1℃时,甲的溶解度是20g。②A.比较溶解度大小,必须指明温度,此选项错误;B.t1℃时,甲、乙的溶解度相等,甲、乙饱和溶液的溶质质量分数相等,此选项正确;C.20℃时,溶解度大于10g的物质是易溶物质,此选项正确;D.甲、乙的饱和溶液从t2℃降至t1℃时,均有晶体析出,此选项错误。故选BC。③可行,t2℃时4g固体能完全溶解在10g水中的是甲,4g固体不能全部溶解在10g水中的是乙。④提纯溶解度受温度影响较大的物质,一般用降温结晶法。
21. 2H2O2H2↑+O2↑ 水分子 9 CO2+H2O=H2CO3 c、b、d、e C 25:100(1:4) II、Ⅲ
【详解】
①水在通电的条件下生成氢气和氧气,化学反应方程式为:2H2O2H2↑+O2↑,水电解过程发生改变的微粒是水分子;②医疗上常用0.9%NaCl溶液作生理盐水,配制1000g生理盐水需要氯化钠固体的质量为1000g×0.9%=9g,制取碳酸饮料是二氧化碳溶于水生成碳酸,发生反应的化学方程式为:CO2+H2OH2CO3;粗盐的提纯实验步骤为:称量、溶解、过滤、蒸发、称量、计算产率;若NaCl的产率偏低,则可能的原因是:溶解含泥沙的粗食盐时,加入的水量不足;过滤时滤纸有破损和蒸发后所得精盐未完全蒸干,含有水则会导致产率偏高;④已知KCl的溶解度20℃时为34g/100g水,则25g氯化钾全部溶解,所以A中所得溶液中溶质与溶剂的质量比为25:100;由于同一温度下物质的溶解度相同,B、E中温度、溶质和溶液质量相同,所以溶质的质量分数相等;根据40℃时为40g/100g水,C中溶液为饱和溶液,溶质质量分数为:,D中加入25g水后,剩余的10g 氯化钾全部溶解,溶液刚好达到饱和,溶质质量分数为:,故C和D溶质的质量分数相等。
22. B B 45 mL 仰视读数(答案合理即可) C 溶剂 隔绝空气 反应物 B
【详解】
(1)根据水的组成和结构分析解答;(2)①一种或几种物质分散到另一种物质中,形成均一的、稳定的混合物叫做溶液,它的基本特征是均一性和稳定性;只有被分散的物质在另一种物质中是可溶的,二者混合后才会形成溶液;②根据溶剂质量等于溶液质量-溶质质量进行分析;③根据固体的溶解度曲线可以:a查出某物质在一定温度下的溶解度,从而确定物质的溶解性,b比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,c判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的;(3)根据水在不同实验中的作用进行分析。(1)A、水中氢、氧元素的质量比为(1×2):16=1:8,错误;B、水是由水分子构成的,正确;C、分子是由原子构成的。水分子是由氢原子和氧原子构成的,错误;D、由分子构成的物质,分子是保持物质化学性质的最小粒子。故保持水的化学性质的最小微粒是水分子,错误。故选B;(2)①A、牛奶不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,错误;B、蔗糖易溶于水,能和水形成均一、稳定的混合物,即能和水形成溶液,正确;C、面粉不易溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,错误;D、花生油不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,错误。故选B。②实验室中用5g氯化钠配成溶质质量分数为10%的氯化钠溶液,则需加入蒸馏水-5g=45g,合45mL,所配溶液质量分数偏小的原因可能是仰视读数;③A、通过分析溶解度曲线可知,t1℃时,三种物质的溶解度:乙>甲=丙,正确;B、20℃时,甲物质的溶解度是40g,所以将30g甲放入50g水中,充分搅拌,所得溶液的质量是70g,正确;C、溶液的质量不能确定,所以分别将t2℃时三种物质的饱和溶液降温到t1℃,析出的晶体质量也不能确定,错误;D、t2℃时,丙物质的溶解度最小,所以将相同质量的甲、乙、丙三种物质分别加入到100g水中充分溶解后,若只有一种固体物质没有完全溶解,则该固体一定是丙,正确。故选C;(3)在溶解过程中,水可以作溶剂;②实验B中水的作用是提供热量和隔绝氧气;③实验C中二氧化碳和水反应生成碳酸,所以水作反应物;④灭火时将水喷成细雾状的主要原因是增大与可燃物接触面积,故选B。
答案第1页,共2页
一、选择题(共16题)
1.现有两杯20℃时的食盐饱和溶液,甲为500g,乙为1000g,在温度不变的情况下分别蒸发掉15g水,析出食盐晶体的质量分别为m克和n克,则m、n的关系是
A.n=2m B.n=m C.m=2n D.无法确定
2.下列物质分别放入水中,能形成溶液的是
A.碳酸钙粉末 B.白砂糖 C.菜籽油 D.面粉
3.下列饮料中,不属于溶液的是
A.汽水 B.白酒 C.牛奶 D.苏打水
4.下列有关溶液的说法中,正确的是( )
A.溶液都是无色、透明的
B.均一、稳定的液体都是溶液
C.溶液中只能有两种物质
D.一种物质以分子或离子的形式分散到另一种物质中
5.把下列厨房里的调味剂分别放入水中,充分搅拌,不能形成溶液的是
A.味精 B.花生油 C.蔗糖 D.食盐
6.实验室中,区分下列物质的两个实验方案都合理的是
选项 需区分的物质 方案一 方案二
A 5mL汽油和5mL蒸馏水 分别投入1-2小粒碘 点燃
B 硝酸铵和氯化钠 溶于水,测温度 尝味道
C 蒸馏水和5%的过氧化氢溶液 加入少量二氧化锰 伸入带火星的木条
D 木炭粉和氧化铜粉末 看颜色 点燃
A.A B.B C.C D.D
7.如图是氢氧化钙的溶解度曲线图,下列有关叙述错误的是
A.在30℃时,氢氧化钙的溶解度为0.20g
B.氢氧化钙的溶解度随温度升高而降低
C.升高温度可使氢氧化钙的不饱和溶液转化为饱和溶液
D.增加溶质可使氢氧化钙的不饱和溶液转化为饱和溶液
8.某同学配制一定浓度的NaOH溶液,下列操作不正确的是
A.称量固体 B.量筒读数
C.倾倒液体 D.搅拌均匀
9.如图是甲、乙两种固体物质的溶解度曲线。请根据图示判断,下列选项中正确的是
A.t1 ℃时,甲、乙两种物质的质量分数相等
B.当甲中含有少量乙物质时,可采用蒸发溶剂的方法提纯甲物质
C.t2 ℃时,溶质质量相等的甲、乙饱和溶液,溶液质量:甲<乙
D.把甲物质的不饱和溶液变为饱和溶液,溶剂的质量一定变小
10.如图是氯化钠、氯化铵和碳酸氢钠三种物质的溶解度曲线,分析曲线得到的以下说法中,正确的是
①氯化钠和氯化铵是易溶物质,碳酸氢钠是可溶物质
②在20℃时,三种物质饱和溶液的溶质质量分数为NH4Cl>NaCl>NaHCO3
③在30℃时,氯化钠和氯化铵固体各20g分别溶于50g水,所得溶液都是饱和溶液
④利用结晶法从氯化钠、氯化铵混合物中分离出氯化铵的最佳温度在10℃以下。
A.①②③ B.①②④ C.②③④ D.①③④
11.A、B、C三种物质的溶解度曲线如图所示,下列叙述正确的是
A.60℃的A、B、C三种物质的溶液中A物质的溶液中所含溶质的质量最多
B.60℃时A、B、C三种物质的等质量饱和溶液,降温至40℃时析出晶体最多的是A
C.40℃时A物质60g放入50g水溶解后升温至60℃时,溶质的质量分数增大,由饱和溶液变为不饱和溶液
D.物质C中混有少量A时,可以用降温结晶的方法提纯物质C
12.实验室欲进行粗盐提纯,然后用提纯的精盐配制 50g 溶质质量分数为 15%的氯化钠溶液,说法正确的是
A.实验的步骤为:溶解、过滤、蒸发、转移、计算、称取、量取、溶解
B.蒸发实验结束后用手拿着蒸发皿小心的放在石棉网上,不可直接放在实验台上
C.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,结果会偏大
D.量取水时,用规格为 50mL 的量筒量取 42mL 蒸馏水
13.盐场晒盐后所得的卤水中含有MgCl2,KCl和MgSO4等物质,它们的溶解度曲线如图所示,下列说法正确的是
A.t1℃时,KCl和MgSO4两饱和溶液所含溶质质量一定相等
B.t2℃时,MgSO4的饱和溶液升高温度和降低温度都能析出晶体
C.t3℃时,100gMgCl2的饱和溶液中含有agMgCl2
D.将t3℃时的KCl溶液降温到t1℃,溶液的溶质质量分数变小
14.两个烧杯中分别盛装X、Y的饱和溶液,两只试管中分别装有NaOH和NH4NO3固体,向两只试管中分别滴加适量水,现象如图所示,结合图二判断下列说法正确的是
A.Y的溶解度曲线为b曲线
B.降温可使X的饱和溶液变浑浊
C.X的饱和溶液从t2 ℃降温到t1 ℃,溶质的质量分数变大
D.t3 ℃时,X、Y的饱和溶液质量相等,则溶剂质量X>Y
15.如图是甲、乙两种固体物质的溶解度曲线.下列说法中正确的是
A.甲的溶解度大于乙的溶解度
B.30℃时,甲的饱和溶液中溶质的质量分数为30%
C.乙物质的溶解度受温度变化的影响较小,甲物质的溶解度受温度变化的影响较大
D.甲中含有少量乙时,用蒸发溶剂的方法提纯甲
16.将家庭中常用的四种调味品分别放入水中,不能形成溶液的是( )
A.醋
B.蔗糖
C.面粉
D.食盐
二、综合题(共6题)
17.某铁矿粉,主要成分为铁的氧化物(Fe2O3),一学生利用实验作进一步分析。过程及数据如下(注:铁矿粉中杂质不参与下列过程的反应)
步骤一:取29g该铁矿粉在CO气流中充分加热,将反应后的气体用烧碱溶液充分吸收,烧碱溶液增重13.2g。
步骤二:将上述加热后的固体取出后,再向固体图滴加入稀硫酸,测得产生气体与滴入稀硫酸的质量关系如图:
通过计算回答下列问题:
(1)步骤一中生产气体的质量_____g,步骤二中固体充分燃充分反应后,产生气体的质量为______g。
(2)所用稀硫酸溶液的溶质质量分数为_________________(写出具体计算步骤)。
(3)该铁的氧化物化学式为( )(填字母)。
A.Fe2O3 B.FeO C.Fe3O4
18.在实验室中可选择如图装置制取气体。
(1)图中标号①的仪器名称是_______。
(2)若选择A、F组合一套装置制取了某气体,请写出有关反应的化学方程式_______。
(3)①收集二氧化碳所选用的装置为_______。(填字母)
②若用D装置收集氧气,则验满的方法是_______。
③已知某气体可用E装置收集,若改用G装置收集,则该气体应从_______口进(填“a”或“b”)。
(4)实验室制取二氧化碳,其发生装置可选择B或C,与B相比较,C的主要优点是什么?_____。写出实验室制取二氧化碳的方程式:_______。
(5)100g某硫酸溶液恰好和13g锌完全反应。试计算这种硫酸溶液中溶质的质量分数_____。
19.用珍珠加工成的“珍珠粉”是一种名贵中药材、保健品,可近年来市场上出现了一些假冒的“珍珠粉”,仅用肉眼观察难辨真假.为了向消费者提供鉴别方法,须找出真假“珍珠粉”理化性质上的差异.为此,某工商局提供了真、假“珍珠粉”样品和有关真假珍珠粉的资料如表:
品种 外观 成分 制作过程
真珍珠粉 白色无味粉末 主要为碳酸钙,可能含少量碳酸镁、壳角蛋白等. 直接将珍珠磨成粉末.
假珍珠粉 白色无味粉末 贝壳粉(主要成分为CaCO3),可能含少量碳酸镁并掺有少量淀粉. 将贝壳漂白(漂白过程中用到过NaOH),然后磨成粉末.
其中,真珍珠粉中的壳角蛋白(蛋白质的一种)不溶于水,加入浓硝酸加热后会变黄色.某研究性学习小组对提供的真假珍珠粉进行了如下探究.
【探究一】对真假珍珠粉的初步鉴定:
(1)真、假珍珠粉均属于 _____ (“纯净物”或“混合物”).取少量珍珠粉样品于试管中,加入 _____ 并加热,若观察到变黄色,则该样品是真珍珠粉.
(2)另取少量市售廉价珍珠粉于试管中,加入足量水振荡后静置,将上层清液分别倒入2支试管中,向一支试管中滴加 _____ ,混合液变成蓝色,说明其中掺有淀粉;再向另一支试管中加入1~2滴 _____ ,溶液变成微红色,说明在漂白贝壳的过程中用到过氢氧化钠,使溶液呈碱性.
【探究二】测定市售珍珠粉中碳酸钙的质量分数:
步骤Ⅰ:连接仪器组成如图1所示实验装置.某学生堵住C末端玻璃导管口,在A中装入少量水并取下上部塞子,打开玻璃活塞,A中水不能全部滴下,你认为该装置是否漏气? _____ (填“漏气”或“不漏气”)
步骤Ⅱ:准确称取5.00g珍珠粉样品装入仪器B中,在A中装入一定浓度的稀盐酸.
步骤Ⅲ:向B中珍珠粉样品中滴加足量的稀盐酸.在仪器B、C中可观察到的现象分别为 _____ 、 _____ .
步骤Ⅳ:完全反应后C中的混合液经 _____ 、 _____ 、干燥,称得白色固体的质量为9.85g(不考虑装置中原有空气及装置外空气的影响),由此求得珍珠粉样品中碳酸钙的质量分数为100%.
【实验反思】这个测定结果令研究小组的同学们感到难以理解,经过讨论分析,大家认为可能的原因是 _____ .(填数字序号)
①样品中含有碳酸镁 ②盐酸未滴加足量
③CO2气流速度太快导致未被Ba(OH)2完全吸收 ④装置B中水蒸气、HCl等进入装置C中
【拓展延伸】同学们根据测定数据计算出样品中碳酸根离子的质量分数为 _____ %.
有同学提出在探究二中不需要装置C,只要用电子天平准确称量装置A、B反应前后的总质量,也可以求得珍珠粉样品中碳酸根离子的质量分数.你认为这样求得的碳酸根离子的质量分数与上面所得数值相比,将会 _____ (填“不变”、“偏大”或“偏小”).后来,同学们经过精确测定,得到所加稀盐酸与产生的二氧化碳气体质量关系如图2所示.
【分析讨论】
(1)在加入稀盐酸的过程中,开始没有气体产生,是因为固体样品中还含有少量 _____ (填“碳酸镁”或“氢氧化钠”)的缘故.
(2)根据图示,求出所用稀盐酸的溶质质量分数 ____ ?(需有计算过程)
20.人类的日常生活和工农业生产离不开水和溶液。请回答下列问题:
(1)如图所示,三个实验分别用到水。
请回答:
①实验A中热水的作用是提供热量和 ________ 。
②实验B能说明CO2可溶于水,同时发生的化学反应方程式为 ______ 。
③实验C,滴加水后看到U型管中 ______ (填“左边”或“右边”)液面升高。
(2)如图D是甲乙两种物质的溶解度曲线(不含结晶水)请回答下列问题:
①t1℃时,甲的溶解度是 _____ 。 ②下列说法一定正确的是 _______
A.甲的溶解度比乙的溶解度大
B.t1℃时,甲、乙的饱和溶液的溶质的质量分数相等
C.常温下,乙易溶于水
D.从t2℃降至t1℃,甲、乙溶液中均有晶体析出
③某同学设计的鉴别甲、乙固体的方案如下:t2℃时,取4.0g甲和4.0g乙分别放入两只小烧杯中,各加入10mL水(水的密度为1g/mL),用玻璃棒充分搅拌后,观察现象。你认为此方案是否可行?并说明理由 ____ 。
④甲中混有少量的乙,要提纯甲,实验步骤:加水溶解,蒸发浓缩, __________ ,然后过滤。
21.水是宝贵的自然资料,让我们一起走进“水”的世界。
①下图电解水实验中,反应的化学方程式是___。水电解过程发生改变的微粒名称是______。
②医疗上常用0.9%NaCl溶液作生理盐水,配制1000g生理盐水需要氯化钠固体的质量为_______还可以制取碳酸饮料,该过程中发生反应的化学方程式为_____________。
③某化学兴趣小组欲进行粗盐的初步提纯。粗盐的提纯实验步骤包括:a计算产率,b过滤,c溶解,d蒸发,e称量。实验步骤的正确顺序是:e、_________、a(填序号)。若NaCl的产率偏低,则可能的原因是_________(填字母)。
A.过滤时滤纸有破损B.蒸发后所得精盐未完全蒸干,含有水
C.溶解含泥沙的粗食盐时,加入的水量不足
提示:产率=×100%
④已知KCl的溶解度20℃时为34g/100g水,40℃时为40g/100g水。某实验小组做了如下实验。
A中所得溶液中溶质与溶剂的质量比为__________;溶质的质量分数相等的是___________。
I. B和CII. B和EⅢ. C和DIV. D和E
22.水是宝贵的自然资源,对于人类生活、生产都具有重要意义。
(1)水的组成
有关水的组成和结构的叙述中,正确的是____(填字母);
A.水中氢、氧元素的质量比为2 :1 B.水是由水分子构成的
C.水分子是由氢分子和氧原子构成的 D.保持水的化学性质的最小微粒是氢原子和氧原子
(2)水的性质
① 少量下列物质加入到水中,充分搅拌后,可以得到溶液的是_______。
A.牛奶 B.蔗糖 C.面粉 D.花生油
② 实验室中用5g氯化钠配成溶质质量分数为10%的氯化钠溶液,则需加入蒸馏水______mL,所配溶液质量分数偏小的原因可能是______________。(填一种即可)
③ 甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图。下列说法不正确的是_______。
A.t1℃时,三种物质的溶解度:乙>甲=丙
B.20℃时,将30g甲放入50g水中,充分搅拌,所得溶液的质量是70g
C.分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体质量最大
D.t2℃时将相同质量的甲、乙、丙三种物质分别加入到100g水中充分溶解后,若只有一种固体物质没有完全溶解,则该固体一定是丙
(3)水的用途
①实验A中水作_____(填“溶剂”或“溶质”)。
②实验B中水的作用是提供热量和______________。
③实验C中的水作________________。
④灭火时将水喷成细雾状的主要原因是______(选填编号)。
A.降低着火点 B.增大与可燃物接触面积 C.与空气中气体反应生成CO2 D.隔离氧气
试卷第1页,共3页
参考答案:
1.B
【详解】
两溶液为相同温度下,同溶质的饱和溶液,析出的食盐可看作是蒸发掉的水中溶解的食盐,蒸发掉的水的质量相同,则析出食盐晶体的质量也相同。故选B。
2.B
【详解】
A、碳酸钙粉末不溶于水,与水混合形成的是悬浊液,故A错误;
B、白砂糖易溶于水,形成均一、稳定的混合物,属于溶液,故B正确;
C、菜籽油不溶于水,与水混合形成的是乳浊液,不均一、不稳定,故C错误;
D、面粉不溶于水,混合后形成的是悬浊液,故D错误。故选B。
3.C
【详解】
A、汽水是均一稳定的混合物,是溶液。
B、白酒是均一稳定的混合物,是溶液。
C、牛奶不是均一稳定的混合物,不是溶液。
D、苏打水是均一稳定的混合物,是溶液。
故选C。
4.D
【详解】
A、溶液不一定是无色的,如常见的硫酸铜溶液(蓝色)、氯化铁溶液(黄色)等都是有色溶液,故A错误;
B、均一、稳定的液体可以是单一液体,即纯净物,比如水等,故B错误;
C、溶液里最少含有两种物质,也可以含有多种物质,故C错误;
D、在分散时该种物质(即溶质)可以以离子或分子的形式分散到另一种物质里(即溶剂),故D正确;
故选D。
5.B
【详解】
A、味精能溶于水形成均一稳定的溶液,故不符合题意;
B、花生油不溶于水,放入水中不能形成均一稳定的溶液,故符合题意;
C、蔗糖能溶于水形成均一稳定的溶液,故不符合题意;
D、食盐能溶于水形成均一稳定的溶液,故不符合题意。
6.A
【详解】
A、取样品,加入碘,可以溶解碘的是汽油,不能溶解碘的是蒸馏水,现象不同,可以鉴别;点燃,可以燃烧的是汽油,不能燃烧的是蒸馏水,现象不同,可以鉴别,故A正确;B、在实验室不能品尝任何药品的味道,故B错误;C、5%的过氧化氢溶液在不加催化剂的条件下,放出氧气的速率较慢,也不能使带火星的木条复燃,蒸馏水也不会放出氧气,现象相同,不能鉴别,故C错误;D、氧化铜和木炭粉都是黑色粉末,观察颜色的方法不能鉴别,故D错误。故选A。
7.A
【详解】
A、根据氢氧化钙的溶解度曲线图,不难看出,在30℃时,氢氧化钙的溶解度为0.15g,故A错误;
B、根据溶解度曲线图可知氢氧化钙的溶解度随温度的升高而减小,故B正确;
C、由于氢氧化钙的溶解度随温度的升高而减小,因此升高温度可使氢氧化钙的不饱和溶液转化饱和溶液,故C正确;
D、对于任何物质的溶液而言,都可以通过增加溶质的方法使它的不饱和溶液转化为饱和溶液,故D正确。
故选A。
8.A
【详解】
A、称量固体要左物右码,且氢氧化钠要放在玻璃器皿中称量,错误;
B、量筒读数时,视线要与凹液面最低处水平,正确;
C、倾倒液体时容器口紧挨,沿器壁慢慢倒入,正确;
D、使用玻璃棒可以搅拌均匀,正确;
故选A。
9.C
【详解】
A.由图可知,t1 ℃时,甲、乙两种物质的溶解度相等,质量分数不一定相等,故错误;
B.由图可知,甲的溶解度受温度的影响变化较大,当甲中含有少量乙物质时,可采用降温结晶的方法提纯甲物质,故错误;
C. t2 ℃时,甲的溶解度大于乙的溶解度,溶质质量相等的甲、乙饱和溶液,溶液质量:甲<乙,正确;
D. 把甲物质的不饱和溶液变为饱和溶液,若采用增加溶质的方法则溶剂的质量不变,故错误。
故选C。
10.B
【详解】
①在20℃时,氯化钠和氯化铵的溶解度大于10g,是易溶物质;碳酸氢钠的溶解度大于1g小于10g,是可溶物质,故正确;
②在20℃时,三种物质的溶解度是为NH4Cl>NaCl>NaHCO3,由饱和溶液的溶质质量分数=100%,故三种物质饱和溶液的溶质质量分数为NH4Cl>NaCl>NaHCO3 ,故正确;
③30℃时,氯化铵的溶解度大于40g,20g氯化铵能完全溶于50g水,所得溶液不是饱和溶液,氯化钠的溶解度小于40g,20g氯化钠不能全部溶解,所得溶液是饱和溶液,故错误;
④10℃以下氯化铵的溶解度比氯化钠的溶解度小很多,利用结晶法从氯化钠、氯化铵混合物中分离出氯化铵的最佳温度在10℃以下,故正确。
答案B。
11.B
【详解】
试题分析:A、60℃时,A、B、C三种物质的溶解度大小关系是A>B>C>,所以A、B、C三种物质的饱和溶液中A物质的溶液中所含溶质的质量最多,而这里没有指明是饱和溶液,错误,B、通过溶解度曲线图,可看出物质A的溶解度随温度的升高而变化最大,所以60℃时A、B、C三种物质的等质量饱和溶液,降温至40℃时析出晶体最多的是A,正确, C、60℃时,A的溶解度小于110g,表示在100g溶剂中,达到饱和状态溶解A的质量最多是110g,所以在50 g水中最多能溶解55g,故40℃时A物质60g放入50g水溶解后升温至60℃时,固体不能全部溶解,溶液仍然是饱和,错误,D、由于C物质的溶解度随温度的升高而变化不大,所以物质C中混有少量A时,可以用蒸发结晶的方法提纯C,错误,故选B
12.A
【详解】
A. 粗盐提纯的实验步骤是:溶解、过滤、蒸发、转移;配制 50g 溶质质量分数为 15%的氯化钠溶液实验的步骤为:计算、称取、量取、溶解,此选项正确;
B. 蒸发实验结束后用坩埚钳拿着蒸发皿小心的放在石棉网上,不能用手去拿,不可直接放在实验台上,此选项错误;
C. 刚用蒸馏水润洗过的试剂瓶,瓶壁沾有水,把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,溶剂增多,结果会偏小,此选项错误;
D. 所需水的质量为:50g×(1-15%)=42.5g,量取水时,用规格为 50mL 的量筒量取 42.5mL 蒸馏水,此选项错误。故选A。
13.B
【详解】
A. t1℃时,质量不相等的KCl和MgSO4两饱和溶液所含溶质质量不相等,错误;B. t2℃时,MgSO4的饱和溶液升高温度和降低温度溶解度都变小,故都能析出晶体,正确;C. t3℃时,(100+a)gMgCl2的饱和溶液中含有agMgCl2 ,错误;D. 将t3℃时的KCl的饱和溶液溶液降温到t1℃,溶液的溶质质量分数变小,错误。故选B。
14.D
【详解】
NaOH溶于水放热,NH4NO3 溶于水吸热。A. Y的溶解度曲线为a曲线,故A错误;B.升温可使X的饱和溶液变浑浊,故B错误;C. X的饱和溶液溶解度曲线是b,从t2 ℃降温到t1 ℃,溶质的质量分数不变,故C错误;D. t3 ℃时,X溶解度小于Y溶解度,饱和溶液质量相等,则溶剂质量X>Y,故D正确。
15.C
【详解】
A.在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。由图可知,温度会影响物质的溶解度,不说明温度时,不能比较溶解度的大小。
B、饱和溶液溶质的质量分数=溶解度÷(溶解度+100g)×100%,30℃时,甲的溶解度为30g,其饱和溶液中溶质的质量分数为30g÷(30g+100g) ×100%<30%;
C. 由图可知,当温度变化时,乙物质的溶解度变化较小,所以乙物质的溶解度受温度变化的影响较小,当温度变化时,甲物质的溶解度会有较大的改变,甲物质的溶解度受温度变化的影响较大;
D. 甲物质的溶解度受温度变化的影响较大,且随温度降低而减小;乙物质的溶解度受温度变化的影响较小,而甲中含有少量乙时,用降温结晶的方法提纯甲;选C。
16.C
【详解】
A、醋易溶于水,形成均一、稳定的混合物,属于溶液,选项正确;
B、蔗糖易溶于水,形成均一、稳定的混合物,属于溶液,选项正确;
C、面粉难溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,选项错误;
D、食盐易溶于水,形成均一、稳定的混合物,属于溶液,选项正确,故选C。
17. 13.2 0.6 4.9% B
18. 长颈漏斗 D 将带火星的木条平放在集气瓶口,若木条复燃,证明氧气已满 b 可以控制反应速率 19.6%
19. 混合物 浓硝酸 碘酒或碘水 酚酞 不漏气 产生大量气泡 溶液变浑浊 过滤 洗涤 ① 60% 偏大 NaOH 10%.
20. 隔绝氧气 CO2+H2O=H2CO3 左边 20g BC 可行,t2℃时4g甲能溶解在10g水中形成溶液,而4g乙不能全部溶解在10g水中形成溶液 降温结晶
【详解】
(1)①实验A中热水的作用是提供热量和隔绝氧气,让铜片上的白磷和热水中的白磷形成对比,说明温度达到可燃物的着火点才能燃烧。②二氧化碳与水反应生成碳酸。③硝酸铵溶于水吸收大量的热,锥形瓶内温度降低,压强变小,在大气压的作用下,U型管中左边液面升高。
(2)①由溶解度曲线看出,t1℃时,甲的溶解度是20g。②A.比较溶解度大小,必须指明温度,此选项错误;B.t1℃时,甲、乙的溶解度相等,甲、乙饱和溶液的溶质质量分数相等,此选项正确;C.20℃时,溶解度大于10g的物质是易溶物质,此选项正确;D.甲、乙的饱和溶液从t2℃降至t1℃时,均有晶体析出,此选项错误。故选BC。③可行,t2℃时4g固体能完全溶解在10g水中的是甲,4g固体不能全部溶解在10g水中的是乙。④提纯溶解度受温度影响较大的物质,一般用降温结晶法。
21. 2H2O2H2↑+O2↑ 水分子 9 CO2+H2O=H2CO3 c、b、d、e C 25:100(1:4) II、Ⅲ
【详解】
①水在通电的条件下生成氢气和氧气,化学反应方程式为:2H2O2H2↑+O2↑,水电解过程发生改变的微粒是水分子;②医疗上常用0.9%NaCl溶液作生理盐水,配制1000g生理盐水需要氯化钠固体的质量为1000g×0.9%=9g,制取碳酸饮料是二氧化碳溶于水生成碳酸,发生反应的化学方程式为:CO2+H2OH2CO3;粗盐的提纯实验步骤为:称量、溶解、过滤、蒸发、称量、计算产率;若NaCl的产率偏低,则可能的原因是:溶解含泥沙的粗食盐时,加入的水量不足;过滤时滤纸有破损和蒸发后所得精盐未完全蒸干,含有水则会导致产率偏高;④已知KCl的溶解度20℃时为34g/100g水,则25g氯化钾全部溶解,所以A中所得溶液中溶质与溶剂的质量比为25:100;由于同一温度下物质的溶解度相同,B、E中温度、溶质和溶液质量相同,所以溶质的质量分数相等;根据40℃时为40g/100g水,C中溶液为饱和溶液,溶质质量分数为:,D中加入25g水后,剩余的10g 氯化钾全部溶解,溶液刚好达到饱和,溶质质量分数为:,故C和D溶质的质量分数相等。
22. B B 45 mL 仰视读数(答案合理即可) C 溶剂 隔绝空气 反应物 B
【详解】
(1)根据水的组成和结构分析解答;(2)①一种或几种物质分散到另一种物质中,形成均一的、稳定的混合物叫做溶液,它的基本特征是均一性和稳定性;只有被分散的物质在另一种物质中是可溶的,二者混合后才会形成溶液;②根据溶剂质量等于溶液质量-溶质质量进行分析;③根据固体的溶解度曲线可以:a查出某物质在一定温度下的溶解度,从而确定物质的溶解性,b比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,c判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的;(3)根据水在不同实验中的作用进行分析。(1)A、水中氢、氧元素的质量比为(1×2):16=1:8,错误;B、水是由水分子构成的,正确;C、分子是由原子构成的。水分子是由氢原子和氧原子构成的,错误;D、由分子构成的物质,分子是保持物质化学性质的最小粒子。故保持水的化学性质的最小微粒是水分子,错误。故选B;(2)①A、牛奶不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,错误;B、蔗糖易溶于水,能和水形成均一、稳定的混合物,即能和水形成溶液,正确;C、面粉不易溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,错误;D、花生油不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,错误。故选B。②实验室中用5g氯化钠配成溶质质量分数为10%的氯化钠溶液,则需加入蒸馏水-5g=45g,合45mL,所配溶液质量分数偏小的原因可能是仰视读数;③A、通过分析溶解度曲线可知,t1℃时,三种物质的溶解度:乙>甲=丙,正确;B、20℃时,甲物质的溶解度是40g,所以将30g甲放入50g水中,充分搅拌,所得溶液的质量是70g,正确;C、溶液的质量不能确定,所以分别将t2℃时三种物质的饱和溶液降温到t1℃,析出的晶体质量也不能确定,错误;D、t2℃时,丙物质的溶解度最小,所以将相同质量的甲、乙、丙三种物质分别加入到100g水中充分溶解后,若只有一种固体物质没有完全溶解,则该固体一定是丙,正确。故选C;(3)在溶解过程中,水可以作溶剂;②实验B中水的作用是提供热量和隔绝氧气;③实验C中二氧化碳和水反应生成碳酸,所以水作反应物;④灭火时将水喷成细雾状的主要原因是增大与可燃物接触面积,故选B。
答案第1页,共2页
