第九单元溶液综合训练-2021-2022学年九年级化学人教版下册(word 含答案)
文档属性
| 名称 | 第九单元溶液综合训练-2021-2022学年九年级化学人教版下册(word 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 185.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-30 00:00:00 | ||
图片预览



文档简介
人教版九下 第九单元 溶液 综合训练
一、单选题
1.下列关于溶液的说法,正确的是( )
A.溶液具有均一性和稳定性,因为溶液中的各种粒子保持静止不动
B.—定温度下的不饱和溶液还能溶解溶质,则一定温度下的饱和溶液不能溶解任何物质
C.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
D.—定质量的溶液,加水稀释前后,溶质质量分数不变
2.20℃时,NaCl的溶解度为36g。配制此温度下20g质量分数为5%的NaCl溶液,下列说法正确的是( )
A.配制该溶液需要5g NaCl
B.该溶液为饱和溶液
C.将该溶液长时间敞口放置,最终有晶体析出
D.配溶液时,量取所需体积的水倒入烧杯,有少量水洒出,则所配溶液浓度小于5%
3.如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀. 如表中液体X和固体Y的组合,符合题意的是
① ② ③ ④
X 双氧水 水 水 水
Y 二氧化锰 氯化钠 氢氧化钠 硝酸铵
A.①② B.①③ C.①③④ D.②③④
4.水和溶液与我们的生活生产息息相关。下列有关说法中,不正确的是。
A.肥皂水可以区分硬水和软水
B.洗涤剂除去油污的原理是将油污溶解
C.溶液是均一、稳定的混合物
D.饱和溶液不一定比不饱和溶液浓度大
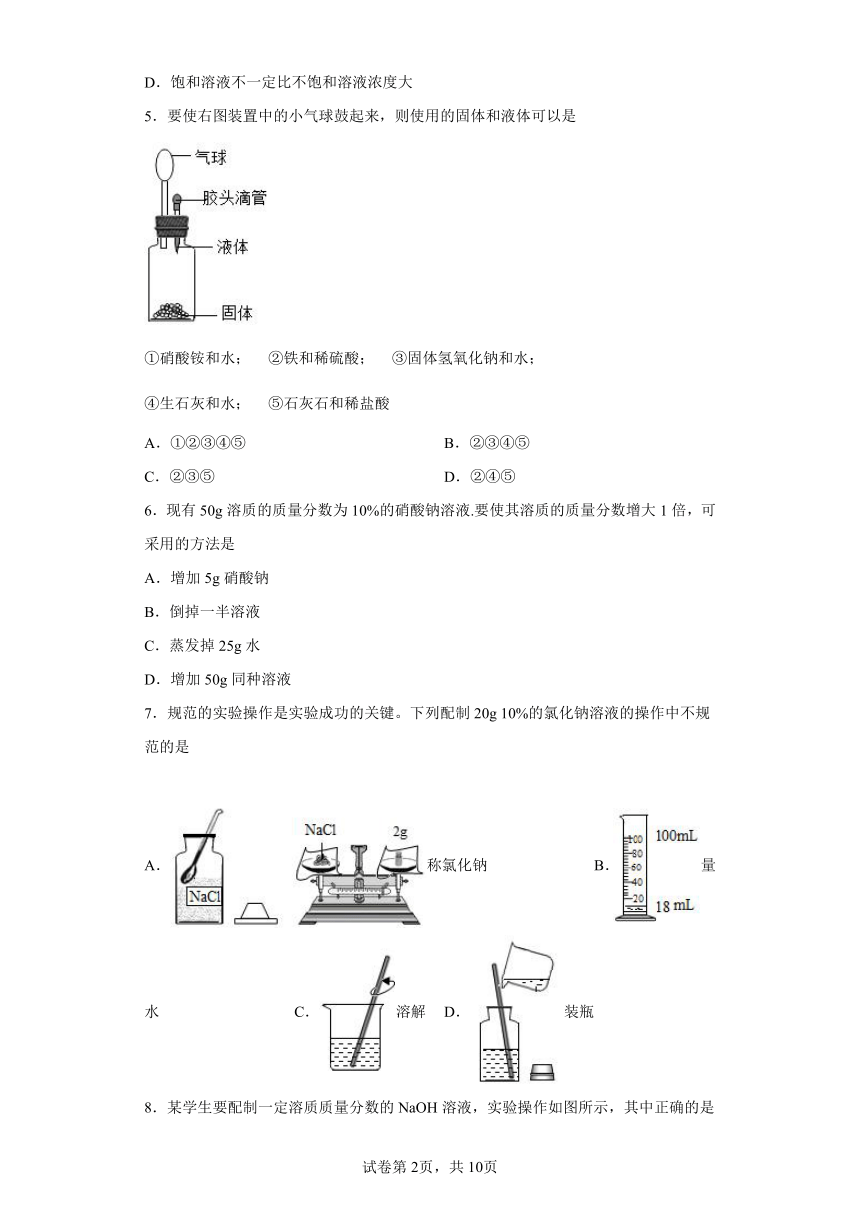
5.要使右图装置中的小气球鼓起来,则使用的固体和液体可以是
①硝酸铵和水; ②铁和稀硫酸; ③固体氢氧化钠和水;
④生石灰和水; ⑤石灰石和稀盐酸
A.①②③④⑤ B.②③④⑤
C.②③⑤ D.②④⑤
6.现有50g溶质的质量分数为10%的硝酸钠溶液.要使其溶质的质量分数增大1倍,可采用的方法是
A.增加5g硝酸钠
B.倒掉一半溶液
C.蒸发掉25g水
D.增加50g同种溶液
7.规范的实验操作是实验成功的关键。下列配制20g 10%的氯化钠溶液的操作中不规范的是
A.称氯化钠 B.量水 C.溶解 D.装瓶
8.某学生要配制一定溶质质量分数的NaOH溶液,实验操作如图所示,其中正确的是
A.取用NaOH固体
B.称量NaOH固体
C.量取一定体积的水
D.溶解NaOH固体
9.溶液在我们生活中有着广泛的用途。下列物质不属于溶液的是
A.白酒
B.蒸馏水
C.医用酒精
D.生理盐水
10.常温下,对100mL氯化钠饱和溶液进行图示实验。下列分析错误的是( )
A.实验1后,甲、乙中溶液的溶质质量分数相等
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲中溶液为氯化钠的不饱和溶液
D.实验2后,甲、乙中溶液所含溶质质量相等
11.下列物质加入水中,不能形成溶液的是
A.二氧化碳 B.氯化钠 C.蔗糖 D.花生油
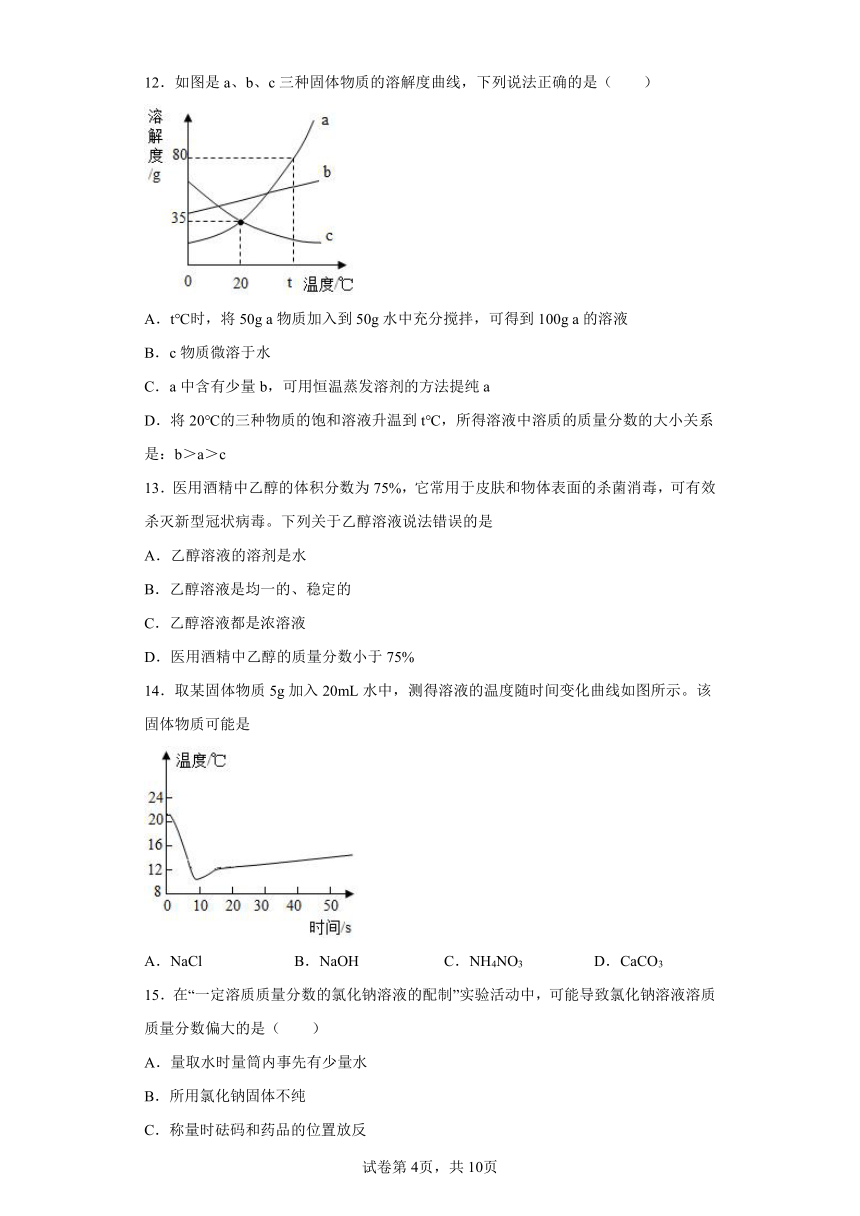
12.如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是( )
A.t℃时,将50g a物质加入到50g水中充分搅拌,可得到100g a的溶液
B.c物质微溶于水
C.a中含有少量b,可用恒温蒸发溶剂的方法提纯a
D.将20℃的三种物质的饱和溶液升温到t℃,所得溶液中溶质的质量分数的大小关系是:b>a>c
13.医用酒精中乙醇的体积分数为75%,它常用于皮肤和物体表面的杀菌消毒,可有效杀灭新型冠状病毒。下列关于乙醇溶液说法错误的是
A.乙醇溶液的溶剂是水
B.乙醇溶液是均一的、稳定的
C.乙醇溶液都是浓溶液
D.医用酒精中乙醇的质量分数小于75%
14.取某固体物质5g加入20mL水中,测得溶液的温度随时间变化曲线如图所示。该固体物质可能是
A.NaCl B.NaOH C.NH4NO3 D.CaCO3
15.在“一定溶质质量分数的氯化钠溶液的配制”实验活动中,可能导致氯化钠溶液溶质质量分数偏大的是( )
A.量取水时量筒内事先有少量水
B.所用氯化钠固体不纯
C.称量时砝码和药品的位置放反
D.将量筒中的水倒入烧杯时有水溅出
二、填空题
16.溶解是生活中常见的现象,不同物质在水中的溶解能力不同。
①下表是KNO3、KNO3在不同温度下的溶解度(单位:g/100g水)。
温度(℃) 0 20 40 60 80 100
KNO3 13.3 31.6 63.9 110 169 246
NaCl 35.7 36.0 36.6 37.3 38.4 39.8
I.上表中的两种物质在40℃时,______的溶解度较大;请用相应的数据列式表示该温度是KNO3饱和溶液的质量分数________(不要求计算)。
II.请写出一种将KNO3的不饱和溶液转化为饱和溶液的方法_____________________。
III.20℃时,将20gNaCl放入50g水中,所得溶液的质量是_____g。
IV. ①从NaCl溶液中得到NaCl晶体的方法是_______。
②用硫酸铜进行如下图所示的实验,完成下列填空_______(用编号表示)。
所得三个溶液中:一定属于饱和溶液的是______,溶液中溶剂质量的大小关系是________。
17.水是一种重要的物质。
(1)用水可以获得氢气。请写出一个由水生成氢气的化学方程式_________。
(2)水还可以用于鉴别物质。水鉴别氯化钠和硝酸铵依据的是_______。
(3)水是最常见的溶剂。
①下列溶液用水作溶剂的是____(填字母序号);
a.生理盐水 b.碘酒 c.葡萄糖溶液
②将100g溶质质量分数为98%的浓硫酸稀释为溶质质量分数为10%的稀硫酸,需加水的质量为___g。
③如图为某物质在水中的溶解度曲线,欲使a点所示溶液变为b点,可采取的措施是___。
④20℃时,用精密仪器称量5.85 g NaCl和7.90gNH4HCO3,放入盛有50.00g水的烧杯中,充分搅拌,静置,有晶体析出。请结合下表分析,理论上析出的晶体及晶体的质量分别为_____。20℃时,五种物质在水中的溶解度如下表:
物质 NaCl NH4HCO3 NH4Cl NaHCO3 Na2CO3
溶解度/g 36.0 21.0 37.2 9.6 21.5
18.硝酸钾和氯化钾两种物质的溶解度曲线见下图,这两种物质的溶解度见下表。
温度/℃ 10 20 30 40 50 60
溶解度/g 甲 20.9 31.6 45.8 63.9 85.5 110
乙 31.0 34.0 37.0 40.0 42.6 45.5
请回答下列问题:
(1)观察溶解度曲线和溶解度表,判断物质乙是指________(填写化学式)。
(2)60℃时,饱和KNO3溶液中混有少量KCl,应采用________的方法提纯KNO3(填写“蒸发溶剂”或“冷却结晶”)。
(3)60℃时,分别将等质量的KNO3和KCl两种物质的饱和溶液温度降至t ℃,析出晶体的质量关系为:KNO3_____ KCl(填写“>”“=”或“<”)。
(4)如图所示,20℃时,将一定质量的KNO3固体放入盛水的试管中,发现有少量固体未溶解,向烧杯的水中加入某物质后,试管内固体能完全溶解。则加入的物质可以是_____(填写字母标号)。
①冰块 ②生石灰固体 ③硝酸铵固体 ④干冰 ⑤浓硫酸 ⑥氢氧化钠固体
A ①③④ B ②⑤⑥ C ①③⑤ D ②④⑥
(5)60 ℃时,将45g KCl固体溶解于100 g水中,降温至20 ℃,析出晶体的质量是______。
19.从下图选择仪器,配置60g溶质质量分数为10%的NaCl溶液。
(1)需要称量NaCl的质量为____g。
(2)量取水用到的仪器有____(写名称)。
(3)从配好的溶液中倒出10g,其中溶质和溶剂的质量比为_____。
三、综合应用题
20.张南和化学兴趣小组的同学为了测定铁样品中铁的质量分数(杂质不含铁元素,不溶于水,也不与其他物质发生反应),进行了如下实验:
请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为______;
(2)根据已知条件列出求解所加稀硫酸中溶质质量(x)的比例式______;
(3)此铁样品中铁的质量分数为______;
(4)用98%的浓硫酸配制100g上述稀硫酸,所需浓硫酸的质量为______;
(5)所得不饱和溶液A中溶质的质量分数为______;
(6)若要用含氧化铁80%的赤铁矿生产上述铁样品1000t,需要赤铁矿的质量为_____。
21.水和水溶液与人类的生产生活关系紧密。
(1)水净化时先加入絮凝剂,沉降过滤后,通过活性炭。活性炭的作用是______。
(2)将硬水通过如图所示的阳离子交换柱后可变成软水(图中阴离子未画出),交换后的水仍然呈电中性。
①一个Ca2+可以交换出______个Na+。
②阳离子交换柱长时间使用后,Na+变少,失去软化硬水的功能而失效。利用生活中常见物质检验阳离子交换柱已失效的方法是______。
(3)20℃时打开汽水瓶盖时,有大量气泡冒出。汽水瓶盖打开前后,CO2的溶解度变化如图中的a点变化到______(选填“b”、“c”、“d”或“e”)点。
(4)甲、乙、丙三种不含结晶水的固体物质在水中的溶解度曲线如图所示,请回答下列问题。
①t1℃时,甲的饱和溶液中溶质与溶液的质量比为______。
②t2℃时,将甲、乙、丙三种物质的饱和溶液分别降温至t1℃时,所得溶液中溶质质量分数的大小关系为______。
(5)某工厂化验室用20%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性。这一定量石油产品中含硫酸的质量是多少。(写出计算过程)______。
22.如图是一组“吹气球”实验,请回答:
(1)仪器 a 的名称为 _____ .装置甲检查气密性的方法是 _____
(2)①若甲中固体为大理石,则反应方程式为 _____
②若甲中固体为生石灰,a 中液体为水,则气球胀大的主要原因 _____
③若乙锥形瓶中充满 HCl 气体,欲使气球明显胀大,分液漏斗中的液体可以是 _____
(3)甲装置也能用于实验室制取氧气。现有 13.6g 溶质质量分数为 5%的过氧化氢溶液,充分分解后可以制得氧气的质量为多少 _____ (写出计算过程)
23.水是生命之源,人类的生产、生活离不开水。
(1)我国规定生活饮用水的水质必须达到下列四项指标,通过过滤可达到_____________ (填字母序号)。
A无异色
B无异味
C澄清透明
D无细菌和病毒
(2)镁与碘的化合反应十分缓慢,若滴加少量水,则反应立即剧烈进行,反应前后水的质量和化学性质不发生改变,此时水的作用是_______________。
(3)如图1分别将2g高锰酸钾加入到A、B两支试管中,A试管中固体全部溶解B试管中固体部分溶解,该实验说明物质的溶解性和_______________有关。
(4)甲、乙、丙三种固体物质的溶解度曲线如图2所示,请回答下列问题:
①甲、乙两物质溶解度相等时的温度为_______________℃;
②t1℃时,丙物质的饱和溶液中溶质质量分数为________________(结果精确到0.1% );
③将t3℃甲、乙、丙三种物质的饱和溶液降温至0℃,所得溶液中溶质质量分数的大小关系为___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.B
4.B
5.B
6.C
7.B
8.D
9.B
10.B
11.D
12.D
13.C
14.C
15.D
16. 硝酸钾, 降低温度 68g 蒸发结晶 68g A B>C>A
17. 氯化钠和硝酸铵溶于水后温度变化不同(或氯化钠溶于水温度变化不大,硝酸铵溶于水吸热会导致溶液温度降低等;合理即可) ac 880 升温加溶质(或升温蒸发溶剂) NaHCO3、3. 6g
18. KCl 冷却结晶 > B 11g (或11.0 g,漏写单位不得分)
19. 6 100mL量筒、胶头滴管(顺序可变) 1:9
20. Fe+H2SO4=FeSO4+H2↑
84% 15g 15.2% 1500t
21. 吸附水中的色素和异味 2 取交换后的水于试管中,加入适量肥皂水,振荡,若出现较多浮渣,则交换后的水仍然是硬水,说明阳离子交换柱已失效 c 1:6 乙>甲>丙 9.8g
22. 分液漏斗 旋转分液漏斗活塞,向锥形瓶中加水会看到气球胀大,一段时间后气球大小没有变化,说明气密性良好 CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 生石灰与水反应放热,使瓶内压强增大 氢氧化钠溶液 0.32g
23. C 作催化剂 温度 t2 28.6% 乙>甲=丙(或丙=甲<乙)
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列关于溶液的说法,正确的是( )
A.溶液具有均一性和稳定性,因为溶液中的各种粒子保持静止不动
B.—定温度下的不饱和溶液还能溶解溶质,则一定温度下的饱和溶液不能溶解任何物质
C.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
D.—定质量的溶液,加水稀释前后,溶质质量分数不变
2.20℃时,NaCl的溶解度为36g。配制此温度下20g质量分数为5%的NaCl溶液,下列说法正确的是( )
A.配制该溶液需要5g NaCl
B.该溶液为饱和溶液
C.将该溶液长时间敞口放置,最终有晶体析出
D.配溶液时,量取所需体积的水倒入烧杯,有少量水洒出,则所配溶液浓度小于5%
3.如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀. 如表中液体X和固体Y的组合,符合题意的是
① ② ③ ④
X 双氧水 水 水 水
Y 二氧化锰 氯化钠 氢氧化钠 硝酸铵
A.①② B.①③ C.①③④ D.②③④
4.水和溶液与我们的生活生产息息相关。下列有关说法中,不正确的是。
A.肥皂水可以区分硬水和软水
B.洗涤剂除去油污的原理是将油污溶解
C.溶液是均一、稳定的混合物
D.饱和溶液不一定比不饱和溶液浓度大
5.要使右图装置中的小气球鼓起来,则使用的固体和液体可以是
①硝酸铵和水; ②铁和稀硫酸; ③固体氢氧化钠和水;
④生石灰和水; ⑤石灰石和稀盐酸
A.①②③④⑤ B.②③④⑤
C.②③⑤ D.②④⑤
6.现有50g溶质的质量分数为10%的硝酸钠溶液.要使其溶质的质量分数增大1倍,可采用的方法是
A.增加5g硝酸钠
B.倒掉一半溶液
C.蒸发掉25g水
D.增加50g同种溶液
7.规范的实验操作是实验成功的关键。下列配制20g 10%的氯化钠溶液的操作中不规范的是
A.称氯化钠 B.量水 C.溶解 D.装瓶
8.某学生要配制一定溶质质量分数的NaOH溶液,实验操作如图所示,其中正确的是
A.取用NaOH固体
B.称量NaOH固体
C.量取一定体积的水
D.溶解NaOH固体
9.溶液在我们生活中有着广泛的用途。下列物质不属于溶液的是
A.白酒
B.蒸馏水
C.医用酒精
D.生理盐水
10.常温下,对100mL氯化钠饱和溶液进行图示实验。下列分析错误的是( )
A.实验1后,甲、乙中溶液的溶质质量分数相等
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲中溶液为氯化钠的不饱和溶液
D.实验2后,甲、乙中溶液所含溶质质量相等
11.下列物质加入水中,不能形成溶液的是
A.二氧化碳 B.氯化钠 C.蔗糖 D.花生油
12.如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是( )
A.t℃时,将50g a物质加入到50g水中充分搅拌,可得到100g a的溶液
B.c物质微溶于水
C.a中含有少量b,可用恒温蒸发溶剂的方法提纯a
D.将20℃的三种物质的饱和溶液升温到t℃,所得溶液中溶质的质量分数的大小关系是:b>a>c
13.医用酒精中乙醇的体积分数为75%,它常用于皮肤和物体表面的杀菌消毒,可有效杀灭新型冠状病毒。下列关于乙醇溶液说法错误的是
A.乙醇溶液的溶剂是水
B.乙醇溶液是均一的、稳定的
C.乙醇溶液都是浓溶液
D.医用酒精中乙醇的质量分数小于75%
14.取某固体物质5g加入20mL水中,测得溶液的温度随时间变化曲线如图所示。该固体物质可能是
A.NaCl B.NaOH C.NH4NO3 D.CaCO3
15.在“一定溶质质量分数的氯化钠溶液的配制”实验活动中,可能导致氯化钠溶液溶质质量分数偏大的是( )
A.量取水时量筒内事先有少量水
B.所用氯化钠固体不纯
C.称量时砝码和药品的位置放反
D.将量筒中的水倒入烧杯时有水溅出
二、填空题
16.溶解是生活中常见的现象,不同物质在水中的溶解能力不同。
①下表是KNO3、KNO3在不同温度下的溶解度(单位:g/100g水)。
温度(℃) 0 20 40 60 80 100
KNO3 13.3 31.6 63.9 110 169 246
NaCl 35.7 36.0 36.6 37.3 38.4 39.8
I.上表中的两种物质在40℃时,______的溶解度较大;请用相应的数据列式表示该温度是KNO3饱和溶液的质量分数________(不要求计算)。
II.请写出一种将KNO3的不饱和溶液转化为饱和溶液的方法_____________________。
III.20℃时,将20gNaCl放入50g水中,所得溶液的质量是_____g。
IV. ①从NaCl溶液中得到NaCl晶体的方法是_______。
②用硫酸铜进行如下图所示的实验,完成下列填空_______(用编号表示)。
所得三个溶液中:一定属于饱和溶液的是______,溶液中溶剂质量的大小关系是________。
17.水是一种重要的物质。
(1)用水可以获得氢气。请写出一个由水生成氢气的化学方程式_________。
(2)水还可以用于鉴别物质。水鉴别氯化钠和硝酸铵依据的是_______。
(3)水是最常见的溶剂。
①下列溶液用水作溶剂的是____(填字母序号);
a.生理盐水 b.碘酒 c.葡萄糖溶液
②将100g溶质质量分数为98%的浓硫酸稀释为溶质质量分数为10%的稀硫酸,需加水的质量为___g。
③如图为某物质在水中的溶解度曲线,欲使a点所示溶液变为b点,可采取的措施是___。
④20℃时,用精密仪器称量5.85 g NaCl和7.90gNH4HCO3,放入盛有50.00g水的烧杯中,充分搅拌,静置,有晶体析出。请结合下表分析,理论上析出的晶体及晶体的质量分别为_____。20℃时,五种物质在水中的溶解度如下表:
物质 NaCl NH4HCO3 NH4Cl NaHCO3 Na2CO3
溶解度/g 36.0 21.0 37.2 9.6 21.5
18.硝酸钾和氯化钾两种物质的溶解度曲线见下图,这两种物质的溶解度见下表。
温度/℃ 10 20 30 40 50 60
溶解度/g 甲 20.9 31.6 45.8 63.9 85.5 110
乙 31.0 34.0 37.0 40.0 42.6 45.5
请回答下列问题:
(1)观察溶解度曲线和溶解度表,判断物质乙是指________(填写化学式)。
(2)60℃时,饱和KNO3溶液中混有少量KCl,应采用________的方法提纯KNO3(填写“蒸发溶剂”或“冷却结晶”)。
(3)60℃时,分别将等质量的KNO3和KCl两种物质的饱和溶液温度降至t ℃,析出晶体的质量关系为:KNO3_____ KCl(填写“>”“=”或“<”)。
(4)如图所示,20℃时,将一定质量的KNO3固体放入盛水的试管中,发现有少量固体未溶解,向烧杯的水中加入某物质后,试管内固体能完全溶解。则加入的物质可以是_____(填写字母标号)。
①冰块 ②生石灰固体 ③硝酸铵固体 ④干冰 ⑤浓硫酸 ⑥氢氧化钠固体
A ①③④ B ②⑤⑥ C ①③⑤ D ②④⑥
(5)60 ℃时,将45g KCl固体溶解于100 g水中,降温至20 ℃,析出晶体的质量是______。
19.从下图选择仪器,配置60g溶质质量分数为10%的NaCl溶液。
(1)需要称量NaCl的质量为____g。
(2)量取水用到的仪器有____(写名称)。
(3)从配好的溶液中倒出10g,其中溶质和溶剂的质量比为_____。
三、综合应用题
20.张南和化学兴趣小组的同学为了测定铁样品中铁的质量分数(杂质不含铁元素,不溶于水,也不与其他物质发生反应),进行了如下实验:
请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为______;
(2)根据已知条件列出求解所加稀硫酸中溶质质量(x)的比例式______;
(3)此铁样品中铁的质量分数为______;
(4)用98%的浓硫酸配制100g上述稀硫酸,所需浓硫酸的质量为______;
(5)所得不饱和溶液A中溶质的质量分数为______;
(6)若要用含氧化铁80%的赤铁矿生产上述铁样品1000t,需要赤铁矿的质量为_____。
21.水和水溶液与人类的生产生活关系紧密。
(1)水净化时先加入絮凝剂,沉降过滤后,通过活性炭。活性炭的作用是______。
(2)将硬水通过如图所示的阳离子交换柱后可变成软水(图中阴离子未画出),交换后的水仍然呈电中性。
①一个Ca2+可以交换出______个Na+。
②阳离子交换柱长时间使用后,Na+变少,失去软化硬水的功能而失效。利用生活中常见物质检验阳离子交换柱已失效的方法是______。
(3)20℃时打开汽水瓶盖时,有大量气泡冒出。汽水瓶盖打开前后,CO2的溶解度变化如图中的a点变化到______(选填“b”、“c”、“d”或“e”)点。
(4)甲、乙、丙三种不含结晶水的固体物质在水中的溶解度曲线如图所示,请回答下列问题。
①t1℃时,甲的饱和溶液中溶质与溶液的质量比为______。
②t2℃时,将甲、乙、丙三种物质的饱和溶液分别降温至t1℃时,所得溶液中溶质质量分数的大小关系为______。
(5)某工厂化验室用20%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性。这一定量石油产品中含硫酸的质量是多少。(写出计算过程)______。
22.如图是一组“吹气球”实验,请回答:
(1)仪器 a 的名称为 _____ .装置甲检查气密性的方法是 _____
(2)①若甲中固体为大理石,则反应方程式为 _____
②若甲中固体为生石灰,a 中液体为水,则气球胀大的主要原因 _____
③若乙锥形瓶中充满 HCl 气体,欲使气球明显胀大,分液漏斗中的液体可以是 _____
(3)甲装置也能用于实验室制取氧气。现有 13.6g 溶质质量分数为 5%的过氧化氢溶液,充分分解后可以制得氧气的质量为多少 _____ (写出计算过程)
23.水是生命之源,人类的生产、生活离不开水。
(1)我国规定生活饮用水的水质必须达到下列四项指标,通过过滤可达到_____________ (填字母序号)。
A无异色
B无异味
C澄清透明
D无细菌和病毒
(2)镁与碘的化合反应十分缓慢,若滴加少量水,则反应立即剧烈进行,反应前后水的质量和化学性质不发生改变,此时水的作用是_______________。
(3)如图1分别将2g高锰酸钾加入到A、B两支试管中,A试管中固体全部溶解B试管中固体部分溶解,该实验说明物质的溶解性和_______________有关。
(4)甲、乙、丙三种固体物质的溶解度曲线如图2所示,请回答下列问题:
①甲、乙两物质溶解度相等时的温度为_______________℃;
②t1℃时,丙物质的饱和溶液中溶质质量分数为________________(结果精确到0.1% );
③将t3℃甲、乙、丙三种物质的饱和溶液降温至0℃,所得溶液中溶质质量分数的大小关系为___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.B
4.B
5.B
6.C
7.B
8.D
9.B
10.B
11.D
12.D
13.C
14.C
15.D
16. 硝酸钾, 降低温度 68g 蒸发结晶 68g A B>C>A
17. 氯化钠和硝酸铵溶于水后温度变化不同(或氯化钠溶于水温度变化不大,硝酸铵溶于水吸热会导致溶液温度降低等;合理即可) ac 880 升温加溶质(或升温蒸发溶剂) NaHCO3、3. 6g
18. KCl 冷却结晶 > B 11g (或11.0 g,漏写单位不得分)
19. 6 100mL量筒、胶头滴管(顺序可变) 1:9
20. Fe+H2SO4=FeSO4+H2↑
84% 15g 15.2% 1500t
21. 吸附水中的色素和异味 2 取交换后的水于试管中,加入适量肥皂水,振荡,若出现较多浮渣,则交换后的水仍然是硬水,说明阳离子交换柱已失效 c 1:6 乙>甲>丙 9.8g
22. 分液漏斗 旋转分液漏斗活塞,向锥形瓶中加水会看到气球胀大,一段时间后气球大小没有变化,说明气密性良好 CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 生石灰与水反应放热,使瓶内压强增大 氢氧化钠溶液 0.32g
23. C 作催化剂 温度 t2 28.6% 乙>甲=丙(或丙=甲<乙)
答案第1页,共2页
答案第1页,共2页
同课章节目录
