7.2物质溶解的量同步练习 -2021-2022学年九年级化学科粤版(2012)下册(word版 含答案)
文档属性
| 名称 | 7.2物质溶解的量同步练习 -2021-2022学年九年级化学科粤版(2012)下册(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 373.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-30 00:00:00 | ||
图片预览

文档简介
科粤版九年级化学下册 7.2 物质溶解的量 同步练习
一、单选题
1.能证明硝酸钾在20℃时已达到饱和状态的是( )
A.取少量该溶液,升温后没有硝酸钾晶体析出
B.温度不变,向该溶液中加入少量水,溶质的质量分数变小
C.温度不变,向该溶液加入少量硝酸钾晶体,溶质质量分数不变
D.取少量该溶液,降温到10℃,有硝酸钾晶体析出
2.如图是KNO3的溶解度曲线,下列说法正确的是
A.溶液从b点降温到a点,有晶体析出
B.60℃时,b、c点对应的都是饱和溶液
C.将a点的饱和溶液从20℃升温到60℃时仍是饱和溶液
D.60℃时,向50g水中加入60gKNO3,形成不饱和溶液
3.夏季,鱼虾养殖塘内常放一些水泵,把水喷向空中(如图),从化学角度分析,喷水的目的是
A.增加观赏性 B.降低塘内水温
C.杀灭水中细菌 D.便于溶解氧气
4.下列关于溶解度的说法,正确的是
A.20℃时,20g硝酸钾溶解在100g水里,所以20℃时硝酸钾的溶解度是20g
B.20℃时,把20g硝酸钾溶解在水里制成饱和溶液,所以20℃时硝酸钾的溶解度是20g
C.把31.6克硝酸钾溶解在100g水里形成饱和溶液,所以硝酸钾的溶解度是31.6
D.20℃时,把31.6g硝酸钾溶解在100g水里,形成饱和溶液,所以20℃时硝酸钾的溶解度是31.6 g
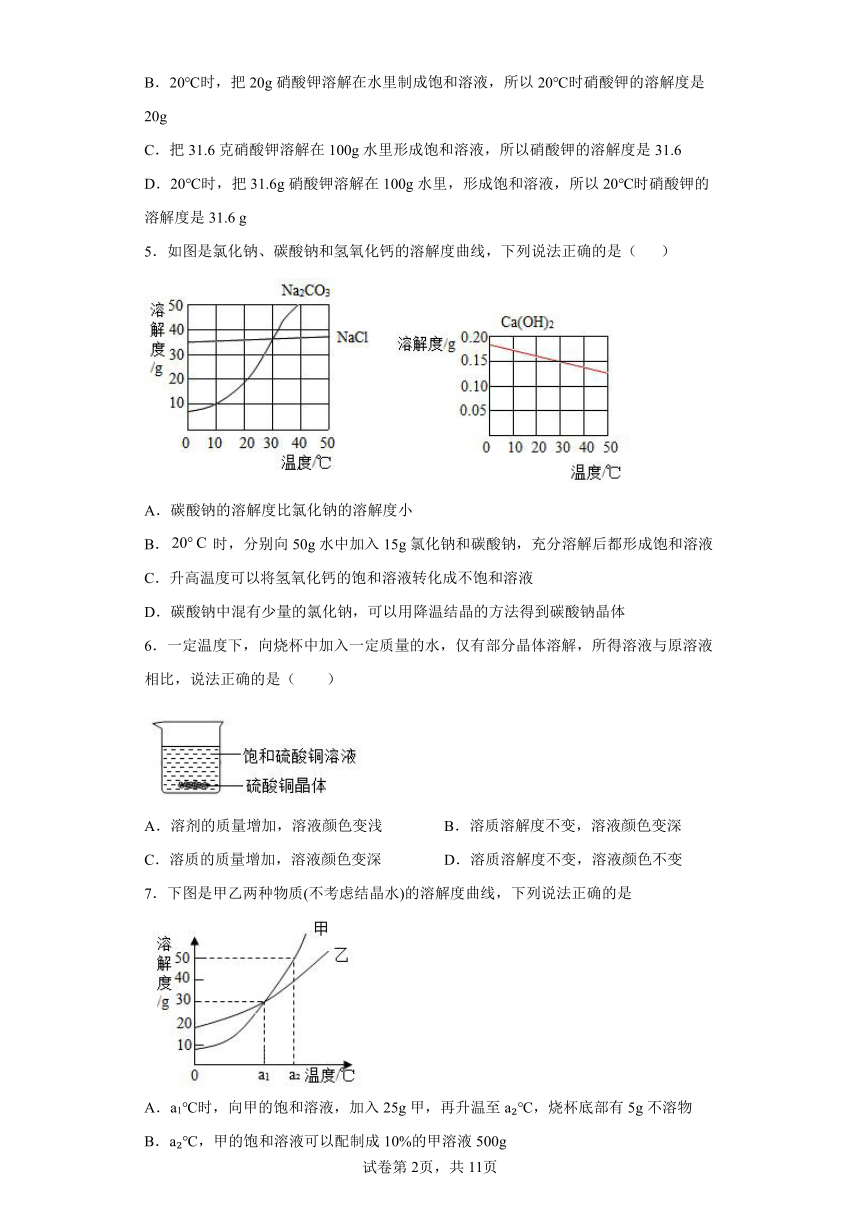
5.如图是氯化钠、碳酸钠和氢氧化钙的溶解度曲线,下列说法正确的是( )
A.碳酸钠的溶解度比氯化钠的溶解度小
B.时,分别向50g水中加入15g氯化钠和碳酸钠,充分溶解后都形成饱和溶液
C.升高温度可以将氢氧化钙的饱和溶液转化成不饱和溶液
D.碳酸钠中混有少量的氯化钠,可以用降温结晶的方法得到碳酸钠晶体
6.一定温度下,向烧杯中加入一定质量的水,仅有部分晶体溶解,所得溶液与原溶液相比,说法正确的是( )
A.溶剂的质量增加,溶液颜色变浅 B.溶质溶解度不变,溶液颜色变深
C.溶质的质量增加,溶液颜色变深 D.溶质溶解度不变,溶液颜色不变
7.下图是甲乙两种物质(不考虑结晶水)的溶解度曲线,下列说法正确的是
A.a1℃时,向甲的饱和溶液,加入25g甲,再升温至a ℃,烧杯底部有5g不溶物
B.a ℃,甲的饱和溶液可以配制成10%的甲溶液500g
C.a ℃甲的溶液中溶质和溶剂的质量比一定小于1:2
D.a ℃时,将等质量的甲乙两物质的饱和溶液降温至a1℃,所得溶液中溶质质量甲等于乙
8.下列方法能使硝酸钾固体在水中溶解度增大的是
A.增加水的质量 B.增加硝酸钾的质量
C.升高溶液的温度 D.将硝酸钾固体粉碎
9.下列有关溶液的说法错误的是
A.泥土与水混合不能形成溶液
B.硝酸铵溶于水能使水温降低
C.升高温度可使大多数固体物质的饱和溶液变为不饱和溶液
D.饱和溶液的溶质质量分数一定大于不饱和溶液
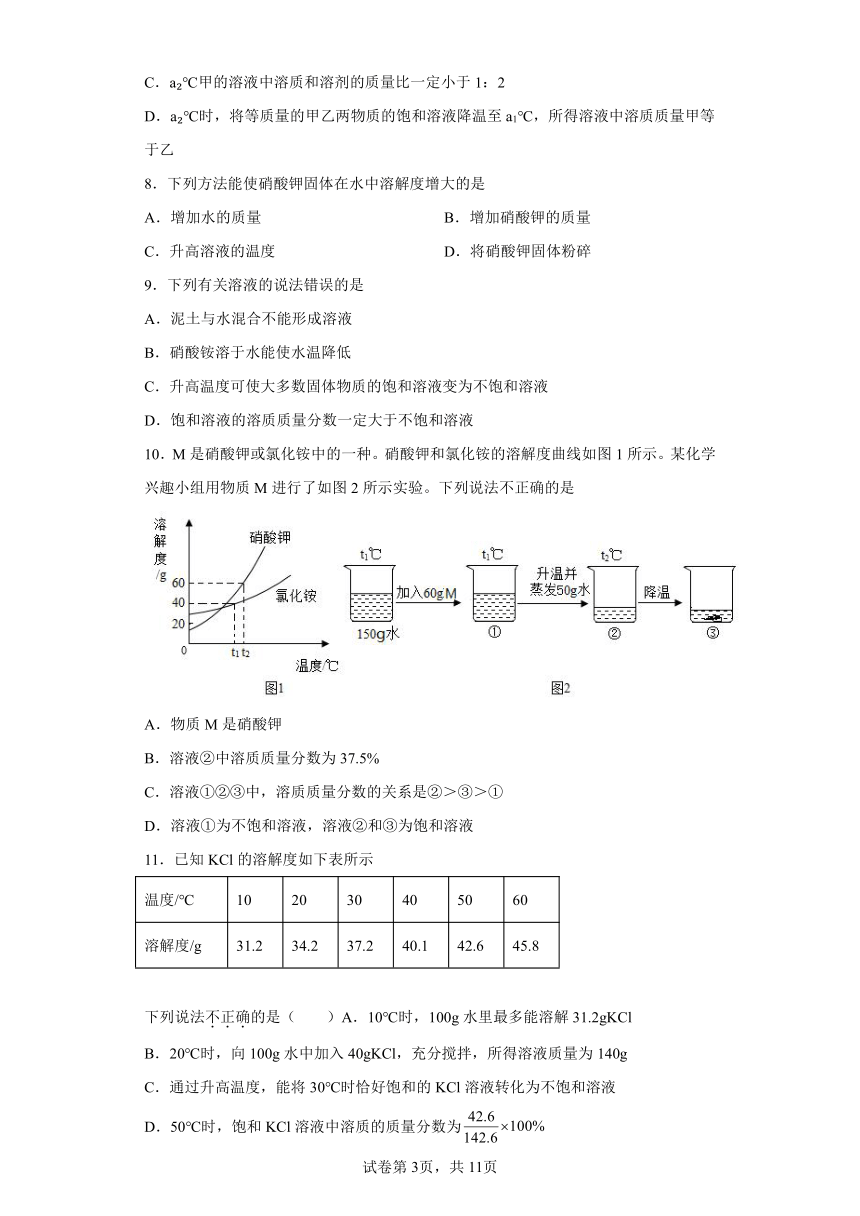
10.M是硝酸钾或氯化铵中的一种。硝酸钾和氯化铵的溶解度曲线如图1所示。某化学兴趣小组用物质M进行了如图2所示实验。下列说法不正确的是
A.物质M是硝酸钾
B.溶液②中溶质质量分数为37.5%
C.溶液①②③中,溶质质量分数的关系是②>③>①
D.溶液①为不饱和溶液,溶液②和③为饱和溶液
11.已知KCl的溶解度如下表所示
温度/℃ 10 20 30 40 50 60
溶解度/g 31.2 34.2 37.2 40.1 42.6 45.8
下列说法不正确的是( )A.10℃时,100g水里最多能溶解31.2gKCl
B.20℃时,向100g水中加入40gKCl,充分搅拌,所得溶液质量为140g
C.通过升高温度,能将30℃时恰好饱和的KCl溶液转化为不饱和溶液
D.50℃时,饱和KCl溶液中溶质的质量分数为
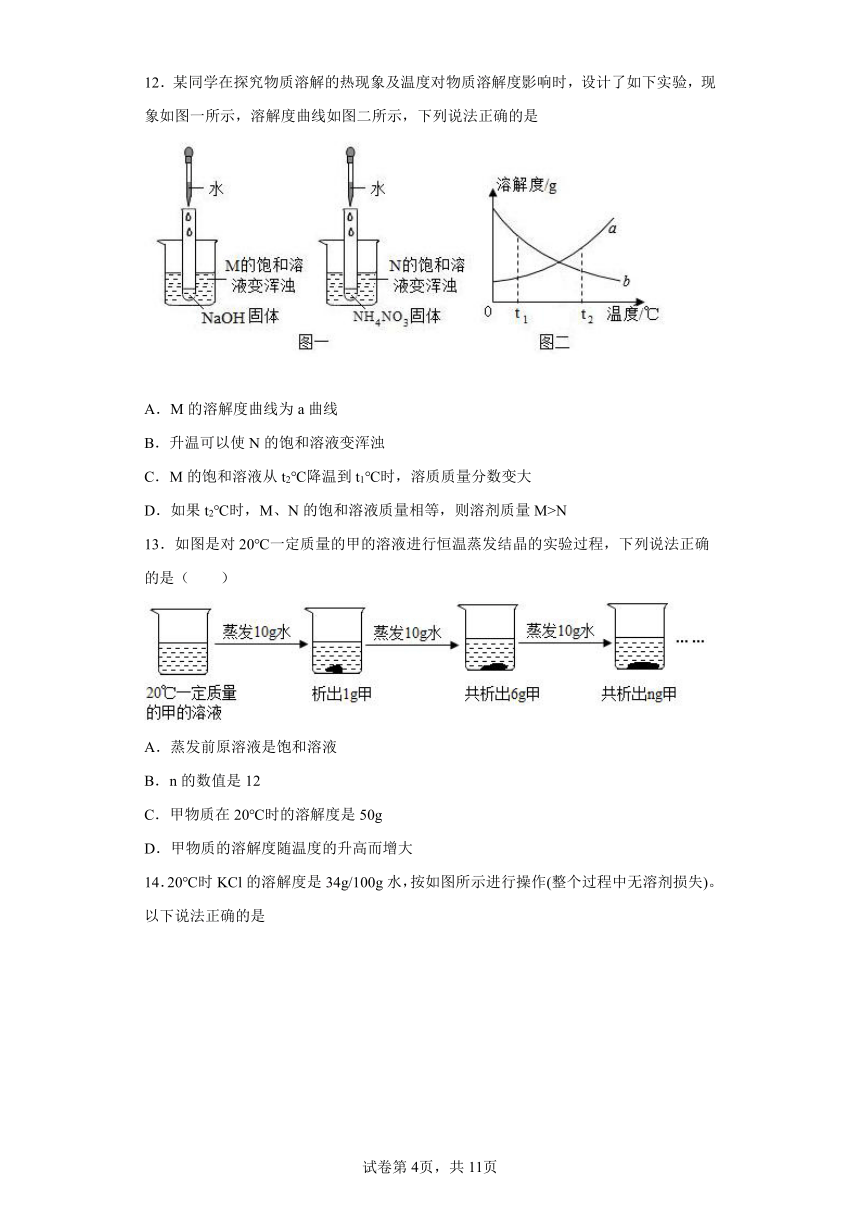
12.某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是
A.M的溶解度曲线为a曲线
B.升温可以使N的饱和溶液变浑浊
C.M的饱和溶液从t2℃降温到t1℃时,溶质质量分数变大
D.如果t2℃时,M、N的饱和溶液质量相等,则溶剂质量M>N
13.如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,下列说法正确的是( )
A.蒸发前原溶液是饱和溶液
B.n的数值是12
C.甲物质在20℃时的溶解度是50g
D.甲物质的溶解度随温度的升高而增大
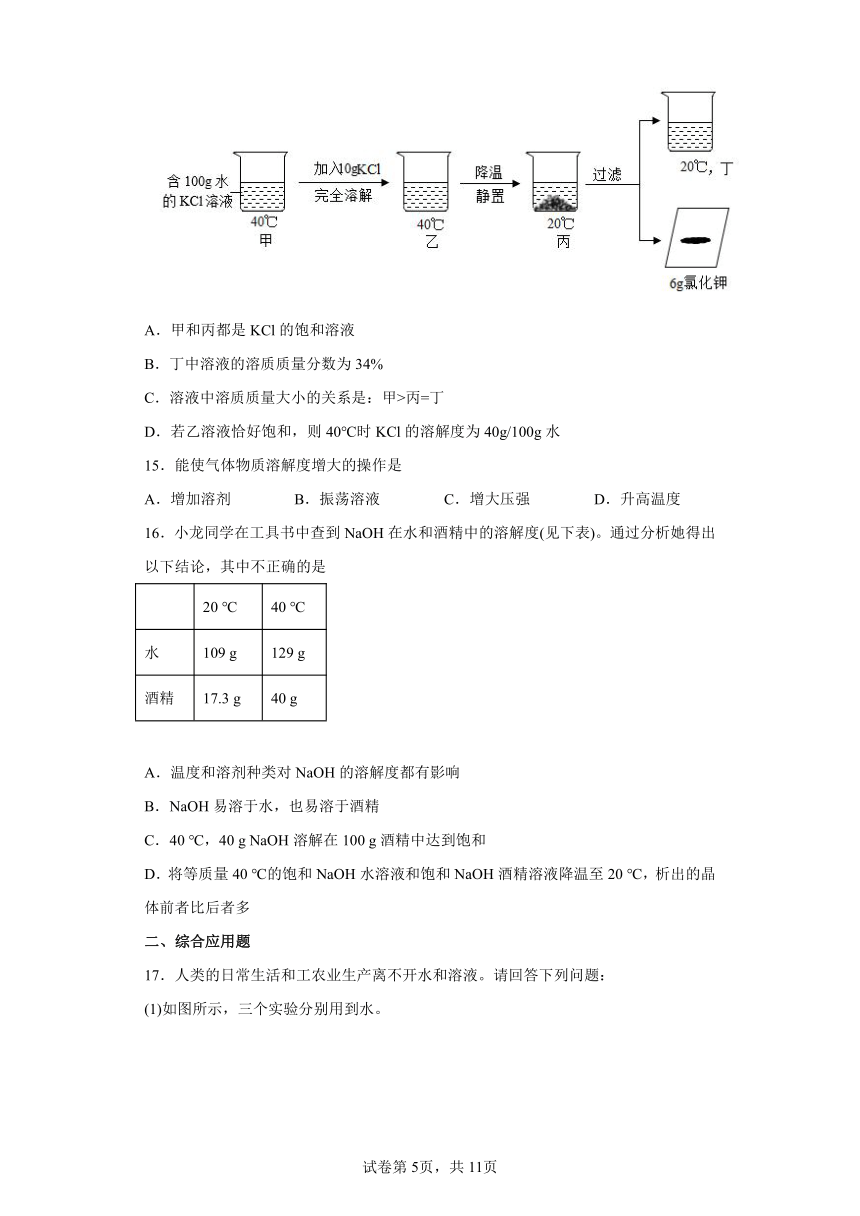
14.20℃时KCl的溶解度是34g/100g水,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是
A.甲和丙都是KCl的饱和溶液
B.丁中溶液的溶质质量分数为34%
C.溶液中溶质质量大小的关系是:甲>丙=丁
D.若乙溶液恰好饱和,则40℃时KCl的溶解度为40g/100g水
15.能使气体物质溶解度增大的操作是
A.增加溶剂 B.振荡溶液 C.增大压强 D.升高温度
16.小龙同学在工具书中查到NaOH在水和酒精中的溶解度(见下表)。通过分析她得出以下结论,其中不正确的是
20 ℃ 40 ℃
水 109 g 129 g
酒精 17.3 g 40 g
A.温度和溶剂种类对NaOH的溶解度都有影响
B.NaOH易溶于水,也易溶于酒精
C.40 ℃,40 g NaOH溶解在100 g酒精中达到饱和
D.将等质量40 ℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20 ℃,析出的晶体前者比后者多
二、综合应用题
17.人类的日常生活和工农业生产离不开水和溶液。请回答下列问题:
(1)如图所示,三个实验分别用到水。
请回答:
①实验A中热水的作用是提供热量和 ________ 。
②实验B能说明CO2可溶于水,同时发生的化学反应方程式为 ______ 。
③实验C,滴加水后看到U型管中 ______ (填“左边”或“右边”)液面升高。
(2)如图D是甲乙两种物质的溶解度曲线(不含结晶水)请回答下列问题:
①t1℃时,甲的溶解度是 _____ 。 ②下列说法一定正确的是 _______
A.甲的溶解度比乙的溶解度大
B.t1℃时,甲、乙的饱和溶液的溶质的质量分数相等
C.常温下,乙易溶于水
D.从t2℃降至t1℃,甲、乙溶液中均有晶体析出
③某同学设计的鉴别甲、乙固体的方案如下:t2℃时,取4.0g甲和4.0g乙分别放入两只小烧杯中,各加入10mL水(水的密度为1g/mL),用玻璃棒充分搅拌后,观察现象。你认为此方案是否可行?并说明理由 ____ 。
④甲中混有少量的乙,要提纯甲,实验步骤:加水溶解,蒸发浓缩, __________ ,然后过滤。
18.如图所示是氢氧化钠的溶解度曲线,请回答下列问题:
(1)t℃时氢氧化钠饱和溶液的溶质质量分数是 _______
(2)室温为20℃时,小芳同学向100g20℃的水中加入150g氢氧化钠,发现氢氧化钠全部溶解,于是对此曲线的准确性提出了质疑,其理由是_______小明同学经过认真分析后对出现上述现象的原因作出了合理的解释,你认为出现这种现象的原因是_______
(3)他们想继续测定室温(20℃)时氢氧化钠的溶解度,小芳提出:将(2)中所得溶液冷却到20℃、过滤、干燥、称量固体质量为m1g,由此得出室温(20℃)时氢氧化钠的溶解度为_______g。
交流与反思:
(4)经讨论他们发现上述方案从操作的角度看,是因为_______使固体质量m1偏大,从而会使测定结果偏_______。
(5)最后一致同意按如下方案进行实验:
①将(2)中所得溶液冷却到20℃后,取溶液20.9g,向其中慢慢滴加MgCl2溶液至氢氧化钠完全反应(MgCl2+2NaOH=2NaCl+Mg(OH)2↓),表明氢氧化钠也完全反应的现象是_______
②过滤、洗涤、干燥、称量得固体质量为m2g,从而计算出室温(20℃)时氢氧化钠的溶解度,若室温(20℃)时氢氧化钠的溶解度确实为109g,则m2=____g
19.下表是甲、乙、丙三种物质的部分溶解度(单位:g/100g水),请回答。
温度(℃) 10 20 30 40 50 60
甲 35.8 36.0 36.3 36.6 37.0 37.3
乙 20.9 31.6 45.8 63.9 85.5 110.0
丙 0.182 0.165 0.160 0.141 x 0.121
(1)10℃时,甲物质的溶解度是_____g/100g水。
(2)三种物质中溶解度受温度影响较大的是_____;
(3)物质在水中的溶解性与其溶解度(20℃)的关系示意图如下,则丙物质在水中的溶解性是_____;
(4)30℃时,乙物质饱和溶液的溶质质量分数是_____;(列式即可,不要求计算)
(5)50℃时,三种物质的溶解度由大到小的顺序是_____;
(6)向不同温度的100g水中分别放入等质量的乙物质,保持温度不变,溶解情况如图所示。相关分析正确的是_____;
a.溶液温度:Ⅰ>Ⅱ>Ⅲ>Ⅳ
b.溶液质量:Ⅰ=Ⅱ>Ⅲ>Ⅳ
c.溶液Ⅰ一定是不饱和溶液
d.使Ⅳ中的固体恰好全部溶解,溶质质量分数不变
(7)气体的溶解度也有一定的变化规律,不同温度下,氧气的溶解度随压强变化如下图所示,图中t2对应温度为30℃,则t1对应的温度_____。
A小于30℃ B等于30℃ C大于30℃ D无法确定
(8)t℃时,某物质(固体)的饱和溶液中,溶质与溶液的质量比是 n:m,则在 t℃时,该物质的溶解度为_____。
20.研究“水”可从多角度展开。
(1)水的电解
①宏观现象:按图1所示装置,通电一段时间后,试管A和B中产生气体的体积比约为_______,检验B中气体的现象是_____;
②微观分析:该反应中发生分解的微粒名称是_____;
③结论:水由氢氧元素组成。
(2)水的性质
将黄豆大小的金属钾放入盛有水的烧杯中,生成H2;在反应后的溶液中滴入酚酞试液,溶液变红。写出该反应的化学方程式_____
(3)水的用途
①碘与锌在常温下反应速度很慢,若滴入几滴水则反应剧烈,水在此的作用是__;
②图2实验中,对水的主要作用分析不全面的是_____(填字母)
a. a图中的水便于观察烧瓶内气压变化
b. b图中的水提供热量
c. c图集气瓶中的水排尽空气且便于观察H2何时集满
d. d图中的水防止熔融物炸裂集气瓶
(4)水与溶液
根据所给氯化钠和碳酸钠的溶解度及溶解度曲线的信息,回答下列问题:
温度 0℃ 10℃ 20℃ 30℃ 40℃
氯化钠溶解度/g 35 35.5 36 36.5 37
碳酸钠溶解度/g 6 10 18 36.5 50
①30℃时,NaCl的溶解度是_____g。
②t2℃时,将40g Na2CO3固体加入50g水中,充分溶解后所得Na2CO3溶液中溶质与溶剂的质量比为___。
③若Na2CO3中混有少量的NaCl,提纯Na2CO3应采取的方法是______(填“降温结晶”或“蒸发结晶”)
21.请按要求完成下列试验中的有关问题:
(1)图1实验何时停止加热?_____
(2)用如图2所示的装置进行电解水实验,有一下描述:
①正极产生的是氧气 ②a、b两试管内收集到的气体的体积比约2:1
③A试管内产生的气体能燃烧 ④b试管内产生的气体能使带火星的木条复燃
⑤化学反应前后元素的种类不变 ⑥该实验说明水是由氢气与氧气组成
以上描述中正确的是_____(填序号)
(3)图3为某兴趣小组在实验室中利用CO气体模拟炼铁的装置:
①装置A玻璃管中发生反应的化学方程式是_____
②装置B的作用是_____
(4)图4盛水的烧杯中放着t2℃下装有甲、乙两种物质饱和溶液的试管(不考虑溶剂的蒸发),根据图5甲、乙两种固体物质的溶解度曲线和有关信息回答:
①据图可以推测甲物质的溶解度随温度的变化规律是_____;
②向烧杯内的水中加入硝酸铵固体后,盛_____溶液的试管中有晶体析出(填“甲”或“乙”)
22.水和溶液在日常生活、科学研究中具有广泛的用途。
(1)生活中为了降低水的硬度并杀菌消毒,常用的方法是______。
(2)甲、乙两种物质(均不含结晶水)的溶解度曲线如图所示,请回答。
①t1℃时,在50g水中加入20g乙固体,充分搅拌后得到______(填“饱和或不饱和”)溶液。
②t2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须恒温蒸发掉较多水的是______(填“甲”或“乙”)物质的饱和溶液。
③使甲物质的溶液状态发生如下改变,对应操作正确的是______。
A.a点→c点:加水 B.b点→c点:恒温蒸发
C.a点→b点:升温 D.c点→a点:降温、过滤
(3)生理盐水是医疗上常用的一种溶液,取出其中的任意一部分进行比较,发现它们的组成完全相同,说明溶液具有______性。
(4)实验室常用过氧化氢溶液制取氧气,若要制取6.4g氧气,则同时产生水的质量是多少?(写出计算过程)
试卷第1页,共3页
试卷第2页,共2页
参考答案:
1.C
2.A
3.D
4.D
5.D
6.D
7.B
8.C
9.D
10.C
11.B
12.D
13.C
14.D
15.C
16.D
17. 隔绝氧气 CO2+H2O=H2CO3 左边 20g BC 可行,t2℃时4g甲能溶解在10g水中形成溶液,而4g乙不能全部溶解在10g水中形成溶液 降温结晶
18. 37.5% 20℃时氢氧化钠溶解度为109g,100g20℃的水中最多可溶解氢氧化钠的质量为109g 氢氧化钠溶于水放热,使水温升高,氢氧化钠溶解度增大,使氢氧化钠全部溶解 (150- m1) 过滤所得的氢氧化钠固体附带氢氧化钠溶液 小 不再产生白色沉淀 7.9
19. 35.8 乙 微溶于水 ×100% 乙、甲、丙 bd A
20. 2:1 带火星的木条复燃 水分子 2K+2H2O=2KOH+H2↑ 加快反应速度(合理即可) ab 36.5 2:5 降温结晶
21. 待蒸发皿中出现较多固体时,停止加热 ①②③④⑤ Fe2O3+3CO2Fe+3CO2 吸收生成的二氧化碳并收集尾气 甲物质的溶解度随温度升高而增大 甲
22.(1)加热煮沸
(2) 饱和 乙 BCD
(3)均一
(4)解:设同时产生水的质量是x
答:同时产生水的质量是7.2g。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.能证明硝酸钾在20℃时已达到饱和状态的是( )
A.取少量该溶液,升温后没有硝酸钾晶体析出
B.温度不变,向该溶液中加入少量水,溶质的质量分数变小
C.温度不变,向该溶液加入少量硝酸钾晶体,溶质质量分数不变
D.取少量该溶液,降温到10℃,有硝酸钾晶体析出
2.如图是KNO3的溶解度曲线,下列说法正确的是
A.溶液从b点降温到a点,有晶体析出
B.60℃时,b、c点对应的都是饱和溶液
C.将a点的饱和溶液从20℃升温到60℃时仍是饱和溶液
D.60℃时,向50g水中加入60gKNO3,形成不饱和溶液
3.夏季,鱼虾养殖塘内常放一些水泵,把水喷向空中(如图),从化学角度分析,喷水的目的是
A.增加观赏性 B.降低塘内水温
C.杀灭水中细菌 D.便于溶解氧气
4.下列关于溶解度的说法,正确的是
A.20℃时,20g硝酸钾溶解在100g水里,所以20℃时硝酸钾的溶解度是20g
B.20℃时,把20g硝酸钾溶解在水里制成饱和溶液,所以20℃时硝酸钾的溶解度是20g
C.把31.6克硝酸钾溶解在100g水里形成饱和溶液,所以硝酸钾的溶解度是31.6
D.20℃时,把31.6g硝酸钾溶解在100g水里,形成饱和溶液,所以20℃时硝酸钾的溶解度是31.6 g
5.如图是氯化钠、碳酸钠和氢氧化钙的溶解度曲线,下列说法正确的是( )
A.碳酸钠的溶解度比氯化钠的溶解度小
B.时,分别向50g水中加入15g氯化钠和碳酸钠,充分溶解后都形成饱和溶液
C.升高温度可以将氢氧化钙的饱和溶液转化成不饱和溶液
D.碳酸钠中混有少量的氯化钠,可以用降温结晶的方法得到碳酸钠晶体
6.一定温度下,向烧杯中加入一定质量的水,仅有部分晶体溶解,所得溶液与原溶液相比,说法正确的是( )
A.溶剂的质量增加,溶液颜色变浅 B.溶质溶解度不变,溶液颜色变深
C.溶质的质量增加,溶液颜色变深 D.溶质溶解度不变,溶液颜色不变
7.下图是甲乙两种物质(不考虑结晶水)的溶解度曲线,下列说法正确的是
A.a1℃时,向甲的饱和溶液,加入25g甲,再升温至a ℃,烧杯底部有5g不溶物
B.a ℃,甲的饱和溶液可以配制成10%的甲溶液500g
C.a ℃甲的溶液中溶质和溶剂的质量比一定小于1:2
D.a ℃时,将等质量的甲乙两物质的饱和溶液降温至a1℃,所得溶液中溶质质量甲等于乙
8.下列方法能使硝酸钾固体在水中溶解度增大的是
A.增加水的质量 B.增加硝酸钾的质量
C.升高溶液的温度 D.将硝酸钾固体粉碎
9.下列有关溶液的说法错误的是
A.泥土与水混合不能形成溶液
B.硝酸铵溶于水能使水温降低
C.升高温度可使大多数固体物质的饱和溶液变为不饱和溶液
D.饱和溶液的溶质质量分数一定大于不饱和溶液
10.M是硝酸钾或氯化铵中的一种。硝酸钾和氯化铵的溶解度曲线如图1所示。某化学兴趣小组用物质M进行了如图2所示实验。下列说法不正确的是
A.物质M是硝酸钾
B.溶液②中溶质质量分数为37.5%
C.溶液①②③中,溶质质量分数的关系是②>③>①
D.溶液①为不饱和溶液,溶液②和③为饱和溶液
11.已知KCl的溶解度如下表所示
温度/℃ 10 20 30 40 50 60
溶解度/g 31.2 34.2 37.2 40.1 42.6 45.8
下列说法不正确的是( )A.10℃时,100g水里最多能溶解31.2gKCl
B.20℃时,向100g水中加入40gKCl,充分搅拌,所得溶液质量为140g
C.通过升高温度,能将30℃时恰好饱和的KCl溶液转化为不饱和溶液
D.50℃时,饱和KCl溶液中溶质的质量分数为
12.某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是
A.M的溶解度曲线为a曲线
B.升温可以使N的饱和溶液变浑浊
C.M的饱和溶液从t2℃降温到t1℃时,溶质质量分数变大
D.如果t2℃时,M、N的饱和溶液质量相等,则溶剂质量M>N
13.如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,下列说法正确的是( )
A.蒸发前原溶液是饱和溶液
B.n的数值是12
C.甲物质在20℃时的溶解度是50g
D.甲物质的溶解度随温度的升高而增大
14.20℃时KCl的溶解度是34g/100g水,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是
A.甲和丙都是KCl的饱和溶液
B.丁中溶液的溶质质量分数为34%
C.溶液中溶质质量大小的关系是:甲>丙=丁
D.若乙溶液恰好饱和,则40℃时KCl的溶解度为40g/100g水
15.能使气体物质溶解度增大的操作是
A.增加溶剂 B.振荡溶液 C.增大压强 D.升高温度
16.小龙同学在工具书中查到NaOH在水和酒精中的溶解度(见下表)。通过分析她得出以下结论,其中不正确的是
20 ℃ 40 ℃
水 109 g 129 g
酒精 17.3 g 40 g
A.温度和溶剂种类对NaOH的溶解度都有影响
B.NaOH易溶于水,也易溶于酒精
C.40 ℃,40 g NaOH溶解在100 g酒精中达到饱和
D.将等质量40 ℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20 ℃,析出的晶体前者比后者多
二、综合应用题
17.人类的日常生活和工农业生产离不开水和溶液。请回答下列问题:
(1)如图所示,三个实验分别用到水。
请回答:
①实验A中热水的作用是提供热量和 ________ 。
②实验B能说明CO2可溶于水,同时发生的化学反应方程式为 ______ 。
③实验C,滴加水后看到U型管中 ______ (填“左边”或“右边”)液面升高。
(2)如图D是甲乙两种物质的溶解度曲线(不含结晶水)请回答下列问题:
①t1℃时,甲的溶解度是 _____ 。 ②下列说法一定正确的是 _______
A.甲的溶解度比乙的溶解度大
B.t1℃时,甲、乙的饱和溶液的溶质的质量分数相等
C.常温下,乙易溶于水
D.从t2℃降至t1℃,甲、乙溶液中均有晶体析出
③某同学设计的鉴别甲、乙固体的方案如下:t2℃时,取4.0g甲和4.0g乙分别放入两只小烧杯中,各加入10mL水(水的密度为1g/mL),用玻璃棒充分搅拌后,观察现象。你认为此方案是否可行?并说明理由 ____ 。
④甲中混有少量的乙,要提纯甲,实验步骤:加水溶解,蒸发浓缩, __________ ,然后过滤。
18.如图所示是氢氧化钠的溶解度曲线,请回答下列问题:
(1)t℃时氢氧化钠饱和溶液的溶质质量分数是 _______
(2)室温为20℃时,小芳同学向100g20℃的水中加入150g氢氧化钠,发现氢氧化钠全部溶解,于是对此曲线的准确性提出了质疑,其理由是_______小明同学经过认真分析后对出现上述现象的原因作出了合理的解释,你认为出现这种现象的原因是_______
(3)他们想继续测定室温(20℃)时氢氧化钠的溶解度,小芳提出:将(2)中所得溶液冷却到20℃、过滤、干燥、称量固体质量为m1g,由此得出室温(20℃)时氢氧化钠的溶解度为_______g。
交流与反思:
(4)经讨论他们发现上述方案从操作的角度看,是因为_______使固体质量m1偏大,从而会使测定结果偏_______。
(5)最后一致同意按如下方案进行实验:
①将(2)中所得溶液冷却到20℃后,取溶液20.9g,向其中慢慢滴加MgCl2溶液至氢氧化钠完全反应(MgCl2+2NaOH=2NaCl+Mg(OH)2↓),表明氢氧化钠也完全反应的现象是_______
②过滤、洗涤、干燥、称量得固体质量为m2g,从而计算出室温(20℃)时氢氧化钠的溶解度,若室温(20℃)时氢氧化钠的溶解度确实为109g,则m2=____g
19.下表是甲、乙、丙三种物质的部分溶解度(单位:g/100g水),请回答。
温度(℃) 10 20 30 40 50 60
甲 35.8 36.0 36.3 36.6 37.0 37.3
乙 20.9 31.6 45.8 63.9 85.5 110.0
丙 0.182 0.165 0.160 0.141 x 0.121
(1)10℃时,甲物质的溶解度是_____g/100g水。
(2)三种物质中溶解度受温度影响较大的是_____;
(3)物质在水中的溶解性与其溶解度(20℃)的关系示意图如下,则丙物质在水中的溶解性是_____;
(4)30℃时,乙物质饱和溶液的溶质质量分数是_____;(列式即可,不要求计算)
(5)50℃时,三种物质的溶解度由大到小的顺序是_____;
(6)向不同温度的100g水中分别放入等质量的乙物质,保持温度不变,溶解情况如图所示。相关分析正确的是_____;
a.溶液温度:Ⅰ>Ⅱ>Ⅲ>Ⅳ
b.溶液质量:Ⅰ=Ⅱ>Ⅲ>Ⅳ
c.溶液Ⅰ一定是不饱和溶液
d.使Ⅳ中的固体恰好全部溶解,溶质质量分数不变
(7)气体的溶解度也有一定的变化规律,不同温度下,氧气的溶解度随压强变化如下图所示,图中t2对应温度为30℃,则t1对应的温度_____。
A小于30℃ B等于30℃ C大于30℃ D无法确定
(8)t℃时,某物质(固体)的饱和溶液中,溶质与溶液的质量比是 n:m,则在 t℃时,该物质的溶解度为_____。
20.研究“水”可从多角度展开。
(1)水的电解
①宏观现象:按图1所示装置,通电一段时间后,试管A和B中产生气体的体积比约为_______,检验B中气体的现象是_____;
②微观分析:该反应中发生分解的微粒名称是_____;
③结论:水由氢氧元素组成。
(2)水的性质
将黄豆大小的金属钾放入盛有水的烧杯中,生成H2;在反应后的溶液中滴入酚酞试液,溶液变红。写出该反应的化学方程式_____
(3)水的用途
①碘与锌在常温下反应速度很慢,若滴入几滴水则反应剧烈,水在此的作用是__;
②图2实验中,对水的主要作用分析不全面的是_____(填字母)
a. a图中的水便于观察烧瓶内气压变化
b. b图中的水提供热量
c. c图集气瓶中的水排尽空气且便于观察H2何时集满
d. d图中的水防止熔融物炸裂集气瓶
(4)水与溶液
根据所给氯化钠和碳酸钠的溶解度及溶解度曲线的信息,回答下列问题:
温度 0℃ 10℃ 20℃ 30℃ 40℃
氯化钠溶解度/g 35 35.5 36 36.5 37
碳酸钠溶解度/g 6 10 18 36.5 50
①30℃时,NaCl的溶解度是_____g。
②t2℃时,将40g Na2CO3固体加入50g水中,充分溶解后所得Na2CO3溶液中溶质与溶剂的质量比为___。
③若Na2CO3中混有少量的NaCl,提纯Na2CO3应采取的方法是______(填“降温结晶”或“蒸发结晶”)
21.请按要求完成下列试验中的有关问题:
(1)图1实验何时停止加热?_____
(2)用如图2所示的装置进行电解水实验,有一下描述:
①正极产生的是氧气 ②a、b两试管内收集到的气体的体积比约2:1
③A试管内产生的气体能燃烧 ④b试管内产生的气体能使带火星的木条复燃
⑤化学反应前后元素的种类不变 ⑥该实验说明水是由氢气与氧气组成
以上描述中正确的是_____(填序号)
(3)图3为某兴趣小组在实验室中利用CO气体模拟炼铁的装置:
①装置A玻璃管中发生反应的化学方程式是_____
②装置B的作用是_____
(4)图4盛水的烧杯中放着t2℃下装有甲、乙两种物质饱和溶液的试管(不考虑溶剂的蒸发),根据图5甲、乙两种固体物质的溶解度曲线和有关信息回答:
①据图可以推测甲物质的溶解度随温度的变化规律是_____;
②向烧杯内的水中加入硝酸铵固体后,盛_____溶液的试管中有晶体析出(填“甲”或“乙”)
22.水和溶液在日常生活、科学研究中具有广泛的用途。
(1)生活中为了降低水的硬度并杀菌消毒,常用的方法是______。
(2)甲、乙两种物质(均不含结晶水)的溶解度曲线如图所示,请回答。
①t1℃时,在50g水中加入20g乙固体,充分搅拌后得到______(填“饱和或不饱和”)溶液。
②t2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须恒温蒸发掉较多水的是______(填“甲”或“乙”)物质的饱和溶液。
③使甲物质的溶液状态发生如下改变,对应操作正确的是______。
A.a点→c点:加水 B.b点→c点:恒温蒸发
C.a点→b点:升温 D.c点→a点:降温、过滤
(3)生理盐水是医疗上常用的一种溶液,取出其中的任意一部分进行比较,发现它们的组成完全相同,说明溶液具有______性。
(4)实验室常用过氧化氢溶液制取氧气,若要制取6.4g氧气,则同时产生水的质量是多少?(写出计算过程)
试卷第1页,共3页
试卷第2页,共2页
参考答案:
1.C
2.A
3.D
4.D
5.D
6.D
7.B
8.C
9.D
10.C
11.B
12.D
13.C
14.D
15.C
16.D
17. 隔绝氧气 CO2+H2O=H2CO3 左边 20g BC 可行,t2℃时4g甲能溶解在10g水中形成溶液,而4g乙不能全部溶解在10g水中形成溶液 降温结晶
18. 37.5% 20℃时氢氧化钠溶解度为109g,100g20℃的水中最多可溶解氢氧化钠的质量为109g 氢氧化钠溶于水放热,使水温升高,氢氧化钠溶解度增大,使氢氧化钠全部溶解 (150- m1) 过滤所得的氢氧化钠固体附带氢氧化钠溶液 小 不再产生白色沉淀 7.9
19. 35.8 乙 微溶于水 ×100% 乙、甲、丙 bd A
20. 2:1 带火星的木条复燃 水分子 2K+2H2O=2KOH+H2↑ 加快反应速度(合理即可) ab 36.5 2:5 降温结晶
21. 待蒸发皿中出现较多固体时,停止加热 ①②③④⑤ Fe2O3+3CO2Fe+3CO2 吸收生成的二氧化碳并收集尾气 甲物质的溶解度随温度升高而增大 甲
22.(1)加热煮沸
(2) 饱和 乙 BCD
(3)均一
(4)解:设同时产生水的质量是x
答:同时产生水的质量是7.2g。
答案第1页,共2页
答案第1页,共2页
