9.2溶解度同步练习—2021-2022学年九年级化学人教版下册(word版 含答案)
文档属性
| 名称 | 9.2溶解度同步练习—2021-2022学年九年级化学人教版下册(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 169.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-30 00:00:00 | ||
图片预览




文档简介
人教版化学九下册 9.2 溶解度 同步练习
一、单选题
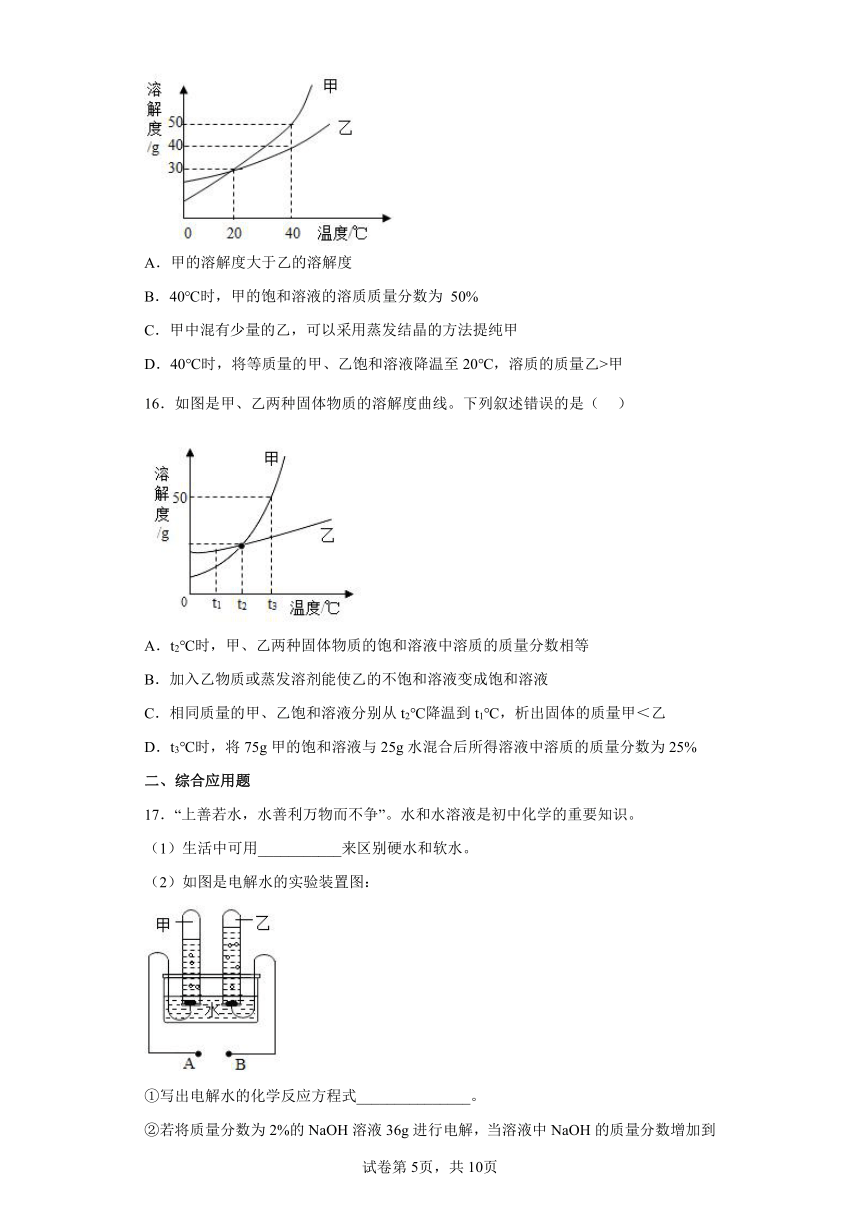
1.下列关于溶液的说法中,正确的是
A.泥土加入水中,振荡后可以形成溶液
B.蔗糖溶液上半部分溶液的甜度低于下半部分溶液的甜度
C.氢氧化钠溶液能导电,因为溶液中有较多自由移动的离子
D.氯化钠饱和溶液中不能再溶解少量硝酸钾晶体
2.如图是氯化钠、碳酸钠和氢氧化钙的溶解度曲线,下列说法正确的是( )
A.碳酸钠的溶解度比氯化钠的溶解度小
B.时,分别向50g水中加入15g氯化钠和碳酸钠,充分溶解后都形成饱和溶液
C.升高温度可以将氢氧化钙的饱和溶液转化成不饱和溶液
D.碳酸钠中混有少量的氯化钠,可以用降温结晶的方法得到碳酸钠晶体
3.下列有关溶液说法正确的是
A.溶液都是均一、稳定的混合物 B.形成溶液的溶质都是固体
C.所有饱和溶液都比不饱和溶液要浓 D.溶液的体积等于溶质的体积与溶剂的体积之和
4.t℃时,向一支盛有0.l克熟石灰的试管内加人 10 mL水,充分振荡,静置,试管底部仍有未溶解的白色固体,对于试管内上层澄清液体的叙述正确的是
A.溶液中溶质的质量为0.1克 B.溶液是t℃时的饱和溶液
C.升高温度溶液变为不饱和溶液 D.溶液中溶质的质量分数等于1%
5.甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示。下列说法正确的是
A.t1 ℃时,甲的溶解度大于乙的溶解度
B.t2 ℃时,乙的饱和溶液升温或降温均会析出晶体
C.乙溶液从t3 ℃降温到t1 ℃,乙溶液中的溶质质量分数会发生改变
D.t3 ℃时,50 g水中加入40 g的甲物质充分溶解可得到90 g甲的饱和溶液
6.能证实A物质的溶液在20°C时为饱和溶液的是( )
A.稍微降温,就有A晶体析出
B.蒸发掉10g水,有A晶体析出
C.加热到30°C时,再加A物质能继续溶解
D.20°C时,向溶液中加入少量的A晶体,溶液质量不变
7.下图是三种常见固体物质的溶解度曲线,下列说法正确的是
A.t1℃时,A和C的饱和溶液中含有相同质量的溶质
B.欲除去A溶液中少量的B物质,常采用蒸发结晶的方法
C.t1℃时,将80gA的饱和溶液稀释为质量分数为20%的溶液,需要加水的质量为70g
D.t2℃时,将A、B、C的饱和溶液降温至t1℃,所得溶液的溶质质量分数大小顺序为:B>A=C
8.一定温度下,向图Ⅰ烧杯中加入一定量的水,如图Ⅱ所示,所得溶液与原溶液相比,判断一定正确的是
A.所得溶液是饱和溶液
B.溶质的质量分数变大
C.溶质的质量增加
D.氯化钾的溶解度变大
9.室温时,有两瓶硝酸钾溶液,一瓶为饱和溶液(溶质的质量分数为 40%),另一瓶为 10%的溶液。下列实验操作中,无法区分这两种溶液的是( )
A.加一定量的水 B.加入少量硝酸钾晶体
C.略降低温度 D.室温时,蒸发少量水
10.如图,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据是( )
A.砂糖水颜色很深 B.砂糖水味道很甜
C.砂糖溶解得很快 D.砂糖固体有剩余
11.压强为101kPa下,硝酸钾和氨气在不同温度下的溶解度如下表。下列说法正确的是
温度℃ 10 20 30 60
溶解度/g KNO3 20.9 31.6 45.8 110
NH3 70 56 44.5 20
A.两种物质的溶解度均随温度升高而增大
B.20℃时,KNO3饱和溶液中溶质的质量分数为31.6%
C.60℃的KNO3饱和溶液降温至30℃,有晶体析出
D.NH3的溶解度只与温度大小有关
12.下列说法中,正确的是( )
A.在100 g水里,最多能溶解36 g食盐,所以食盐的溶解度为36 g
B.所有固体物质的溶解度都随着温度的升高而增大
C.有过剩溶质与溶液共存的溶液一定是该温度时的饱和溶液
D.20 ℃时100 g水里溶解了30 g硝酸钾,所以硝酸钾的溶解度是30 g
13.小龙同学在工具书中查到NaOH在水和酒精中的溶解度(见下表)。通过分析她得出以下结论,其中不正确的是
20 ℃ 40 ℃
水 109 g 129 g
酒精 17.3 g 40 g
A.温度和溶剂种类对NaOH的溶解度都有影响
B.NaOH易溶于水,也易溶于酒精
C.40 ℃,40 g NaOH溶解在100 g酒精中达到饱和
D.将等质量40 ℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20 ℃,析出的晶体前者比后者多
14.如图是甲、乙、丙三种固体物质的溶解度曲线, 下列说法正确的是
A.三种物质的溶解度都随温度升高而增大
B..t1℃时 20g 丙加入 50g 水中,充分搅拌得到 70g 溶液
C.甲的饱和溶液中混有少量乙,可通过降温结晶获得较纯净的甲
D.t2℃时三种物质的饱和溶液降温到t1℃,所得溶液中甲和丙的溶质质量分数相等
15.如图是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是
A.甲的溶解度大于乙的溶解度
B.40℃时,甲的饱和溶液的溶质质量分数为 50%
C.甲中混有少量的乙,可以采用蒸发结晶的方法提纯甲
D.40℃时,将等质量的甲、乙饱和溶液降温至20℃,溶质的质量乙>甲
16.如图是甲、乙两种固体物质的溶解度曲线。下列叙述错误的是( )
A.t2℃时,甲、乙两种固体物质的饱和溶液中溶质的质量分数相等
B.加入乙物质或蒸发溶剂能使乙的不饱和溶液变成饱和溶液
C.相同质量的甲、乙饱和溶液分别从t2℃降温到t1℃,析出固体的质量甲<乙
D.t3℃时,将75g甲的饱和溶液与25g水混合后所得溶液中溶质的质量分数为25%
二、综合应用题
17.“上善若水,水善利万物而不争”。水和水溶液是初中化学的重要知识。
(1)生活中可用___________来区别硬水和软水。
(2)如图是电解水的实验装置图:
①写出电解水的化学反应方程式_______________。
②若将质量分数为2%的NaOH溶液36g进行电解,当溶液中NaOH的质量分数增加到4%时停止电解,电解过程中NaOH始终不变,则产生氢气的质量为_________g。
(3)向NaOH的饱和溶液中再加入少量NaOH固体的过程中,发现固体全部溶解,一段时间后又有部分固体析出。请解释固体全部溶解原因__________。
(4)粗盐中除NaCl外还含有MgSO4以及泥沙等杂质。提纯粗盐的实验流程如下:
①用托盘天平称量3.6g粗盐时,发现天平指针偏向左盘,此时应_______(填序号)
A 向左盘添加粗盐 b 向右移动游码 c 向左移动游码 d 减少左盘粗盐
②操作①、②依次为图1中的_______,_______(填图1序号)。
③玻璃棒在蒸发时所起的作用是________________。
④本实验从滤液得到精盐,采用的是蒸发溶剂而不是降温的方法,结合图说明其原因是________
⑤在温度约为________℃时(取整数),MgSO4饱和溶液的溶质质量分数最大,此时结晶出的NaCl纯度较高。
18.遂宁境内的卓筒井是手工制盐的活化石,被誉为“中国古代第五大发明”、“世界石油钻井之父”,不仅是古代劳动人民勤劳、智慧的象征,也造福了千秋万代。其工艺流程包括下面五个步骤:
请结合所学化学知识,回答下列问题:
(1)第②步汲出的卤水浑浊,浓度一般在7~10度(即溶质质量分数为7%~10%,下同),这样的卤水咸度低,耗燃料,成本高,为了把卤水浓度提高18~20度,就产生了“晒卤”这一环节。在“晒卤”的过程中溶液溶质质量分数_____(填“不变”、“变大”或“变小”)。
(2)第④步“滤卤”和实验室“过滤”的原理一样,都是为了除去液体中的不溶性杂质。在实验室的过滤操作中,必须用到的玻璃仪器有:烧杯、玻璃棒、____,其中玻璃棒的作用是____。
(3)第⑤步“煎盐”和实验室___结晶(填结晶的方法)的原理相同。
(4)如图是甲、乙、丙三种物质的溶解度曲线图,
据图回答下列问题:
Ⅰ.甲、乙两种物质在___℃时溶解度相同。
Ⅱ.t2℃时,甲、乙、丙三种物质溶解度由大到小排列为______。
Ⅲ.t4℃时,将三种物质各ag分别加入100g水中,充分溶解后,只有一种能形成饱和溶液,则a的取值范围是__________。
19.如图是a、b、c三种物质的溶解度曲线,据图回答下列问题。
(1)t2℃时,物质a的溶解度与物质_____的溶解度相等。
(2)t3℃时,把80g物质a加入到200g水中充分搅拌、静置,形成的是_____溶液(填“饱和”或“不饱和”)。
(3)下列说法正确的是( )
A t2℃时,将a和c的混合溶液(两者均已达到饱和),降温至t1℃,析出的晶体含有a和c
B t2℃时将a、b、c饱和溶液分别降温至t1℃,所得溶液中溶质质量分数的大小关系是b>a>c
C 从混有少量b的a物质中提取较纯净的a,可通过冷却它们的热饱和溶液实现
D t1℃时,欲用a的饱和溶液配制10%的a溶液,只需要烧杯、量筒、胶头滴管三种玻璃仪器
20.A、B、C三种固体物质(均不含结晶水)的溶解度曲线。
(1)A中混有少量的B是可用______方法提纯A。
(2)t2℃时,A物质的饱和溶液,为了进一步提高该溶液溶质质量分数,可进行的操作是______。
(3)对于溶解度曲线上的点p,以下描述一定正确的是______。
a. A、B、C溶液的溶质质量分数相同;
b.C的溶液100g有10g溶质;
c.B溶液处于不饱和状态;
d.A、C溶液质量相等
21.请按要求完成下列试验中的有关问题:
(1)图1实验何时停止加热?_____
(2)用如图2所示的装置进行电解水实验,有一下描述:
①正极产生的是氧气 ②a、b两试管内收集到的气体的体积比约2:1
③A试管内产生的气体能燃烧 ④b试管内产生的气体能使带火星的木条复燃
⑤化学反应前后元素的种类不变 ⑥该实验说明水是由氢气与氧气组成
以上描述中正确的是_____(填序号)
(3)图3为某兴趣小组在实验室中利用CO气体模拟炼铁的装置:
①装置A玻璃管中发生反应的化学方程式是_____
②装置B的作用是_____
(4)图4盛水的烧杯中放着t2℃下装有甲、乙两种物质饱和溶液的试管(不考虑溶剂的蒸发),根据图5甲、乙两种固体物质的溶解度曲线和有关信息回答:
①据图可以推测甲物质的溶解度随温度的变化规律是_____;
②向烧杯内的水中加入硝酸铵固体后,盛_____溶液的试管中有晶体析出(填“甲”或“乙”)
22.某固体物质(不含结晶水)的溶解度曲线如图,M、N两点分别表示该物质在不同温度下的两种溶液,当条件改变时,溶液的状态在图中对应的点的位置可能随之变化,回答下列问题:
(1)M点表示该物质在t2℃_____(填“饱和”或“不饱和”)溶液。
(2)将M点所示的溶液变到N点所示的溶液,可以将M点的溶液降温至t1℃,过滤除去析出的晶体后,再将溶液升温至_____℃。
(3)t2℃时,若M点所示溶液的质量为a g,将该溶液降温到t1℃,析出晶体的质量为_____g(用分数表示,假设此过程水不蒸发,析出晶体不含结晶水)。
(4)当恒温蒸发溶剂时,M、N两点的位置变化正确的是_____(填字母)
A M、N点均不动B M、N点均垂直上移
C M点沿曲线下移;N点垂直上移至曲线D M点不动,N点垂直上移至曲线
(5)物质的溶解性也常应用于化工生厂。某化工厂用废硫酸制备K2SO4的流程如下:
物质 KCl K2SO4 NH4Cl (NH4)2SO4
溶解度/g(20℃) 34.2 11.1 37.2 75.4
①反应Ⅲ发生复分解反应,写出化学方程式_____。
②洗涤反应Ⅲ所得晶体最好用下列的_____(填序号)。
a、BaCl2溶液b、饱和NH4Cl溶液c、冷水d、饱和K2SO4溶液
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.A
4.B
5.B
6.D
7.C
8.C
9.A
10.D
11.C
12.C
13.D
14.C
15.D
16.C
17. 肥皂水 2H2O 2H2↑+O2↑ 2 NaOH溶于水放热温度溶液升高,溶解度增大 d C A 搅拌,防止局部温度过高,造成液滴飞溅 食盐的溶解度受温度影响小 70
18. 变大 漏斗 引流 蒸发 t3 乙>丙>甲 20≤a<40
19. b 不饱和 B、C
20.(1)降温结晶
(2)升高温度同时加入A溶质
(3)c
21. 待蒸发皿中出现较多固体时,停止加热 ①②③④⑤ Fe2O3+3CO2Fe+3CO2 吸收生成的二氧化碳并收集尾气 甲物质的溶解度随温度升高而增大 甲
22. 饱和 t3 a/7 D 2KCl+(NH4)2SO4=K2SO4↓+2NH4Cl d
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列关于溶液的说法中,正确的是
A.泥土加入水中,振荡后可以形成溶液
B.蔗糖溶液上半部分溶液的甜度低于下半部分溶液的甜度
C.氢氧化钠溶液能导电,因为溶液中有较多自由移动的离子
D.氯化钠饱和溶液中不能再溶解少量硝酸钾晶体
2.如图是氯化钠、碳酸钠和氢氧化钙的溶解度曲线,下列说法正确的是( )
A.碳酸钠的溶解度比氯化钠的溶解度小
B.时,分别向50g水中加入15g氯化钠和碳酸钠,充分溶解后都形成饱和溶液
C.升高温度可以将氢氧化钙的饱和溶液转化成不饱和溶液
D.碳酸钠中混有少量的氯化钠,可以用降温结晶的方法得到碳酸钠晶体
3.下列有关溶液说法正确的是
A.溶液都是均一、稳定的混合物 B.形成溶液的溶质都是固体
C.所有饱和溶液都比不饱和溶液要浓 D.溶液的体积等于溶质的体积与溶剂的体积之和
4.t℃时,向一支盛有0.l克熟石灰的试管内加人 10 mL水,充分振荡,静置,试管底部仍有未溶解的白色固体,对于试管内上层澄清液体的叙述正确的是
A.溶液中溶质的质量为0.1克 B.溶液是t℃时的饱和溶液
C.升高温度溶液变为不饱和溶液 D.溶液中溶质的质量分数等于1%
5.甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示。下列说法正确的是
A.t1 ℃时,甲的溶解度大于乙的溶解度
B.t2 ℃时,乙的饱和溶液升温或降温均会析出晶体
C.乙溶液从t3 ℃降温到t1 ℃,乙溶液中的溶质质量分数会发生改变
D.t3 ℃时,50 g水中加入40 g的甲物质充分溶解可得到90 g甲的饱和溶液
6.能证实A物质的溶液在20°C时为饱和溶液的是( )
A.稍微降温,就有A晶体析出
B.蒸发掉10g水,有A晶体析出
C.加热到30°C时,再加A物质能继续溶解
D.20°C时,向溶液中加入少量的A晶体,溶液质量不变
7.下图是三种常见固体物质的溶解度曲线,下列说法正确的是
A.t1℃时,A和C的饱和溶液中含有相同质量的溶质
B.欲除去A溶液中少量的B物质,常采用蒸发结晶的方法
C.t1℃时,将80gA的饱和溶液稀释为质量分数为20%的溶液,需要加水的质量为70g
D.t2℃时,将A、B、C的饱和溶液降温至t1℃,所得溶液的溶质质量分数大小顺序为:B>A=C
8.一定温度下,向图Ⅰ烧杯中加入一定量的水,如图Ⅱ所示,所得溶液与原溶液相比,判断一定正确的是
A.所得溶液是饱和溶液
B.溶质的质量分数变大
C.溶质的质量增加
D.氯化钾的溶解度变大
9.室温时,有两瓶硝酸钾溶液,一瓶为饱和溶液(溶质的质量分数为 40%),另一瓶为 10%的溶液。下列实验操作中,无法区分这两种溶液的是( )
A.加一定量的水 B.加入少量硝酸钾晶体
C.略降低温度 D.室温时,蒸发少量水
10.如图,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据是( )
A.砂糖水颜色很深 B.砂糖水味道很甜
C.砂糖溶解得很快 D.砂糖固体有剩余
11.压强为101kPa下,硝酸钾和氨气在不同温度下的溶解度如下表。下列说法正确的是
温度℃ 10 20 30 60
溶解度/g KNO3 20.9 31.6 45.8 110
NH3 70 56 44.5 20
A.两种物质的溶解度均随温度升高而增大
B.20℃时,KNO3饱和溶液中溶质的质量分数为31.6%
C.60℃的KNO3饱和溶液降温至30℃,有晶体析出
D.NH3的溶解度只与温度大小有关
12.下列说法中,正确的是( )
A.在100 g水里,最多能溶解36 g食盐,所以食盐的溶解度为36 g
B.所有固体物质的溶解度都随着温度的升高而增大
C.有过剩溶质与溶液共存的溶液一定是该温度时的饱和溶液
D.20 ℃时100 g水里溶解了30 g硝酸钾,所以硝酸钾的溶解度是30 g
13.小龙同学在工具书中查到NaOH在水和酒精中的溶解度(见下表)。通过分析她得出以下结论,其中不正确的是
20 ℃ 40 ℃
水 109 g 129 g
酒精 17.3 g 40 g
A.温度和溶剂种类对NaOH的溶解度都有影响
B.NaOH易溶于水,也易溶于酒精
C.40 ℃,40 g NaOH溶解在100 g酒精中达到饱和
D.将等质量40 ℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20 ℃,析出的晶体前者比后者多
14.如图是甲、乙、丙三种固体物质的溶解度曲线, 下列说法正确的是
A.三种物质的溶解度都随温度升高而增大
B..t1℃时 20g 丙加入 50g 水中,充分搅拌得到 70g 溶液
C.甲的饱和溶液中混有少量乙,可通过降温结晶获得较纯净的甲
D.t2℃时三种物质的饱和溶液降温到t1℃,所得溶液中甲和丙的溶质质量分数相等
15.如图是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是
A.甲的溶解度大于乙的溶解度
B.40℃时,甲的饱和溶液的溶质质量分数为 50%
C.甲中混有少量的乙,可以采用蒸发结晶的方法提纯甲
D.40℃时,将等质量的甲、乙饱和溶液降温至20℃,溶质的质量乙>甲
16.如图是甲、乙两种固体物质的溶解度曲线。下列叙述错误的是( )
A.t2℃时,甲、乙两种固体物质的饱和溶液中溶质的质量分数相等
B.加入乙物质或蒸发溶剂能使乙的不饱和溶液变成饱和溶液
C.相同质量的甲、乙饱和溶液分别从t2℃降温到t1℃,析出固体的质量甲<乙
D.t3℃时,将75g甲的饱和溶液与25g水混合后所得溶液中溶质的质量分数为25%
二、综合应用题
17.“上善若水,水善利万物而不争”。水和水溶液是初中化学的重要知识。
(1)生活中可用___________来区别硬水和软水。
(2)如图是电解水的实验装置图:
①写出电解水的化学反应方程式_______________。
②若将质量分数为2%的NaOH溶液36g进行电解,当溶液中NaOH的质量分数增加到4%时停止电解,电解过程中NaOH始终不变,则产生氢气的质量为_________g。
(3)向NaOH的饱和溶液中再加入少量NaOH固体的过程中,发现固体全部溶解,一段时间后又有部分固体析出。请解释固体全部溶解原因__________。
(4)粗盐中除NaCl外还含有MgSO4以及泥沙等杂质。提纯粗盐的实验流程如下:
①用托盘天平称量3.6g粗盐时,发现天平指针偏向左盘,此时应_______(填序号)
A 向左盘添加粗盐 b 向右移动游码 c 向左移动游码 d 减少左盘粗盐
②操作①、②依次为图1中的_______,_______(填图1序号)。
③玻璃棒在蒸发时所起的作用是________________。
④本实验从滤液得到精盐,采用的是蒸发溶剂而不是降温的方法,结合图说明其原因是________
⑤在温度约为________℃时(取整数),MgSO4饱和溶液的溶质质量分数最大,此时结晶出的NaCl纯度较高。
18.遂宁境内的卓筒井是手工制盐的活化石,被誉为“中国古代第五大发明”、“世界石油钻井之父”,不仅是古代劳动人民勤劳、智慧的象征,也造福了千秋万代。其工艺流程包括下面五个步骤:
请结合所学化学知识,回答下列问题:
(1)第②步汲出的卤水浑浊,浓度一般在7~10度(即溶质质量分数为7%~10%,下同),这样的卤水咸度低,耗燃料,成本高,为了把卤水浓度提高18~20度,就产生了“晒卤”这一环节。在“晒卤”的过程中溶液溶质质量分数_____(填“不变”、“变大”或“变小”)。
(2)第④步“滤卤”和实验室“过滤”的原理一样,都是为了除去液体中的不溶性杂质。在实验室的过滤操作中,必须用到的玻璃仪器有:烧杯、玻璃棒、____,其中玻璃棒的作用是____。
(3)第⑤步“煎盐”和实验室___结晶(填结晶的方法)的原理相同。
(4)如图是甲、乙、丙三种物质的溶解度曲线图,
据图回答下列问题:
Ⅰ.甲、乙两种物质在___℃时溶解度相同。
Ⅱ.t2℃时,甲、乙、丙三种物质溶解度由大到小排列为______。
Ⅲ.t4℃时,将三种物质各ag分别加入100g水中,充分溶解后,只有一种能形成饱和溶液,则a的取值范围是__________。
19.如图是a、b、c三种物质的溶解度曲线,据图回答下列问题。
(1)t2℃时,物质a的溶解度与物质_____的溶解度相等。
(2)t3℃时,把80g物质a加入到200g水中充分搅拌、静置,形成的是_____溶液(填“饱和”或“不饱和”)。
(3)下列说法正确的是( )
A t2℃时,将a和c的混合溶液(两者均已达到饱和),降温至t1℃,析出的晶体含有a和c
B t2℃时将a、b、c饱和溶液分别降温至t1℃,所得溶液中溶质质量分数的大小关系是b>a>c
C 从混有少量b的a物质中提取较纯净的a,可通过冷却它们的热饱和溶液实现
D t1℃时,欲用a的饱和溶液配制10%的a溶液,只需要烧杯、量筒、胶头滴管三种玻璃仪器
20.A、B、C三种固体物质(均不含结晶水)的溶解度曲线。
(1)A中混有少量的B是可用______方法提纯A。
(2)t2℃时,A物质的饱和溶液,为了进一步提高该溶液溶质质量分数,可进行的操作是______。
(3)对于溶解度曲线上的点p,以下描述一定正确的是______。
a. A、B、C溶液的溶质质量分数相同;
b.C的溶液100g有10g溶质;
c.B溶液处于不饱和状态;
d.A、C溶液质量相等
21.请按要求完成下列试验中的有关问题:
(1)图1实验何时停止加热?_____
(2)用如图2所示的装置进行电解水实验,有一下描述:
①正极产生的是氧气 ②a、b两试管内收集到的气体的体积比约2:1
③A试管内产生的气体能燃烧 ④b试管内产生的气体能使带火星的木条复燃
⑤化学反应前后元素的种类不变 ⑥该实验说明水是由氢气与氧气组成
以上描述中正确的是_____(填序号)
(3)图3为某兴趣小组在实验室中利用CO气体模拟炼铁的装置:
①装置A玻璃管中发生反应的化学方程式是_____
②装置B的作用是_____
(4)图4盛水的烧杯中放着t2℃下装有甲、乙两种物质饱和溶液的试管(不考虑溶剂的蒸发),根据图5甲、乙两种固体物质的溶解度曲线和有关信息回答:
①据图可以推测甲物质的溶解度随温度的变化规律是_____;
②向烧杯内的水中加入硝酸铵固体后,盛_____溶液的试管中有晶体析出(填“甲”或“乙”)
22.某固体物质(不含结晶水)的溶解度曲线如图,M、N两点分别表示该物质在不同温度下的两种溶液,当条件改变时,溶液的状态在图中对应的点的位置可能随之变化,回答下列问题:
(1)M点表示该物质在t2℃_____(填“饱和”或“不饱和”)溶液。
(2)将M点所示的溶液变到N点所示的溶液,可以将M点的溶液降温至t1℃,过滤除去析出的晶体后,再将溶液升温至_____℃。
(3)t2℃时,若M点所示溶液的质量为a g,将该溶液降温到t1℃,析出晶体的质量为_____g(用分数表示,假设此过程水不蒸发,析出晶体不含结晶水)。
(4)当恒温蒸发溶剂时,M、N两点的位置变化正确的是_____(填字母)
A M、N点均不动B M、N点均垂直上移
C M点沿曲线下移;N点垂直上移至曲线D M点不动,N点垂直上移至曲线
(5)物质的溶解性也常应用于化工生厂。某化工厂用废硫酸制备K2SO4的流程如下:
物质 KCl K2SO4 NH4Cl (NH4)2SO4
溶解度/g(20℃) 34.2 11.1 37.2 75.4
①反应Ⅲ发生复分解反应,写出化学方程式_____。
②洗涤反应Ⅲ所得晶体最好用下列的_____(填序号)。
a、BaCl2溶液b、饱和NH4Cl溶液c、冷水d、饱和K2SO4溶液
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.A
4.B
5.B
6.D
7.C
8.C
9.A
10.D
11.C
12.C
13.D
14.C
15.D
16.C
17. 肥皂水 2H2O 2H2↑+O2↑ 2 NaOH溶于水放热温度溶液升高,溶解度增大 d C A 搅拌,防止局部温度过高,造成液滴飞溅 食盐的溶解度受温度影响小 70
18. 变大 漏斗 引流 蒸发 t3 乙>丙>甲 20≤a<40
19. b 不饱和 B、C
20.(1)降温结晶
(2)升高温度同时加入A溶质
(3)c
21. 待蒸发皿中出现较多固体时,停止加热 ①②③④⑤ Fe2O3+3CO2Fe+3CO2 吸收生成的二氧化碳并收集尾气 甲物质的溶解度随温度升高而增大 甲
22. 饱和 t3 a/7 D 2KCl+(NH4)2SO4=K2SO4↓+2NH4Cl d
答案第1页,共2页
答案第1页,共2页
同课章节目录
