9.3溶液的浓度同步练习-2021-2022学年九年级化学人教版下册(word版 含答案)
文档属性
| 名称 | 9.3溶液的浓度同步练习-2021-2022学年九年级化学人教版下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 152.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-30 10:50:51 | ||
图片预览


文档简介
人教版化学九下册 9.3 溶液的浓度 同步练习
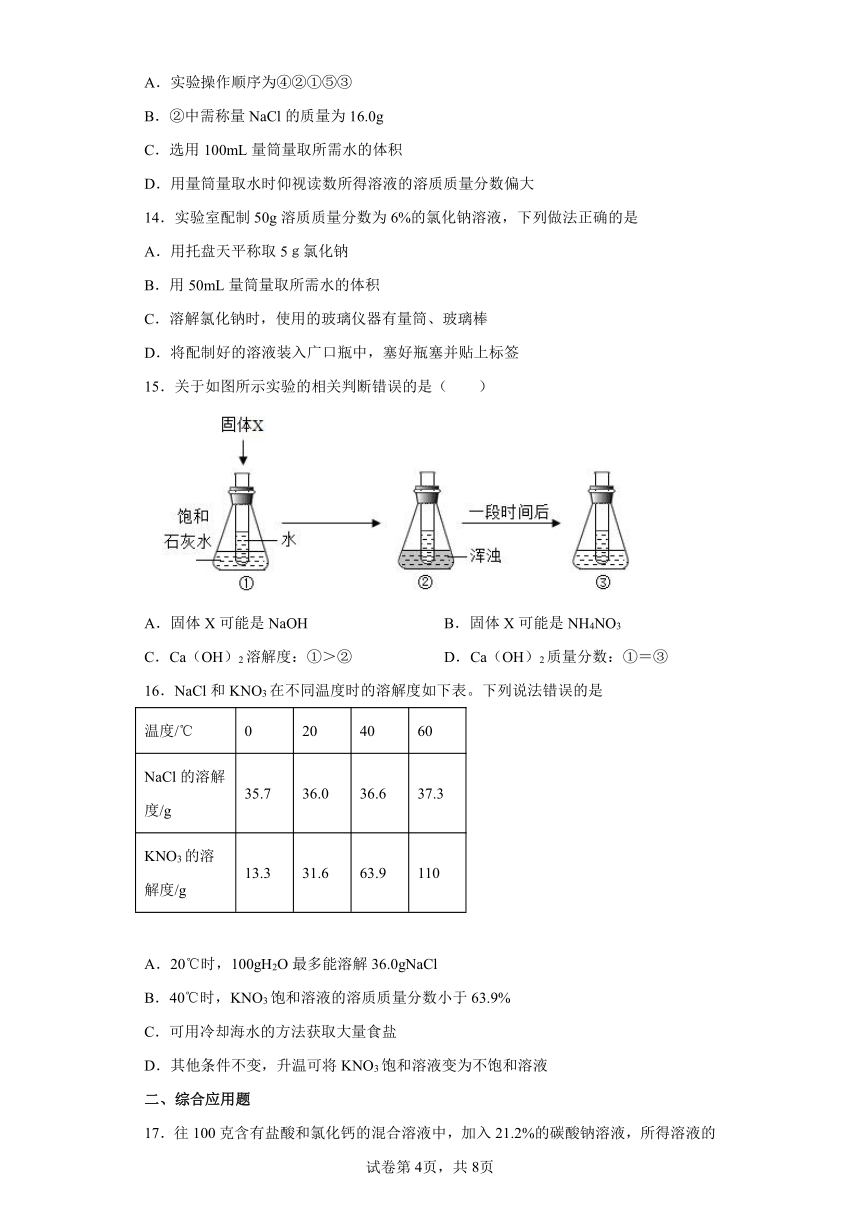
一、单选题
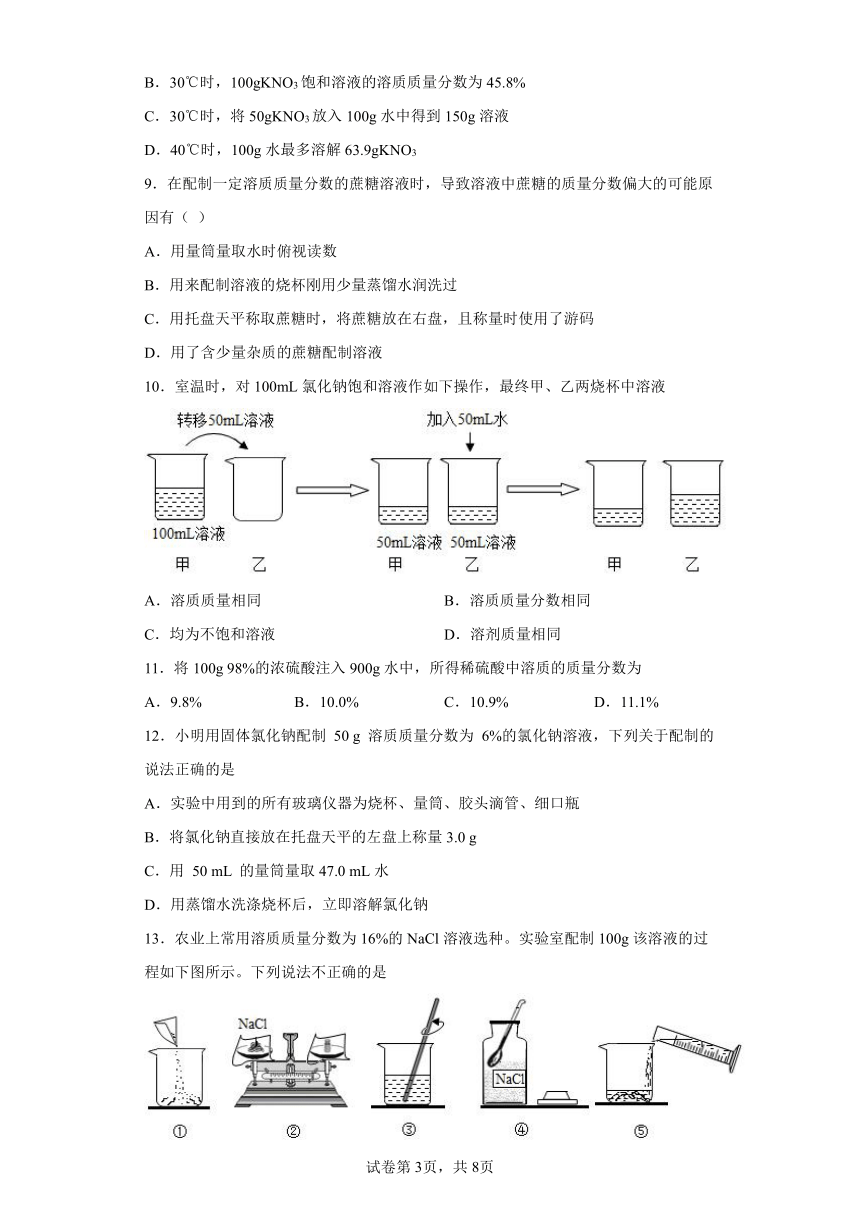
1.常温下,对100mL氯化钠饱和溶液进行图示实验。下列分析错误的是( )
A.实验1后,甲、乙中溶液的溶质质量分数相等
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲中溶液为氯化钠的不饱和溶液
D.实验2后,甲、乙中溶液所含溶质质量相等
2.硝酸钾可作为无土栽培的一种营养液。现将 25%的硝酸钾溶液稀释成 200g 10%来用于培植营养液,则需加水( )
A.80g B.300g C.120g D.100g
3.现有一包金属粉末,可能是由A1、Mg、Zn、Fe、Ag中的一种或几种组成。取该样品2.4g,向其加入100g一定溶质质量分数的稀硫酸,恰好完全反应,产生0.2g H2,溶液呈无色,无固体剩余。则下列结论正确的是
A.该样品的组成仅有两种可能 B.所用稀硫酸的溶质质量分数为19.6%
C.该样品中一定含有Mg D.所得溶液中溶质的总质量为12g
4.KNO3 的溶解度曲线如下图所示。下列说法错误的是( )
A.0~60℃,KNO3 的溶解度随温度升高而增大
B.60℃时的 KNO3 饱和溶液降温至 20℃,有晶体析出
C.20℃,100g 水中最多能溶解 31.6g KNO3
D.60℃时,可配制溶质质量分数为 60%的 KNO3 溶液
5.下列说法正确的是
A.凡是均一的、稳定的液体一定是溶液
B.洗涤剂能够洗涤油污是因为洗涤剂能够溶解油污
C.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
D.5g某物质完全溶于水配成100g溶液,所得溶液的溶质质量分数一定是5%
6.20℃时,在各盛有100克水的烧杯中,分别加入10克甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。下列说法正确的是
A.所得溶液可能都是饱和溶液
B.20℃时,乙溶液的溶质质量最小
C.溶液溶质的质量分数:甲>丙>乙
D.升高温度,溶液溶质的质量分数一定变大
7.20℃时,KCl溶解于水的实验数据如下表,④中溶液的溶质质量分数约为( )
实验序号 水的质量/g 加入KCl质量/g 溶液的质量/g
① 10 1.4 11.4
② 10 2.4 12.4
③ 10 3.4 13.4
④ 10 4.4 13.4
A.25% B.30% C.34% D.44%
8.不同温度下KNO3的溶解度如下表所示。下列说法正确的是
温度/℃ 20 30 40
溶解度/g 31.6 45.8 63.9
A.20℃时,100gKNO3饱和溶液中溶质质量为31.6g
B.30℃时,100gKNO3饱和溶液的溶质质量分数为45.8%
C.30℃时,将50gKNO3放入100g水中得到150g溶液
D.40℃时,100g水最多溶解63.9gKNO3
9.在配制一定溶质质量分数的蔗糖溶液时,导致溶液中蔗糖的质量分数偏大的可能原因有( )
A.用量筒量取水时俯视读数
B.用来配制溶液的烧杯刚用少量蒸馏水润洗过
C.用托盘天平称取蔗糖时,将蔗糖放在右盘,且称量时使用了游码
D.用了含少量杂质的蔗糖配制溶液
10.室温时,对100mL氯化钠饱和溶液作如下操作,最终甲、乙两烧杯中溶液
A.溶质质量相同 B.溶质质量分数相同
C.均为不饱和溶液 D.溶剂质量相同
11.将100g 98%的浓硫酸注入900g水中,所得稀硫酸中溶质的质量分数为
A.9.8% B.10.0% C.10.9% D.11.1%
12.小明用固体氯化钠配制 50 g 溶质质量分数为 6%的氯化钠溶液,下列关于配制的说法正确的是
A.实验中用到的所有玻璃仪器为烧杯、量筒、胶头滴管、细口瓶
B.将氯化钠直接放在托盘天平的左盘上称量3.0 g
C.用 50 mL 的量筒量取47.0 mL水
D.用蒸馏水洗涤烧杯后,立即溶解氯化钠
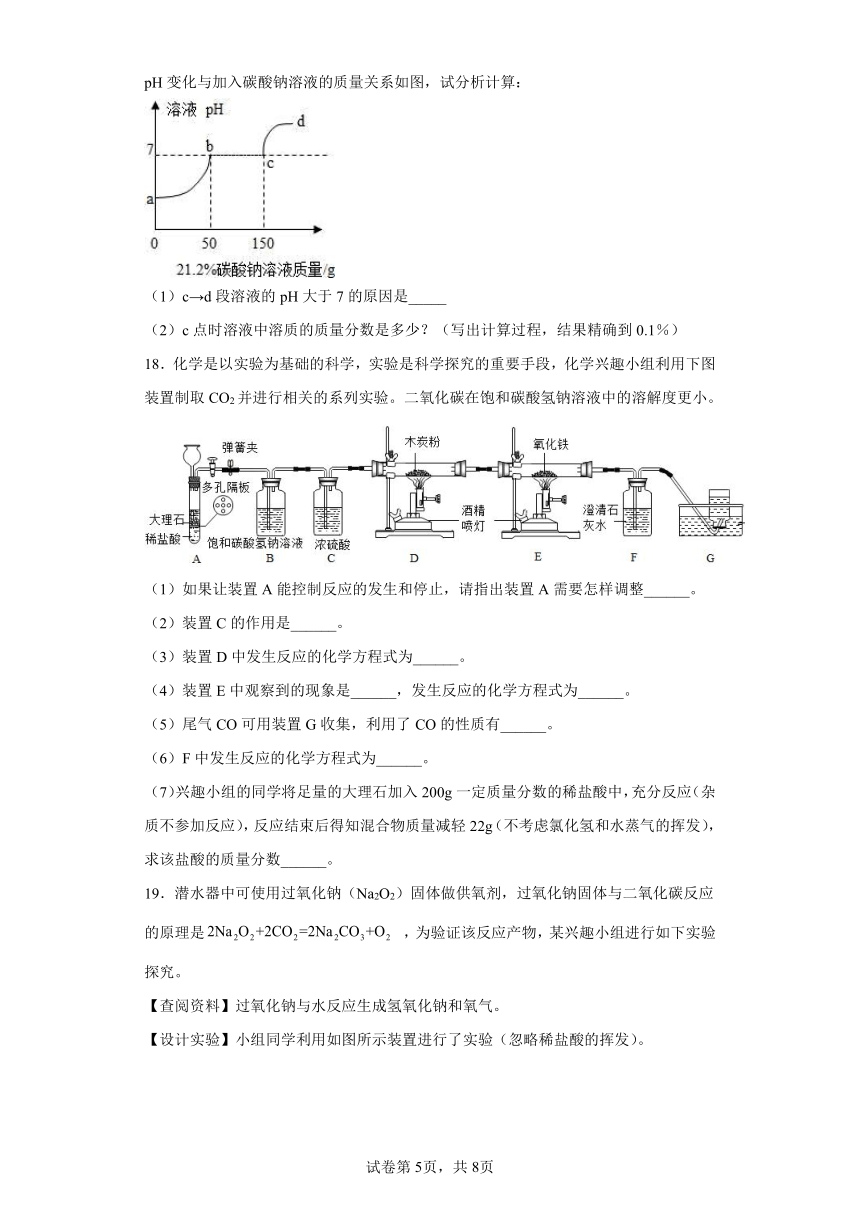
13.农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该溶液的过程如下图所示。下列说法不正确的是
A.实验操作顺序为④②①⑤③
B.②中需称量NaCl的质量为16.0g
C.选用100mL量筒量取所需水的体积
D.用量筒量取水时仰视读数所得溶液的溶质质量分数偏大
14.实验室配制50g溶质质量分数为6%的氯化钠溶液,下列做法正确的是
A.用托盘天平称取5g氯化钠
B.用50mL量筒量取所需水的体积
C.溶解氯化钠时,使用的玻璃仪器有量筒、玻璃棒
D.将配制好的溶液装入广口瓶中,塞好瓶塞并贴上标签
15.关于如图所示实验的相关判断错误的是( )
A.固体X可能是NaOH B.固体X可能是NH4NO3
C.Ca(OH)2溶解度:①>② D.Ca(OH)2质量分数:①=③
16.NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是
温度/℃ 0 20 40 60
NaCl的溶解度/g 35.7 36.0 36.6 37.3
KNO3的溶解度/g 13.3 31.6 63.9 110
A.20℃时,100gH2O最多能溶解36.0gNaCl
B.40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.可用冷却海水的方法获取大量食盐
D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
二、综合应用题
17.往100克含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算:
(1)c→d段溶液的pH大于7的原因是_____
(2)c点时溶液中溶质的质量分数是多少?(写出计算过程,结果精确到0.1%)
18.化学是以实验为基础的科学,实验是科学探究的重要手段,化学兴趣小组利用下图装置制取CO2并进行相关的系列实验。二氧化碳在饱和碳酸氢钠溶液中的溶解度更小。
(1)如果让装置A能控制反应的发生和停止,请指出装置A需要怎样调整______。
(2)装置C的作用是______。
(3)装置D中发生反应的化学方程式为______。
(4)装置E中观察到的现象是______,发生反应的化学方程式为______。
(5)尾气CO可用装置G收集,利用了CO的性质有______。
(6)F中发生反应的化学方程式为______。
(7)兴趣小组的同学将足量的大理石加入200g一定质量分数的稀盐酸中,充分反应(杂质不参加反应),反应结束后得知混合物质量减轻22g(不考虑氯化氢和水蒸气的挥发),求该盐酸的质量分数______。
19.潜水器中可使用过氧化钠(Na2O2)固体做供氧剂,过氧化钠固体与二氧化碳反应的原理是 ,为验证该反应产物,某兴趣小组进行如下实验探究。
【查阅资料】过氧化钠与水反应生成氢氧化钠和氧气。
【设计实验】小组同学利用如图所示装置进行了实验(忽略稀盐酸的挥发)。
(1)装置A中标号仪器名称:①______,②______。
(2)装置A中反应的化学方程式为______。
(3)装置B的作用是______。
(4)为防止装置E收集的氧气中混有二氧化碳,装置D中盛放的试剂是______,并写出装置D中反应的化学方程式______。
(5)实验室制取CO2验满的方法是______。
(6)有一份锌粉与铜粉的混合物样品,为确定其组成,某同学将32.5g样品加入100g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示。
试求:所用稀硫酸的溶质质量分数______(写出计算过程)。
20.硫酸亚铁可以促进花草生长,现有一包混有少量硫酸铜的硫酸亚铁固体X,从X中获得硫酸亚铁的过程如下:
(1)操作Ⅱ的名称是______,此操作中玻璃棒的作用是______。
(2)固体Y过量的目的是______。
(3)现将160g溶质质量分数为40%的硫酸铜溶液稀释成溶质质量分数为20%的硫酸铜溶液。稀释过程中,没有变化的是______质量。
(4)向一定量的铁粉中加入80g20%硫酸铜溶液,恰好完全反应,加水至溶液质量为200g,求所得溶液中溶质的质量分数(计算结果精确到0.1%)。
21.防范新冠疫情依然重要,需要我们“戴口罩,勤洗手,勤消毒,勤通风”
(1)请从微观角度解释:随身携带的酒精湿巾或酒精喷雾用时室内充满酒精气味的原因 _________________
(2)在疫情期间要学会正确的洗手方法,沾有油污的手,可使用洗洁精清洗,洗洁精的作用是 _________________
(3)某校要配制100kg溶质质量分数为0.2%的过氧乙酸消毒液,需要10%的过氧乙酸溶液 _________________ kg
(4)84消毒液因诞生于1984年而得名,在抗击新冠肺炎疫情期间,它频频进入公众视野 当时在1984年,北京第一传染病医院(今地坛医院)研制出了一种消毒液,经过多次研究,3000多次实验,上百次的配方的调整,这种消毒液能够快灭活肝炎病毒,起初它名字叫‘84肝炎洗消液’后来才更名为‘84消毒液’.下面是“84”消毒液主要成分次氯酸钠的生产流程图以及次氯酸钠的相关性质
①标出次氯酸钠中氯元素的化合价 _________________ 。
②操作(1)的名称为 _________________ 。
③反应(2)的化学方程式为 _________________ 。
④84消毒液如何保存 _________________
22.现有一定质量的碳酸钠溶液,为测定其溶质质量分数,将60g稀盐酸分3次加入,实验所得数据如下表:
第I次 第Ⅱ次 第Ⅲ次
稀盐酸的质量/g 20 20 20
生成气体的质量/g 3.3 m 2.2
(1)数据中m= g。
(2)第Ⅲ次反应后溶液总质量为93.6g,求该碳酸钠溶液的溶质质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.C
3.D
4.D
5.C
6.A
7.A
8.D
9.A
10.A
11.A
12.C
13.D
14.B
15.B
16.C
17.(1)碳酸钠溶液显碱性;(2)15.6%
18. 将长颈漏斗深入试管底部 吸收二氧化碳中的水蒸气
红棕色的粉末变成黑色
难溶于水、不与水反应等 Ca(OH)2+CO2=CaCO3↓+H2O 混合物质量减轻的质量俄为二氧化碳的质量,故二氧化碳的质量为22g。
设该盐酸的质量分数为x
解得x=18.25%
19. 分液漏斗 锥形瓶 吸收水蒸气 氢氧化钠溶液 将燃着的木条放在集气瓶口,若木条熄灭,则已集满 设所消耗的稀硫酸中的溶质的质量为x
稀硫酸中溶质的质量分数为
答:所用稀硫酸中溶质的质量分数为19.6%。
20.(1) 过滤 引流
(2)使硫酸铜完全反应
(3)溶质
(4)解:设生成硫酸亚的质量为.
所得溶液的溶质质量分数为:.
答:所得溶液的溶质质量分数为7.6%。
21. 酒精分子在不断的运动 乳化作用 2 过滤 避光密闭
22.(1) 3.3g(2) 50%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.常温下,对100mL氯化钠饱和溶液进行图示实验。下列分析错误的是( )
A.实验1后,甲、乙中溶液的溶质质量分数相等
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲中溶液为氯化钠的不饱和溶液
D.实验2后,甲、乙中溶液所含溶质质量相等
2.硝酸钾可作为无土栽培的一种营养液。现将 25%的硝酸钾溶液稀释成 200g 10%来用于培植营养液,则需加水( )
A.80g B.300g C.120g D.100g
3.现有一包金属粉末,可能是由A1、Mg、Zn、Fe、Ag中的一种或几种组成。取该样品2.4g,向其加入100g一定溶质质量分数的稀硫酸,恰好完全反应,产生0.2g H2,溶液呈无色,无固体剩余。则下列结论正确的是
A.该样品的组成仅有两种可能 B.所用稀硫酸的溶质质量分数为19.6%
C.该样品中一定含有Mg D.所得溶液中溶质的总质量为12g
4.KNO3 的溶解度曲线如下图所示。下列说法错误的是( )
A.0~60℃,KNO3 的溶解度随温度升高而增大
B.60℃时的 KNO3 饱和溶液降温至 20℃,有晶体析出
C.20℃,100g 水中最多能溶解 31.6g KNO3
D.60℃时,可配制溶质质量分数为 60%的 KNO3 溶液
5.下列说法正确的是
A.凡是均一的、稳定的液体一定是溶液
B.洗涤剂能够洗涤油污是因为洗涤剂能够溶解油污
C.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
D.5g某物质完全溶于水配成100g溶液,所得溶液的溶质质量分数一定是5%
6.20℃时,在各盛有100克水的烧杯中,分别加入10克甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。下列说法正确的是
A.所得溶液可能都是饱和溶液
B.20℃时,乙溶液的溶质质量最小
C.溶液溶质的质量分数:甲>丙>乙
D.升高温度,溶液溶质的质量分数一定变大
7.20℃时,KCl溶解于水的实验数据如下表,④中溶液的溶质质量分数约为( )
实验序号 水的质量/g 加入KCl质量/g 溶液的质量/g
① 10 1.4 11.4
② 10 2.4 12.4
③ 10 3.4 13.4
④ 10 4.4 13.4
A.25% B.30% C.34% D.44%
8.不同温度下KNO3的溶解度如下表所示。下列说法正确的是
温度/℃ 20 30 40
溶解度/g 31.6 45.8 63.9
A.20℃时,100gKNO3饱和溶液中溶质质量为31.6g
B.30℃时,100gKNO3饱和溶液的溶质质量分数为45.8%
C.30℃时,将50gKNO3放入100g水中得到150g溶液
D.40℃时,100g水最多溶解63.9gKNO3
9.在配制一定溶质质量分数的蔗糖溶液时,导致溶液中蔗糖的质量分数偏大的可能原因有( )
A.用量筒量取水时俯视读数
B.用来配制溶液的烧杯刚用少量蒸馏水润洗过
C.用托盘天平称取蔗糖时,将蔗糖放在右盘,且称量时使用了游码
D.用了含少量杂质的蔗糖配制溶液
10.室温时,对100mL氯化钠饱和溶液作如下操作,最终甲、乙两烧杯中溶液
A.溶质质量相同 B.溶质质量分数相同
C.均为不饱和溶液 D.溶剂质量相同
11.将100g 98%的浓硫酸注入900g水中,所得稀硫酸中溶质的质量分数为
A.9.8% B.10.0% C.10.9% D.11.1%
12.小明用固体氯化钠配制 50 g 溶质质量分数为 6%的氯化钠溶液,下列关于配制的说法正确的是
A.实验中用到的所有玻璃仪器为烧杯、量筒、胶头滴管、细口瓶
B.将氯化钠直接放在托盘天平的左盘上称量3.0 g
C.用 50 mL 的量筒量取47.0 mL水
D.用蒸馏水洗涤烧杯后,立即溶解氯化钠
13.农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该溶液的过程如下图所示。下列说法不正确的是
A.实验操作顺序为④②①⑤③
B.②中需称量NaCl的质量为16.0g
C.选用100mL量筒量取所需水的体积
D.用量筒量取水时仰视读数所得溶液的溶质质量分数偏大
14.实验室配制50g溶质质量分数为6%的氯化钠溶液,下列做法正确的是
A.用托盘天平称取5g氯化钠
B.用50mL量筒量取所需水的体积
C.溶解氯化钠时,使用的玻璃仪器有量筒、玻璃棒
D.将配制好的溶液装入广口瓶中,塞好瓶塞并贴上标签
15.关于如图所示实验的相关判断错误的是( )
A.固体X可能是NaOH B.固体X可能是NH4NO3
C.Ca(OH)2溶解度:①>② D.Ca(OH)2质量分数:①=③
16.NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是
温度/℃ 0 20 40 60
NaCl的溶解度/g 35.7 36.0 36.6 37.3
KNO3的溶解度/g 13.3 31.6 63.9 110
A.20℃时,100gH2O最多能溶解36.0gNaCl
B.40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.可用冷却海水的方法获取大量食盐
D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
二、综合应用题
17.往100克含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算:
(1)c→d段溶液的pH大于7的原因是_____
(2)c点时溶液中溶质的质量分数是多少?(写出计算过程,结果精确到0.1%)
18.化学是以实验为基础的科学,实验是科学探究的重要手段,化学兴趣小组利用下图装置制取CO2并进行相关的系列实验。二氧化碳在饱和碳酸氢钠溶液中的溶解度更小。
(1)如果让装置A能控制反应的发生和停止,请指出装置A需要怎样调整______。
(2)装置C的作用是______。
(3)装置D中发生反应的化学方程式为______。
(4)装置E中观察到的现象是______,发生反应的化学方程式为______。
(5)尾气CO可用装置G收集,利用了CO的性质有______。
(6)F中发生反应的化学方程式为______。
(7)兴趣小组的同学将足量的大理石加入200g一定质量分数的稀盐酸中,充分反应(杂质不参加反应),反应结束后得知混合物质量减轻22g(不考虑氯化氢和水蒸气的挥发),求该盐酸的质量分数______。
19.潜水器中可使用过氧化钠(Na2O2)固体做供氧剂,过氧化钠固体与二氧化碳反应的原理是 ,为验证该反应产物,某兴趣小组进行如下实验探究。
【查阅资料】过氧化钠与水反应生成氢氧化钠和氧气。
【设计实验】小组同学利用如图所示装置进行了实验(忽略稀盐酸的挥发)。
(1)装置A中标号仪器名称:①______,②______。
(2)装置A中反应的化学方程式为______。
(3)装置B的作用是______。
(4)为防止装置E收集的氧气中混有二氧化碳,装置D中盛放的试剂是______,并写出装置D中反应的化学方程式______。
(5)实验室制取CO2验满的方法是______。
(6)有一份锌粉与铜粉的混合物样品,为确定其组成,某同学将32.5g样品加入100g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示。
试求:所用稀硫酸的溶质质量分数______(写出计算过程)。
20.硫酸亚铁可以促进花草生长,现有一包混有少量硫酸铜的硫酸亚铁固体X,从X中获得硫酸亚铁的过程如下:
(1)操作Ⅱ的名称是______,此操作中玻璃棒的作用是______。
(2)固体Y过量的目的是______。
(3)现将160g溶质质量分数为40%的硫酸铜溶液稀释成溶质质量分数为20%的硫酸铜溶液。稀释过程中,没有变化的是______质量。
(4)向一定量的铁粉中加入80g20%硫酸铜溶液,恰好完全反应,加水至溶液质量为200g,求所得溶液中溶质的质量分数(计算结果精确到0.1%)。
21.防范新冠疫情依然重要,需要我们“戴口罩,勤洗手,勤消毒,勤通风”
(1)请从微观角度解释:随身携带的酒精湿巾或酒精喷雾用时室内充满酒精气味的原因 _________________
(2)在疫情期间要学会正确的洗手方法,沾有油污的手,可使用洗洁精清洗,洗洁精的作用是 _________________
(3)某校要配制100kg溶质质量分数为0.2%的过氧乙酸消毒液,需要10%的过氧乙酸溶液 _________________ kg
(4)84消毒液因诞生于1984年而得名,在抗击新冠肺炎疫情期间,它频频进入公众视野 当时在1984年,北京第一传染病医院(今地坛医院)研制出了一种消毒液,经过多次研究,3000多次实验,上百次的配方的调整,这种消毒液能够快灭活肝炎病毒,起初它名字叫‘84肝炎洗消液’后来才更名为‘84消毒液’.下面是“84”消毒液主要成分次氯酸钠的生产流程图以及次氯酸钠的相关性质
①标出次氯酸钠中氯元素的化合价 _________________ 。
②操作(1)的名称为 _________________ 。
③反应(2)的化学方程式为 _________________ 。
④84消毒液如何保存 _________________
22.现有一定质量的碳酸钠溶液,为测定其溶质质量分数,将60g稀盐酸分3次加入,实验所得数据如下表:
第I次 第Ⅱ次 第Ⅲ次
稀盐酸的质量/g 20 20 20
生成气体的质量/g 3.3 m 2.2
(1)数据中m= g。
(2)第Ⅲ次反应后溶液总质量为93.6g,求该碳酸钠溶液的溶质质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.C
3.D
4.D
5.C
6.A
7.A
8.D
9.A
10.A
11.A
12.C
13.D
14.B
15.B
16.C
17.(1)碳酸钠溶液显碱性;(2)15.6%
18. 将长颈漏斗深入试管底部 吸收二氧化碳中的水蒸气
红棕色的粉末变成黑色
难溶于水、不与水反应等 Ca(OH)2+CO2=CaCO3↓+H2O 混合物质量减轻的质量俄为二氧化碳的质量,故二氧化碳的质量为22g。
设该盐酸的质量分数为x
解得x=18.25%
19. 分液漏斗 锥形瓶 吸收水蒸气 氢氧化钠溶液 将燃着的木条放在集气瓶口,若木条熄灭,则已集满 设所消耗的稀硫酸中的溶质的质量为x
稀硫酸中溶质的质量分数为
答:所用稀硫酸中溶质的质量分数为19.6%。
20.(1) 过滤 引流
(2)使硫酸铜完全反应
(3)溶质
(4)解:设生成硫酸亚的质量为.
所得溶液的溶质质量分数为:.
答:所得溶液的溶质质量分数为7.6%。
21. 酒精分子在不断的运动 乳化作用 2 过滤 避光密闭
22.(1) 3.3g(2) 50%
答案第1页,共2页
答案第1页,共2页
同课章节目录
