11.1生活中常见的盐同步练习—2021-2022学年九年级化学人教版下册(word版 含答案)
文档属性
| 名称 | 11.1生活中常见的盐同步练习—2021-2022学年九年级化学人教版下册(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 146.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-30 00:00:00 | ||
图片预览



文档简介
人教版化学九下册 11.1 生活中常见的盐 同步练习
一、单选题
1.“一带一路”赋予古丝绸之路崭新的时代内涵。古代染坊常用下列物质中的一种盐来处理丝绸,这种盐是
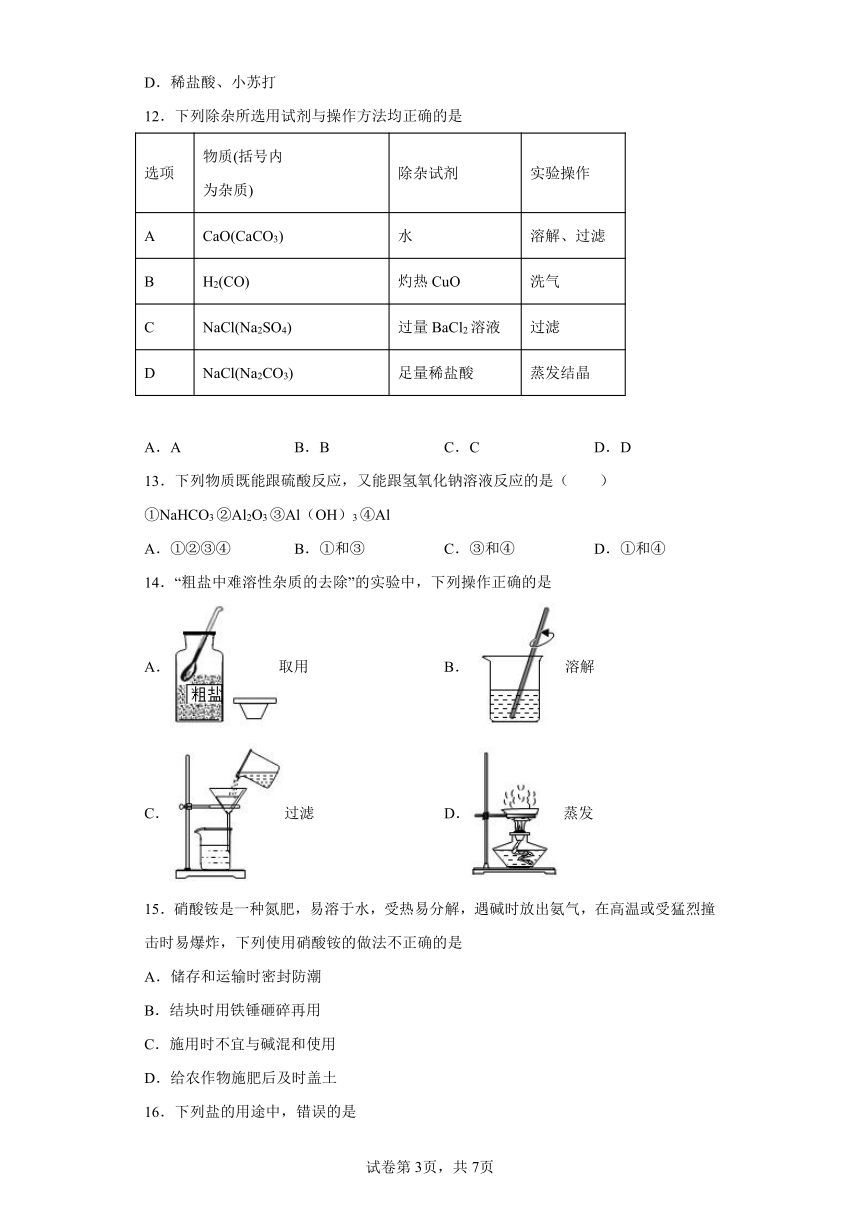
A.熟石灰 B.碳酸钾 C.乙醇 D.烧碱
2.氯化铵(NH4Cl)是“侯氏制碱法”的一种副产品。已知氯化铵的水溶液显酸性,下列关于氯化铵的说法正确的是
A.氯化铵属于酸 B.氯化铵是一种复合肥
C.氯化铵与熟石灰混合使用可提高肥效 D.氯化铵溶液与硝酸银溶液混合会产生白色沉淀
3.将下列各组物质混合后溶于水,得到无色溶液的是
A.NaNO3、KCl、Na2SO4 B.FeCl3、NaOH、KNO3
C.CuSO4、CaCl2、KOH D.BaCl2、K2CO3、H2SO4
4.下列物质的用途,利用了其物理性质的是
A.生石灰用作干燥剂 B.铁粉用作食品保鲜吸氧剂
C.氦气填充飞艇 D.小苏打用于治疗胃酸过多
5.下列做法中一定发生化学变化的是( )
A.用石油分馏制得汽油、柴油等 B.用柠檬酸和小苏打、白糖配置汽水
C.用钢丝球擦除灶具上的污渍 D.用汽油清洗衣服上的油污
6.下列试剂中,能把稀硫酸、KOH溶液、CaCl2溶液一次性鉴别出来的是
A.KCl溶液 B.K2CO3溶液
C.稀盐酸 D.NaNO3溶液
7.下列所示的图象能反映相对应实验的是
A.向pH=12的Ca(OH)2溶液中不断加水稀释
B.向碳酸钙固体中逐滴加入稀盐酸至过量
C.在40℃,将饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出
D.分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
8.“河长制”有利于加强水资源保护,防治水体污染。研学小组对两个工厂排污口排放的污水进行检测,发现共含HNO3、K2SO4、MgCl2和NaOH四种物质,其中每个排污口排放两种不同物质。下列关于污水成分的分析合理的是( )
A.HNO3 和K2SO4一定来自同一排污口 B.HNO3 和MgCl2一定来自同 排污口
C.HNO3和NaOH一定来自同一排污口 D.将两处污水混合后,溶液一定呈中性
9.下列物质间不能发生反应的是( )
A.稀盐酸和镁条
B.稀盐酸和铜丝
C.稀盐酸和氢氧化镁
D.稀盐酸和氢氧化铜
10.除去下列物质中混有的少量杂质所选用的操作方法,正确的是
选项 物质 操作方法
A CO2混有HCl气体 将气体通过足量NaOH溶液
B Cu(NO3)2溶液混有NaCl 加入过量氢氧化钠,过滤,洗涤滤渣后向滤渣中加入适量稀硝酸
C NaCl溶液混有CaCl2 加入过量Na2CO3溶液、过滤
D CuO混有碳粉 加入适量稀HCl,过滤,洗涤,干燥
A.A B.B C.C D.D
11.如图所示,U型管内a、b液面相平,当挤压滴管的胶头,使试剂X进入锥形瓶内,一段时间后会观察到a液面高于b液面。则试剂X、Y的组合可能是
A.水、硝酸铵
B.水、烧碱
C.稀硫酸、铁粉
D.稀盐酸、小苏打
12.下列除杂所选用试剂与操作方法均正确的是
选项 物质(括号内 为杂质) 除杂试剂 实验操作
A CaO(CaCO3) 水 溶解、过滤
B H2(CO) 灼热CuO 洗气
C NaCl(Na2SO4) 过量BaCl2溶液 过滤
D NaCl(Na2CO3) 足量稀盐酸 蒸发结晶
A.A B.B C.C D.D
13.下列物质既能跟硫酸反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
A.①②③④ B.①和③ C.③和④ D.①和④
14.“粗盐中难溶性杂质的去除”的实验中,下列操作正确的是
A.取用 B.溶解
C.过滤 D.蒸发
15.硝酸铵是一种氮肥,易溶于水,受热易分解,遇碱时放出氨气,在高温或受猛烈撞击时易爆炸,下列使用硝酸铵的做法不正确的是
A.储存和运输时密封防潮
B.结块时用铁锤砸碎再用
C.施用时不宜与碱混和使用
D.给农作物施肥后及时盖土
16.下列盐的用途中,错误的是
A.用含亚硝酸钠的工业盐制香肠 B.用碳酸钙做补钙剂
C.用氯化钠配制生理盐水 D.用碳酸氢钠做焙制糕点的发酵粉
二、综合应用题
17.某化学兴趣小组为探究碱和盐的化学性质,进行了如图24所示实验(忽略空气中CO2对本实验的影响)。请你参与并完成相关内容。
(1)步骤一:关闭K,向下缓慢推动注射器活塞并轻轻振荡锥形瓶,使二氧化碳全部进入锥形瓶,并与m克溶质质量分数为10%的NaOH溶液恰好完全反应转化为碳酸钠,反应的化学方程式为______,轻轻振荡锥形瓶的目的是_____.
步骤二:打开K,向上缓慢拉动注射器活塞,观察到乙中溶液进入甲。
(2)上述实验过程中,甲中溶质总质量变化情况如图25所示,B点对应的溶质总质量为(用含m的代数式表示,可以不化简)_____克。BC段反应的化学方程式为______,BC段溶质总质量下降的原因是___.
(3)步骤一和步骤二结束后,将甲和乙中的物质全部转移到烧杯中,搅拌后过滤,得到白色沉淀和滤液。结合图25中C点的值确定滤液中溶质的成分为___,理由是____________.
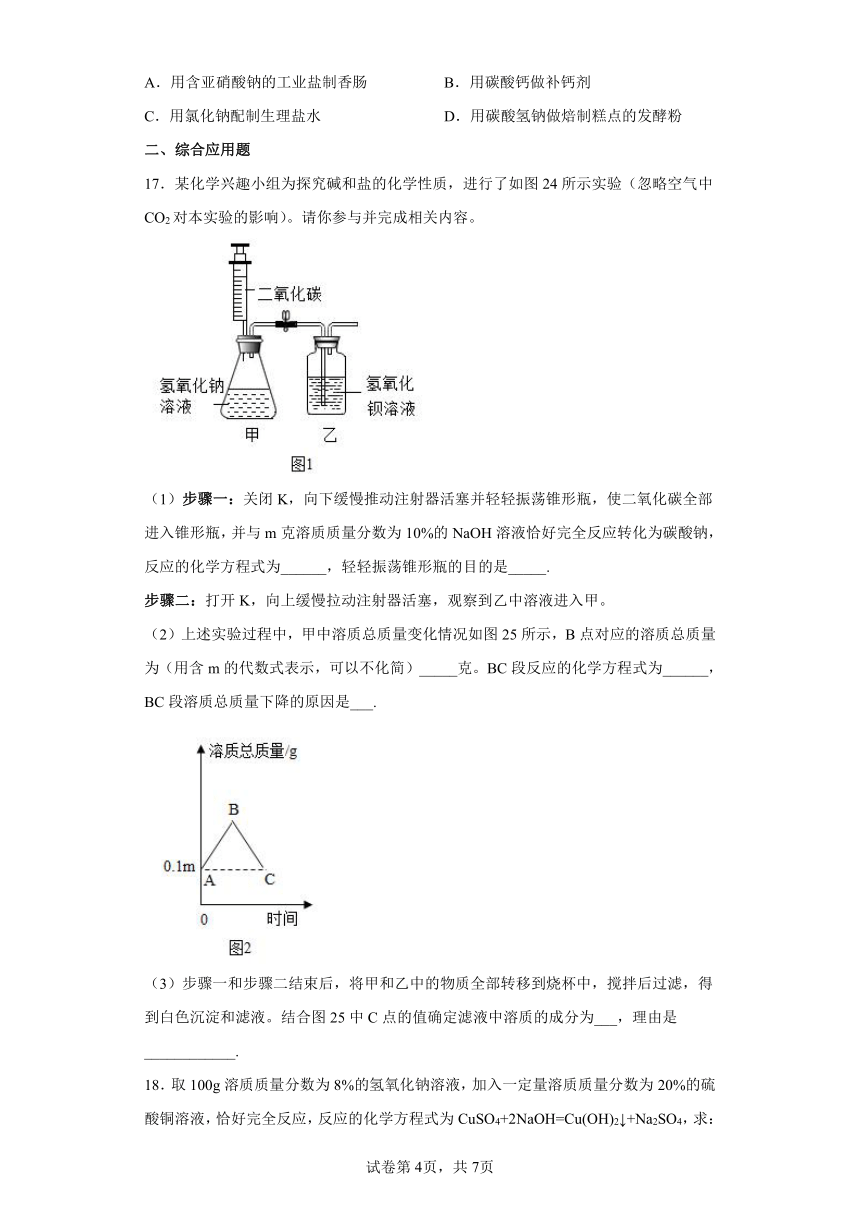
18.取100g溶质质量分数为8%的氢氧化钠溶液,加入一定量溶质质量分数为20%的硫酸铜溶液,恰好完全反应,反应的化学方程式为CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,求:
(1)反应生成沉淀的质量为__________。
(2)反应后所得溶液中溶质的质量分数为__________。(精确到0.1%)
19.比较与归纳是学习化学的重要方法。请你分析下列两个表中的数据,找出对应规律。
(1)
1 g金属与足量稀盐酸反应 (均生成+2价金属的盐溶液) Mg Fe Zn
金属的相对原子质量 24 56 65
产生氢气的质量/g
你发现的规律 _____
(2)
气体 H2 N2 O2 Cl2
气体的相对分子质量 2 28 32 71
标准状况下的气体 密度(g/L) 0.0899 1.251 1.429 3.214
你发现的规律 _____
20.阳光牌小包装“脱氧剂”成分为Fe粉、活性炭及少量NaCl、水。使用一段时间后,其中的Fe粉会转变成Fe2O3而变质。某化学兴趣小组欲探究使用过的阳光牌“脱氧剂”的变质程度(已变质的Fe粉占变质前Fe粉的质量分数),设计并进行如下探究过程。
步骤(1)取食品包装袋中的阳光牌“脱氧剂”一袋,将里面的固体溶于水,过滤、洗涤、干燥滤渣。
步骤(2)取步骤(1)中的滤渣8.0g,加入足量的稀H2SO4与滤渣充分反应,过滤、洗涤、干燥得固体1.2g。
步骤(3)取步骤(2)中的滤液,加入足量的NaOH溶液,得到的固体经洗涤后转移到坩埚中,充分加热、冷却、称量,得到8.0gFe2O3(注:滤液中的Fe元素已全部转化为Fe2O3)。
求(1)滤渣中Fe和Fe2O3两种物质的总质量____。
(2)该“脱氧剂”在未变质时,Fe粉和活性炭的质量之比____。
(3)该“脱氧剂”的变质程度____。
21.高氯酸钠广泛用于火箭和火药工业。粗盐除去泥沙等不溶性杂质后得到“精盐”(只含、两种杂质),以“精盐”为原料制备高氯酸铵()、高氯酸钠晶体()和相关副产品的生产流程如图19-7所示(资料:高氯酸钠在较高温度下容易分解;相关物质的溶解度曲线如图所示)
(1)步骤①中的X是步骤②的副产品经加工再利用的物质,其化学式是__________,步骤①中的副产品的一种用途是___________;步骤②的目的是______________;步骤③的目的是____________.
(2)步骤⑥通入是为了除去溶液中少量的,并制得副产品新型自来水消毒剂,该反应的化学方程式为_____________。
(3)高氯酸铵()是复合火箭推进剂的重要成分,实验室可通过溶液和溶液在90℃条件下反应制取。若用浓氨水和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是_______。
(4)步骤⑦分离出副产品芒硝()的实验操作依次为(填操作名称)________,干燥。
(5)步骤⑧反应得到的混合溶液中和的质量分数分别为0.30和0.15。从混合溶液中获得较多晶体的实验操作与步骤⑦相似,不同的是在干燥前要用冰水洗涤,其原因是___________。
(6)获取时,“气流干燥”的温度应控制在75~95℃,其原因是___________。
(7)根据绿色化学的理念,可以在该生产流程中再利用的物质有、、_______(填化学式),该生产流程的优点除了有的物质可以再利用外,还有__________。
22.小明和小英要验证一块石头是否含碳酸钙。
(1)小明说:“只要取一小块石头放在烧杯中,再在石块上倒入盐酸,发现有大量气泡产生,就能证明石块含有碳酸钙。”小英说:“在石块上倒盐酸,产生的大量气泡是盐酸挥发而成的。”小英的说法对吗?_______(填“对”或“不对”)。
(2)小明和小英带着问题请教王老师,在王老师的指导下,进行了下列实验探究,其实验过程如下:①取一小块石块置于烧杯中,滴加盐酸后,发现产生了无色无味气体;②在老师的指导下,取①中的溶液检验,石块中含有钙元素;③他们又设计了如图所示的实验装置,在实验中观察到广口瓶中有浑浊现象产生。
在上述实验中,他们进行的是_______实验研究(填“定性”或“定量”)。
(3)假若称取10.0 g石块与足量的稀盐酸反应(杂质不与盐酸反应),并用饱和石灰水吸收,得到的沉淀经适当处理后得干燥固体7.5 g。计算:
①石块中含碳酸钙的质量分数_______________;
②已知CO2在标准状况下的密度为1.98 g/L,则生成标准状况下CO2气体的体积为______________毫升
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.D
3.A
4.C
5.B
6.B
7.B
8.B
9.B
10.B
11.A
12.D
13.A
14.B
15.B
16.A
17. CO2+2NaOH=NaCO3+H2O 增大接触面使氢氧化钠溶液与二氧化碳充分反应 Na2CO3+Ba(OH)2=BaCO3↓+2NaOH 加入的氢氧化钡溶液与碳酸钠溶液反应生成沉淀,每171份质量的氢氧化钡,生成197份质量的碳酸钡沉淀,溶质质量减少26份 NaOH和Ba(OH)2 C点对应的溶液中溶质质量与A点相等,都为0.1m克,说明步骤一生成的碳酸钠和步骤二中进入的氢氧化钡恰好完全反应,此时溶液中的溶质只有氢氧化钠,将甲和乙混合后氢氧化钡有剩余,因此滤液中的溶质成分为氢氧化钠和氢氧化钡。
18. 9.8g
解:设反应消耗的CuSO4的质量为x,反应生成的Cu(OH)2的质量为y,生成Na2SO4的质量为z,则
8.3%
因此硫酸铜溶液的质量为16g÷20%=80g
反应后溶液的质量为100g+80g-9.8g=170.2g
所以,反应后所得溶液中溶质的质量分数为×100% ≈8.3%
答:反应生成的沉淀的质量为9.8g;反应后所得溶液中溶质的质量分数为8.3%。
19. 等质量相同价态的金属与足量的酸完全反应,相对原子质量越大(小),产生氢气的质量越少(多)(或等质量相同价态的金属与足量的酸完全反应,产生氢气的质量与其相对原子质量成反比) 气体的相对分子质量越小(大),其标准状况下的密度越小(大)(或标准状况下气体的密度与其相对分子质量成正比)
20. 6.8g 14:3 50%
21. (或) 解除胃酸过多(或作阻燃剂) 除去和 除去和 浓氨水与浓盐酸反应放出热量 蒸发浓缩,冷却结晶,过滤,洗涤 0℃时的溶解度比的溶解度小很多,用冰水洗涤既可以洗去晶体表面的又能减小的溶解损失 温度过高,高氯酸钠晶体会失去结晶水或分解,温度过低,干燥不充分(或75~95℃,干燥充分且高氯酸钠晶体不会失去结晶水或分解) 原料便宜易得,副产品都是有用物质(或没有废物产生)
22. 不对 定性 75% 1667 mL
答案第1页,共2页
答案第1页,共2页
一、单选题
1.“一带一路”赋予古丝绸之路崭新的时代内涵。古代染坊常用下列物质中的一种盐来处理丝绸,这种盐是
A.熟石灰 B.碳酸钾 C.乙醇 D.烧碱
2.氯化铵(NH4Cl)是“侯氏制碱法”的一种副产品。已知氯化铵的水溶液显酸性,下列关于氯化铵的说法正确的是
A.氯化铵属于酸 B.氯化铵是一种复合肥
C.氯化铵与熟石灰混合使用可提高肥效 D.氯化铵溶液与硝酸银溶液混合会产生白色沉淀
3.将下列各组物质混合后溶于水,得到无色溶液的是
A.NaNO3、KCl、Na2SO4 B.FeCl3、NaOH、KNO3
C.CuSO4、CaCl2、KOH D.BaCl2、K2CO3、H2SO4
4.下列物质的用途,利用了其物理性质的是
A.生石灰用作干燥剂 B.铁粉用作食品保鲜吸氧剂
C.氦气填充飞艇 D.小苏打用于治疗胃酸过多
5.下列做法中一定发生化学变化的是( )
A.用石油分馏制得汽油、柴油等 B.用柠檬酸和小苏打、白糖配置汽水
C.用钢丝球擦除灶具上的污渍 D.用汽油清洗衣服上的油污
6.下列试剂中,能把稀硫酸、KOH溶液、CaCl2溶液一次性鉴别出来的是
A.KCl溶液 B.K2CO3溶液
C.稀盐酸 D.NaNO3溶液
7.下列所示的图象能反映相对应实验的是
A.向pH=12的Ca(OH)2溶液中不断加水稀释
B.向碳酸钙固体中逐滴加入稀盐酸至过量
C.在40℃,将饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出
D.分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
8.“河长制”有利于加强水资源保护,防治水体污染。研学小组对两个工厂排污口排放的污水进行检测,发现共含HNO3、K2SO4、MgCl2和NaOH四种物质,其中每个排污口排放两种不同物质。下列关于污水成分的分析合理的是( )
A.HNO3 和K2SO4一定来自同一排污口 B.HNO3 和MgCl2一定来自同 排污口
C.HNO3和NaOH一定来自同一排污口 D.将两处污水混合后,溶液一定呈中性
9.下列物质间不能发生反应的是( )
A.稀盐酸和镁条
B.稀盐酸和铜丝
C.稀盐酸和氢氧化镁
D.稀盐酸和氢氧化铜
10.除去下列物质中混有的少量杂质所选用的操作方法,正确的是
选项 物质 操作方法
A CO2混有HCl气体 将气体通过足量NaOH溶液
B Cu(NO3)2溶液混有NaCl 加入过量氢氧化钠,过滤,洗涤滤渣后向滤渣中加入适量稀硝酸
C NaCl溶液混有CaCl2 加入过量Na2CO3溶液、过滤
D CuO混有碳粉 加入适量稀HCl,过滤,洗涤,干燥
A.A B.B C.C D.D
11.如图所示,U型管内a、b液面相平,当挤压滴管的胶头,使试剂X进入锥形瓶内,一段时间后会观察到a液面高于b液面。则试剂X、Y的组合可能是
A.水、硝酸铵
B.水、烧碱
C.稀硫酸、铁粉
D.稀盐酸、小苏打
12.下列除杂所选用试剂与操作方法均正确的是
选项 物质(括号内 为杂质) 除杂试剂 实验操作
A CaO(CaCO3) 水 溶解、过滤
B H2(CO) 灼热CuO 洗气
C NaCl(Na2SO4) 过量BaCl2溶液 过滤
D NaCl(Na2CO3) 足量稀盐酸 蒸发结晶
A.A B.B C.C D.D
13.下列物质既能跟硫酸反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
A.①②③④ B.①和③ C.③和④ D.①和④
14.“粗盐中难溶性杂质的去除”的实验中,下列操作正确的是
A.取用 B.溶解
C.过滤 D.蒸发
15.硝酸铵是一种氮肥,易溶于水,受热易分解,遇碱时放出氨气,在高温或受猛烈撞击时易爆炸,下列使用硝酸铵的做法不正确的是
A.储存和运输时密封防潮
B.结块时用铁锤砸碎再用
C.施用时不宜与碱混和使用
D.给农作物施肥后及时盖土
16.下列盐的用途中,错误的是
A.用含亚硝酸钠的工业盐制香肠 B.用碳酸钙做补钙剂
C.用氯化钠配制生理盐水 D.用碳酸氢钠做焙制糕点的发酵粉
二、综合应用题
17.某化学兴趣小组为探究碱和盐的化学性质,进行了如图24所示实验(忽略空气中CO2对本实验的影响)。请你参与并完成相关内容。
(1)步骤一:关闭K,向下缓慢推动注射器活塞并轻轻振荡锥形瓶,使二氧化碳全部进入锥形瓶,并与m克溶质质量分数为10%的NaOH溶液恰好完全反应转化为碳酸钠,反应的化学方程式为______,轻轻振荡锥形瓶的目的是_____.
步骤二:打开K,向上缓慢拉动注射器活塞,观察到乙中溶液进入甲。
(2)上述实验过程中,甲中溶质总质量变化情况如图25所示,B点对应的溶质总质量为(用含m的代数式表示,可以不化简)_____克。BC段反应的化学方程式为______,BC段溶质总质量下降的原因是___.
(3)步骤一和步骤二结束后,将甲和乙中的物质全部转移到烧杯中,搅拌后过滤,得到白色沉淀和滤液。结合图25中C点的值确定滤液中溶质的成分为___,理由是____________.
18.取100g溶质质量分数为8%的氢氧化钠溶液,加入一定量溶质质量分数为20%的硫酸铜溶液,恰好完全反应,反应的化学方程式为CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,求:
(1)反应生成沉淀的质量为__________。
(2)反应后所得溶液中溶质的质量分数为__________。(精确到0.1%)
19.比较与归纳是学习化学的重要方法。请你分析下列两个表中的数据,找出对应规律。
(1)
1 g金属与足量稀盐酸反应 (均生成+2价金属的盐溶液) Mg Fe Zn
金属的相对原子质量 24 56 65
产生氢气的质量/g
你发现的规律 _____
(2)
气体 H2 N2 O2 Cl2
气体的相对分子质量 2 28 32 71
标准状况下的气体 密度(g/L) 0.0899 1.251 1.429 3.214
你发现的规律 _____
20.阳光牌小包装“脱氧剂”成分为Fe粉、活性炭及少量NaCl、水。使用一段时间后,其中的Fe粉会转变成Fe2O3而变质。某化学兴趣小组欲探究使用过的阳光牌“脱氧剂”的变质程度(已变质的Fe粉占变质前Fe粉的质量分数),设计并进行如下探究过程。
步骤(1)取食品包装袋中的阳光牌“脱氧剂”一袋,将里面的固体溶于水,过滤、洗涤、干燥滤渣。
步骤(2)取步骤(1)中的滤渣8.0g,加入足量的稀H2SO4与滤渣充分反应,过滤、洗涤、干燥得固体1.2g。
步骤(3)取步骤(2)中的滤液,加入足量的NaOH溶液,得到的固体经洗涤后转移到坩埚中,充分加热、冷却、称量,得到8.0gFe2O3(注:滤液中的Fe元素已全部转化为Fe2O3)。
求(1)滤渣中Fe和Fe2O3两种物质的总质量____。
(2)该“脱氧剂”在未变质时,Fe粉和活性炭的质量之比____。
(3)该“脱氧剂”的变质程度____。
21.高氯酸钠广泛用于火箭和火药工业。粗盐除去泥沙等不溶性杂质后得到“精盐”(只含、两种杂质),以“精盐”为原料制备高氯酸铵()、高氯酸钠晶体()和相关副产品的生产流程如图19-7所示(资料:高氯酸钠在较高温度下容易分解;相关物质的溶解度曲线如图所示)
(1)步骤①中的X是步骤②的副产品经加工再利用的物质,其化学式是__________,步骤①中的副产品的一种用途是___________;步骤②的目的是______________;步骤③的目的是____________.
(2)步骤⑥通入是为了除去溶液中少量的,并制得副产品新型自来水消毒剂,该反应的化学方程式为_____________。
(3)高氯酸铵()是复合火箭推进剂的重要成分,实验室可通过溶液和溶液在90℃条件下反应制取。若用浓氨水和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是_______。
(4)步骤⑦分离出副产品芒硝()的实验操作依次为(填操作名称)________,干燥。
(5)步骤⑧反应得到的混合溶液中和的质量分数分别为0.30和0.15。从混合溶液中获得较多晶体的实验操作与步骤⑦相似,不同的是在干燥前要用冰水洗涤,其原因是___________。
(6)获取时,“气流干燥”的温度应控制在75~95℃,其原因是___________。
(7)根据绿色化学的理念,可以在该生产流程中再利用的物质有、、_______(填化学式),该生产流程的优点除了有的物质可以再利用外,还有__________。
22.小明和小英要验证一块石头是否含碳酸钙。
(1)小明说:“只要取一小块石头放在烧杯中,再在石块上倒入盐酸,发现有大量气泡产生,就能证明石块含有碳酸钙。”小英说:“在石块上倒盐酸,产生的大量气泡是盐酸挥发而成的。”小英的说法对吗?_______(填“对”或“不对”)。
(2)小明和小英带着问题请教王老师,在王老师的指导下,进行了下列实验探究,其实验过程如下:①取一小块石块置于烧杯中,滴加盐酸后,发现产生了无色无味气体;②在老师的指导下,取①中的溶液检验,石块中含有钙元素;③他们又设计了如图所示的实验装置,在实验中观察到广口瓶中有浑浊现象产生。
在上述实验中,他们进行的是_______实验研究(填“定性”或“定量”)。
(3)假若称取10.0 g石块与足量的稀盐酸反应(杂质不与盐酸反应),并用饱和石灰水吸收,得到的沉淀经适当处理后得干燥固体7.5 g。计算:
①石块中含碳酸钙的质量分数_______________;
②已知CO2在标准状况下的密度为1.98 g/L,则生成标准状况下CO2气体的体积为______________毫升
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.D
3.A
4.C
5.B
6.B
7.B
8.B
9.B
10.B
11.A
12.D
13.A
14.B
15.B
16.A
17. CO2+2NaOH=NaCO3+H2O 增大接触面使氢氧化钠溶液与二氧化碳充分反应 Na2CO3+Ba(OH)2=BaCO3↓+2NaOH 加入的氢氧化钡溶液与碳酸钠溶液反应生成沉淀,每171份质量的氢氧化钡,生成197份质量的碳酸钡沉淀,溶质质量减少26份 NaOH和Ba(OH)2 C点对应的溶液中溶质质量与A点相等,都为0.1m克,说明步骤一生成的碳酸钠和步骤二中进入的氢氧化钡恰好完全反应,此时溶液中的溶质只有氢氧化钠,将甲和乙混合后氢氧化钡有剩余,因此滤液中的溶质成分为氢氧化钠和氢氧化钡。
18. 9.8g
解:设反应消耗的CuSO4的质量为x,反应生成的Cu(OH)2的质量为y,生成Na2SO4的质量为z,则
8.3%
因此硫酸铜溶液的质量为16g÷20%=80g
反应后溶液的质量为100g+80g-9.8g=170.2g
所以,反应后所得溶液中溶质的质量分数为×100% ≈8.3%
答:反应生成的沉淀的质量为9.8g;反应后所得溶液中溶质的质量分数为8.3%。
19. 等质量相同价态的金属与足量的酸完全反应,相对原子质量越大(小),产生氢气的质量越少(多)(或等质量相同价态的金属与足量的酸完全反应,产生氢气的质量与其相对原子质量成反比) 气体的相对分子质量越小(大),其标准状况下的密度越小(大)(或标准状况下气体的密度与其相对分子质量成正比)
20. 6.8g 14:3 50%
21. (或) 解除胃酸过多(或作阻燃剂) 除去和 除去和 浓氨水与浓盐酸反应放出热量 蒸发浓缩,冷却结晶,过滤,洗涤 0℃时的溶解度比的溶解度小很多,用冰水洗涤既可以洗去晶体表面的又能减小的溶解损失 温度过高,高氯酸钠晶体会失去结晶水或分解,温度过低,干燥不充分(或75~95℃,干燥充分且高氯酸钠晶体不会失去结晶水或分解) 原料便宜易得,副产品都是有用物质(或没有废物产生)
22. 不对 定性 75% 1667 mL
答案第1页,共2页
答案第1页,共2页
同课章节目录
