8.2金属的化学性质一课一练—2021-2022学年九年级化学人教版下册(word版有答案)
文档属性
| 名称 | 8.2金属的化学性质一课一练—2021-2022学年九年级化学人教版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 200.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-30 11:04:32 | ||
图片预览



文档简介
人教版化学九下 8.2 金属的化学性质 一课一练
一、单选题
1.有X、Y、Z三种金属,把Y投入X(NO3)2溶液中,Y表面有X析出,溶液质量增大:把X投入Z(NO3)2溶液中,得到X(NO3)2,溶液质量减小。下列判断错误的是( )
A.X、Y、Z可能依次是:Cu、Fe、Ag
B.元素的相对原子质量可能是:Z>Y>X
C.金属活动性顺序是:Y>X>Z
D.X、Y、Z可能依次是:Fe、Zn、Hg
2.下列化学方程式书写正确的是( )
A.2H2+O2=2H2O
B.2NaOH+H2SO4=Na2SO4+H2O
C.2Fe+6HCl=2FeCl3+3H2↑
D.2KMnO4K2MnO4+MnO2+O2↑
3.把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,可出现的是
A.溶液蓝色变浅直至无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
4.学习金属单元后,我们知道Zn、Fe、Cu三种金属的活动性顺序为:Zn>Fe>Cu。为验证这一结论,下面实验设计合理的是
A.将Zn、Cu两金属片分别放入稀盐酸中
B.将Fe、Cu两金属片分别放入稀盐酸中
C.将Zn、Fe两金属片分别放入CuCl2溶液中
D.将Zn、Cu两金属片分别放入FeCl2溶液中
5.将一定质量的铁粉加入到Mg(NO3)2、AgNO3的混合溶液中,充分反应后过滤,得到滤液和滤渣。向滤液中加入稀盐酸,无明显现象。下列叙述正确的是( )
A.滤液中一定含有Mg2+和Fe3+
B.滤液中含有Mg2+和Ag+
C.滤渣中一定含有Ag
D.滤渣中可能含有Mg
6.某同学为验证镁、铁、铜、银的金属活动性顺序,设计了下图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③所用盐酸的溶质质量分数和体积均相同)。下列分析不正确的是
A.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
7.下图所示反应,有关说法的错误的是
A.铝丝需要砂纸打磨
B.溶液由蓝色变为无色
C.金属活动性强弱:Al>Cu
D.反应的化学方程式为:Al+CuSO4=Cu+AlSO4
8.某同学为了探究甲、乙、丙三种金属的活动性强弱,做了如下实验。则三种金属的活动性顺序是
实验步骤 实验现象
(1)把甲、乙、丙三种金属分别加入稀硫酸中 甲、乙表面有气泡产生,丙无明显变化
(2)再把甲放入到乙的硫酸盐溶液中 无明显现象
A.甲>乙>丙 B.乙>甲>丙 C.丙>甲>乙 D.丙>乙>甲
9.已知化学反应:X+YSO4 = Y+XSO4,根据此反应信息判断正确的是( )
A.X一定是金属铁 B.Y一定是金属铜
C.X的金属活动性比Y强 D.Y的金属活动性比X强
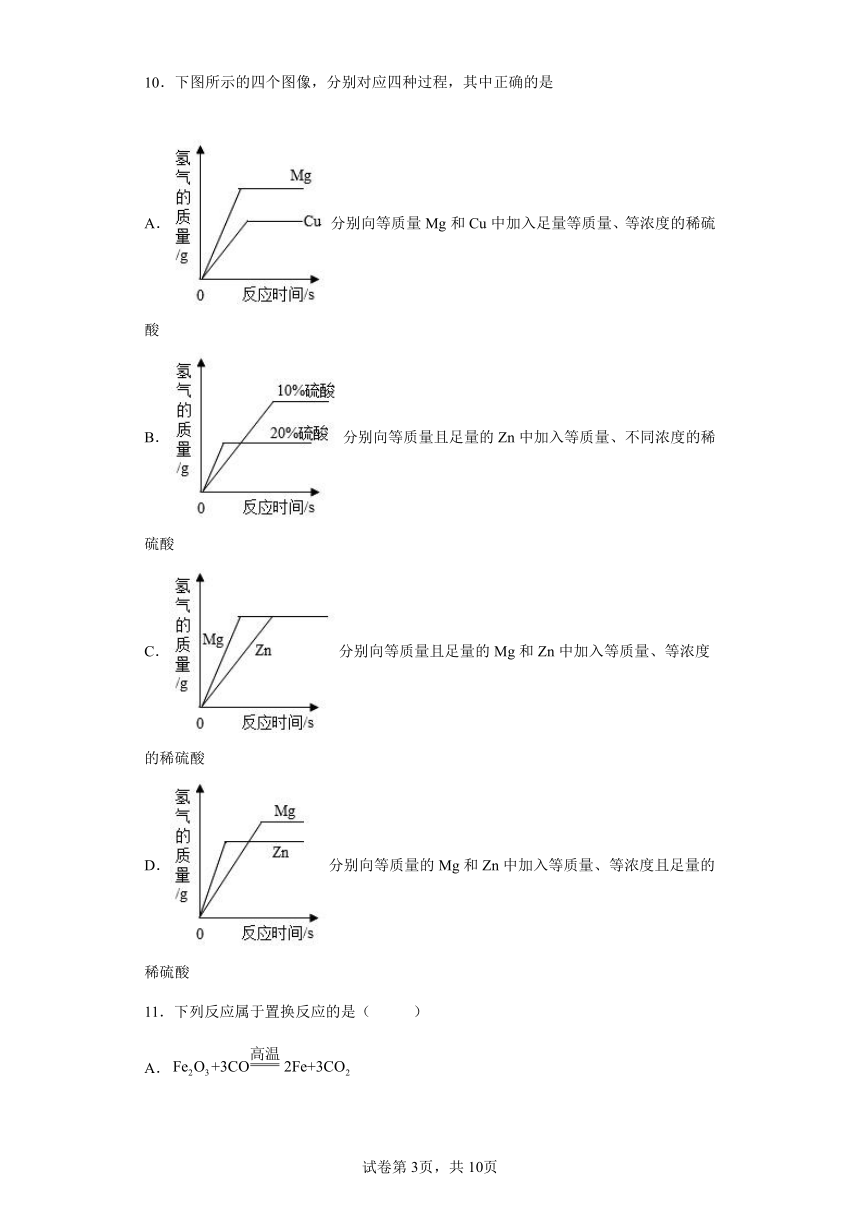
10.下图所示的四个图像,分别对应四种过程,其中正确的是
A.分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
B.分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸
C.分别向等质量且足量的Mg和Zn中加入等质量、等浓度的稀硫酸
D.分别向等质量的Mg和Zn中加入等质量、等浓度且足量的稀硫酸
11.下列反应属于置换反应的是( )
A.
B.
C.
D.
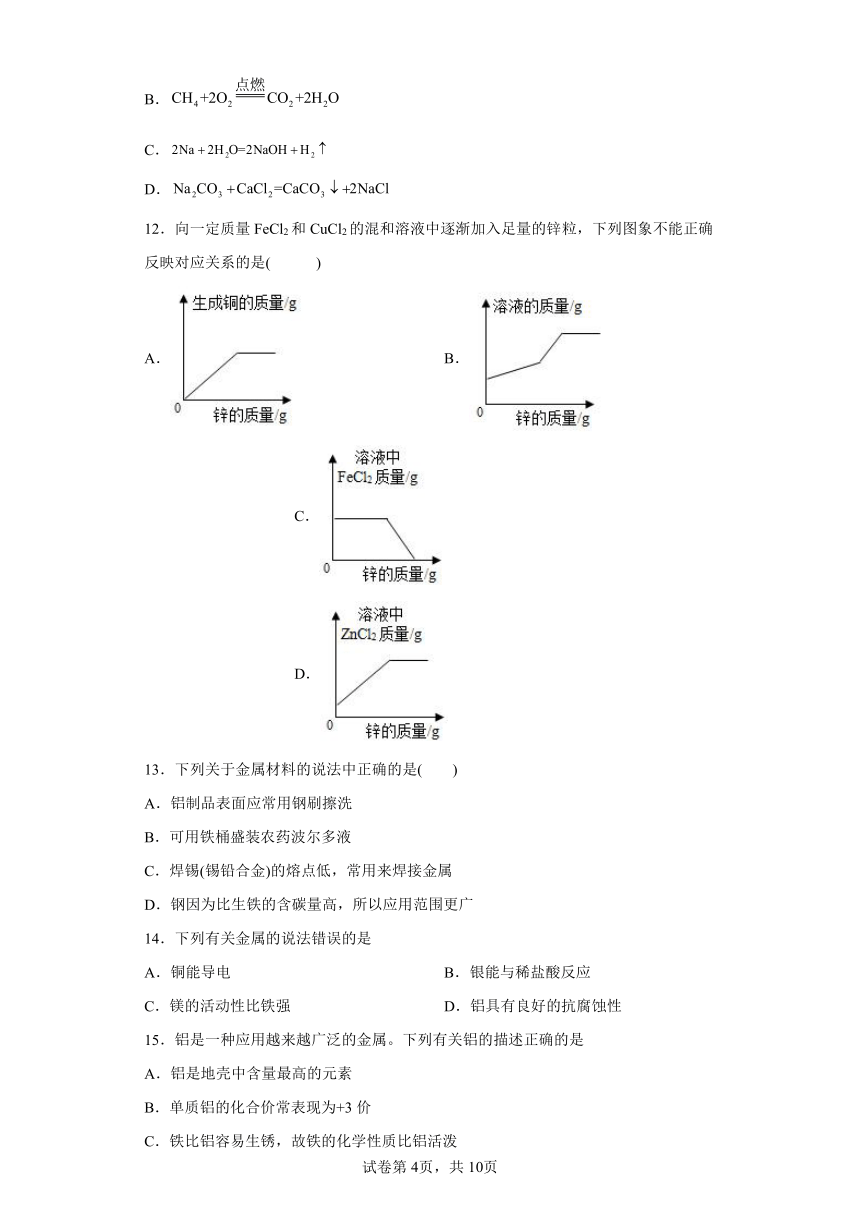
12.向一定质量FeCl2和CuCl2的混和溶液中逐渐加入足量的锌粒,下列图象不能正确反映对应关系的是( )
A. B. C. D.
13.下列关于金属材料的说法中正确的是( )
A.铝制品表面应常用钢刷擦洗
B.可用铁桶盛装农药波尔多液
C.焊锡(锡铅合金)的熔点低,常用来焊接金属
D.钢因为比生铁的含碳量高,所以应用范围更广
14.下列有关金属的说法错误的是
A.铜能导电 B.银能与稀盐酸反应
C.镁的活动性比铁强 D.铝具有良好的抗腐蚀性
15.铝是一种应用越来越广泛的金属。下列有关铝的描述正确的是
A.铝是地壳中含量最高的元素
B.单质铝的化合价常表现为+3价
C.铁比铝容易生锈,故铁的化学性质比铝活泼
D.镁和铝的金属活动性可通过等浓度的稀盐酸来判断
16.在一密闭容器中加入a、b、c、d四种物质,测得反应前后各物质的质量如下表。
物质 a b c d
反应前质量/g 5.6 10 0 20
反应后质量/g 0 16.4 15.2 x
下列说法正确的是A.x等于36
B.b可能是单质
C.该反应一定为置换反应
D.a与b的相对分子质量之比为7:8
二、综合应用题
17.金属是现代生活和工业生产中应用极为普遍的一类材料。
(1)下列金属制品的用途中,利用金属导热性的是___________(填字母)。
A.马踏飞燕 B.汽车
C.火锅 D.金属丝
(2)为减少污染并变废为宝,某化学小组在实验室探究工业废水的综合利用,设计了以下流程图并完成了回收铜和硫酸锌的实验。
①操作I的名称是___________。
②加入过量A时反应的化学方程式为___________。
③物质B的名称是___________。
18.日常使用的干电池是一种锌锰电池,它的构造是:负极为锌做的圆筒,正极是一根碳棒,它的周围被二氧化锰,碳粉和氯化铵的混合剂所包围,总称为"碳包"。碳包和锌筒之间填充着氯化铵、氯化锌的水溶液和淀粉等组成的糊状物。废旧干电池随意丢弃会造成环境污染。学校兴趣小组同学准备对废旧的干电池进行探究。
(一)拆解干电池,得到铜帽、锌皮、碳棒、黑色粉末等物质。
(二)回收二氧化锰并测定碳粉与二氧化锰的质量比:
(1)干电池使用时将化学能转化成 ___________ 能。
(2)上述操作中灼烧的目的是 ___________ ;
(3)同学们将过滤后得到的滤渣干燥后称得质量为25克,充分灼烧后冷却称得剩余固体质量为20克,则滤渣中二氧化锰与碳粉的质量比为 ___________ 。经分析,此结果偏大,老师指出同学们在实验中缺少一步操作,该操作是 ___________ 。
(4)为验证二氧化锰,同学们用A、B两支洁净试管,分别取5毫升3%的过氧化氢溶液,往A试管中加入少量上述实验灼烧后得到的固体,如果出现 ___________ 的现象,说明为二氧化锰。反应的化学方程式为 ___________ 。
(三)用拆解得到的锌皮(含杂质)制取硫酸锌晶体。
实验步骤:①将剪碎后的锌皮放入烧杯中,加入足量的稀硫酸,充分反应;②将上述反应后的混合物过滤。③将滤液加热浓缩、 _____ 、过滤,得到ZnSO4·7H2O晶体。
(5)步骤①中反应方程式为 ___________ ,将锌皮剪碎的目的是 __________ 。
(6)步骤②需要的仪器有铁架台、烧杯、 ___________ 和玻璃棒,玻璃棒的作用是 ___________ 。
(7)步骤③缺少的操作是 ____________ 。
(四)测定锌皮中锌的质量分数。同学们设计了如下实验装置,取1克锌皮放于试管中,实验中将注射器内50毫升稀硫酸(足量)完全注入试管中。当试管中不再产生气泡时立刻读数得到量筒中水的体积为350毫升。已知实验条件下氢气的密度为0.09g/L。
(8)计算该锌皮中锌的质量分数 ___________ 。(写出计算过程,结果保留两位小数)
(9)上述方法测得的锌的质量分数偏大,不可能的原因是 ____________
A.没等装置冷却就读数
B.锌皮中含有少量铁
C.试管中有气体没有排出
D.将注射器中稀硫酸全部注入试管中后忘掉夹紧弹簧夹
19.探究小组欲从含有FeCl3、CuCl2的废液中回收金属铜,取一定量的废液样品加入少量铁粉,一段时间后铁粉完全溶解,但未发现红色固体沉积,出现这种现象的可能原因是_____________________;
经查阅资料,铁粉在废液中发生两个化学反应:
①2FeCl3+Fe=3FeCl2 ②CuCl2+Fe=FeCl2+Cu
(2)探究小组另取废液,向废液中加入一定且足量的铁粉至充分反应,溶液变为浅绿色,过滤、干燥,称得固体沉积物质量与加入铁粉质量相等.
①固体沉积物质量与加入铁粉质量相等的原因是_____________________________;
②经测定,反应后得到铜的质量为1.6g,其中,反应①消耗铁粉的质量是____,反应②消耗铁粉的质量是____(计算结果精确到0.1)。
20.金属材料在人类的生产和生活中有着广泛的应用。
(1)生铁和钢都是铁的合金,两者性能不同的原因是_________。
(2)我国航母螺旋桨由铜合金制造,与纯铜相比,铜合金的硬度更_____(选填“大”或“小”)。
(3)某兴趣小组为探究铝、铜、银三种金属的活动性顺序,设计了如图所示的方案:
①I中发生反应的化学方程式为_________。
②通过以上实验,_________(选填“能”或“不能”)得出三种金属的活动性的强弱。
(4)金属钛被称为铁和铝之后崛起的“第三种金属”,它是航海、化工、医疗上不可缺少的材料。工业上用钛铁矿(主要成分为FeTiO3)制备金属钛的一种工艺流程如图所示:
①操作I的名称是_________。
②向钛铁矿中加入的稀盐酸须过量,目的是_________。
③高温条件下,TiO2固体、单质碳和通入的C12发生反应的化学方程式为_________。
(5)高铁的高速运行离不开铁轨,建造铁轨所需要的钢铁通常用还原铁矿石的方法制得。工业上用赤铁矿石(主要成分为Fe2O3)与一氧化碳反应来炼铁。若制得5.6t铁,理论上需要含氧化铁80%的赤铁矿石多少吨?
21.某兴趣小组通过镁与稀盐酸反应探究影响反应速率的因素(镁的质量相等,镁条的形状一样,稀盐酸均过量),设计实验如下表:
实验编号 盐酸的质量分数 镁的形态 溶液初始温度/℃
① 3% 粉末 30
② 3% 条状 20
③ 6% 粉末 20
④ 6% 条状 20
(1)镁与稀盐酸反应的化学方程式为_________。
(2)若四组实验均以收集到 250 mL 氢气为标准,要比较各组反应速率,则以上实验还需要测出的数据是_________。
(3)实验________和________(填实验编号)是研究盐酸的浓度对该反应速率的影响。
(4)若要研究溶液初始温度对该反应速率的影响,增加第五组实验与实验① 行对照,第五组实验的方案是_________。
(5)测定在不同时间产生的氢气的体积数据,绘制出图Ⅰ,则实验②对应的曲线可能是______(填序号)。
(6)利用图Ⅱ压力传感器进行实验,得到图Ⅲ锥形瓶内的压强随时间变化的曲线图,发现实验测得的实际值比理论值偏大。请分析可能的原因_________。
22.金属材料在生活、生产中有广泛的应用。
(1)将铝片和稀盐酸放在密闭容器中,传感器中反应容器内的温度随时间变化如图。
①写出发生反应的化学方程式______。
②溶液温度升高的原因是什么?______。
(2)向一定量硝酸银、硝酸铜和硝酸亚铁的混合溶液中加入锌质粉、充分反应后所得溶液的质量与加入锌粉的质量关系如图所示。
①写出让溶液质量变小的化学方程式______。
②cd段溶液是什么颜色?______。
③e点所得固体成分是什么?______。
(3)如图是工业上用赤铁矿炼铁的示意图。
①写出玻璃管内发生的现象______。
②右侧酒精灯的作用是什么?______。
(4)上题中,若氧化铁质量为3.2g,求完全反应后生成铁的质量______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.D
3.B
4.D
5.C
6.B
7.D
8.B
9.C
10.C
11.C
12.D
13.C
14.B
15.D
16.B
17.(1)C
(2) 过滤
稀硫酸##硫酸
18. 电 除去碳粉(或者将碳粉变成二氧化碳除去,合理即可) 4:1 洗涤 有气泡产生 2H2O22H2O + O2↑ 冷却结晶 Zn + H2SO4 = ZnSO4 + H2↑ 增大接触面积,使反应更快更充分 漏斗 引流 降温结晶(或冷却结晶) 解:氢气的质量=(350-50)x10-3L ×0.09g/L = 0.027g
设锌的质量为x
Zn + H2SO4 == ZnSO4 + H2↑
65 2
X 0.027g
x =0.8775g
锌皮中锌的质量分数 = ×100% = 87.75% C D
19. 加入的铁先和氯化铁反应,由于铁的量不足,没有来得及和氯化铜反应 铁和氯化铁反应固体质量是减少的,而铁和氯化铜反应固体质量是增大的,当两者变化量相同时则固体沉积物质量和加入的铁质量相等 0.2g 1.4g
20.(1)含碳量不同
(2)大
(3) 能
(4) 过滤 使钛铁矿完全反应
(5)解:设制得5.6t铁,理论上需要Fe2O3的质量为x
x=8t
理论上需要含氧化铁80%的赤铁矿石的质量为8t÷80%=10t
答:理论上需要含氧化铁80%的赤铁矿石的质量为10t。
21.(1)
(2)测收集 250mL 氢气所需时间
(3) ② ④
(4)20℃ 时,取质量分数为 3%的盐酸与等量镁粉反应,测收集 250mL 氢气所需时间
(5)d
(6)反应放热
22. 铝与稀盐酸反应放热,使溶液温度升高 浅绿色 银、铜、铁、锌(写元素符号或名称均可,少写、错写均不给分) 红棕色变为黑色 除去未反应的CO,防止污染空气 解:设生成铁的质量为x
答:生成铁的质量为2.24g。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.有X、Y、Z三种金属,把Y投入X(NO3)2溶液中,Y表面有X析出,溶液质量增大:把X投入Z(NO3)2溶液中,得到X(NO3)2,溶液质量减小。下列判断错误的是( )
A.X、Y、Z可能依次是:Cu、Fe、Ag
B.元素的相对原子质量可能是:Z>Y>X
C.金属活动性顺序是:Y>X>Z
D.X、Y、Z可能依次是:Fe、Zn、Hg
2.下列化学方程式书写正确的是( )
A.2H2+O2=2H2O
B.2NaOH+H2SO4=Na2SO4+H2O
C.2Fe+6HCl=2FeCl3+3H2↑
D.2KMnO4K2MnO4+MnO2+O2↑
3.把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,可出现的是
A.溶液蓝色变浅直至无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
4.学习金属单元后,我们知道Zn、Fe、Cu三种金属的活动性顺序为:Zn>Fe>Cu。为验证这一结论,下面实验设计合理的是
A.将Zn、Cu两金属片分别放入稀盐酸中
B.将Fe、Cu两金属片分别放入稀盐酸中
C.将Zn、Fe两金属片分别放入CuCl2溶液中
D.将Zn、Cu两金属片分别放入FeCl2溶液中
5.将一定质量的铁粉加入到Mg(NO3)2、AgNO3的混合溶液中,充分反应后过滤,得到滤液和滤渣。向滤液中加入稀盐酸,无明显现象。下列叙述正确的是( )
A.滤液中一定含有Mg2+和Fe3+
B.滤液中含有Mg2+和Ag+
C.滤渣中一定含有Ag
D.滤渣中可能含有Mg
6.某同学为验证镁、铁、铜、银的金属活动性顺序,设计了下图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③所用盐酸的溶质质量分数和体积均相同)。下列分析不正确的是
A.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
7.下图所示反应,有关说法的错误的是
A.铝丝需要砂纸打磨
B.溶液由蓝色变为无色
C.金属活动性强弱:Al>Cu
D.反应的化学方程式为:Al+CuSO4=Cu+AlSO4
8.某同学为了探究甲、乙、丙三种金属的活动性强弱,做了如下实验。则三种金属的活动性顺序是
实验步骤 实验现象
(1)把甲、乙、丙三种金属分别加入稀硫酸中 甲、乙表面有气泡产生,丙无明显变化
(2)再把甲放入到乙的硫酸盐溶液中 无明显现象
A.甲>乙>丙 B.乙>甲>丙 C.丙>甲>乙 D.丙>乙>甲
9.已知化学反应:X+YSO4 = Y+XSO4,根据此反应信息判断正确的是( )
A.X一定是金属铁 B.Y一定是金属铜
C.X的金属活动性比Y强 D.Y的金属活动性比X强
10.下图所示的四个图像,分别对应四种过程,其中正确的是
A.分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
B.分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸
C.分别向等质量且足量的Mg和Zn中加入等质量、等浓度的稀硫酸
D.分别向等质量的Mg和Zn中加入等质量、等浓度且足量的稀硫酸
11.下列反应属于置换反应的是( )
A.
B.
C.
D.
12.向一定质量FeCl2和CuCl2的混和溶液中逐渐加入足量的锌粒,下列图象不能正确反映对应关系的是( )
A. B. C. D.
13.下列关于金属材料的说法中正确的是( )
A.铝制品表面应常用钢刷擦洗
B.可用铁桶盛装农药波尔多液
C.焊锡(锡铅合金)的熔点低,常用来焊接金属
D.钢因为比生铁的含碳量高,所以应用范围更广
14.下列有关金属的说法错误的是
A.铜能导电 B.银能与稀盐酸反应
C.镁的活动性比铁强 D.铝具有良好的抗腐蚀性
15.铝是一种应用越来越广泛的金属。下列有关铝的描述正确的是
A.铝是地壳中含量最高的元素
B.单质铝的化合价常表现为+3价
C.铁比铝容易生锈,故铁的化学性质比铝活泼
D.镁和铝的金属活动性可通过等浓度的稀盐酸来判断
16.在一密闭容器中加入a、b、c、d四种物质,测得反应前后各物质的质量如下表。
物质 a b c d
反应前质量/g 5.6 10 0 20
反应后质量/g 0 16.4 15.2 x
下列说法正确的是A.x等于36
B.b可能是单质
C.该反应一定为置换反应
D.a与b的相对分子质量之比为7:8
二、综合应用题
17.金属是现代生活和工业生产中应用极为普遍的一类材料。
(1)下列金属制品的用途中,利用金属导热性的是___________(填字母)。
A.马踏飞燕 B.汽车
C.火锅 D.金属丝
(2)为减少污染并变废为宝,某化学小组在实验室探究工业废水的综合利用,设计了以下流程图并完成了回收铜和硫酸锌的实验。
①操作I的名称是___________。
②加入过量A时反应的化学方程式为___________。
③物质B的名称是___________。
18.日常使用的干电池是一种锌锰电池,它的构造是:负极为锌做的圆筒,正极是一根碳棒,它的周围被二氧化锰,碳粉和氯化铵的混合剂所包围,总称为"碳包"。碳包和锌筒之间填充着氯化铵、氯化锌的水溶液和淀粉等组成的糊状物。废旧干电池随意丢弃会造成环境污染。学校兴趣小组同学准备对废旧的干电池进行探究。
(一)拆解干电池,得到铜帽、锌皮、碳棒、黑色粉末等物质。
(二)回收二氧化锰并测定碳粉与二氧化锰的质量比:
(1)干电池使用时将化学能转化成 ___________ 能。
(2)上述操作中灼烧的目的是 ___________ ;
(3)同学们将过滤后得到的滤渣干燥后称得质量为25克,充分灼烧后冷却称得剩余固体质量为20克,则滤渣中二氧化锰与碳粉的质量比为 ___________ 。经分析,此结果偏大,老师指出同学们在实验中缺少一步操作,该操作是 ___________ 。
(4)为验证二氧化锰,同学们用A、B两支洁净试管,分别取5毫升3%的过氧化氢溶液,往A试管中加入少量上述实验灼烧后得到的固体,如果出现 ___________ 的现象,说明为二氧化锰。反应的化学方程式为 ___________ 。
(三)用拆解得到的锌皮(含杂质)制取硫酸锌晶体。
实验步骤:①将剪碎后的锌皮放入烧杯中,加入足量的稀硫酸,充分反应;②将上述反应后的混合物过滤。③将滤液加热浓缩、 _____ 、过滤,得到ZnSO4·7H2O晶体。
(5)步骤①中反应方程式为 ___________ ,将锌皮剪碎的目的是 __________ 。
(6)步骤②需要的仪器有铁架台、烧杯、 ___________ 和玻璃棒,玻璃棒的作用是 ___________ 。
(7)步骤③缺少的操作是 ____________ 。
(四)测定锌皮中锌的质量分数。同学们设计了如下实验装置,取1克锌皮放于试管中,实验中将注射器内50毫升稀硫酸(足量)完全注入试管中。当试管中不再产生气泡时立刻读数得到量筒中水的体积为350毫升。已知实验条件下氢气的密度为0.09g/L。
(8)计算该锌皮中锌的质量分数 ___________ 。(写出计算过程,结果保留两位小数)
(9)上述方法测得的锌的质量分数偏大,不可能的原因是 ____________
A.没等装置冷却就读数
B.锌皮中含有少量铁
C.试管中有气体没有排出
D.将注射器中稀硫酸全部注入试管中后忘掉夹紧弹簧夹
19.探究小组欲从含有FeCl3、CuCl2的废液中回收金属铜,取一定量的废液样品加入少量铁粉,一段时间后铁粉完全溶解,但未发现红色固体沉积,出现这种现象的可能原因是_____________________;
经查阅资料,铁粉在废液中发生两个化学反应:
①2FeCl3+Fe=3FeCl2 ②CuCl2+Fe=FeCl2+Cu
(2)探究小组另取废液,向废液中加入一定且足量的铁粉至充分反应,溶液变为浅绿色,过滤、干燥,称得固体沉积物质量与加入铁粉质量相等.
①固体沉积物质量与加入铁粉质量相等的原因是_____________________________;
②经测定,反应后得到铜的质量为1.6g,其中,反应①消耗铁粉的质量是____,反应②消耗铁粉的质量是____(计算结果精确到0.1)。
20.金属材料在人类的生产和生活中有着广泛的应用。
(1)生铁和钢都是铁的合金,两者性能不同的原因是_________。
(2)我国航母螺旋桨由铜合金制造,与纯铜相比,铜合金的硬度更_____(选填“大”或“小”)。
(3)某兴趣小组为探究铝、铜、银三种金属的活动性顺序,设计了如图所示的方案:
①I中发生反应的化学方程式为_________。
②通过以上实验,_________(选填“能”或“不能”)得出三种金属的活动性的强弱。
(4)金属钛被称为铁和铝之后崛起的“第三种金属”,它是航海、化工、医疗上不可缺少的材料。工业上用钛铁矿(主要成分为FeTiO3)制备金属钛的一种工艺流程如图所示:
①操作I的名称是_________。
②向钛铁矿中加入的稀盐酸须过量,目的是_________。
③高温条件下,TiO2固体、单质碳和通入的C12发生反应的化学方程式为_________。
(5)高铁的高速运行离不开铁轨,建造铁轨所需要的钢铁通常用还原铁矿石的方法制得。工业上用赤铁矿石(主要成分为Fe2O3)与一氧化碳反应来炼铁。若制得5.6t铁,理论上需要含氧化铁80%的赤铁矿石多少吨?
21.某兴趣小组通过镁与稀盐酸反应探究影响反应速率的因素(镁的质量相等,镁条的形状一样,稀盐酸均过量),设计实验如下表:
实验编号 盐酸的质量分数 镁的形态 溶液初始温度/℃
① 3% 粉末 30
② 3% 条状 20
③ 6% 粉末 20
④ 6% 条状 20
(1)镁与稀盐酸反应的化学方程式为_________。
(2)若四组实验均以收集到 250 mL 氢气为标准,要比较各组反应速率,则以上实验还需要测出的数据是_________。
(3)实验________和________(填实验编号)是研究盐酸的浓度对该反应速率的影响。
(4)若要研究溶液初始温度对该反应速率的影响,增加第五组实验与实验① 行对照,第五组实验的方案是_________。
(5)测定在不同时间产生的氢气的体积数据,绘制出图Ⅰ,则实验②对应的曲线可能是______(填序号)。
(6)利用图Ⅱ压力传感器进行实验,得到图Ⅲ锥形瓶内的压强随时间变化的曲线图,发现实验测得的实际值比理论值偏大。请分析可能的原因_________。
22.金属材料在生活、生产中有广泛的应用。
(1)将铝片和稀盐酸放在密闭容器中,传感器中反应容器内的温度随时间变化如图。
①写出发生反应的化学方程式______。
②溶液温度升高的原因是什么?______。
(2)向一定量硝酸银、硝酸铜和硝酸亚铁的混合溶液中加入锌质粉、充分反应后所得溶液的质量与加入锌粉的质量关系如图所示。
①写出让溶液质量变小的化学方程式______。
②cd段溶液是什么颜色?______。
③e点所得固体成分是什么?______。
(3)如图是工业上用赤铁矿炼铁的示意图。
①写出玻璃管内发生的现象______。
②右侧酒精灯的作用是什么?______。
(4)上题中,若氧化铁质量为3.2g,求完全反应后生成铁的质量______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.D
3.B
4.D
5.C
6.B
7.D
8.B
9.C
10.C
11.C
12.D
13.C
14.B
15.D
16.B
17.(1)C
(2) 过滤
稀硫酸##硫酸
18. 电 除去碳粉(或者将碳粉变成二氧化碳除去,合理即可) 4:1 洗涤 有气泡产生 2H2O22H2O + O2↑ 冷却结晶 Zn + H2SO4 = ZnSO4 + H2↑ 增大接触面积,使反应更快更充分 漏斗 引流 降温结晶(或冷却结晶) 解:氢气的质量=(350-50)x10-3L ×0.09g/L = 0.027g
设锌的质量为x
Zn + H2SO4 == ZnSO4 + H2↑
65 2
X 0.027g
x =0.8775g
锌皮中锌的质量分数 = ×100% = 87.75% C D
19. 加入的铁先和氯化铁反应,由于铁的量不足,没有来得及和氯化铜反应 铁和氯化铁反应固体质量是减少的,而铁和氯化铜反应固体质量是增大的,当两者变化量相同时则固体沉积物质量和加入的铁质量相等 0.2g 1.4g
20.(1)含碳量不同
(2)大
(3) 能
(4) 过滤 使钛铁矿完全反应
(5)解:设制得5.6t铁,理论上需要Fe2O3的质量为x
x=8t
理论上需要含氧化铁80%的赤铁矿石的质量为8t÷80%=10t
答:理论上需要含氧化铁80%的赤铁矿石的质量为10t。
21.(1)
(2)测收集 250mL 氢气所需时间
(3) ② ④
(4)20℃ 时,取质量分数为 3%的盐酸与等量镁粉反应,测收集 250mL 氢气所需时间
(5)d
(6)反应放热
22. 铝与稀盐酸反应放热,使溶液温度升高 浅绿色 银、铜、铁、锌(写元素符号或名称均可,少写、错写均不给分) 红棕色变为黑色 除去未反应的CO,防止污染空气 解:设生成铁的质量为x
答:生成铁的质量为2.24g。
答案第1页,共2页
答案第1页,共2页
同课章节目录
