溶液的配制及分析
图片预览



文档简介
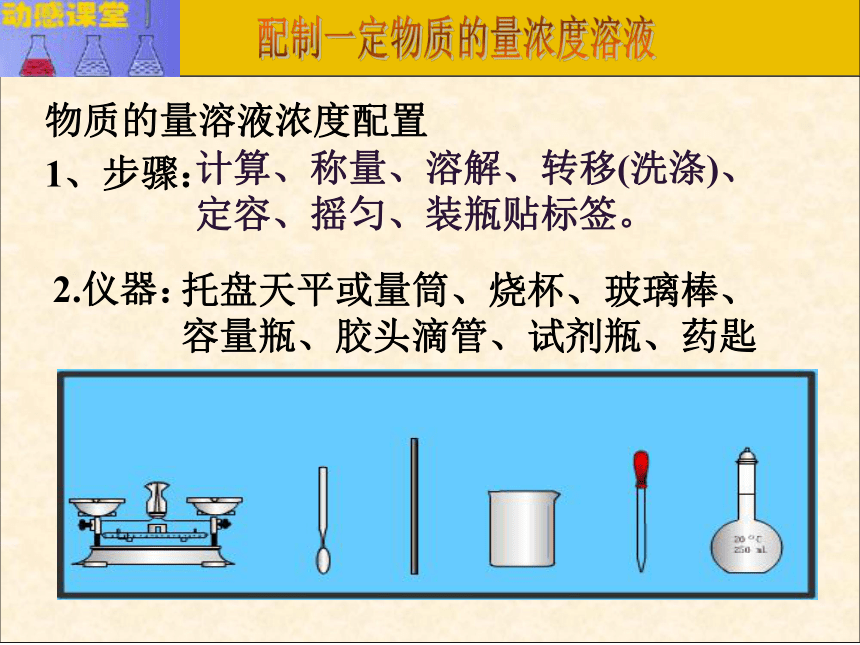
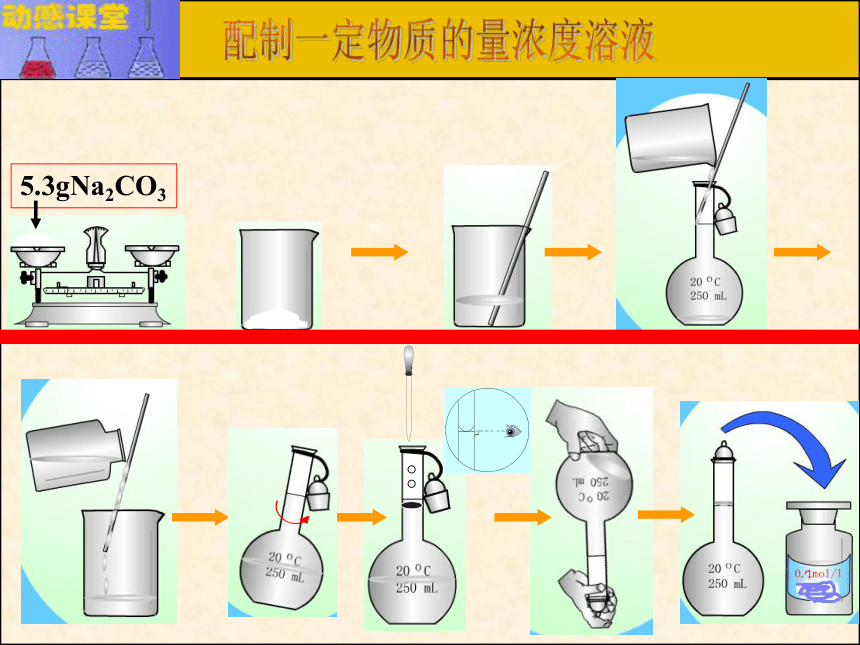
课件12张PPT。溶液的配制和分析容量瓶简介:容量瓶2.使用之前要检查是否漏水.如何检漏? 加水倒立观察瓶塞旋转180oC倒立观察3.只能用作配制的量具。不能在其中直接溶解固体或稀释浓溶液,不能将热的溶液倒入,不能作为反应器,也不能长期存放溶液。4.读数时 ,应平视,使溶液的凹液面正好与刻度相切。形状:细颈,梨形,平底的玻璃瓶;构造:瓶上标有容积,温度,颈部标有刻度线;常见规格: 50ml , 100mL,250,500mL,1000mL;物质的量溶液浓度配置1、步骤:2.仪器:计算、称量、溶解、转移(洗涤)、定容、摇匀、装瓶贴标签。托盘天平或量筒、烧杯、玻璃棒、容量瓶、胶头滴管、试剂瓶、药匙现在,我们要配制100mL 0.1mol/L的Na2CO3 溶液怎么办?首先应该做什么?1、计算
计算所需无水碳酸钠的质量
m(Na2CO3)=n(Na2CO3)?M(Na2CO3)
=0.1mol/L×0.10L×106g/mol
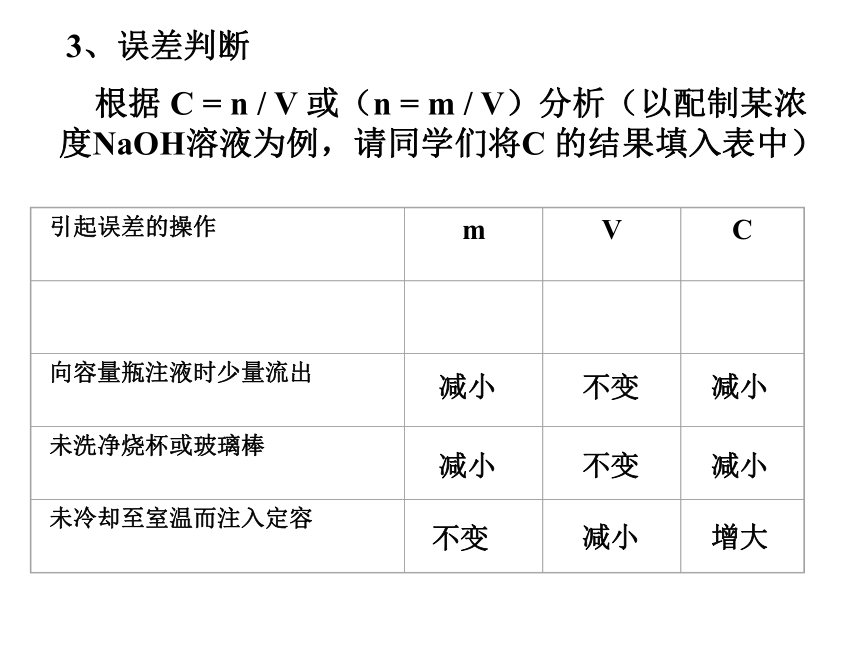
=1.06g?配制一定物质的量浓度溶液5.3gNa2CO33、误差判断???? 根据 C = n / V 或(n = m / V)分析(以配制某浓度NaOH溶液为例,请同学们将C 的结果填入表中)减小 不变减小 减小 不变减小 不变减小 增大 减小 不变减小 不变增大减小不变减小 增大不变增大 减小 不变不变不变讨论定容时俯视或仰视刻度线,对溶液的浓度有何影响? ?俯
视仰
视 俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大; 仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。 随堂检测 欲配制1 mol/L的氢氧化钠溶液250mL,完成下列步骤:
①用天平称取氢氧化钠固体 克。
②将称好的氢氧化钠固体放入 中 加 蒸馏水将其溶解,待 后将溶液沿 移入 mL的容量瓶中。10烧杯少量冷却玻璃棒250③用少量蒸馏水冲洗 次,将冲洗液移入 中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏 (高或低)。
④向容量瓶内加水至刻度线 时,改 用 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏 ,应该 。
⑤最后盖好瓶盖, ,将配好的溶液移入 中并贴好标签。 2~3偏低2~3厘米胶头滴管偏低重新配制摇匀中和120mL 1mol/LH2SO4溶液共用去了NaOH溶液80ml,求此NaOH溶液的物质的量浓度。作业
计算所需无水碳酸钠的质量
m(Na2CO3)=n(Na2CO3)?M(Na2CO3)
=0.1mol/L×0.10L×106g/mol
=1.06g?配制一定物质的量浓度溶液5.3gNa2CO33、误差判断???? 根据 C = n / V 或(n = m / V)分析(以配制某浓度NaOH溶液为例,请同学们将C 的结果填入表中)减小 不变减小 减小 不变减小 不变减小 增大 减小 不变减小 不变增大减小不变减小 增大不变增大 减小 不变不变不变讨论定容时俯视或仰视刻度线,对溶液的浓度有何影响? ?俯
视仰
视 俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大; 仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。 随堂检测 欲配制1 mol/L的氢氧化钠溶液250mL,完成下列步骤:
①用天平称取氢氧化钠固体 克。
②将称好的氢氧化钠固体放入 中 加 蒸馏水将其溶解,待 后将溶液沿 移入 mL的容量瓶中。10烧杯少量冷却玻璃棒250③用少量蒸馏水冲洗 次,将冲洗液移入 中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏 (高或低)。
④向容量瓶内加水至刻度线 时,改 用 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏 ,应该 。
⑤最后盖好瓶盖, ,将配好的溶液移入 中并贴好标签。 2~3偏低2~3厘米胶头滴管偏低重新配制摇匀中和120mL 1mol/LH2SO4溶液共用去了NaOH溶液80ml,求此NaOH溶液的物质的量浓度。作业
